白介素-32基因多态性及血清水平与多发性硬化遗传易感性的关联性①
2018-03-23许朝卿戴迟兵汪应瑞
许朝卿 戴迟兵 汪应瑞
(三峡大学附属仁和医院神经内科,宜昌 443001)
多发性硬化(Multiple sclerosis,MS)是一种累及中枢神经系统的炎性脱髓鞘病。以往的研究证实,MS可能是遗传因素和环境因素共同作用所引起的中枢神经系统自身免疫性疾病,其发病机制不完全清楚[1]。有研究表明,炎症在神经系统脱髓鞘病变的形成和发展中起着至关重要的作用[2]。进一步研究发现,细胞因子在神经系统脱髓鞘病变中占有重要地位,炎症因子的水平与MS患者的疾病严重程度有关[3],白介素-32(Interleukin-3,IL-32)作为一种内源性的炎症调控因子,在炎症中起着关键作用[4]。最近研究发现,IL-32基因多态性与系统性红斑狼疮、急性肺损伤及癌症等多种炎症性疾病密切相关[5-7]。因此,本研究探讨 IL-32基因多态性与MS遗传易感性的关系,拟寻找一种新的炎症因子为临床MS的治疗提供潜在的靶点,同时,为MS高危人群的筛查提供理论依据。
1 材料与方法
1.1材料
1.1.1研究对象 选取2012年~2016年于我院就诊的MS患者 580 例,所有病例的诊断均符合2005年McDonald的MS诊断标准及1999年Wingerchuck NMO的诊断标准[8]。所有入选患者均为新确诊的患者,其中男性 360 例,女性220 例,年龄(32.7±10.26)岁。 同时,选取650例同期同地区健康无血缘关系的个体作为对照,其中男性400 例,女性 250例,年龄(33.2±9.18)岁。所有入选对象排除心血管疾病、高血压、糖尿病、肾功能不全、感染性疾病、免疫性疾病及其他恶性肿瘤性疾病。本次研究经过我院伦理委员会批准。
1.1.2主要试剂和仪器 PCR产物(德国Qiagen公司),虾碱酶和外切酶Ⅰ分别购自美国Promega公司和Epieentre公司,SNaPshot Multiplex试剂盒购自美国ABI公司,IL-32试剂盒(上海江莱生物科技有限公司) 。
1.2方法
1.2.1DNA 的提取和基因型检测 采集静脉血2 ml 于EDTA 抗凝管-20℃保存。DNA的提取采用改良碘化钠法,经纯度鉴定后-20℃保存备用。上海天昊生物科技有限公司根据IL-32基因rs28372698,rs12934561及rs11861531位点多态性和已知的DNA序列设计PCR引物。rs28372698位点的上下游引物序列分别为:5′-CCATGGGTGTGGAGGTTCATAAAG-3′,5′-GAATGGAAGGTCTTGAT-GGGAGAG-3′。 rs12934561位点的上下游引物序列分别为5′-AGGCCCGAATGGTAAGCT-3′,5′-CCACAGTGTCCTCAGTGTCAC-3′。 rs11861531位点的上下游引物序列分别为5′-ATGAGTATGCCTGC-CGTGTG-3′,5′-AATGCGGCATCTTCAAAC-3′。IL-32的PCR扩增反应体系为 5 μl,其中包含2.5 μl缓冲液,0.25 μl反应物,1.75 μl去离子水。若扩增反应体系不足,则用灭菌双蒸水补足至5 μl。扩增程序主要包括:95℃ 10 min变性,92℃ 15 s和60℃ 1 min 共69个循环。PCR产物 4℃保存。采用GeneMapper4.1分析SNP分型。
1.2.2血清IL-32水平的检测 采用酶联免疫吸附测定(ELISA)法测定IL-32血清水平,实验操作严格按照说明书进行。
1.3统计学方法 采用SPSS16.0软件包进行统计分析。等位基因和基因型分布频率采用直接计数法计算,各分布频率比较采用卡方检验。 IL-32血清水平的组间比较采用t检验,遗传平衡检验采用Hardy-Weinberg,采用SHEsis分析软件行连锁不平衡分析。P<0.05表示差异有统计学意义。
2 结果
2.1MS患者临床特点 在所有入选的MS患者中,复发缓解型占77.9%(452/580),继发进展型占20%(116/580)以及进展型占2.1%(12/580)。MS患者的年龄和性别与对照组比较,无显著统计学意义(P>0.05,表1)。
2.2MS患者组和健康对照组IL-32基因型频率比较结果 检测结果表明,rs28372698位点存在AA、AT、TT 3种基因型。rs12934561位点存在TT、CT、CC三种基因型。rs11861531位点存在CC、CT、TT 3种基因型。两组三个位点的频率均符合Hardy-Weinberg遗传平衡(P>0.05),表明该基因型在所研究人群中分布已达到了遗传平衡。基因测序进一步验证了检测结果。IL-32基因rs28372698 A/T位点的基因型频率存在显著差异(χ2=9.814,P=0.007),其等位基因频率在两组间分布差异有统计学意义(χ2=4.561,P=0.033)。rs12934561C/T与 rs11861531 C/T的各基因型及等位基因频率在两组间差异无显著统计学意义(P>0.05,表2)。
表1MS患者和健康对照基线资料的比较
Tab.1ComparisonofbasicinformationbetweenMSpatientsandhealthycontrols
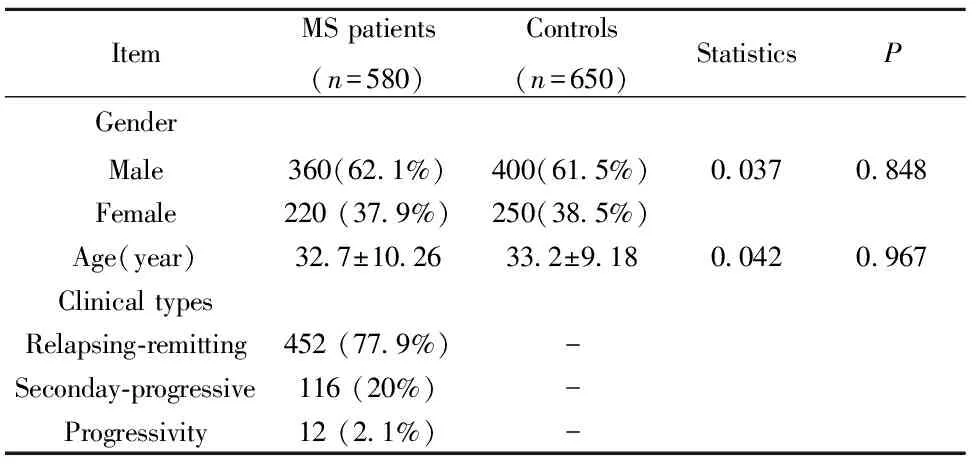
ItemMSpatients(n=580)Controls(n=650)StatisticsPGenderMale360(62 1%)400(61 5%)0 0370 848Female220(37 9%)250(38 5%)Age(year)32 7±10 2633 2±9 180 0420 967ClinicaltypesRelapsing⁃remitting452(77 9%)-Seconday⁃progressive116(20%)-Progressivity12(2 1%)-
2.3配对连锁分析及单倍基因型分析结果 采用SHEsis在线分析软件对rs28372698 A/T、rs12934561 C/T以及 rs11861531 C/T三个位点进行两两配对连锁不平衡分析,结果显示:三位点两两之间均存在连锁不平衡(rs28372698 vs rs12934561,D′=0.874;rs28372698 vs rs11861531,D′=0.795;rs12934561 vs rs11861531,D′=0.931)。进一步的单倍型分析结果显示,T-T-T单倍型在MS中的分布频率显著高于对照组(P=0.012),T-T-T单倍型与MS的发病风险密切相关(OR=1.968,95%CI:1.352-2.574,表3)。
表2IL-32基因rs28372698A/T、rs12934561C/T及rs11861531C/T基因型在两组间的分布频率
Tab.2GenotypefrequencydistributionofIL-32genesrs28372698A/T,andrs11861531rs12934561C/TC/TbetweenMSpatientsandcontrols

SNPgenotypingMSpatients(n=580)Controls(n=650)StatisticsPrs28372698A/TGenotypeAA240(41 4%)285(49 1%)9 8140 0071)AT255(44 0%)307(47 2%)TT85(14 7%)58(8 9%)AlleleA735(63 4%)877(67 5&)4 5610 0332)T425(36 6%)423(32 5%)rs12934561C/TGenotypeCC138(23 8%)141(21 7%)1 6430 440CT312(53 8%)345(53 1%)TT130(22 4%)164(25 2%)AlleleC588(50 7%)627(48 2%)1 4830 223T572(49 3%)673(51 8%)rs11861531C/TGenotypeCC192(33 1%)214(32 9%)0 1220 941CT302(52 1%)335(51 5%)TT86(14 8%)101(15 5%)AlleleC686(59 1%)783(60 2%)0 0080 927T474(40 9%)537(41 3%)
Note:1)Gnotype frequency was statistically differences in AA,AT and TT;2)Allele was statistically difference between A and T.
2.4IL-32血清水平在两组的比较结果 MS患者组血清IL-32水平明显高于对照组[(399.08±156.85)pg/ml vs (239.99±88.35)pg/ml,P=0.001]。进一步,在所有MS患者中,按照rs28372698 A/T位点的AA、AT、TT基因型分为三组,AT和TT基因型的MS患者IL-32血清水平明显高于AA基因型MS患者,差异存在显著统计学意义[(465.53±172.40)pg/ml vs (295.86±103.96)pg/ml,P<0.001;(491.15±133.65)pg/ml vs (295.86±103.96)pg/ml,P<0.001]。而AT型与TT型间的IL-32血清水平无显著统计学差异[(465.53±172.40)pg/ml vs (491.15±133.65)pg/ml,P=0.612]。
3 讨论
随着人类基因扫描计划的推进,完成了人类基因组DNA序列测序和分析工作,基因多态性在疾病中的影响逐渐受到重视。有研究表明,抗炎和促炎因素的失衡在MS患者的发病中扮演了重要的角色[9]。本研究发现,IL-32基因位点rs28372698与MS相关。IL-32基因rs28372698的三种基因型(AA、AT及TT)与等位基因(A、T)的分布频率在MS患者和健康人群中存在比较较大的差异,MS患者的T等位基因携带明显高于对照组,携带T等位基因的MS患者血清IL-32的表达水平明显高于非携带者,提示rs28372698基因的变异促进IL-32的高表达。
表3IL-32单倍基因型在MS患者与对照组之间的分布情况及风险分析
Tab.3RiskanalysisandhaploidgenotypedistributionbetweenMSpatientsandcontrols
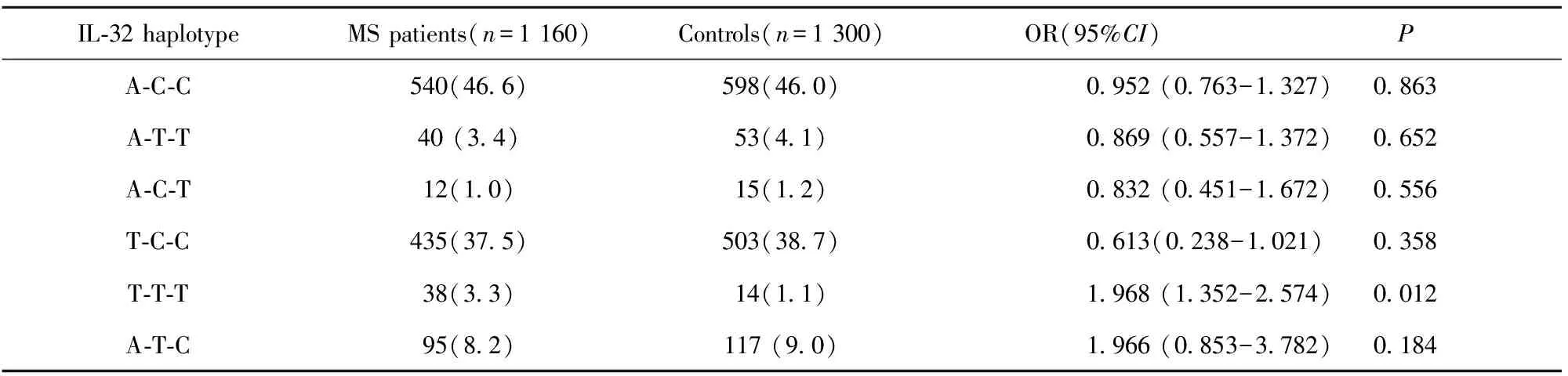
IL⁃32haplotypeMSpatients(n=1160)Controls(n=1300)OR(95%CI)PA⁃C⁃C540(46 6)598(46 0)0 952(0 763-1 327)0 863A⁃T⁃T40(3 4)53(4 1)0 869(0 557-1 372)0 652A⁃C⁃T12(1 0)15(1 2)0 832(0 451-1 672)0 556T⁃C⁃C435(37 5)503(38 7)0 613(0 238-1 021)0 358T⁃T⁃T38(3 3)14(1 1)1 968(1 352-2 574)0 012A⁃T⁃C95(8 2)117(9 0)1 966(0 853-3 782)0 184
研究发现IL-32基因位点rs28372698与MS相关。有报道表明,IL-32的高表达与一些炎症性疾病和感染性疾病相关[10,11],进一步研究发现,IL-32牵涉到一些癌症相关疾病的发病机制[12]。以往的研究证实,IL-32可以促进一些炎症因子的高表达,如TNF-α、IL-6及IL-8,同时,IL-32也涉及到各种趋化因子的分泌和合成[13,14]。最近的研究表明,IL-32 rs28372698A/T,rs129345-61C/T及rs11861531 C/T三个位点的基因多态性与子宫内膜癌、类风湿关节炎及肺纤维化存在密切关系,这些研究证实了炎症机制可能与IL-32的基因位点突变存在联系[15-17]。炎症在神经系统脱髓鞘病变的形成和发展是一个重要的因素。有研究证实,在MS患者外周血和脑脊液中,T淋巴细胞肿瘤坏死因子的 mRNA表达明显增加,表达水平与疾病严重程度相关,同时,IL-6在MS患者血清中显著升高,显然,这些炎症的调控过程与MS的发病密切相关[18-20]。重要的是,氧化应激参与了MS的病理生理过程[21,22],这个过程通过影响机体活性氧-炎症平衡损伤神经系统的髓鞘[23-25]。因此,IL-32可能作为一种炎症调控因子参与了MS患者 IL-32基因位点rs28372698的基因变异过程。
MS的确切病因与发病机制至今不明,炎症因素在许多发病环节中起着重要作用。本研究首次单碱基延伸和DNA测序对IL-32基因位点进行基因分型,证实了IL-32基因和MS易感等位基因的关系。在此基础上进一步研究了IL-32相关的单倍型与MS的关系,这个发现将有助于阐明MS患者独特的免疫和炎症遗传学机制,我们的研究结果可能为MS的分子分型、风险预测、辅助诊断和治疗方案提供重要的参考依据。
[1] Patejdl R,Penner IK,Noack TK,etal.Multiple sclerosis and fatigue:A review on the contribution of inflammation and immune-mediated neurodegeneration[J].Autoimmun Rev,2016,15(3):210-220.
[2] Keswani A,Kern RC,Schleimer RP,etal.Role of interleukin-32 in chronic rhinosinusitis[J].Curr Opin Allergy Clin Immunol,2013,13(1):13-18.
[3] Graber JJ,Ford D,Zhan M,etal.Cytokine changes during interferon-beta therapy in multiple sclerosis:correlations with interferon dose and MRI response[J].J Neuroimmunol,2007,185(1/2):168-174.
[4] 李 莉,宝福凯.白介素-32及其与炎症性疾病的关系研究进展[J].中国热带医学,2010,10(6):761-762,770.
Li L,Bao FK.Advance in the research of relationship between IL-32 and inflammatory diseases[J].Chin Trop Med,2010,10(6):761-762.
[5] Gonzalez-Hormazabal P,Musleh M,Bustamante M,etal.Role of cytokine gene polymorphisms in gastric cancer risk in Chile[J].Anticancer Res,2014,34(7):3523-3530.
[6] Arcaroli JJ,Liu N,Yi N,etal.Association between IL-32 genotypes and outcome in infection-associated acute lung injury[J].Crit Care,2011,15(3):R138.
[7] Wang Y,Yang Y,Zhu Y,etal.Polymorphisms and expression of IL-32:impact on genetic susceptibility and clinical outcome of lung cancer[J].Biomarkers,2017,22(2):165-170.
[8] 中华医学会神经病学分会.中国多发性硬化及相关CNS脱髓鞘疾病的诊断和治疗专家共识(草案)[J].中华神经科杂志,2006,39(12):862-864.
Inese medical association neurology branch.The diagosis and treatment of China′s multiple sclerosis and related demyelinating centerl nerovus system disease(Draft)[J].Chin J Neurol,2006,39(12):862-864.
[9] Macchi B,Marino-Merlo F,Nocentini U,etal.Role of inflammation and apoptosis in multiple sclerosis:Comparative analysis between the periphery and the central nervous system[J].J Neuroimmunol,2015,287(287):80-87.
[10] Khawar MB,Abbasi MH,Sheikh N.IL-32:A novel pluripotent inflammatory interleukin,towards gastric inflammation,gastric cancer,and chronic rhino sinusitis[J].Mediators Inflamm,2016,2016:8413768.
[11] Kim S.Interleukin-32 in inflammatory autoimmune diseases[J].Immune Netw,2014,14(3):123-127.
[12] Wang J,Wang Q,Han T,etal.Soluble interleukin-6 receptor is elevated during influenza A virus infection and mediates the IL-6 and IL-32 inflammatory cytokine burst[J].Cell Mol Immunol,2015,12(5):633-644.
[13] Netea MG,Lewis EC,Azam T,etal.Interleukin-32 induces the differentiation of monocytes into macrophage-like cells[J].Proc Natl Acad Sci U S A,2008,105(9):3515-3520.
[14] Saetta M,Baraldo S,Corbino L,etal.CD8+ve cells in the lungs of smokers with chronic obstructive pulmonary disease[J].Am J Respir Crit Care Med,1999,160(2):711-717.
[15] Yu XZ,Zhou B,Zhang Z,etal.Significant association between IL-32 gene polymorphisms and susceptibility to endometrial cancer in Chinese Han women[J].Tumour Biol,2015,36(7):5265-5272.
[16] Meyer B,Chavez RA,Munro JE,etal.DNA methylation at IL32 in juvenile idiopathic arthritis[J].Sci Rep,2015,5(5):11063.
[17] Li D,Chen D,Zhang X,etal.c-Jun n-terminal kinase and Akt signalling pathways regulating tumour necrosis factor-α-induced interleukin-32 expression in human lung fibroblasts:implications in airway inflammation[J].Immunology,2015,144(2):282-290.
[18] Mansouri B,Horner ME,Menter A.Tumor necrosis factor-α inhibitor use in psoriasis patients with a first-degree relative with multiple sclerosis[J].J Drugs Dermatol,2015,14(8):876-878.
[19] Yan J,Liu J,Lin CY,etal.Interleukin-6 gene promoter-572 C allele May play a role in rate of disease progression in multiple sclerosis[J].Int J Mol Sci,2012,13(10):13667-13679.
[20] Horellou P,Wang M,Keo V,etal.Increased interleukin-6 correlates with myelin oligodendrocyte glycoprotein antibodies in pediatric monophasic demyelinating diseases and multiple sclerosis[J].J Neuroimmunol,2015,289(15):1-7.
[21] Smith KJ,Lassmann H.The role of nitric oxide in multiple sclerosis[J].Lancet Neurol,2002,1(4):232-241.
[22] Koch M,Ramsaransing GS,Arutjunyan AV,etal.Oxidative stress in serum and peripheral blood leukocytes in patients with different disease courses of multiple sclerosis[J].J Neurol,2006,253(4):483-487.
[23] Gray E,Thomas TL,Betmouni S,etal.Elevated myeloperoxidase activity in white matter in multiple sclerosis[J].Neurosci Lett,2008,444(2):195-198.
[24] Zeis T,Probst A,Steck AJ,etal.Molecular changes in white matter adjacent to an active demyelinating lesion in early multiple sclerosis:molecular changes in MS periplaque white matter[J].Brain Pathol,2009,19(3):459-466.
[25] Fischer MT,Sharma R,Lim JL,etal.NADPH oxidase expression in active multiple sclerosis lesions in relation to oxidative tissue damage and mitochondrial injury[J].Brain,2012,135(Pt 3):886-899.