NEDD8共价修饰抑制因子MLN4924对人卵巢癌细胞株SKOV3增殖和凋亡的影响①
2018-03-23吴会芳赵亚伟张纪岩
刘 健 吴会芳 赵亚伟 张纪岩
(广西医科大学,南宁 530021)
神经前体细胞发育相关受控表达分子8(Neural precursor cell-expressed developmentally down regulat-ed 8,NEDD8 )是一种类泛素化样蛋白,与泛素最为接近[1,2]。NEDD8与底物蛋白共价结合的过程称之为NEDD8共价修饰(Neddylation),有着调节底物蛋白稳定性、亚细胞定位和活性的作用。与泛素化修饰相同,NEDD8共价修饰需要酶1(Enzyme1,E1)、酶2(Enzyme2,E2)、酶3(Enzyme3,E3)的连续催化[3],最终完成NEDD8分子与底物蛋白分子的共价结合。鉴定最清楚的NEDD8修饰底物是Cullins,Cullins是一类重要的泛素化修饰E3复合物中的关键组分,通过降解P-IκBα等机制促进细胞存活与增殖。MLN4924是一种小分子化合物,能够特异性地与NEDD8活化酶E1结合,从而抑制NEDD8共价修饰的发生。大量研究报道揭示,NEDD8活化酶E1有希望成为抗肿瘤药物的新靶点,而MLN4924作为NEDD8修饰的特异性抑制剂,可以抑制结肠癌、肺癌、多发性骨髓癌等多种肿瘤细胞的恶性生长[4-6],有望成为新型抗肿瘤药物。
近年来,我国卵巢癌的发病率正在逐年上升,且趋于年轻化,成为第二大危害女性健康的恶性肿瘤,是我国肿瘤治疗的重点之一。目前,随着我国医疗水平的提高,虽然很多患者的症状可以在早期就被发现并给予治疗,使患者生存期大大延长,但依然存有很高的死亡率,严重威胁女性的身心健康。MLN4924对卵巢癌细胞恶性生长的影响及机制还不清楚,本文以不同浓度的MLN4924作用于人卵巢癌细胞株SKOV3,通过CCK-8法及Annexin V-APC/PI双染等方法观察其对细胞增殖和凋亡的影响,并探讨其可能机制[7,8],进而为临床应用提供一定的理论依据,现将结果报道如下。
1 材料与方法
1.1材料
1.1.1主要试剂 MLN4924,美国Active Biochen公司;胎牛血清,美国HyClone公司;AnnexinV-APC/PI试剂盒,美国BioLegend公司;RIPA裂解液、蛋白定量试剂盒,北京天根生物公司;山羊抗兔NEDD8抗体,英国Abcam公司;山羊抗兔P-IκBα和HER2抗体,美国Cell Signaling公司;山羊抗兔PAR3抗体,中国爱必信公司;山羊抗鼠β-actin抗体,美国Santa Cruz公司;辣根过氧化物酶标记的山羊抗小鼠和山羊抗兔IgG二抗,北京中杉金桥公司;CCK-8试剂盒,碧云天公司;ECL和人IL-6 ELISA试剂盒,美国Thermo公司;X光片、显影液、定影液,美国Kodak公司。
1.1.2仪器设备 CO2培养箱、低温高速冷冻离心机,美国Thermo公司;酶标仪,瑞士Tecan sunrise公司;紫外分光光度计,北京普析通用仪器有限责任公司;FACS Calibur型流式细胞仪,美国BD公司。SDS-PAGE蛋白电泳及转印,美国Bio-Rad公司。
1.2方法
1.2.1细胞培养 人卵巢癌细胞株SKOV3,本实验室保种存放。由含10%胎牛血清的DMEM培养基,于37℃、5%CO2培养箱中培养,待细胞融合度生长至80%左右,0.25%胰酶消化、计数、传代。1.2.2CCK8法检测细胞存活 取对数生长期的SKOV3细胞,以每孔5×103细胞接种于96孔板,置于37℃、5%CO2培养箱中待细胞贴壁后,分别加入MLN4924 0、0.125、0.25和0.5 μmol/L处理72 h,每组设4个复孔。72 h后,每孔直接加入1/10体积的Cell Counting Kit 8(CCK8),充分混合,保证孔中蓝色均一性,但避免产生气泡。于37℃培养箱中培养1 h至颜色变为橙色,在酶标仪450 nm波长处读取吸光度(A450 nm)值。细胞增殖抑制率(%)=(1-药物组A450 nm/对照组A450 nm)×100%。
1.2.3Western蛋白印迹法检测蛋白表达水平 使用不同浓度MLN4924 0、0.125、0.25和0.5 μmol/L处理24孔板内生长良好的SKOV3细胞4 h后,用预冷的PBS 1 ml/孔洗涤细胞一次,每孔加80 μl RIPA裂解液,用细胞刮在冰上迅速刮下,吸取裂解液至预冷的1.5 ml EP管中,冰上裂解15 min,再4℃离心机,13 000 r/min离心15 min,吸取上清至新的预冷1.5 ml EP管中,利用蛋白定量试剂盒调整蛋白浓度一致。加入4×SDS上样缓冲液,100℃沸水煮10 min,6 000 r/min离心30 s,弹匀。SDS-PAGE电泳,60 V恒压转印3 h冰浴电转至PVDF膜,5%脱脂牛奶的TBST室温封闭1 h后,加入一抗(PAR3、HER2、NEDD8、P-IκBα、β-Actin)4℃过夜,次日TBST洗涤10 min×3遍后加二抗室温孵育1 h,TBST洗涤10 min×3遍后,于暗室加入ECL发光显影。
1.2.4ELISA法测定IL-6的表达情况 将生长良好的SKOV3细胞用0.25%的胰蛋白酶消化,用DMEM培养基重悬细胞,以每孔5×104细胞接种于24孔板。置于37℃、5%CO2培养箱中待细胞贴壁,分别加入MLN4924 0、0.125、0.25和0.5 μmol/L处理4 h,每组设两个复孔,4 h时取培养基上清,按照ELISA试剂盒说明操作检测,在酶标仪450 nm波长处读取吸光度,测定其OD A450 nm值,使用prism软件计算分析。
1.2.5流式细胞仪分析细胞周期 处理方法同上述1.2.4,培养72 h后用0.25%胰蛋白酶消化收集细胞,PBS洗涤两遍弃上清,70%乙醇4℃固定过夜,与RNaseA在37℃下共培养30 min后用PI避光染色10~15 min后,立即用流式细胞仪测定细胞周期。实验重复3次。
1.2.6流式细胞仪检测细胞凋亡 处理方法同上述1.2.4,培养72 h后用0.25%胰蛋白酶消化收集细胞,PBS洗涤一遍弃上清,Annexin V Buffer洗涤并重悬,按照试剂盒说明分别加入Annexin V-APC/PI抗体,避光染色15 min后,立即用流式细胞仪测定细胞凋亡率。实验重复3次。
2 结果
2.1MLN4924对SKOV3细胞增殖的抑制作用 MLN4924在0.125、0.25和0.5 μmol/L的浓度下对SKOV3细胞作用72 h时,对细胞增殖有明显的抑制作用,并且随着剂量的加大,抑制效果也显著提高,在0.125、0.25和0.5 μmol/L的浓度下,细胞增殖抑制率分别达到了5%、32%和41%,见图1。
2.2MLN4924通过诱导P-IκBα积聚抑制IL-6表达 已有研究表明,自分泌的IL-6促进HER2阳性肿瘤细胞恶性生长,而NF-κB、PAR3和HER2是这些细胞中调控IL-6表达的关键机制[9-12]。分别加入MLN4924 0、0.125、0.25和0.5 μmol/L处理SKOV3细胞4 h后,0.25和0.5 μmol/L组细胞培养上清中IL-6分泌下降(图2)。同样条件下,将细胞裂解,Western blot检测PAR3、HER2、Neddylated-cullins、P-IκBα的表达水平。发现P-IκBα随MLN4924剂量的升高而积聚,NEDD8共价修饰的Cullins蛋白量明显降低,而PAR3、HER2表达水平变化不显著(图3)。提示MLN4924诱导P-IκBα积聚,IκBα降解减少,NF-κB入核减少,导致IL-6表达下降。
2.3MLN4924对SKOV3细胞周期的影响 由图4和表1可以看出,SKOV3细胞经不同浓度MLN4924刺激72 h后,加药组S期细胞百分比相较于对照组明显升高,表明MLN4924诱导细胞S期阻滞,且MLN4924 剂量在0.25和0.5 μmol/L时,可以看到形成了大量的四倍体细胞,使之没有完整的细胞周期,从而抑制细胞增殖。
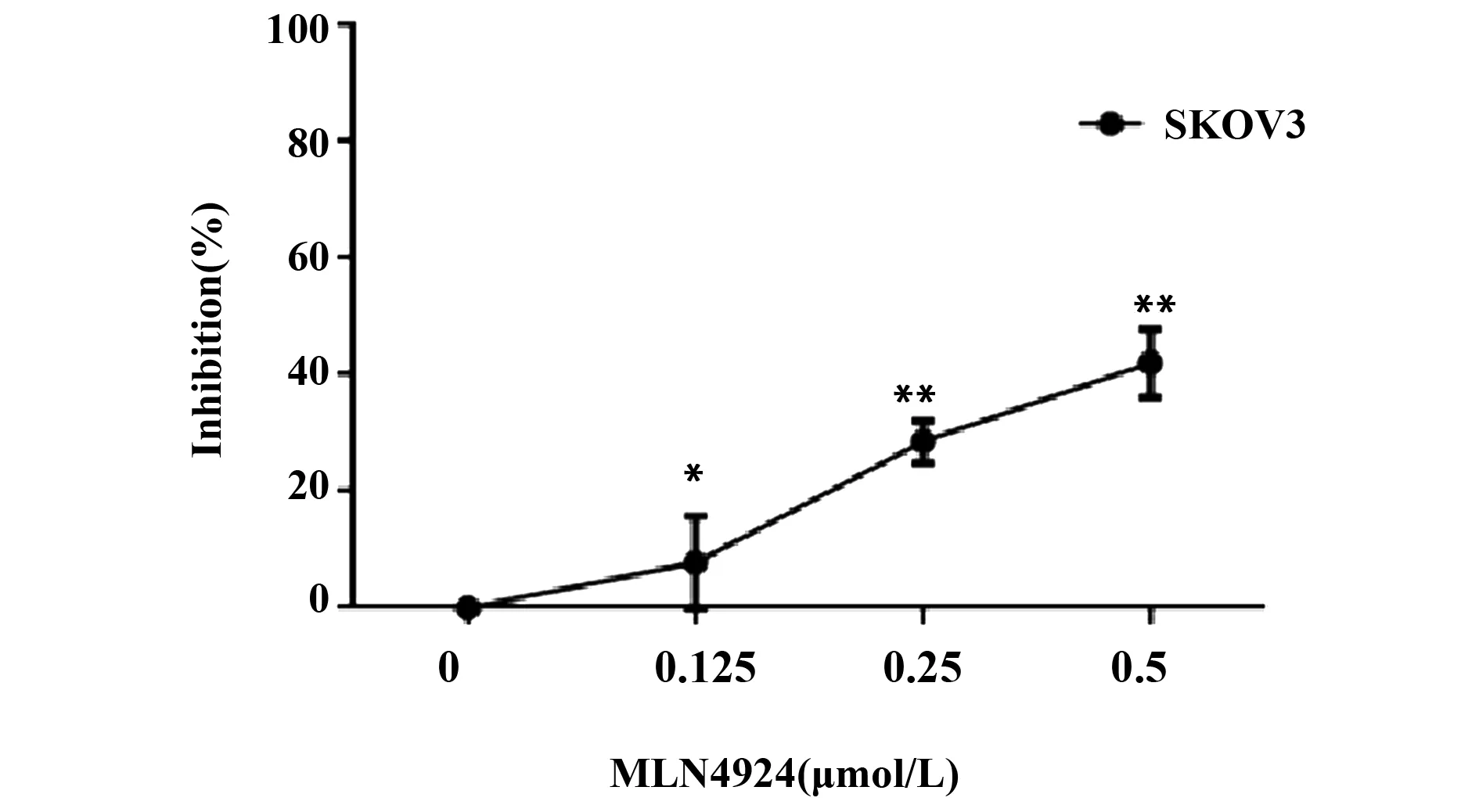
图1 MLN4924对SKOV3细胞增殖的抑制作用Fig.1 Inhibitory effect of MLN4924 on proliferation of SKOV3 cells(±s,n=4)Note:Compared with control (0 μmol/L) group,*.P<0.05,**.P<0.01.
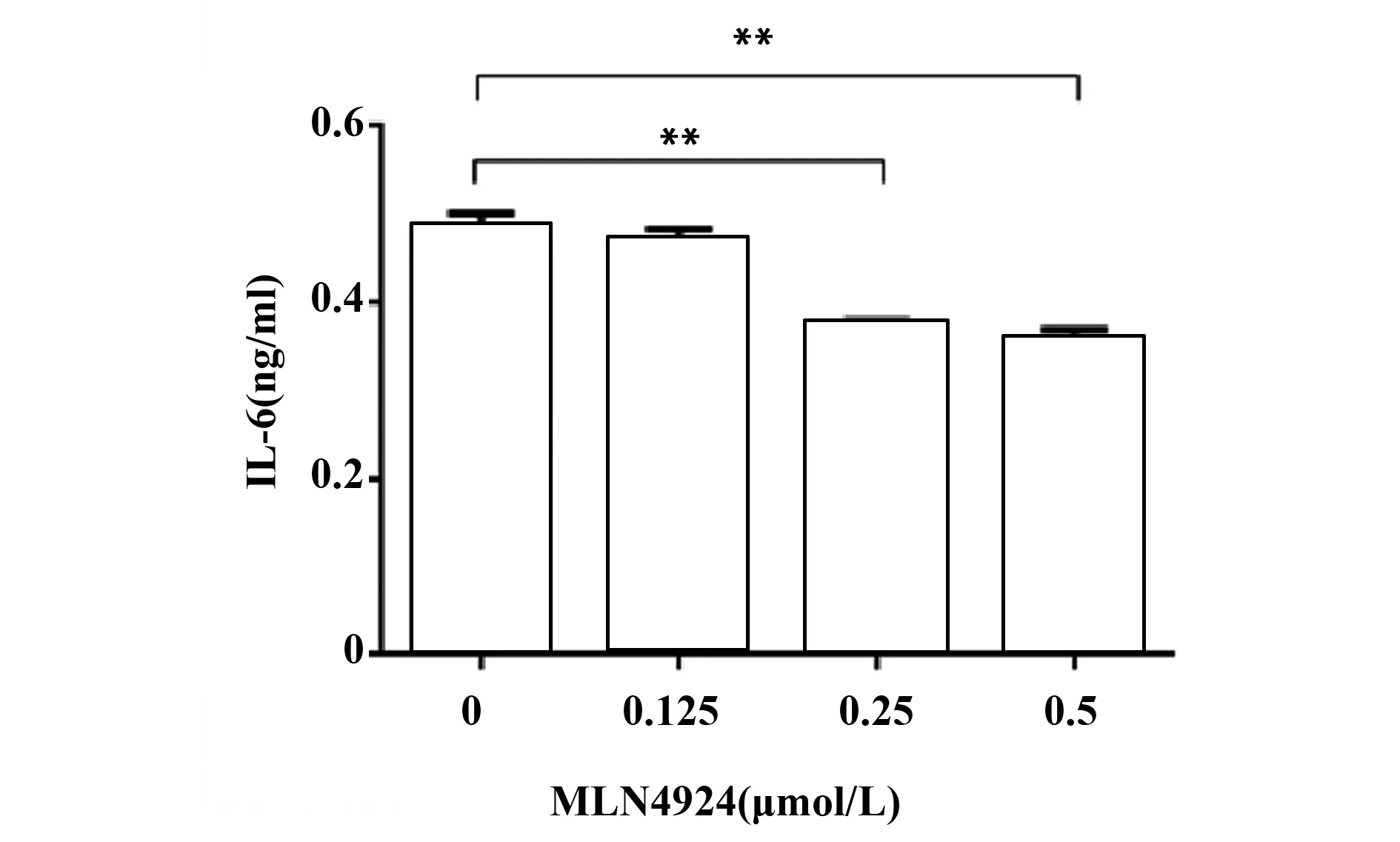
图2 MLN4924对SKOV3细胞分泌IL-6的抑制作用Fig.2 Inhibitory effect of MLN4924 on secretion of IL-6 by SKOV3 cells
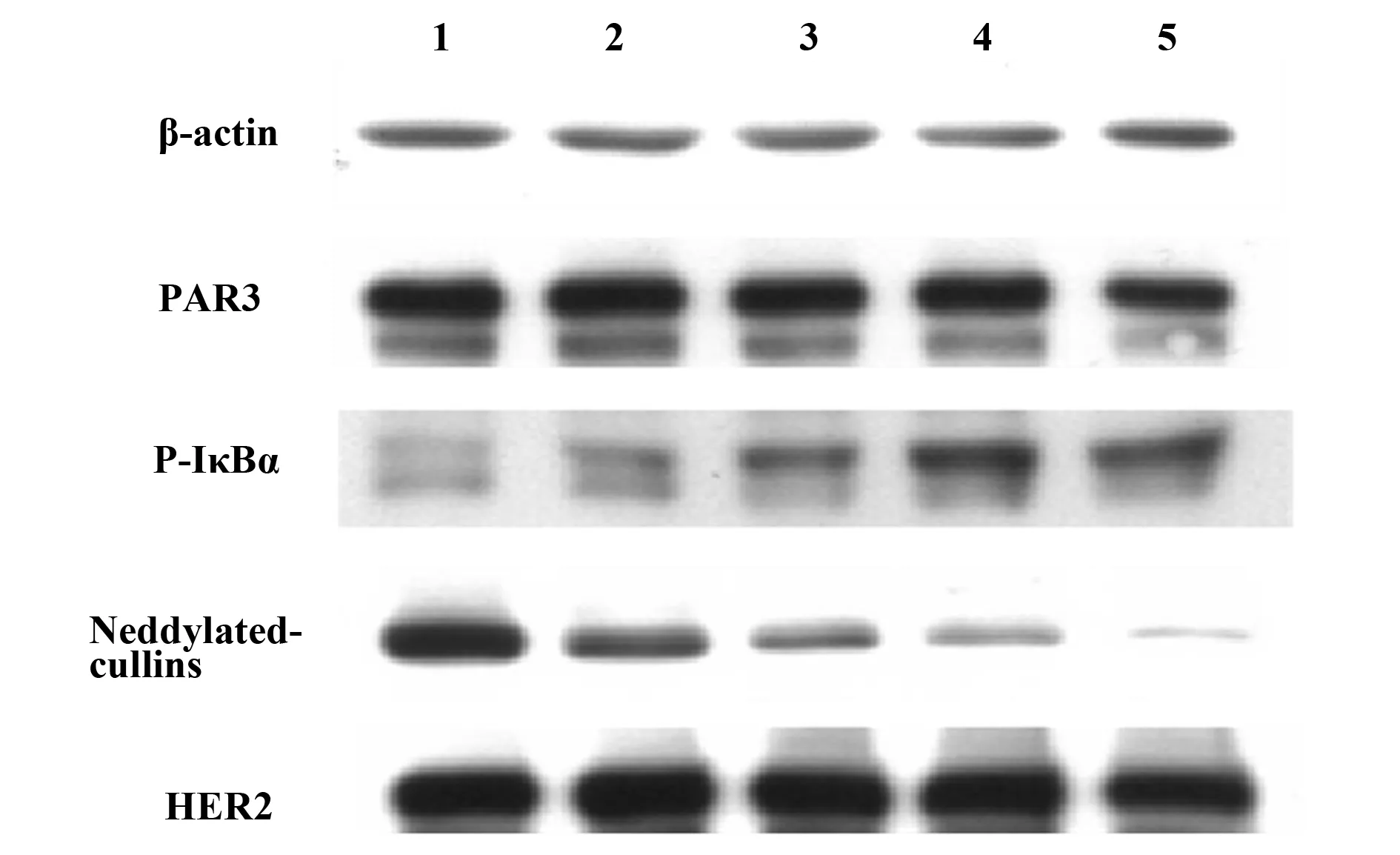
图3 MLN4924对SKOV3细胞PAR3、P-IκBα、neddylated-cullins、HER2表达的影响Fig.3 Effect of MLN4924 on PAR3,P-IκBα,neddylated-cullins,HER2 expression in SKOV3 cellsNote:Lanes 1-5.MLN4924 0,0.125,0.25,0.5,1 μmol/L,respectively.
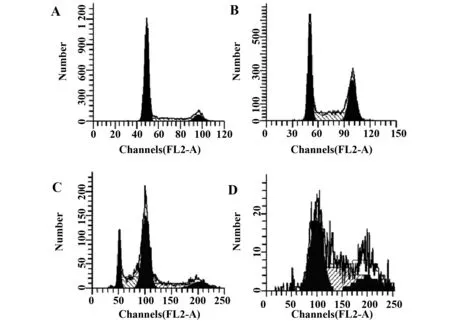
图4 MLN4924对SKOV3细胞周期的影响Fig.4 Effect of MLN4924 on cell cycle of SKOV3 cellsNote:A-D.MLN4924 0,0.125,0.25 or 0.5 μmol/L treatment for 72 h,respectively.
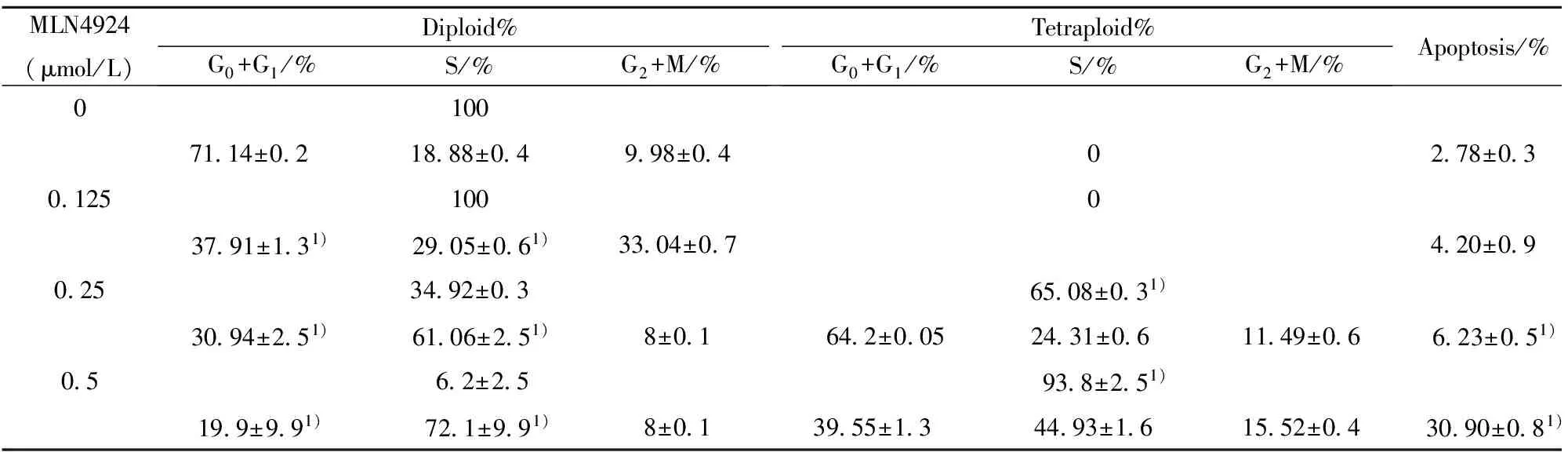
MLN4924(μmol/L)Diploid%G0+G1/%S/%G2+M/%Tetraploid%G0+G1/%S/%G2+M/%Apoptosis/%010071 14±0 2 18 88±0 49 98±0 402 78±0 30 125100037 91±1 31) 29 05±0 61)33 04±0 74 20±0 90 2534 92±0 365 08±0 31)30 94±2 51) 61 06±2 51)8±0 164 2±0 0524 31±0 611 49±0 6 6 23±0 51)0 5 6 2±2 5 93 8±2 51)19 9±9 91) 72 1±9 91)8±0 139 55±1 3 44 93±1 615 52±0 4 30 90±0 81)
Note:Compared with control (0 μmol/L) group,1)P<0.01.
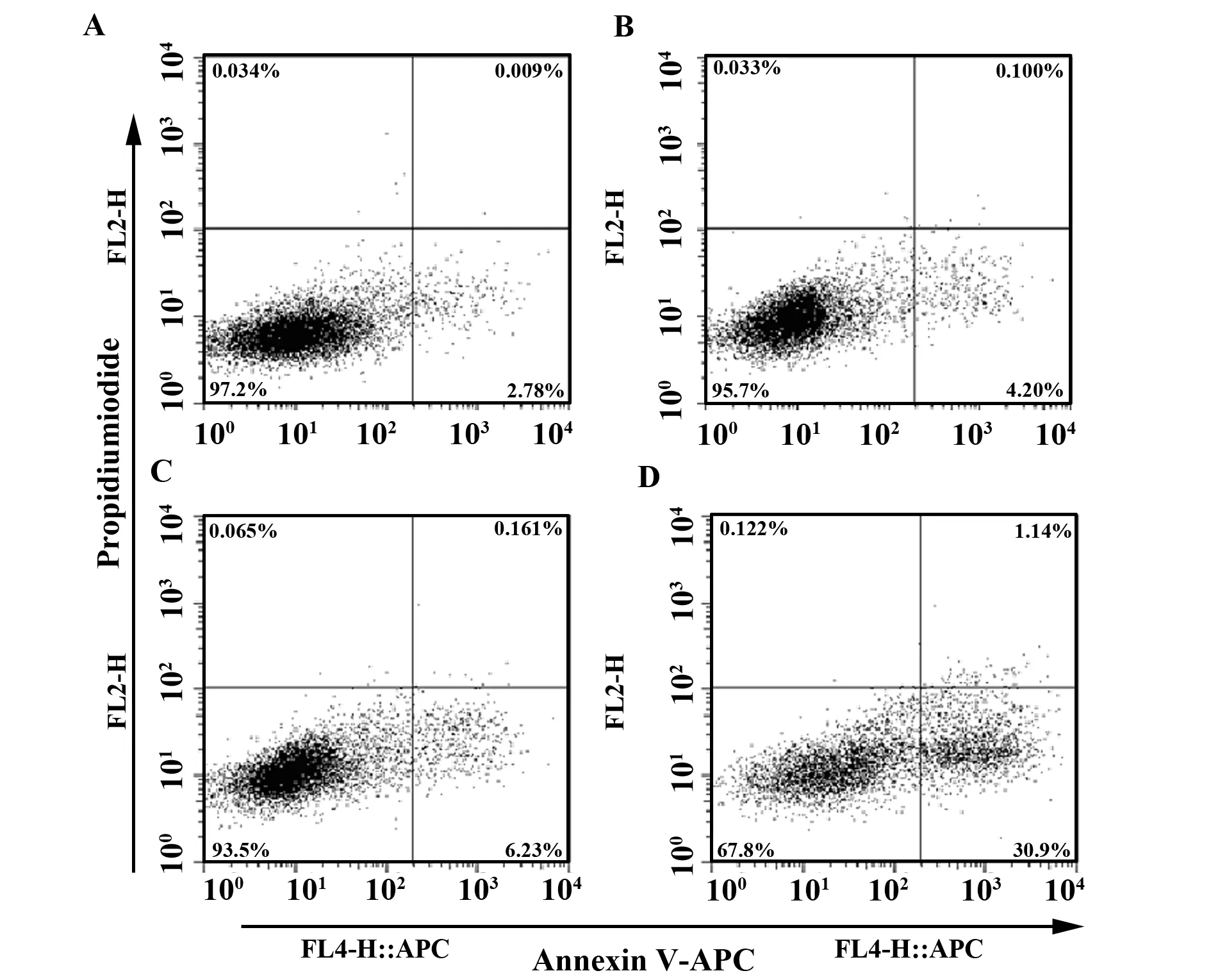
图5 MLN4924对SKOV3细胞凋亡的影响Fig.5 Effect of MLN4924 on apoptosis of SKOV3 cellsNote:A-D.MLN4924 0,0.125,0.25 or 0.5 μmol/L treatment for 72 h,respectively.
2.4MLN4924对SKOV3细胞凋亡的影响 用浓度为0、0.125、0.25和0.5 μmol/L的MLN4924处理SKOV3细胞72 h后,流式细胞仪检测细胞凋亡率,加药组与对照组相比较发现,随着MLN4924浓度的增加,细胞凋亡率也明显提升,并且具有统计学意义(P<0.05)。表明MLN4924能够诱导细胞凋亡,从而抑制细胞增殖(表1、图5)。
3 讨论
本研究结果显示,MLN4924在体外对SKOV3细胞增殖具有明显的抑制作用。SKOV3细胞是HER2阳性肿瘤细胞,这类细胞的恶性生长往往依赖于IL-6的自分泌,而NF-κB,PAR3和HER2是调控IL-6表达分泌的关键机制[9-12]。为了研究MLN4924对卵巢癌细胞增殖抑制的作用机制,我们用Western blot检测了PAR3、HER2、Neddylated-cullins、P-IκBα的表达,同时检测IL-6的分泌情况。我们的结果提示MLN4924处理导致P-IκBα积聚,IκBα降解减少,NF-κB入核减少,所以导致了IL-6表达下降[13,14]。
细胞的增殖依赖于细胞周期的运行,而肿瘤治疗的中心环节就是干扰肿瘤细胞的细胞周期,从而使肿瘤细胞增殖速率减慢或诱导肿瘤细胞走向死亡。我们还分析了不同浓度MLN4924处理后,MLN4924对SKOV3细胞周期和细胞凋亡影响的研究。实验结果表明,MLN4924诱导细胞S期阻滞,且MLN4924剂量在0.25和0.5 μmol/L时,形成了大量的四倍体细胞,使之没有完整的细胞周期,同时细胞凋亡率明显升高,从而抑制细胞增殖[15]。
P-IκBα积聚、IL-6自分泌的下降可以部分解释MLN4924对SKOV3细胞增殖的抑制作用和凋亡效应。但是细胞S期阻滞,特别是大量的四倍体细胞的形成,无法用这一机制来解释。显然,MLN4924利用多种机制抑制卵巢癌细胞的恶性生长。
总之,本实验从细胞水平阐述了MLN4924对卵巢癌细胞SKOV3增殖的抑制作用,为其用于卵巢癌的临床治疗提供了一定的理论依据,下一步将从具体的分子机制、与现有化疗药物之间的协同效应等方面进行实验,并进一步评价MLN4924对卵巢癌发生发展的抑制作用及其安全性。
[1] Kim W,Bennett EJ,Huttlin EL,etal.Systematic and quantitative assessment of the ubiquitin-modified proteome[J].Mol Cell,2011,44(21):325-340.
[2] Burroughs AM,Balaji S,Lyer LM,etal.Small but versatile:the extraordinary functional and structural diversity of the beta-grasp fold[J].Biol Direct,2007,2(18):1-28.
[3] Soucy TA,Smith PG,Milhollen MA,etal.An inhibitor of NEDD8-activating enzyme as a new approach to treat cancer[J].Nature,2009,458(7239):732-736.
[4] Lin JJ,Milhollen MA,Smith PG,etal.NEDD8-targeting drug MLN4924 elicits DNA rereplication by stabilizing Cdt1 in S phase,triggering checkpoint activation,apoptosis,and senescence in cancer cells[J].Cancer Res,2010,70(24):10310-10320.
[5] Milhollen MA,Narayanan U,Soucy TA,etal.Inhibition of NEDD8-activating enzyme induces rereplication and apoptosis in human tumor cells consistent with deregulating CDT1 turnover[J].Cancer Res,2011,71(8):3042-3051.
[6] Swords RT,Kelly KR,Smith PG,etal.Inhibition of NEDD8-activating enzyme:a novel approach for the treatment of acute myeloid leukemia[J].Blood,2010,115(33):3796-3800.
[7] 钟秀宏,赵丽微,赵芬琴,等.桦褐孔菌醇诱导人卵巢癌SKOV3 细胞株凋亡及其分子机制研究[J].中国药学杂志,2014,49(3):191-194.
Zhong XH,Zhao LW,Zhao FQ,etal.Effect of inotodiol on cell proliferation and apptosis of human ovary cancer cell line SKOV3 and its molecular mechanism[J].China Pharm J,2014,49(3):191-194.
[8] 马湘一,王世宣,刘 琰,等.雷帕霉素联合紫杉醇诱导卵巢癌细胞A2780和SKOV3 凋亡及其分子机制[J].癌症,2007,26(4):367-370.
Ma XY,Wnag SX,Liu Y,etal.Induction effect of rapamycin combined paclitaxel on apoptosis of ovarian cancer cells lines A2780 and SKOV3 and the molecular mechanism[J].Clin J Cancer,2007,26(4):367-370.
[9] Jin S,Mutvei AP,Chivukula IV,etal.Non-canonical Notch signaling activates IL-6/JAK/STAT signaling in breast tumor cells and is controlled by p53 and IKK/IKK[J].Oncogene,2013,32(41):4892-4902.
[10] Guyer RA and Macara IG.Loss of the polarity protein PAR3 activates STAT3 signaling via atypical protein kinase C (aPKC)/NF-B/interleukin-6 (IL-6) axis in mouse mammary cells[J].J Biol Chem,2015,290(13):8457-8468.
[11] Huang WC,Hung CM,Wei CT,etal.Interleukin-6 expression contributes to lapatinib resistance through maintenance of stemness property in HER2-positive breast cancer cells[J].Oncotarget,2016,7(38):62352-62363.
[12] Hartman ZC,Yang XY,Glass O,etal.HER2 overexpression elicits a proinflammatory IL-6 autocrine signaling loop that is critical for tumorigenesis[J].Cancer Res,2011,71(13):4380-4391.
[13] Read MA,Brownell JE,Gladysheva TB,etal.NEDD8 modification of cul-1 activates SCF(beta(TrCP))-dependent ubiquitination of IkappaBalpha[J].Mol Cell Biol,2000,20(7):2326-2333.
[14] Saha A,Deshaies RJ.Multimodal activation of the ubiquitin ligase SCF by Nedd8 conjugation[J].Mol Cell,2008,32(10):21-31.
[15] Soucy TA,Smith PG,Milhollen MA,etal.An inhibitor of NEDD8-activating enzyme as a new approach to treat cancer[J].Nature,2009,458(7239):732-736.