miR-194在增龄性胸腺萎缩中的表达及靶基因研究①
2018-03-23易丽君祝漫琴胡清华江志军郭智彬
易丽君 祝漫琴 周 菁 胡清华 黄 慧 陈 卡 江志军 郭智彬
(江西省儿童医院中心实验室,南昌 330006)
胸腺作为中枢免疫器官的一种,是胸腺依赖性淋巴细胞(Thymus-dependent lymphocyte,简称T细胞)分化发育的场所[1,2]。随着我国老龄人口的不断增长,其健康水平受到越来越多的社会及政府关注。而老年人的免疫水平低下是老年病的重要诱因之一。特别是老年人胸腺的重量和结构发生显著萎缩,外周免疫器官中成熟T细胞数量显著降低,机体免疫功能受到严重影响。随着年龄的增加,胸腺重量和体积明显缩小,免疫功能减退的过程称为增龄性胸腺萎缩。胸腺由胸腺细胞与胸腺基质细胞组成。胸腺细胞是处于不同分化阶段的T细胞。胸腺基质细胞是胸腺微环境的主要成分,包括胸腺上皮细胞、树突状细胞、成纤维细胞与巨噬细胞。已有文献报道胸腺微环境中促进T淋巴细胞发育的主要是胸腺上皮细胞[3,4]。国内外公认的增龄性胸腺萎缩机理有两种:①胸腺细胞功能受损,数量减少,直接影响胸腺细胞分化与成熟。②胸腺上皮细胞的数量减少,功能缺失,破坏了胸腺细胞发育的胸腺微环境,间接影响胸腺细胞分化与成熟。本课题组前期研究结果支持后者。
miRNA是一种22 bp左右的非编码蛋白RNA,在真核细胞中miRNA通过结合特异序列影响相关靶基因的表达水平[5]。在胸腺的发育、衰老以及T细胞的成熟过程中已发现很多miRNA参与调节进程。如miR-181a,参与了胸腺细胞分化与发育过程等[6]。目前为止,关于miR-194在胸腺增龄萎缩过程中的作用机制尚无报道。本实验旨在通过检测不同年龄组胸腺上皮细胞中miR-194与相应靶基因表达水平并探讨二者关系,阐述增龄性胸腺萎缩过程中的调节机制。
1 材料与方法
1.1动物分组与细胞提取 24只健康无疾病且无特定病原体(Specific pathogen free,SPF)级C57BL/6小鼠,购自上海斯莱克实验动物有限公司,每只体质量25 g左右。中老龄小鼠均为自然老化。所有小鼠均在本实验中心饲养。小鼠按月龄分为4组:1月龄组、6月龄组、10月龄组和19月龄组,每组6只,雌雄各半。小鼠麻醉后,用眼科摄取出胸腺组织,置于无菌PBS液中,将胸腺囊膜轻轻撕裂并振荡,释放出T细胞。经过CD45抗体磁珠分选法获得胸腺上皮细胞。
1.2方法
1.2.1总RNA和反转录按照试剂盒说明书提取各组胸腺上皮细胞总RNA。紫外分光光度仪检测总RNA浓度及纯度,琼脂糖凝胶(1.5%)电泳检测总RNA是否完整。取0.5 μg总RNA,利用SYBRTMPrime Script RT-PCR kit反转录成cDNA。
1.2.2miRNA的提取、加尾与反转录参照miRNA 抽提试剂盒说明书提取各组胸腺细胞miRNA。核酸紫外分析仪检测miRNA浓度及纯度。参照Ecoli.Poly(A)聚合酶试剂盒将miRNA进行加尾。取0.5 μg加尾后的miRNA,利用SYBR Prime ScriptTMRT-PCR kit反转录成cDNA。反转录引物为:5-GCTGTCAACGATACGCTACGTAACGGCATG-ACAGTG(T)24V-3′。
1.2.3实时荧光定量PCR反应 反应体积 20 μl(TaKaRa,Japan):RNase Freed H2O 6 μl,2×SYBR PrimeScriptTM10 μl上下游引物2 μl,DNA模板(cDNA)2 μl,共计20 μl。在ABI7500中进行Real-time PCR反应。miR-194上游引物序列:CATTCAACGCTGTCGGTGAGT;下游引物序列:GCTGTCAACGATACGCTACGTAACG。PTPN12上游引物序列:TCCTGAGGAGGTTCATCCAGA;下游引物序列:CAGTGGCTGTGGGATAAATCTT。GAPDH上游引物序列:AGGTCGGTGTGAACGGATTTG;下游引物序列:GGGGTCGTTGATGGCAACA。miRNA内参引物使用美国 Ambion公司U6 snRNA。
1.2.4蛋白质免疫印迹实验 从胸腺上皮细胞或OP9-DL1细胞中提取总蛋白并测定蛋白浓度。取总蛋白30 μg,经10%SDS/PAGE分离胶电泳后转膜,用5%脱脂牛奶封闭,室温静置2 h。再经过PTPN12抗体(1∶1 00)、β-actin抗体(1∶2 000)孵育,4℃过夜。然后TBST洗膜6次,5 min/次,加入辣根酶标记IgG(稀释),室温孵育60 min,TBST洗二抗3次。最后加入化学发光显色液,暗室压片,显影和定影。使用Bio-Rad扫描仪扫描图像,并用Image Lab进行灰度值分析,将PTPN12与β-actin灰度值的比值作为蛋白的相对表达量。
1.2.5细胞的培养与转染 HEK293细胞购买自南昌乐悠生物有限公司,DMEM高糖(HyClone),10%FBS(HyClone),37℃、5%CO2,过夜培养。OP9-DL1获赠于中国医科大学附属盛京医院中心实验室,DMEM高糖(自配),10%FBS(Gibco),37℃、5%CO2,过夜培养。细胞转染:50 μl Opti-MEMI培养基稀释0.8~1.0 μg DNA,50 μl Opti-MEMI培养基稀释1 μl Lipofectamine 2000试剂。混合稀释的DNA和Lipofectamine 2000并直接将复合物加入到每孔细胞中,37℃、5%CO2培养箱孵育24 h或48 h。
1.2.6荧光素酶报告基因检测 为验证 PTPN12是否为miR-194的靶基因,将插入PTPN12基因3′UTR片段(野生型或突变型)的荧光素酶报告载体与 miR-194 mimics(或miR-194 inhibitor)共转染HEK293细胞中。所有荧光素酶报告载体、mimics与inhibitor均购自广州复能基因有限公司。分别于24 h、48 h后吸取细胞培养液。按试剂说明书稀释10倍GLS buffer母液至1倍工作液,避光室温孵育25 min。加10 μl培养液至96孔板中再加入GLS buffer工作液100 μl,孵育1 min。取40~50 μl培养液,65℃孵育10~15 min,置于冰上。SEAP buffer中加入SEAP底物,室温孵育5~10 min。加样至96孔板中,开始检测。
2 结果
2.1不同月龄组胸腺上皮细胞内PTPN12基因与miR-194表达水平 随着月龄增长,小鼠胸腺上皮细胞内miR-194呈现表达下降趋势(表1),1月龄组与其他3组间均存在统计学差异(P<0.05)。其中19月龄组小鼠胸腺上皮细胞内miR-194表达下降趋势最显著,见图1A。而PTPN12基因mRNA表达水平则明显呈现上升趋势(表1),1月龄与其他3组间均存在统计学差异(P<0.05)。其中19月龄组小鼠胸腺上皮细胞内 PTPN12表达上升趋势最显著,见图1B。
表1不同月龄小鼠胸腺上皮细胞内miR-194、PTPN12表达水平变化
Tab.1ExpressionofmiR-194andPTPN12inthymusepi-thelialcellsfromdifferentmonthsofmouse
与mRNA结果一致的是,PTPN12的蛋白表达水平也呈现上升趋势(表1), 1月龄组与其他3组间均存在统计学差异(P<0.05),见图1D、E。相关性分析结果显示,小鼠胸腺上皮细胞内miR-194与PTPN12基因mRNA表达水平呈负相关性(r=-0.80,P<0.05),见图1C。
2.2荧光素酶报告基因实验 分别转染miR-194 mimics或 inhibitor 24 h后检测荧光值,详见表2。结果显示过表达miR-194 后,PTPN12基因3′UTR野生型组荧光值显著降低约50%,与突变组、空质粒组(NC)、乱序组均有统计学差异(P<0.05)。而PTPN12基因3′UTR位点突变后与miR-194的结合效率明显下降,与空白质粒组及Scramble 1组三组荧光值无统计学差异。该结果直接证实PTPN12基因是miR-194靶基因之一。
表2分别转染miR-194mimics或inhibitor24h后结果
Tab.2ResultoftransfectionofmiR-194mimicsorinhibi-torintocellsafter24h
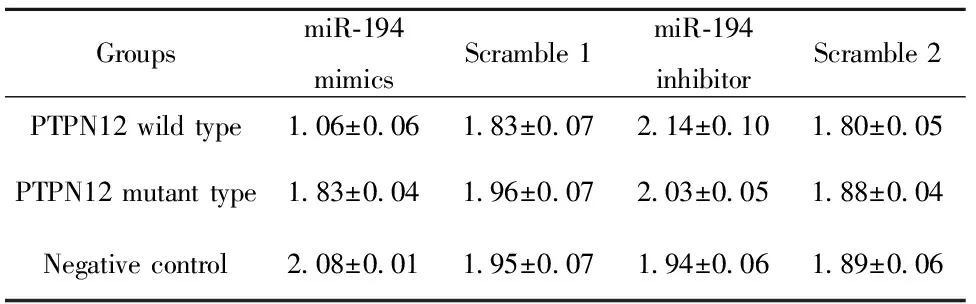
GroupsmiR⁃194mimicsScramble1miR⁃194inhibitorScramble2PTPN12wildtype1 06±0 061 83±0 072 14±0 101 80±0 05PTPN12mutanttype1 83±0 041 96±0 072 03±0 051 88±0 04Negativecontrol2 08±0 011 95±0 071 94±0 061 89±0 06
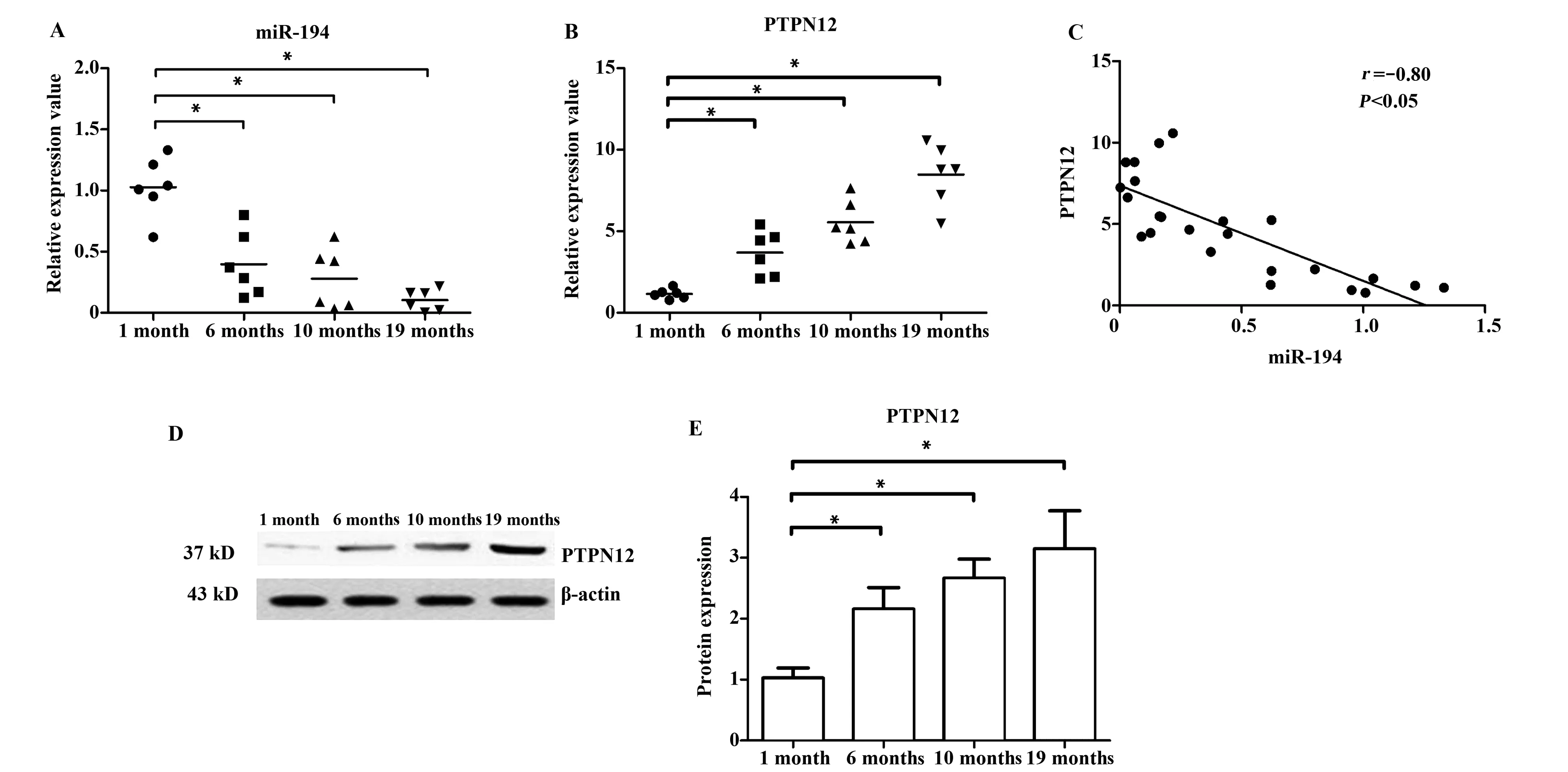
图1 miR-194与PTPN12基因的表达水平及相关性分析Fig.1 Expression level and correlation analysis of miR-194 and PTPN12 geneNote:A.miR-194 expression level;B.PTPN12 mRNA expression level;C.Correlation analysis between miR-194 and PTPN12 mRNA expression;D.PTPN12 protein expression level(Western blot);E.PTPN12 protein expression level (statistics).
表3分别转染miR-194mimics或inhibitor48h后结果
Tab.3ResultoftransfectionofmiR-194mimicsorinhi-bitorintocellsafter48h
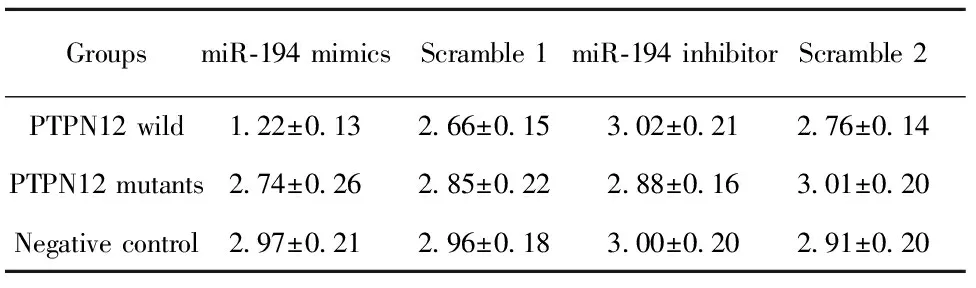
GroupsmiR⁃194mimicsScramble1miR⁃194inhibitorScramble2PTPN12wild1 22±0 132 66±0 153 02±0 212 76±0 14PTPN12mutants2 74±0 262 85±0 222 88±0 163 01±0 20Negativecontrol2 97±0 212 96±0 183 00±0 202 91±0 20
表4转染miR-194mimic48h后检测PTPN12表达水平
Tab.4ExpressionlevelofPTPN12withmiR-194mimictransfectionintocellsafter48h
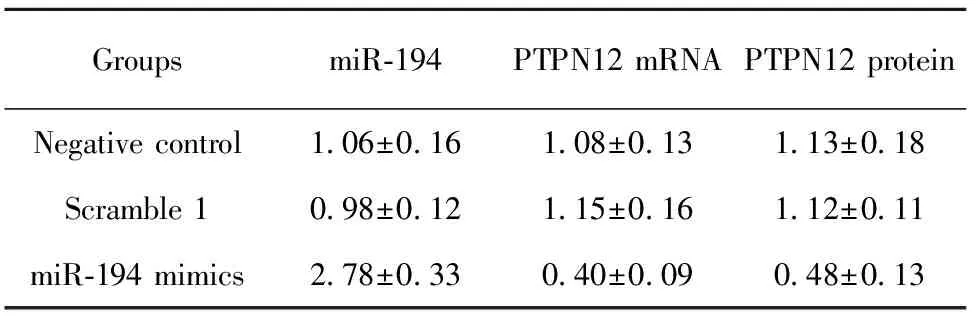
GroupsmiR⁃194PTPN12mRNAPTPN12proteinNegativecontrol1 06±0 161 08±0 131 13±0 18Scramble10 98±0 121 15±0 161 12±0 11miR⁃194mimics2 78±0 330 40±0 090 48±0 13
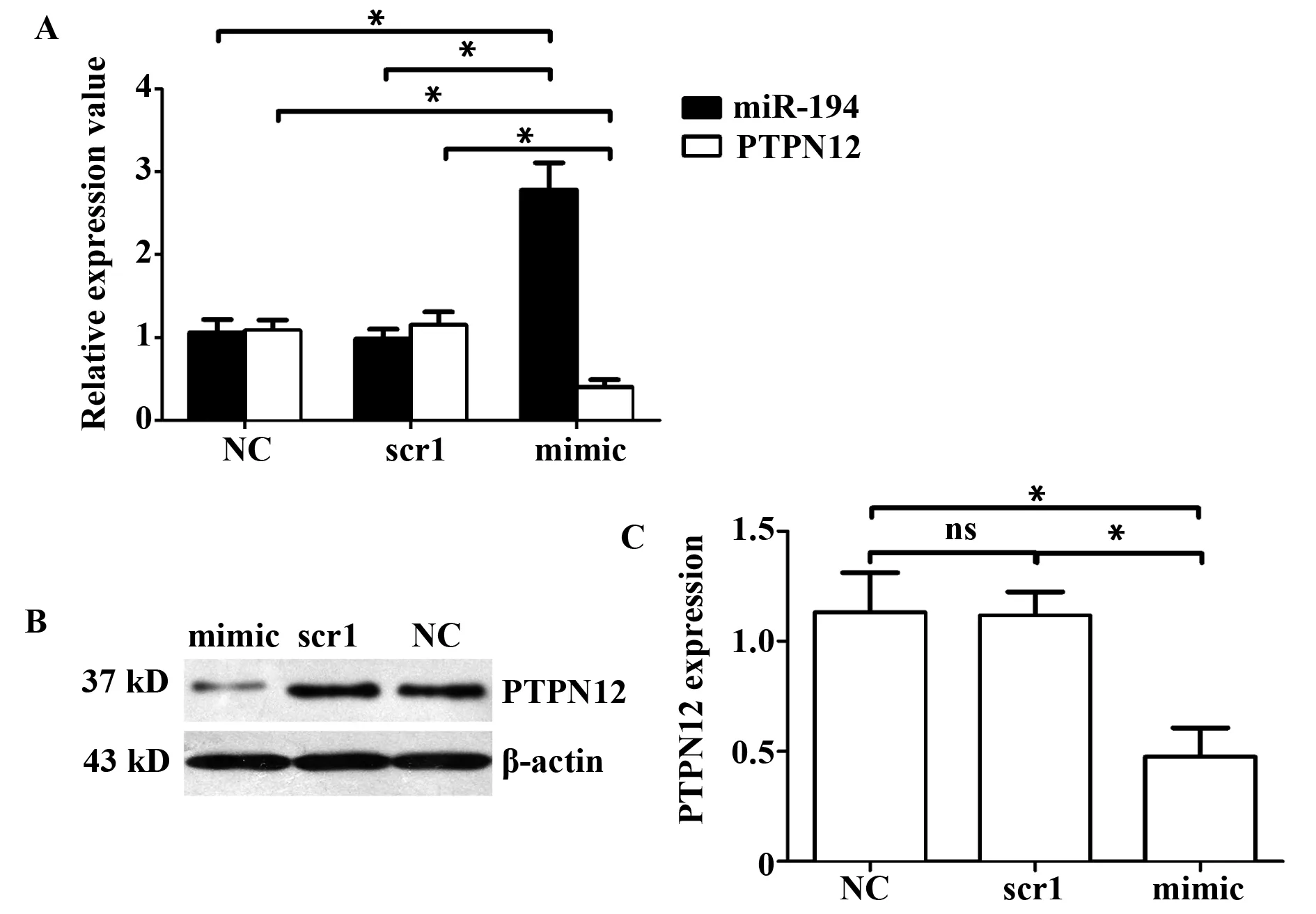
图2 转染miR-194 mimic 48 h后PTPN12基因的表达水平及相关性分析Fig.2 Expression level and correlation analysis of miR-194 and PTPN12 with miR-194 mimic transfection into cells after 48 hNote:A.miR-194 and PTPN12 mRNA expression level;B.PTPN12 protein expression level (Western blot);C.PTPN12 protein expression level (statistics).
结果还显示沉默miR-194 后,PTPN12基因3′UTR野生型组荧光值比突变组稍高,虽无统计学意义,但说明少量内源性miR-194对PTPN12基因3′UTR有影响,间接证实PTPN12基因是miR-194靶基因之一。
再次观察转染miR-194 mimics或 inhibitor 48 h后的荧光值,详见表3。结果与24 h相似,但共转染miR-194 与PTPN12基因3′UTR野生型组荧光值降低约60%,比24 h下降程度更明显,因此观察时间上48 h比24 h更合适,二者结合效率更高。该结果同样直接证实PTPN12基因是miR-194靶基因之一。
2.3过表达miR-194后,细胞内PTPN12基因表达水平变化 取指数生长期的OP9-DL1细胞,转染miR-194 mimic,48 h后检测PTPN12表达水平变化。结果(表4)显示:转染Scramble1组与未转染组(NC)之间miR-194表达水平无统计学差异,而转染miR-194 mimics组比其他两组miR-194表达水平明显升高且有统计学差异,说明转染成功。而过表达miR-194的OP9-DL1细胞内PTPN12基因的mRNA与蛋白水平显著下降(图2),说明miR-194确实影响了PTPN12基因的表达水平。再次证实PTPN12基因是miR-194靶基因之一。
3 讨论
人体免疫系统是由相应的免疫器官、组织、细胞及分子构成。免疫器官包括中枢与外周免疫器官。骨髓作为中枢免疫器官之一,是所有免疫细胞的产生地,也是B细胞发育的场所。胸腺则是T细胞分化发育的场所。
近年来越来越多的研究发现,增龄性胸腺萎缩是老年人机体免疫功能下降的主要原因之一,但其分子机制尚不明确。目前,国内外公认的增龄性胸腺萎缩机制假说有两种:①T淋巴祖细胞本身功能受损,数量减少,导致胸腺发生萎缩。②胸腺上皮细胞数量减少,功能退化,数量减少,T细胞的发育微环境被破坏,影响T细胞的分化与成熟。本研究认为后者是主要原因。国内外已有文献报道参与胸腺发育与衰老的基因,如Foxn1、Hoxa3、Wnt4等[7]。在增龄性胸腺萎缩过程中,这些基因与miRNA构成了非常复杂的调节网络并发挥作用。
miRNA是一种22 bp左右的非编码蛋白RNA,它的前体中包含发夹结构。Dicer酶将miRNA前体剪切成为成熟的miRNA序列,参与到RISC复合体中起降解mRNA或阻断mRNA翻译的过程。
本课题组在前期研究工作中将不同年龄组小鼠胸腺上皮细胞进行miRNA表达谱筛选,并进行了Real-time PCR验证。实验结果发现了与增龄性胸腺萎缩密切相关的20种miRNA[8]。其中,miR-194是随年龄增长,胸腺上皮细胞中表达差异非常明显的miRNA之一。而miR-194的靶基因鉴定及基因功能等后续研究工作尚未展开。已有文献报道,miR-194靶基因有很多,且作用机制各异。如miR-194通过下调STAT1促进成骨细胞分化[9],或靶定RBX1调节胃癌细胞的增殖与迁移[10],或靶定细胞骨架蛋白talin2抑制了肿瘤细胞的迁移[11]等。Khella等[12]还发现在肾细胞癌中miR-194靶定ZEB2、MDM2抑制肿瘤发生、发展。Wu等[13]在肺癌中发现,miR-194靶定BMP1和p27来调控TGF-β信号通路,进而下调MMP2和MMP9基因。Zhai等[14]发现在子宫内膜癌患者中,miR-194高表达的患者预后较好。然而,Zhang等[15]在小鼠胰管癌中发现miR-194靶定DACH1促进肿瘤细胞的增殖与侵袭,是一种肿瘤促进因子。Iizuka等[16]也认为miR-194靶定NUDC和DEPDC1B基因促进乳腺癌细胞的增殖。目前已发现的miR-194靶基因还有Tcf1、ACVR2B、Sox5等[17-19]。由此可见,在肿瘤学中miR-194的靶基因及相关调控机制研究较多。但在免疫学,特别是增龄性胸腺萎缩发生、发展过程中miR-194的靶基因及调控的下游信号通路尚未发现,其分子调节机制尚不明确。
在本课题组前期研究工作中,通过microRNA靶基因预测数据库预测到miR-194的靶基因有:PTPN12、Hbegf和Sumo2。PTPN12,1993年被首次克隆出来,是一种非跨膜蛋白酪氨酸磷酸酶[20]。2004年Hasegawa等[21]发现PTPN12基因调节T细胞发育与分化,影响效应/记忆T细胞的功能,参与免疫反应。最近的研究发现PTPN12与AKT通路或NF-kappaB通路相关,影响T细胞受体的先天性免疫[22-24]。目前为止,PTPN12的细胞生物学功能主要是抑制细胞增殖或促进细胞凋亡,但是肿瘤学功能尚不明确。虽然在大部分肿瘤研究中普遍认为PTPN12是一种肿瘤抑制基因,抑制肿瘤细胞的增殖与迁移或者被甲基化沉默[25,26]。但是Harris等[27]却发现在乳腺癌中PTPN12是一种肿瘤促进因子,与FOXO信号通路有关。综上所述,PTPN12是增龄性胸腺萎缩研究中miR-194未知的靶基因之一。
本次实验结果显示,随着年龄增长,小鼠胸腺上皮细胞内PTPN12 基因表达明显呈现上升趋势,与 miR-194 的表达水平呈负相关。通过荧光素酶实验证实miR-194 的靶基因之一是PTPN12,并通过多组对照反向证实该结果。在细胞中改变miR-194表达水平时,PTPN12表达水平亦发生相应变化。表明 miR-194 有极大可能是通过靶向调节 PTPN12 基因,参与增龄性胸腺萎缩过程,为研究增龄性胸腺萎缩的分子机制提供新的研究方向。综上所述,PTPN12是miR-194的靶基因之一,有极大可能调控胸腺上皮细胞功能,参与增龄性胸腺萎缩过程。为进一步阐明增龄性胸腺萎缩过程中的基因调节机制,也为提高老年人健康生活水平提供坚实的理论基础和科学依据。
[1] 宋佳乐,李丕鹏.胸腺神经内分泌功能与衰老[J].中国免疫学杂志,2011,3(27):274-276.
Song JL,Li PP.Thymus neuroendocrine function and aging[J].Chin J Immunol,2011,3(27):274-276.
[2] 蒋定文,郭明秋,陈立茵,等.胸腺基质细胞促进CD4CD8双阳性胸腺细胞排除或成熟[J].中国免疫学杂志,2002,18(11):755-756.
Jiang DW,Guo MQ,Chen LY,etal.Thymic stromal cells promote the exclusion or maturation of CD4CD8 double positive thymocytes[J].Chin J Immunol,2002,18(11):755-756.
[3] Anderson G,Lane PJ,Jenkinson EJ.Generating intrathymic microenvironments to establish T-cell tolerance[J].Nat Rev Immunol,2007,7(12):954-963.
[4] Boehm T.Thymus development and function[J].Curr Opin Immunol,2008,20(2):178-184.
[5] Weatherall DJ.Thalassaemia:the long road from bedside to genome[J].Nat Rev Genet,2004,5(8):625-631.
[6] Neilson JR,Zheng GX,Burge CB,etal.Dynamic regulation of miRNA expression in ordered stages of cellular development[J].Genes Dev,2007,21(5):578-589.
[7] 郭智彬,朱喜科.胸腺发育与衰老相关基因调控的研究进展[J].国际免疫学杂志,2011,34(1):24-27.
Guo ZB,Zhu XK.Research progress of gene regulation in thymus development[J].Int J Immunol,2011,34(1):24-27.
[8] Guo Z,Chi F,Song Y,etal.Transcriptome analysis of murine thymic epithelial cells reveals age associated changes in microRNA expression[J].Int J Mol Med,2013,32(4):835-842.
[9] Jun L.MicroRNA-194 promotes osteoblast differentiation via downregulating STAT1[J].Biochem Biophys Res Commun,2015,460(2):482-488.
[10] Xiaonan C.miR-194 targets RBX1 gene to modulate proliferation and migration of gastric cancer cells[J].Tumour Biol,2015,36(4):2393-2401.
[11] Le XF,Almeida MI,Mao W,etal.Modulation of MicroRNA-194 and cell migration by HER2-targeting trastuzumab in breast cancer[J].PLoS One,2012,7(7):e41170.
[12] Khella HW,Bakhet M,Allo G,etal.miR-192,miR-194 and miR-215:a convergent microRNA network suppressing tumor progression in renal cell carcinoma[J].Carcinogenesis,2013,34(10):2231-2239.
[13] Wu X,Liu T,Fang O,etal.miR-194 suppresses metastasis of non-small cell lung cancer through regulating expression of BMP1 and p27(kip1)[J].Oncogene,2014,33(12):1506-1514.
[14] Zhai H,Karaayvaz M,Dong P,etal.Prognostic significance of miR-194 in endometrial cancer[J].Biomark Res,2013,1:pii:12.
[15] Zhang J,Zhao CY,Zhang SH,etal.Upregulation of miR-194 contributes to tumor growth and progression in pancreatic ductal adenocarcinoma[J].Oncol Rep,2014,31(3):1157-1164.
[16] Iizuka D,Imaoka T,Nishimura M,etal.Aberrant microRNA expression in radiation-induced rat mammary cancer:the potential role of miR-194 overexpression in cancer cell proliferation[J].Radiat Res,2013,179(2):151-159.
[17] Krutzfeldt J,Rosch N,Hausser J,etal.MicroRNA-194 is a target of transcription factor 1 (Tcf1,HNF1alpha) in adult liver and controls expression of frizzled-6[J].Hepatology,2012,55(1):98-107.
[18] Senanayake U,Das S,Vesely P,etal.miR-192,miR-194,miR-215,miR-200c and miR-141 are downregulated and their common target ACVR2B is strongly expressed in renal childhood neoplasms[J].Carcinogenesis,2012,33(5):1014-1021.
[19] Xu J,Kang Y,Liao WM,etal.MiR-194 regulates chondrogenic differentiation of human adipose-derived stem cells by targeting Sox5[J].PLoS One,2012,7(3):e31861.
[20] Yang Q,Co D,Sommercorn J,etal.Cloning and expression of PTP-PEST.A novel,human,nontransmembrane protein tyrosine phosphatase[J].J Biol Chem,1993,268(9):6622-6628.
[21] Hasegawa K,Martin F,Huang G,etal.PEST domain-enriched tyrosine phosphatase (PEP) regulation of effector/memory T cells[J].Science,2004,303(5658):685-689.
[22] Villa-Moruzzi E.PTPN12 controls PTEN and the AKT signalling to FAK and HER2 in migrating ovarian cancer cells[J].Mol Cell Biochem,2013,375(1-2):151-157.
[23] Zheng Y,Zhang C,Croucher DR,etal.Temporal regulation of EGF signalling networks by the scaffold protein Shc1[J].Nature,2013,499(7457):166-171.
[24] Zhang P,Liu X,Li Y,etal.Protein tyrosine phosphatase with proline-glutamine-serine-threonine-rich motifs negatively regulates TLR-triggered innate responses by selectively inhibiting IkappaB kinase beta/NF-kappaB activation[J].J Immunol,2013,190(4):1685-1694.
[25] Su Z,Tian H,Song HQ,etal.PTPN12 inhibits oral squamous epithelial carcinoma cell proliferation and invasion and can be used as a prognostic marker[J].Med Oncol,2013,30(3):618.
[26] Xunyi Y,Zhentao Y,Dandan J,etal.Clinicopathological significance of PTPN12 expression in human breast cancer[J].Braz J Med Biol Res,2012,45(12):1334-1340.
[27] Harris IS,Blaser H,Moreno J,etal.PTPN12 promotes resistance to oxidative stress and supports tumorigenesis by regulating FOXO signaling[J].Oncogene,2014,33(8):1047-1054.