合理营养治疗对AECOPD行机械通气患者的影响
2018-03-23孟涛诚赵义芹王元业
孟涛诚 赵义芹 王元业*
(1 枣庄市立医院内科ICU,山东 枣庄 277000;2 枣庄市立医院超声科,山东 枣庄 277000)
AECOPD是呼吸科慢性阻塞性肺病(COPD)患者转入ICU治疗的重要原因之一。在COPD的进展过程中,常伴有营养不良,其发病率为24%~71%[1-2]。长期营养不良可导致肌肉蛋白质分解,降低患者通气驱动能力,导致呼吸功能障碍,特别是在伴有呼吸衰竭需行机械通气患者中,常导致撤机困难,增加了感染机会和治疗费用。本研究对AECOPD需行机械通气的患者分别采用对照营养治疗和观察营养治疗,以观察不同营养治疗方案对患者营养状况、肺功能及预后的影响。
1 材料与方法
1.1 一般资料:选择2013年12月至2014年12月因AECOPD收入我院内科ICU,并进行机械通气的60例患者。将60例患者随机分为对照组(32例)和观察组(28例),其中对照组男17例,女15例;观察组男16例,女12例。两组患者年龄、性别、基础营养状况、肺功能等方面均无统计学差异。
1.2 纳入及排除标准:慢性阻塞性肺疾病(COPD)和AECOPD的诊断符合美国国立心肺血液研究所(NHLRI)、美国胸科学会(AST)、欧洲呼吸病学会(ERS)和世界卫生组织(WHO)共同制定的“全球关于COPD的诊断和防治策略”(GOLD)2006年版的定义,及我国2007版《慢性阻塞性肺疾病诊治指南》[3];慢性呼吸衰竭的诊断标准:①有COPD的病史;②有与缺氧和CO2潴留有关的临床表现;③血气分析是主要诊断依据。在海平面上吸空气时,PaO2<60 mmHg(8.0 kPa),PaCO2正常或略低为Ⅰ型呼吸衰竭。PaO2< 60 mm Hg(8.0 kPa), PaCO2>50 mmHg(6.7 kPa)时为Ⅱ型呼吸衰竭。所有患者肝、肾功能正常,并排除合并肺结核、支气管哮喘、肺性脑病、自发性气胸、肿瘤、甲亢、神经肌肉疾病等。
1.3 研究方法
1.3.1 在营养治疗中,一般先根据Harris-Benedict方程式计算出患者每天的基础能量需求(BEE)。膳食中各营养素占的热卡比为蛋白质17%,脂肪30%,碳水化合物53%。
1.3.2 患者入组后立即行机械通气,给予抗感染、解痉、平喘、化痰等常规治疗,并放置鼻胃管或鼻空肠管、深静脉置管等保证肠内肠外营养治疗途径通畅;
1.3.3 研究方案:对照组给予常规营养支持,即嘱患者家属自备营养餐,多为米汤、蛋羹、豆汁、菜汤等,由有经验的医护人员根据患者病情及胃肠功能情况决定供给量,静脉不予特殊营养治疗;实验组给予肠内营养液如瑞能、瑞高、瑞素等提供热量,不足部分由静脉营养提供,保证热量及各营养素比例达标。采集入组患者治疗后第1、7天的营养指标:白蛋白、前白蛋白、三酰甘油;肺功能指标:PaCO2、PaO2/FiO2、顺应性(C);呼吸力学指标:最大吸气负压(MIP)、浅快呼吸指数(SBI)、P0.1;并记录预后相关指标:机械通气时间、脱机拔管例数(患者死亡或家属放弃机械通气等治疗者记为未脱机)、住ICU时间及出ICU前4 h时APACHEⅡ评分。
1.3.4 统计结果:采用专业统计软件分析,计量资料以均数±标准差表示,组间比较采用t检验,计数资料采用卡方检验。以P<0.05为检验水准。
2 结 果
2.1 营养治疗后两组患者的营养指标变化:经营养治疗后,实验组患者的白蛋白、前白蛋白及三酰甘油三项指标有明显改善,对照组上述指标无明显改善,治疗7 d后两组间比较均有显著差异(P<0.05)。见表1。2.2 营养治疗后两组患者动脉血气和肺功能变化:行机械通气后患者PaO2/FiO2及PaCO2较通气前有明显改善。经营养治疗7 d后,实验组患者的上述指标改善更为明显;且两组间比较有显著差异(P<0.05)。实验组患者的顺应性(C)优于对照组,差异有统计学意义。见表2。
表1 治疗后第1天与第7天营养指标变化()

表1 治疗后第1天与第7天营养指标变化()
注:*与对照组比较,P<0.05;#与治疗后第1天比较,P<0.05
观察组1 d 7 d 1 d 7 d白蛋白(g/L) 32.1±4.6 33.2±4.7 33.2±3.7 36.6±4.6*#前白蛋白(mg/L) 158.9±38.9 172.1±46.2 160.3±34.1 231.2±34.5*#三酰甘油(mmol/L) 0.32±0.05 0.38±0.07 0.32±0.03 0.56±0.12*#观察指标 对照组
表2 治疗后第1天与第7天肺功能指标变化()
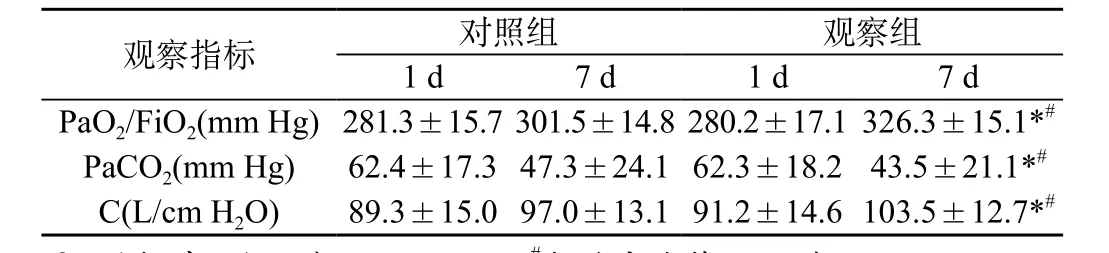
表2 治疗后第1天与第7天肺功能指标变化()
注:*与对照组比较,P<0.05;#与治疗后第1天比较,P<0.05
观察指标 对照组 观察组1 d 7 d 1 d 7 d PaO2/FiO2(mm Hg)281.3±15.7 301.5±14.8 280.2±17.1 326.3±15.1*#PaCO2(mm Hg) 62.4±17.3 47.3±24.1 62.3±18.2 43.5±21.1*#C(L/cm H2O) 89.3±15.0 97.0±13.1 91.2±14.6 103.5±12.7*#
2.3 营养治疗后两组患者呼吸力学变化:经营养治疗后,实验组患者的最大吸气负压(MIP)浅快呼吸指数(SBI)、P0.1等指标优于对照组,两组间比较有显著差异(P<0.05)。见表3。
表3 治疗后第1天与第7天呼吸力学指标变化()

表3 治疗后第1天与第7天呼吸力学指标变化()
注:*与对照组比较,P<0.05;#与治疗后第1天比较,P<0.05
观察指标 对照组 观察组1 d 7 d 1 d 7 d MIP(cm H2O) 18.3±5.6 23.4±8.7# 18.6±7.1 32.4±5.6*#SBI 123.1±14.3 96.2±15.4 121.3±15.8 83.1±11.7*#P0.1(cm H2O) 4.3±2.1 5.8±1.4# 4.1±2.3 3.6±2.1*#
2.4 营养支持前后两组患者预后相关指标:经营养治疗后,实验组患者的机械通气时间、脱机拔管例数、住ICU时间及出ICU前4 h时APACHEⅡ评分等指标优于对照组,两组间比较有显著差异 (P<0.05) 。见表4。
表4 两组患者预后指标比较()
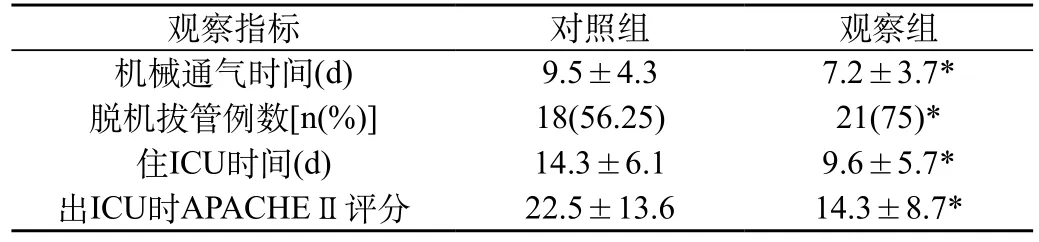
表4 两组患者预后指标比较()
注:*与对照组比较,P<0.05
观察指标 对照组 观察组机械通气时间(d) 9.5±4.3 7.2±3.7*脱机拔管例数[n(%)] 18(56.25) 21(75)*住ICU时间(d) 14.3±6.1 9.6±5.7*出ICU时APACHEⅡ评分 22.5±13.6 14.3±8.7*
3 讨 论
COPD是不可逆的慢性进展性疾病,且病程长,病情易反复,患者通常合并营养不良[4],但其发生机制尚不清楚[5],目前的研究显示可能与下列因素有关:①热量摄入不足、能源底物配比不合理,②感染等情况导致的严重高分解代谢,能量消耗增加,③长期的通气功能障碍导致的缺氧和(或)二氧化碳潴留,心、肝功能不全及胃肠道淤血等引起营养物质的消化吸收不良。此外,机械通气时,进食活动受限,并伴有人机对抗,呼吸功额外增加及糖皮质激素等药物的应用加速蛋白质的分解,更进一步加重患者营养不良,使患者逐步出现能量负平衡。由此可见,COPD患者代谢改变的特点为热量摄入不足、能量消耗及机体分解代谢增加,加之多数患者需要机械通气治疗,其静息能量消耗(REE)可达预计值的1.5~2.0倍,可迅速出现营养不良。营养不良可导致患者机体免疫力下降,诱发感染;患者住院时间延长、住院次数增加,容易发生肺心病和心力衰竭,增加病死率[6]。因此,营养支持对COPD合并营养不良患者来说显得十分必要。
大量实验证实,营养支持可以提高COPD患者的呼吸肌肌力及耐力,改善呼吸功能,预防急性发作,而对于急性期患者,则有利于控制感染、纠正呼吸衰竭,降低致残、致死率[7]。2007版COPD治疗指南中也指出,营养支持是治疗COPD的重要环节[3]。通过肠内营养可恢复胃肠的正常蠕动,改善血运;防止胃肠黏膜废用性萎缩,恢复胃肠黏膜的屏障作用,防止肠道病原菌的迁移,加重肺部及全身感染;另外肠内营养更符合人生理需要。但由于COPD患者急性加重期存在胃肠道淤血、药物对胃肠黏膜的损伤、肠道菌群失调等原因,导致消化吸收功能障,加上行机械通气治疗时多伴膈肌运动异常、胃肠胀气,进一步影响了消化功能,使肠内营养难以实施。因此,单纯肠内营养难以满足COPD患者高分解、高消耗的机体需求。一项对原发病为COPD行机械通气患者的研究表明,营养不良、能量不足的机械通气患者只有55%可以成功脱机,而获得合理营养支持的患者中脱机成功率可达93%左右[8]。可见正确合理的营养支持将有助于机械通气患者的病情缓解、呼吸功能恢复、缩短住院时间、改善预后,提高治愈率、降低病死率。
本研究中实验组采取肠内营养液为主导的供能方式,不足部分由静脉补充,可基本满足患者在疾病消耗状态下对热量总量及各营养素比例的需求。数据表明,治疗7 d后各项指标不仅优于治疗前,更较对照组有明显改善,充分说明合理的营养支持方案,能够明显改善患者营养状况,有利于呼吸肌肉的合成,改善呼吸肌的结构及功能,进而改善肺功能,恢复正常呼吸中枢的驱动力[7]。
因此,合理的营养支持治疗能够改善AECOPD患者,特别是行机械通气治疗的患者的营养状况和肺功能,有利于减少机械通气时间,缩短住院时间,减缓疾病的进展,改善预后。
[1] Laaban JP. Nutrition and chronic respiratory failure[J]. Ann Inter Med,2000,151(7):542-548.
[2] Ezzell L,Jensen G.l Malnutrition in chronic obstructive pulnonary disease[J].Am J C lin Nutr, 2000, 72(6): 1415-1416.
[3] 中华医学会呼吸病学分会慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2007年修订版)[J].中华结核和呼吸杂志,2007,30(1):8-17.
[4] Laaban JP,Kouchakji B,Dore NF,et al Nutritional status of patients with chronic chronic obstructive pulmonary disease and acute respiratory failure[J].Chest,1993,103:1362-1368.
[5] 吴蔚然.老年临床营养学[M].北京:人民卫生出版社,2011:206-211.
[6] Landbo C,Prescott E,Lange P,et al Prognostic value of nutritional status in chronic obstructive pulmonary disease[J].Am J Respi Crit Care Med,1999,160(6):1856-1861.
[7] Macnaughton PD.Management of adult respiratory distress syndrome[J].Lancet,1992,339:469
[8] Andre P Hitzl,Rudolf A Jorres,Frank Heinemann,et al.Nutritional status in patients with chronic respiratory failure receiving home mechanical ventilation :impact on survival[J].Clin Nutr,2010,29(1):65-71.
