食物组分差异对树麻雀能量代谢及消化道形态结构的影响
2018-03-23徐兴军田金波王有祥王卿惠薛明强邵淑丽王维禹张伟伟李旭艳
徐兴军,田金波,王有祥,王卿惠,薛明强,邵淑丽,王维禹,张伟伟,李旭艳
(齐齐哈尔大学 生命科学与农林学院, 黑龙江 齐齐哈尔161006)
食物作为重要的生态因子,其品质、可获得性、种类等是动物能量学、生理生态学研究的主要内容之一。食物的丰富度和质量,以及动物对食物中能量的同化能力都会对动物的能量代谢水平产生决定性影响[1]。动物的最大可持续代谢能就受到食物的可利用性和动物的同化能力的制约[2]。随着食物品质的改变,动物的消化系统会进行适应性调节,并通过体质量与基础代谢率反映出来。鸟类在其生理、形态等方面的适应与能量的分配密切相关,保持自身能量的收支平衡是应对外界环境的重要手段[3-4]。ROZMAN等[5]研究发现:当冬季食物丰富度和能量不足时,鸟类会通过降低能量代谢,改变脂肪含量等方式来应对食物的短缺。WILLIAMS等[6]研究表明:云雀Alauda arvensis通过进食高能量食物来补偿与产热有关的能量消耗,以应对恶劣的环境条件变化。崔思荣等[7]研究发现:斑翅山鹑Perdix dauurica会选择性地食用能量高的食物,例如麻籽Cannabis sativa ssp.sativa,芝麻Sesamum indicum,而吃得很少甚至不吃小麦Triticum aestivum和高粱Sorghum bicolor,反映了斑翅山鹑觅食的能量代谢适应性对策;杨志宏等[8]发现:树麻雀Passer montanus进食高能食物时消化能、消化率增加,进食低能食物反之;徐兴军等[4]的研究表明:树麻雀进食高蛋白的黄粉虫Tenebrio molitor与进食纤维素含量较高的稗草Echinochloa crusgalli籽相比,肌糖原、肝糖原含量增高。糖原是动物机体内糖的储存形式,肌糖原分解为肌肉自身收缩供给能量,肝糖原分解主要维持血糖浓度,因此,糖原对动物获得生存所需要的能量具有重要意义[9]。树麻雀属雀形目Passeriformes雀科Fringillidae,生活于溪边丛生柳林、沼泽和农田,食性比较杂,主要以谷粒、稗草籽、种子、果实等植物性食物为食,繁殖期间也吃大量昆虫,常见于中国东北地区,是中国北方地区最常见的雀形目鸟类之一[10]。关于树麻雀的研究主要针对其代谢产热方面[11-12],如树麻雀肝脏的线粒体呼吸和肝脏、肌肉的细胞色素C氧化酶在夏季明显高于冬季等。目前,对食物组分差异影响树麻雀消化道组织学变化的研究较少。本研究以树麻雀为试验材料,从器官水平、整体水平及显微水平来探究树麻雀对食物组分差异的适应性,旨在深入了解树麻雀适应不同食物组分对其能量代谢的影响,阐明产热和能量代谢调节在动物适应不良环境条件变化中的作用和意义,为进一步了解北方小型鸟类的生存机制提供理论依据。
1 材料与方法
1.1 试验动物
实验用树麻雀于2016年3月捕自黑龙江省齐齐哈尔市扎龙国家级自然保护区(47°32′~46°52′N,124°37′~123°47′E),于齐齐哈尔大学生命科学与农林学院动物学实验室饲养。适应饲养1周后按体质量随机分为对照组、稗草籽组和黄粉虫组, 8只·组-1(5只雄性,3只雌性),组间体质量无明显差异(P>0.05)。对照组饲喂小米Setaria italica,稗草籽组饲喂稗草种子,黄粉虫组饲喂黄粉虫,自然光照,自由取食及饮水,驯化4周。
1.2 测定指标及方法
1.2.1 体质量及器官质量 体质量和各器官组织鲜质量、干质量用BS124S电子天平测量,精确到0.01 g。驯化实验开始后分别测定3组树麻雀的初始体质量;驯化期间每周测定1次体质量,至驯化结束时测定3组树麻雀的最终体质量及主要器官质量。
1.2.2 基础代谢率 基础代谢率(BMR)是维持动物正常生理反应和机体机制的最小产热速率,是动物维持身体各部分基本功能所需要的最小能量值[13]。试验采取动物气体代谢分析仪来测量树麻雀的基础代谢率,7 d测定1次,测量前先将树麻雀禁食4 h,称量各只树麻雀的体质量,精确至0.01 g。测定开始前,提前2 h将氧气和二氧化碳分析仪打开预热,进行标定,硬件与软件标定完成后分别将树麻雀放入标好编号的4个呼吸室内适应1 h,待树麻雀呼吸稳定后开始进行测量,记录每分钟的耗氧量,共测定30 min,分别取5个连续稳定的数值进行计算。
1.2.3 摄入热量值及消化率 用全收粪法[14]测定树麻雀在一定期间内食入饲料物质的质量与粪便中排出物质的质量。记录动物在某阶段的饲料采食量和全部排粪量,收集时间为9:00-11:00,用氧弹量热仪对饲料和粪便进行热量测定。摄入能=摄入干物质质量×食物热值;粪便能=粪便干质量×粪便热值;消化能=摄入能-粪便能; 消化率=消化能(kJ·d-1)/摄入能(kJ·d-1)×100%。
1.2.4 体脂质量分数 体脂质量分数的测定采取索氏抽提法[15]。体脂质量分数=(胴体干质量-抽提后不含体脂的胴体干质量)/个体体质量。
1.2.5 消化道质量与长度 解剖后取出消化道各器官,分离出大肠、小肠、十二指肠、直肠,剔除肠系膜及脂肪组织,各部平展为自然状态下最大长度,用游标卡尺(精度±1 mm)测定长度[16]。用剪刀将各器官纵剖开,用生理盐水清洗以除去肠道内容物滤纸吸干生理盐水,用电子天平称量各器官鲜质量。将称量后的各器官置于60℃烘箱烘干至恒量,记录各器官干质量。
1.2.6 糖原质量分数 肌糖原、肝糖原采取硫酸蒽酮测定法[17]。
1.2.7 消化道绒毛长度、绒毛宽度、黏膜层厚度及肠壁截面积 采用石蜡切片法对树麻雀消化道组织进行制片[18],应用Nikon显微成像系统在10×40倍视野对消化道组织的绒毛高度、绒毛宽度、黏膜层厚度、肠壁截面积进行测量。
1.3 数据分析
用SPSS 17.0软件进行数据统计分析。体质量、器官质量、基础代谢率、体脂质量分数、糖原含量、消化道长度均采用一元方差检测组间差异;驯化因素对体质量、热量值、基础代谢率等的影响采用多重最小显著性差异(LSD)法进行分析。
2 结果与分析
2.1 各处理树麻雀的体质量、体脂质量分数及器官质量
由表1可见:驯化开始时,3组树麻雀的体质量组间无明显差异,驯化至第1周结束时,3组树麻雀体质量均呈上升趋势,稗草籽组树麻雀体质量与对照组、黄粉虫组相比差异极显著(P<0.01);对照组、黄粉虫组树麻雀在驯化2~4周时大幅增加,在第4周驯化结束时比初始体质量分别增加1.12,0.66 g;稗草籽组在驯化2~3周时大幅降低,在第4周驯化结束时比初始体质量降低了0.41 g;4周驯化结束时3组树麻雀体质量组间差异均极显著(P<0.01)。

表1 各处理树麻雀的体质量Table 1 Body mass of Passer montanus in different treatments
稗草籽组、黄粉虫组、对照组树麻雀的体脂质量分数分别为17.09%,19.48%,18.58%。稗草籽组体脂质量分数与黄粉虫组、对照组相比差异均显著(P<0.05),黄粉虫组体脂质量分数与对照组相比差异不显著(P>0.05)。
由表2可见:稗草籽组树麻雀心脏、肝脏、肺、胰腺的鲜质量极显著高于黄粉虫组和对照组(P<0.01);黄粉虫组大肠、小肠、十二指肠、直肠、肌胃的鲜质量极显著高于稗草籽组和对照组(P<0.01);黄粉虫组肝脏、十二指肠、肌胃的干质量极显著高于稗草籽组和对照组(P<0.01);对照组肺、大肠、直肠的干质量均极显著高于其他2组(P<0.01);3组树麻雀胰腺干质量组间差异均不显著(P>0.05)。
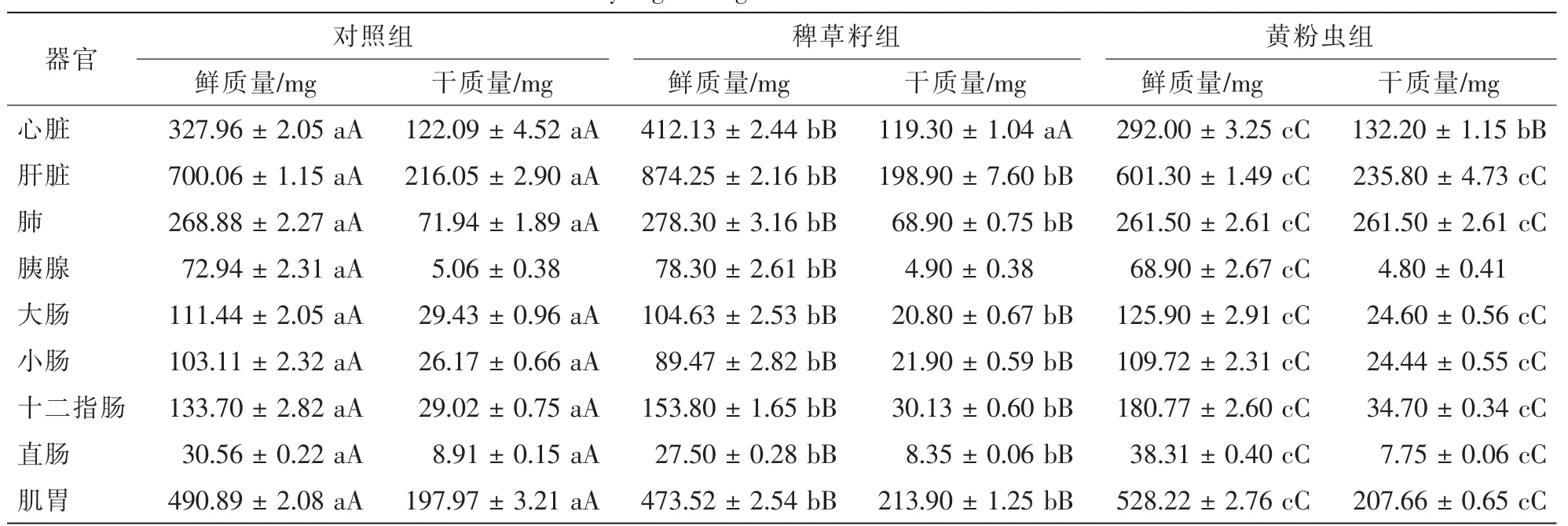
表2 各处理树麻雀器官的鲜质量和干质量Table 2 Fresh and dry organ weight of Passer montanus in different treatments
2.2 各处理树麻雀的基础代谢率
由表3可见:驯化1周后,对照组和稗草籽组的基础代谢率呈小幅增高趋势;3~4周时3组基础代谢率均增加,在第4周驯化结束时达到最大值,对照组、稗草籽组、黄粉虫组基础代谢率与第1周相比分别增加0.14,0.35,0.11 mL·g-1·h-1,稗草籽组与对照组、黄粉虫组差异均极显著(P<0.01),对照组与黄粉虫组差异不显著(P>0.05)。

表3 各处理树麻雀的基础代谢率Table 3 Basal metabolic rate of Passer montanus in different treatments
2.3 各处理树麻雀的消化能和消化率
由表4可知:驯化后稗草籽组和黄粉虫组的消化能、消化率与对照组相比,差异均极显著(P<0.01);稗草籽组与黄粉虫组相比差异极显著(P<0.01)。
2.4 各处理树麻雀的消化道长度
由表5可见:驯化后,树麻雀大肠、小肠、直肠、十二指肠长度由长到短的顺序均为:黄粉虫组>对照组>稗草籽组,3组树麻雀大肠、小肠、十二指肠长度组间差异均极显著(P<0.01);对照组、稗草籽组直肠长度与黄粉虫组相比差异均极显著(P<0.01),对照组与稗草籽组相比差异不显著(P>0.05)。

表4 各处理树麻雀的消化能和消化率Table 4 Digestion and digestibility ofPasser montanus in different treatments

表5 各处理树麻雀的消化道长度Table 5 Digestive tract length of Passer montanus in different treatments
2.5 各处理树麻雀的糖原质量分数
由表6可见:驯化4周后,对照组树麻雀肝糖原质量分数分别比稗草籽组、黄粉虫组高1.5 g·kg-1,2.6 g·kg-1;对照组肌糖原质量分数分别比稗草籽组、 黄粉虫组低 3.8 g·kg-1, 2.1 g·kg-1; 3 组树麻雀肝糖原、肌糖原含量组间差异均极显著(P<0.01),且肌糖原的变化幅度大于肝糖原的变化幅度。

表6 各处理树麻雀的糖原质量分数Table 6 Glycogen content of Passer montanus in different treatments
2.6 各处理树麻雀的消化道绒毛高度、宽度、黏膜层厚度及肠壁截面积
由表7可见:稗草籽组、黄粉虫组大肠绒毛高度与对照组相比差异均极显著(P<0.01),稗草籽组与黄粉虫组组间差异不显著(P>0.05);3组树麻雀的大肠绒毛宽度、大肠黏膜层厚度、大肠壁截面积组间差异均不显著(P>0.05)。
对照组、稗草籽组小肠及十二指肠的绒毛高度、绒毛宽度、黏膜层厚度与黄粉虫组相比差异均极显著(P<0.01);3组小肠及十二指肠的肠壁截面积组间差异均不显著(P>0.05)。
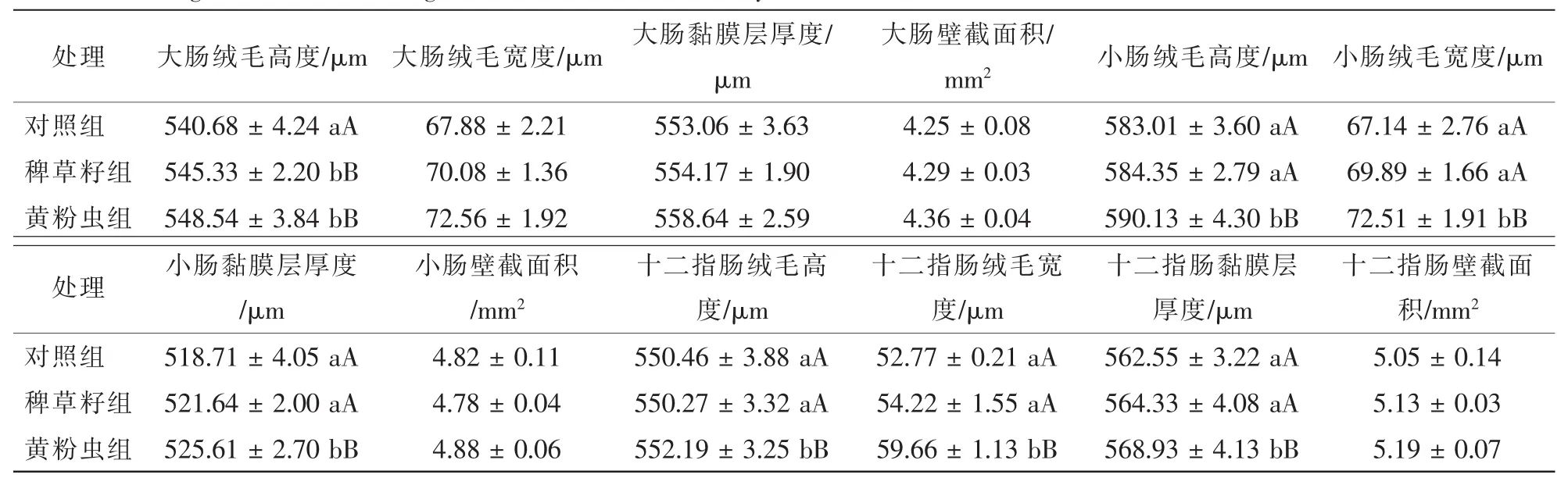
表7 各处理树麻雀的大肠绒毛高度、宽度、黏膜层厚度及肠壁截面积Table 7 Large intestine villus height, villus width, mucosal layer thickness, section area of Passer montanus in different treatments
3 结论与讨论
基础代谢率是恒温动物维持正常生理机制的最小产热速率,是动物在清醒时维持身体各项基本功能所需的最小能量值。在单位体质量代谢率不变的条件下,体质量的增加可以使个体总的代谢水平升高。动物的体质量调节主要取决于能量摄入和能量支出的平衡,产热能力的适应性改变不仅影响能量收支平衡,也是动物维持恒定体温、适应环境季节性变化的重要策略[19]。动物体质量的变化可以反映其营养状态和随环境变化而进行的一些适应性调节,同时体质量对动物的生理学、形态学和行为学等各种参数都有重要的影响[20]。鸟类的体质量受环境变化及自身消化能力的影响,如温度、光照、食物品质和食物来源等,体质量已成为衡量鸟类生存代价的重要指标之一[21-23]。在本研究中,黄粉虫组和对照组树麻雀驯化结束时体质量比初始分别增加1.12和0.66 g,稗草籽组在驯化结束时体质量比初始降低0.41 g,表明当食物来源相对单一受限时,鸟类会转而食用低能食物来满足自己的能量需求。个体在长期食用低能食物的情况下,体质量会逐渐降低[24],基础代谢率与体质量成反比例关系,即随着体质量的降低,基础代谢率不断增加[25]。本研究中饲喂4周后,对照组、稗草籽组、黄粉虫组树麻雀基础代谢率与第1周相比分别增加0.14,0.35,0.11 mL·g-1·h-1,稗草籽组基础代谢率明显高于对照组和黄粉虫组。黄粉虫组体质量增加,基础代谢率也升高,可能是由于多个器官或组织共同作用的结果[26]。动物体质量变化是影响能量代谢的最重要因素,体质量的变化往往是身体体脂质量分数的变化所导致的。鸟类体质量增加的同时体脂质量分数也逐步提高,动物的体质量调节还取决于能量摄入和支出及产热能力的适应性改变,这与许多生活在温带地区的其他雀形目鸟类的适应模式相一致[27]。在本研究中黄粉虫组树麻雀体脂质量分数相对较高,是因为食物中脂肪含量与蛋白质含量相对较高导致的,这与前人的研究结果相符。
肝脏是能量转换的器官,其干质量增加能量转换能力增强。肾脏是重要的排泄器官,肾脏组织质量增加可能是因为食用高蛋白食物后体内含氮量高,需要排出,这与对不同日粮饲喂鸡Gallus gallus domesticus的研究[28]相一致。对内蒙古布氏田鼠Lasiopodomys brandtii研究[29]发现:日能量消耗的残差与心脏、肾脏、胃和盲肠的残差正相关,表明食用高能食物器官质量会增加。本研究中,黄粉虫组大肠、小肠、十二指肠、直肠、肌胃的鲜质量极显著高于稗草籽组和对照组 (P<0.01);黄粉虫组肝脏、心脏、十二指肠的干质量极显著高于稗草籽组和对照组(P<0.01),这与上述研究得出的结论一致。3组树麻雀的心脏、肺脏、肌胃和直肠均差异显著,表明食物成分差异对这几种器官造成显著影响。
糖原是动物体糖类能源物质的重要储存形式,主要以肌糖原和肝糖原的形式分别存在于骨骼肌和肝脏中,用以满足骨骼肌运动时的能量需求和维持血糖的稳定[30]。在本研究中,驯化4周后,对照组、稗草籽组肝糖原质量分数较黄粉虫组显著增高,原因可能是较长时间进食低能量的植食性食物,食物资源单一,使机体中肝糖原的储存受到激素和底物浓度的控制,当达到上限水平时,能量的供应无法满足正常的代谢需求,因而需要大量肝糖原的不断分解,为机体提供能量,因此肝糖原质量分数相对较高。而肌糖原质量分数高于肝糖原是因为肌糖原不能直接分解供能,需转化为肝糖原才能分解供能;肌糖原质量分数高于肝糖原另一可能的原因是由于肌肉组织中缺乏一种关键酶,使肌肉中的葡萄糖-6-磷酸不能转化为葡萄糖进入血液为机体提供能量造成的。
与哺乳动物相比,鸟类消化系统占体质量的比例较小,其消化道的适应调节变化在鸟类的适应中占有重要地位[31]。鸟类消化道结构与能量需求或能量利用之间有着密切的关系,在不同环境中鸟类对能量的需求不同,消化道各器官的结构和功能也会随之发生代偿性变化[32]。当能量需求增加(如低温、食物质量降低和繁殖等)时,鸟类的消化道形态及容量会进行某些调节,以提高能量利用效率[17]。本研究驯化结束后,树麻雀大肠、小肠、直肠、十二指肠长度由长到短的顺序为:黄粉虫组>对照组>稗草籽组,黄粉虫组小肠、大肠长度最长,这种器官水平的影响可能是增加能量摄入的能量预算方式,稗草籽驯化组采用了缩短消化道长度减少消化器官能耗支出的节能预算,当摄能不足时采用动用体内能量储备的能量预算方式。根据消化道切片结果可知,稗草籽组、黄粉虫组大肠绒毛高度与对照组间的差异均极显著(P<0.01),对照组、稗草籽组树麻雀的小肠、十二指肠绒毛高度、绒毛宽度、黏膜层厚度与黄粉虫组间的差异均极显著(P<0.01),大肠、小肠绒毛高度和黏膜层厚度的增加使腺体细胞和成熟的绒毛细胞数目增多,这些形态结构的变化可提高营养物质的吸收效率和有效吸收面积。对营养物质的吸收能力增强,会进一步提高食物的消化率和消化能。本研究中低能食物使代谢器官质量显著增高,器官代谢活性增高,产热量增加;高能食物使动物消化道绒毛高度和黏膜层厚度增加,肠壁上的绒毛和腺体细胞数目增多,提高肠壁细胞有效吸收面积和对营养物质的吸收能力,从而提高食物的消化率,表明动物的消化道具有一定的可塑性[33]。
总之,在诸多环境生态因子中,食物的品质和来源对树麻雀的产能代谢和消化道形态结构改变具有重要影响。树麻雀在食物来源单一的条件下通过改变消化道形态结构来提高消化能和消化率以增加能量储备,是树麻雀应对不良环境条件,缓解生存压力的策略之一。
[1] 宋志刚,王德华.哺乳动物基础代谢率的主要影响因素[J].兽类学报,2002,22(1):53-60.SONG Zhigang, WANG Dehua.Influcing factors on basal metabolic rate in mammals [J].Acta Theriol Sin,2002,22(1):53-60.
[2] 王玉山,王德华,王祖望.动物长期能量收支理论及研究进展[J].动物学研究,2000,21(3):238-244.WANG Yushan, WANG Dehua, WANG Zuwang.The progress on the theory of long-term energy budget in animals[J].Zool Res,2000,21(3):238-244.
[3] LOVEGROVE B G.The influence of climate on the basal metabolic rate of small mammals:a slow-fast metabolic continuum [J].J Comp Physiol B,2003,173(2):87-112.
[4] 徐兴军,邵淑丽,张伟伟,等.不同食物对麻雀肝糖原和肌糖原含量的影响[J].黑龙江畜牧兽医,2012(12):126-128.XU Xingjun, SHAO Shuli, ZHANG Weiwei, et al.Influence of different foods on the content of liver glycogen and muscle glycogen [J].Heilongjiang Anim Sci Vet Med,2012(12):126-128.
[5] ROZMAN J,RUNCIMAN D,ZANN R A.Seasonal variation in body mass and fat of Zebra finches in south-eastern Australia [J].Emu Austr Ornitho,2003,103(1):11-19.
[6] WILLIAMS J B,TIELEMAN B I.Flexibility in basal metabolic rate and evaporative water loss among hoopoe larks exposed to different environmental temperatures [J].J Exp Biol,2000,203(20):3153-3159.
[7] 崔思荣.斑翅山鹑的食物能量代谢[J].佳木斯大学学报(自然科学版),2010,28(4):622-623.CUI Sirong.Food energy metabolism of partridge [J].J Jiarnusi Univ Nat Sci Ed,2010,28(4):622-623.
[8] 杨志宏,邵淑丽.食物质量差异对树麻雀能量预算和消化道形态特征的影响[J].生态学报,2011,31(14):3937-3946.YANG Zhihong,SHAO Shuli.The influence of different food qualities on the energy budget and digestive tract morphology of tree sparrows Passer montanus [J].Acta Ecol Sin,2011,31(14):3937-3946.
[9] 柳劲松,李铭,邵淑丽.树麻雀肝脏和肌肉产热特征的季节性变化[J].动物学报,2008,54(5):777-784.LIU Jinsong, LI Ming, SHAO Shuli.Seasonal changes in thermogenic properties of liver and muscle in tree sparrows Passer montanus [J].Acta Zool Sin,2008,54(5):777-784.
[10] 阮向东.麻雀生态学研究进展[J].动物学杂志,1989,24(6):44-48.RUAN Xiangdong.Development of sparrow ecology [J].Chin J Zool,1989,24(6):44-48.
[11] 张国凯,方媛媛,姜雪华,等.白头鹎的代谢率与器官重量在季节驯化中的可塑性变化[J].动物学杂志,2008,43(4):13-19.ZHANG Guokai, FANG Yuanyuan, JIANG Xuehua, et al.Adaptive plasticity in metabolic rate and organ masses among Pycnonotus sinensis,in seasonal acclimatization [J].Chin J Zool,2008,43(4):13-19.
[12] BARCELÓ G,SALINAS J,CAVIERES G,et al.Thermal history can affect the short-term thermal acclimation of basal metabolic rate in the passerine Zonotrichia capensis [J].J Therm Biol,2009,34(8):415-419.
[13] 林琳,曹梦婷,胡益林,等.环境温度对白头鹎代谢产热和蒸发失水的影响[J].生态学报,2014,34(3):564-571.LIN Lin, CAO Mengting, HU Yilin, et al.Effect of environmental temperature on thermogenesis and evaporative water loss in Chinese bulbuls (Pycnonotus sinensis) [J].Acta Ecol Sin,2014,34(3):564-571.
[14] 汪诗平,李永宏.放牧率和放牧时期对绵羊排粪量、采食量和干物质消化率关系的影响[J].动物营养学报,1997, 9(1): 47-54.WANG Shiping,LI Yonghong.The influence of different stocking rates and grazing periods on the amount of feces and its relationship to DM intake and digestibility of grezing sheep [J].Acta Zoonutr Sin,1997,9(1):47-54.
[15] AL-MANSOUR M I.Seasonal variation in basal metabolic rate and body composition within individual sanderling bird Calidris alba [J].J Biol Sci,2004,4(4):564-567.
[16] 吴梦斯,赵丽丹,王润梅,等.画眉冬夏两季能量收支和消化道形态特征比较[J].生态学杂志,2015,34(4):1031-1037.WU Mengsi, ZHAO Lidan, WANG Runmei, et al.Comparison of energy budget and digestive tract morphology in Hwamei Garrulax canorus between winter and summer [J].Chin J Ecol,2015,34(4):1031-1037.
[17] 徐兴军,邵淑丽,张伟伟,等.饥饿条件下麻雀体内糖原含量和基础代谢率的变化[J].江苏农业科学,2013,40(11):348-350.XU Xingjun, SHAO Shuli, ZHANG Weiwei, et al.In the body of tree sparrow glycogen content and BMR changeunder the condition of hunger [J].Jiangsu Agric Sci,2013,40(11):348-350.
[18] 王昌河,谢振丽,吕建伟.动物组织石蜡切片H-E染色的快速方法[J].生物学通报,2012,47(7):50-51.WANG Changhe, XIE Zhenli, LÜ Jianwei.A H-E dyeing fast method for animal tissue paraffin section [J].Bull Biol,2012,47(7):50-51.
[19] 李兴升.布氏田鼠和长爪沙鼠血清瘦素对体重、能量摄入和产热的作用[D].北京:中国科学院,2005.LI Xingsheng.Effects of Serum Leptin on Body Weight,Energy Intake and Heat Production in Brandt’s voles and Mongolian gerbil[D].Beijing:Chinese Academy of Sciences,2005.
[20] COOPER S J.Daily and seasonal variation in body mass and visible fat in mountain chickadees and juniper titmice[J].Wilson J Ornithol,2007,119(4):720-724.
[21] WU Mengsi,XIAO Yuchao,YANG Fang,et al.Seasonal variation in body mass and energy budget in Chinese bulbuls (Pycnonotus sinensis) [J].Avian Res,2014,5:4.doi:10.1186/s40657-014-0004-8.
[22] ZHANG Weihong,LI Ming,LIU Jinsong,et al.Seasonal acclimatization of metabolism in Eurasian tree sparrows(Passer montanus) [J].Comp Biochem Physiol Part A Molr Integra Physiol,2008,151(4):519-525.
[23] 赵志军,陈竞峰,王德华.光周期和高脂食物对布氏田鼠能量代谢和产热的影响[J].动物学报,2008,54(4):576-589.ZHAO Zhijun, CHEN Jingfeng,, WANG Dehua.Effects of photoperiod and high fat diet on energy intake and thermogenesis in brandt’s voles Lasiopodomys brandtii[J].Acta Zool Sin,2008,54(4):576-589.
[24] 娄美芳.食物质量对布氏田鼠母体能量代谢、繁殖输出及后代代谢表型的影响[D].济南:山东师范大学,2013.LOU Meifang.Effects of Food Quality on Energy Metabolism,Reproductive Output and Offspring Metabolic Phenotype in Maternal Brandt’s Voles (Lasiopodomys brandtii) [D].Ji’nan:Shandong Normal University,2013.
[25] 王有祥,徐兴军,邵淑丽,等.温度驯化对白腰朱顶雀脱支酶活性的影响[J].东北林业大学学报,2015,43(9):107-110.WANG Youxiang, XU Xingjun, SHAO Shuli, et al.Effects of temperature acclimatization on enzyme activity in Carduelis flammea debranching [J].J Northeast For Univ,2015,43(9):107-110.
[26] DOWD W W,BRILL R W,BUSHNELL P G,et al.Standard and routine metabolic rates of juvenile sandbar sharks(Carcharhinus plumbeus),including effects of body mass and acute temperature change [J].Fish Bull,2005,104(3):323-331.
[27] RINTAMAKI P T, STONE J R, LUNDBERG A.Seasonal and diurnal body-mass fluctuations for two nonhoarding species of parus in Sweden modeled using pathanalysis [J].Auk Orithol Adv,2003,120(3):658-670.
[28] 刘丽,陈晓波,余红心,等.品种与日粮营养水平对鸡内脏器官质量及指数的影响[J].饲料研究,2010(11):49-51.LIU Li, CHEN Xiaobo, YU Hongxin, et al.Breed and daily ration nutritional level influence of chicken’s visceral organ mass and index [J].Feed Res,2010(11):49-51.
[29] 宋志刚,王德华.内蒙古草原布氏田鼠代谢率与身体器官的关系[J].兽类学报,2003,23(3):230-234.SONG Zhigang, WANG Dehua.Relationship between metabolic rate and organ size in Brandt’s voles (Microtus brandti) [J].Acta Theriol Sin,2003,23(3):230-234.
[30] 冯照军,季丽萍,施雯,等.中华蟾蜍糖原含量的季节变化[J].动物学报,2007,53(6):1048-1053.FENG Zhaojun,JI Liping,SHI Wen,et al.Seasonal changes of the glycogen content in Bufo gargarizans[J].Acta Zool Sin,2007,53(6):1048-1053.
[31] KARASOV W H,del RIO C M,CAVIEDESVIDAL E.Ecological physiology of diet and digestive systems [J].Ann Rev Physiol,2011,73(73):69-93.
[32] STARCK J M,RAHMAAN G H.Phenotypic flexibility of structure and function of the digestive system of Japanese quail[J].J Exp Biol,2003,206(11):1887-1897.
[33] PIERSMA T,DRENT J.Phenotypic flexibility and the evolution of organisnal design [J].Trends Ecol Evol,2003,18(5):228-233.
