大豆疫霉对根分泌物中异黄酮、氨基酸和糖的响应
2018-03-22文景芝陈宇飞武文旭高新颖张卓群宋光梅
文景芝,吴 迪,陈宇飞,武文旭,所 冰,高新颖,张卓群,徐 莹,宋光梅
(东北农业大学农学院,哈尔滨 150030)
大豆疫霉根腐病是典型土传病害[1],其病原菌大豆疫霉(Phytophthora sojae Kaufmann and Gerdemann)在自然界只侵染栽培大豆(Glycine max(L.)Merr)[2]。该菌于1948年首次在美国印第安纳州发现,我国1989年在东北大豆产区分离获得[3]。大豆疫霉是卵菌,其接种体游动孢子通过鞭毛与寄主根分泌的化合物互作定位寄主,侵染种子和根系[4]。Zentmyer报道植物产生的化学物质对卵菌游动孢子具有趋化作用[5]。Chi等发现紫花苜蓿(Medicago sativa L.)幼根对引起苜蓿疫病大雄疫霉(Phytophthora megasperma Drechs)有趋化作用,但其信号分子尚不清楚[6]。研究发现,游动孢子游动方向易受多种化学物质影响。
Graham鉴定大豆种子和根分泌物中含多种类黄酮(flavonoid)和异黄酮类(isflavonoid)物质,发现90%异黄酮大豆黄素(daidzein)和染料木素(genistein)存在于大豆根尖伸长区[7]。Morris等首次报道daidzein和genistein对大豆疫霉游动孢子有趋化作用,可使正在游动的大豆疫霉游动孢子迅速成囊并萌发,但对非病原菌无效[8]。Riggs等也发现根尖伸长区含高浓度异黄酮,该区域可有效吸引大豆疫霉游动孢子,认为daidzein和genistein是大豆疫霉识别和定位其寄主信号分子[9]。研究表明,当大豆根分泌daidzein和genistein浓度达10 nmol·L-1以上时可吸引大豆疫霉游动孢子,但其他6种疫霉(P.capsici,P.cryptogea,P.parasitica,P.medicaginis,P.megasperma Alfalfa,P.megasperma Douglas)和1种腐霉(Pythium irregulare)游动孢子不易被daidzein和genistein吸引[8,10]。由此可见,大豆疫霉对异黄酮敏感趋向性一部分由寄主范围决定。
Riggs等用基因表达沉默方法将异黄酮合成酶基因敲除,终止异黄酮合成,发现大豆根仍可吸引大量大豆疫霉游动孢子[9]。Graham也发现异黄酮合成酶基因沉默的大豆对大豆疫霉感病性增强,说明除异黄酮外,可能还有其他信号分子参与大豆疫霉与大豆根互作[11]。
Donaldson等研究证实,外源氨基酸和可溶性糖可影响3种腐霉(Pythium aphanidermatum,P.catenulatum,P.dissotocum)游动孢子行为[12]。Suo等研究证实这些外源氨基酸和可溶性糖影响大豆疫霉游动孢子行为,但是否存在于根分泌物中及其在相对原位浓度对大豆疫霉游动孢子是否有趋化作用尚不清楚[13]。Tyler等研究发现寄主特异性物质和非特异性物质均影响疫霉菌游动孢子趋化性、成囊及孢囊萌发,影响疫霉菌对寄主植物侵染[14]。
本研究旨在明确寄主大豆和非寄主菜豆根分泌物中异黄酮、氨基酸和可溶性糖相对原位浓度及其对大豆疫霉游动孢子侵染前行为影响(大豆疫霉对游动孢子趋化性、成囊以及孢囊萌发影响),阐明这些物质在大豆疫霉选择寄主过程中作用,为进一步研究大豆疫霉侵染大豆和不侵染非寄主分子机制奠定基础。
1 材料与方法
1.1 材料
1.1.1 大豆疫霉菌株及植物品种
大豆疫霉菌株Eps597-3,由东北农业大学植物病理实验室保存,致病型为1a,3c,7。大豆感病品种Sloan和抗病品种Williams82由Dr.Sung M.Lim(University of Arkansas)提供,其中Sloan(rps)不含任何已知抗疫霉根腐病基因,可被大豆疫霉任何生理小种侵染;Williams82含有抗疫霉根腐病基因Rps1k,对菌株Eps597-3表现抗病;非寄主菜豆(Phaseolusvulgaris L.)一点红,市售,为黑龙江省主栽品种,非寄主,不感染大豆疫霉。
1.1.2 试剂
2种大豆异黄酮(色谱纯级):大豆黄素(daidzein)和染料木素(genistein)购自Sigma公司(上海,中国)。
18种氨基酸(色谱纯级)和6种可溶性糖(色谱纯级)由上海融禾医药科技发展有限公司生产(上海,中国)。氨基酸包括丙氨酸(Ala)、精氨酸(Arg)、天冬酰胺(Asn)、天冬氨酸(Asp)、谷氨酸(Glu)、甘氨酸(Gly)、胱氨酸(H-Cys)、组氨酸(His)、羟脯氨酸(Hypro)、异亮氨酸(Ile)、赖氨酸(Lys)、蛋氨酸(Met)、苯丙氨酸(Phe)、脯氨酸(Pro)、丝氨酸(Ser)、苏氨酸(Thr)、色氨酸(Trp)、缬氨酸(Val);可溶性糖包括阿拉伯糖(Ara)、果糖(Fru)、半乳糖(Gal)、葡萄糖(Glu)、麦芽糖(Mal)和蔗糖(Suc)。以上试剂作为色谱分析标准品,若根分泌物中含该物质,则配制成相对原位浓度用于趋化作用试验。
1.2 试验方法
1.2.1 根分泌物收集及组分测定
于2017年5月初在东北农业大学园艺站盆栽大豆Sloan、Williams82和菜豆一点红,4~6叶期,将植株完整拔出,依次用自来水、蒸馏水和去离子水将根部冲洗干净,取15~20 g植物根系浸入100 mL灭菌去离子水中,根部作遮光处理。滴加浓磷酸避免微生物对根分泌物分解。同时等量灭菌去离子水中滴1滴浓磷酸作平行对照,该灭菌去离子水即为后续对照中去离子水,消除浓磷酸影响。阳光下培养5 h,根分泌物释放到去离子水中。将含根分泌物去离子水用3层灭菌滤纸过滤2次,滤液经孔径0.22μm滤膜过滤,冷冻真空干燥器(Marin Christ,Osterode,Sachsen,Germany)浓缩成粉末状,于无菌干燥器内备用。一般浸泡15~20 g植物根系100 mL灭菌去离子可冷冻干燥成0.36 g粉末。
分别取3种根分泌物粉末,按1 g根干重对应1 mL浓缩液比例加超纯水溶解,0.22μm滤膜过滤,取400μL于小离心管中,100μL 10% 磺基水杨酸混合,0.22μm滤膜过滤,滤液于4℃冰箱中静置60 min,4℃下14 500 r·min-1离心15 min,取上清液在相同条件下再次离心5 min,取上清液用超纯水按1∶1(v/v)稀释,0.22μm滤膜过滤后备用。以2种异黄酮、18种氨基酸和6种可溶性糖为标准品对3个根分泌物样品中26种组分含量作HPLC分析(日本岛津LC-10A高效液相色谱仪,岛津公司,京都,日本;德国安米诺西斯A200氨基酸分析仪,柏林,德国)。
1.2.2 大豆疫霉游动孢子对根分泌物组分趋化性
在充满游动孢子悬浮液(2×104个·mL-1)趋化性测定室两端分别插入充满超纯水毛细管和充满充满待测溶液(将外源物质用超纯水配制成根分泌物中相对原位浓度)毛细管[13]。记录25 min时两只毛细管中游动孢子数量。室温下作9次生物学重复。
1.2.3 根分泌物组分对大豆疫霉游动孢子成囊影响
将新鲜游动孢子悬浮液与待测溶液混合后(终浓度为试验所需浓度)加至凹玻片凹槽内,以等量超纯水游动孢子悬浮液为对照。30 min时记录各处理游动孢子成囊率。室温下作3次生物学重复。
1.2.4 根分泌物组分对大豆疫霉游动孢子萌发影响
利用涡旋混合器使游动孢子成囊,将游动孢子悬浮液与待测溶液混合后(二者终浓度为试验所需浓度)加至凹玻片凹槽内,以等量超纯水游动孢子悬浮液为对照。将凹玻片放入含无菌润湿纱布培养皿中保湿,静置培养18 h。显微镜下观察各处理孢囊萌发数。试验在室温下作3次生物学重复。
1.2.5 数据分析
用 Excel 2003(Microsoft, Redmond,Washington,USA)及 SPSS 20.0(Statistical Product and Service Solutions,IBM,Armonk,New York,USA)作数据分析。

表1 寄主大豆和非寄主菜豆根分泌物中异黄酮、氨基酸和可溶性糖种类及含量Table1 Kindsand contentsof isoflavones,freeamino acidsand solublesugarsin the host and non-host root exudates (ng·μL-1)
2 结果与分析
2.1 根分泌物中异黄酮、氨基酸和可溶性糖种类及含量
分别对非寄主菜豆一点红、抗病品种Williams82和感病品种Sloan根分泌物中2种大豆异黄酮、18种氨基酸和6种可溶性糖含量作HPLC分析。由表1可知,3个品种根分泌物中均含异黄酮daidzein和genistein,但寄主与非寄主间及感病品种与抗病品种间在含量上均无显著性差异。3个品种genistein含量均显著高于daidzein,约高6~8倍。
根分泌物中氨基酸种类分别为一点红18种、Williams82 9种和Sloan 5种,其中Val、Hypro、Ser和H-Cys均存在于3个品种根分泌物中。除HCys在一点红根分泌物中浓度显著低于其在Williams82和Sloan根分泌物中浓度外(约低1.6倍),其他氨基酸在根分泌物中浓度均为非寄主显著高于寄主,抗病品种略高于感病品种(见表1)。
6种可溶性糖中,Glu、Suc、Fru和Ara均存在于3个品种根分泌物中,Gal仅存在于Williams82根分泌物中,Mal在3个品种根分泌物中均不存在。Ara、Glu和Suc在Sloan根分泌物中含量最高,Fru在一点红中含量最高(见表1)。

续表
2.2 根分泌物组分对大豆疫霉游动孢子趋化作用
2.2.1 异黄酮及其混合液对大豆疫霉游动孢子趋化作用
游动孢子对3个品种根分泌物中相对原位浓度异黄酮daidzein和genistein趋化性较强,相对原位浓度不同,趋化性强度存在差异。Daidzein在Sloan根分泌物中含量最多,吸引游动孢子数最少,一点红根分泌物中含量最少,吸引游动孢子数最多。Genistein在一点红根分泌物中含量最少,吸引游动孢子数也最少,在Sloan和Williams82中含量相同,吸引游动孢子数量相同。两种异黄酮混合后对大豆疫霉游动孢子趋化作用表现为减效(与简单相加相比较,下文均用SUM表示),其中Williams82约减效60%,一点红约减效48%,Sloan约减效22%,但游动孢子对异黄酮混合液仍有趋化性,Sloan趋化性促进指数为1.72,Williams82趋化性促进指数为1.55,一点红趋化性促进指数为0.87(见图1 a)。

图1 异黄酮及其混合液对大豆疫霉游动孢子(2×104个·mL-1)趋化作用Fig.1 Promotion index of the isoflavones and their mixture to taxis,encystment,and germination of zoosporesor cysts(2×104 z·mL-1)of Phytophthora sojae
3个品种根分泌物中相对原位浓度异黄酮daidzein和genistein均显著促进游动孢子快速成囊,促进程度差异显著。一点红根分泌物中daidzein对游动孢子成囊促进作用最显著,约为Williams82 1.6倍和Sloan 2倍。3个品种根分泌物中genistein对游动孢子成囊促进无显著差异。2种异黄酮混合后对游动孢子成囊促进作用呈一定程度减效,一点红减效约76%,Williams82约减效63%,Sloan约减效36%,减效后异黄酮混合液对游动孢子成囊仍有促进作用,Sloan成囊率促进指数为0.82,Williams82成囊率促进指数为0.50,一点红成囊率促进指数为0.38(见图1b)。
3个品种根分泌物中相对原位浓度异黄酮daidzein和genistein均显著促进游动孢子萌发,促进程度不同。Sloan根分泌物中daidzein对游动孢子萌发促进作用最显著,其次是Williams82,一点红根分泌物中daidzein促进作用最弱。3个品种根分泌物中genistein对游动孢子萌发促进作用无显著差异。2种异黄酮混合后对大豆疫霉游动孢子萌发促进作用显著减效,其中一点红约减效78%,Williams82和Sloan分别约减效67%和73%,但减效后异黄酮混合液对游动孢子萌发仍有促进作用,Sloan萌发率促进指数为0.21,Williams82萌发率促进指数为0.14,一点红萌发率促进指数为0.08(见图1c)。
2.2.2 氨基酸及其混合液对大豆疫霉游动孢子趋化作用
游动孢子对3个品种根分泌物中18种氨基酸均具较强趋化性,但由于相对原位浓度不同,趋化性强度存在差异。4种氨基酸(Val、Hypro、Ser和H-Cys)中,Val在一点红中含量最多,但游动孢子对其趋化性最不显著;H-Cys在一点红根分泌物中含量最低,游动孢子对其趋化性最弱,约为Williams82和Sloan0.6倍;游动孢子对Williams82根分泌物中Hypro以及Sloan根分泌物中Ser趋化性最显著,但游动孢子对Hypro和Ser趋化性与其根分泌物中浓度无显著相关性。氨基酸混合后对大豆疫霉游动孢子趋化作用也减效,其中一点红约减效96%,Williams82约减效88%,Sloan约减效19%,减效后氨基酸混合液对游动孢子趋化性仍有显著促进作用,Sloan趋化性促进指数为2.69,Williams82趋化性促进指数为1.54,一点红趋化性促进指数为0.89(见图2-a1-a3)。
一点红、Williams82和Sloan根分泌物中绝大多数相对原位浓度氨基酸均显著促进游动孢子成囊,少数种类氨基酸抑制游动孢子成囊,如一点红根分泌物中His、Phe、H-Cys和Pro,Williams82根分泌物中Pro及Sloan根分泌物中Phe和H-Cys抑制游动孢子成囊。氨基酸混合后对大豆疫霉游动孢子成囊影响减效94%~99%,但仍有显著促进作用,Sloan成囊率促进指数为0.42,Williams82成囊率促进指数为0.22,一点红成囊率促进指数为0.05(见图2-b1-b3)。
菜豆、Williams82和Sloan根系分泌物中绝大多数相对原位浓度氨基酸均显著促进游动孢子萌发,少数种类氨基酸抑制游动孢子萌发。但一点红根分泌物中Gly、Ile、Trp和Arg抑制游动孢子萌发。此外一点红中Phe和H-Cys,Williams82中Pro及Sloan中Phe和H-Cys也抑制游动孢子萌发。Sloan中5种和Williams82中9种氨基酸混合液对孢囊萌发有促进作用,但促进作用显著低于简单相加之和(分别降低92%和68%),且Sloan促进作用高于Williams82。一点红中18种氨基酸混合液表现减效作用,且由促进变为抑制作用(见图2-c1-c3)。
2.2.3 可溶性糖及其混合液对大豆疫霉游动孢子趋化作用
处理25 min后,游动孢子对3个品种根分泌物中不同可溶性糖均具较强趋化性,但由于相对原位浓度不同,趋化性强度存在差异。寄主和非寄主根分泌物中均含Glu、Suc、Fru和Ara,其中一点红根中相对原位浓度Glu、Fru和Suc吸引游动孢子数量显著高于Williams82和Sloan,而Ara吸引游动孢子数量在一点红、Williams82和Sloan之间差异不显著。可溶性糖混合后有一定减效作用,其中Williams82减效约91%,Sloan减效约75%,一点红减效约72%,3个品种可溶性糖混合液对游动孢子的趋化性仍有显著促进作用,一点红趋化性促进指数为2.57,Sloan趋化性促进指数为2.40,Williams82趋化性促进指数为0.86(见图3-a)。
3个品种根分泌物中相对原位浓度可溶性糖均可促进游动孢子成囊,但因浓度不同,促进效果存在差异。处理30 min后,Williams82根分泌物中Glu、Suc、Fru和Ara对游动孢子成囊促进作用最显著。可溶性糖混合后有减效作用,一点红减效约29%,Williams82和Sloan分别减效约53%和55%,混合液对游动孢子成囊仍有显著促进作用,Williams82成囊率促进指数为4.83,一点红成囊率促进指数为4.51,Sloan成囊率促进指数为3.11(见图3-b)。

图2 氨基酸及其混合液对大豆疫霉游动孢子(2×104个·mL-1)趋化作用Fig.2 Promotion index of the the 18 kinds of amino acidsand their mixtureto taxis,encystment,and germination of zoosporesor cysts(2×104 z·mL-1)of Phytophthora sojae
3个品种根分泌物中相对原位浓度可溶性糖均可促进孢囊萌发。其中相对原位浓度Glu对孢囊萌发率促进作用在3个品种间差异不显著;相对原位浓度Fru对孢囊萌发促进作用表现为Williams82和Sloan显著高于一点红;相对原位浓度Suc对孢囊萌发促进作用表现为一点红和Sloan显著高于Williams82;相对原位浓度Ara对孢囊萌发促进作用表现为一点红显著高于Williams82和Sloan。Sloan和Williams82根分泌物中可溶性糖混合后有一定减效作用,分别减效约86%和51%,但对孢囊萌发仍有促进作用,且Sloan促进作用低于Williams82。一点红根分泌物中可溶性糖混合液对孢囊萌发影响由促进变为抑制作用(见图3-c)。
2.2.4 异黄酮、氨基酸及可溶性糖混合液对大豆疫霉游动孢子趋化作用
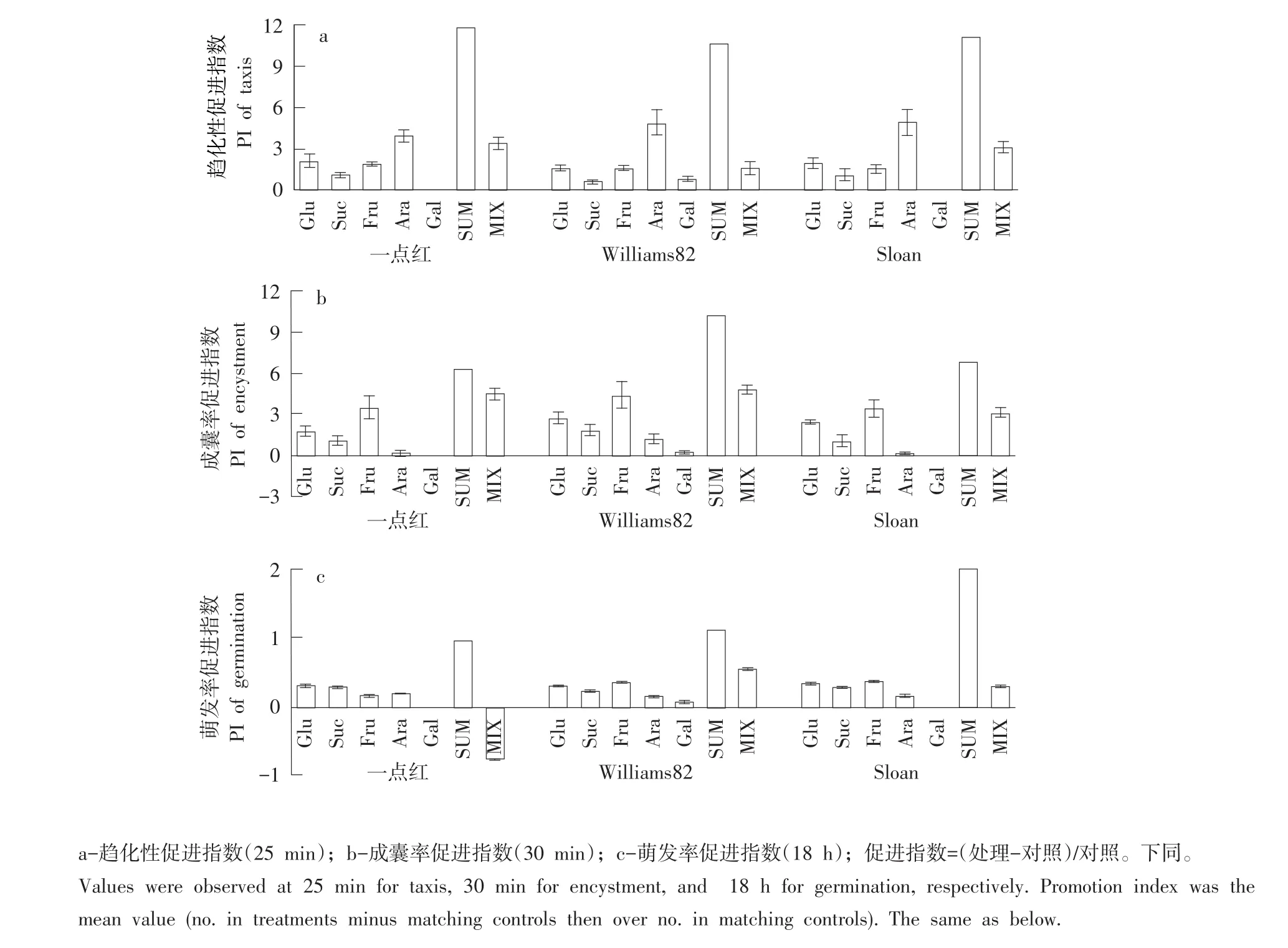
图3 可溶性糖及其混合液对大豆疫霉游动孢子(2×104个·mL-1)趋化作用Fig.3 Promotion index of thethe 6 kinds of Soluble sugar and their mixture to taxis,encystment,and germination of zoosporesor cysts(2×104 z·mL-1)of Phytophthora sojae.
将所有试验组分按3种根分泌物中原位浓度混合后测定其对大豆疫霉游动孢子趋化作用。结果表明,3个混合液对游动孢子3个生理指标均表现为显著促进或抑制作用,且促进或抑制作用显著低于其SUM值,表明3类物质混合后发生显著减效作用,减效程度由强到弱依次是一点红、Williams82及Sloan。
3类物质混合后9个试验中,仅趋化性试验中一点红处理由促进逆转为抑制,促进指数为-0.75,其他8个试验均表现为不同程度促进作用。
趋化性试验中Sloan促进指数为2.02,Williams82促进指数为1.73;成囊试验中一点红促进指数为0.26,Williams82促进指数为0.51,Sloan促进指数为1.05;萌发试验中一点红促进指数为1.63,Williams82促进指数为0.94,Sloan促进指数为0.76(见图4)。

图4 三类物质混合后对大豆疫霉游动孢子(2×104个·mL-1)趋化作用Fig.4 Promotion index of the the all the test components mixture to taxis,encystment,and germination of zoospores or cysts(2×104 z·mL-1)of Phytophthora sojae
3 讨论与结论
大豆疫霉主要利用游动孢子传播和扩散,游动孢子具双鞭毛[15],当游动孢子感受到寄主根分泌物中特异性信号时,即游向这类物质,利用该类物质找到寄主[8,10,16]。游动孢子接触到根表面即休止并吸附在根表面开始萌发侵染。
寄主特异性物质如异黄酮,寄主非特异性物质如氨基酸均影响疫霉菌游动孢子趋化性、成囊及孢囊萌发和寄主植物侵染[16]。本文用HPLC测定寄主大豆和非寄主菜豆根分泌物中异黄酮、氨基酸和可溶性糖含量,发现异黄酮含量在寄主大豆和非寄主菜豆间无显著差异,对游动孢子趋化作用差异不显著,说明根分泌物中2种异黄酮不是唯一决定大豆疫霉寄主范围化学信号,与Riggs等研究结果一致[9]。氨基酸和糖种类和含量在寄主大豆抗、感品种与非寄主菜豆间差异显著,且3种根分泌物中氨基酸和可溶性糖均影响游动孢子趋化性、成囊及萌发,但由于种类和相对原位浓度不同,影响程度和方式不同,绝大多数物质对游动孢子趋化性、成囊及萌发有显著促进作用,少数有抑制作用。本文中氨基酸Hypro、Ser、Val和His及可溶性糖Ara均影响大豆疫霉游动孢子,Donaldson等测定结果表明,这些物质不影响腐霉(P.aphanidermatum、P.catenulatum和P.dissotocum)游动孢子[12],这种差异可能与疫霉和腐霉游动孢子受体不同有关,因为游动孢子对化学信号响应通过受体介导[14]。
Donaldson等在研究外源氨基酸和可溶性糖对Pythium aphanidermatum、P.catenulatum和P.dissotocum游动孢子趋化性、成囊和萌发影响时发现,Glu和Asp在与其他氨基酸混合发生不同程度减少或阻止对游动孢子吸引,说明不同种类氨基酸混合后会发生互作,对游动孢子趋化作用发生改变[12]。本试验分别测定非寄主菜豆、寄主大豆抗、感病品种根分泌物相对原位浓度异黄酮混合液、氨基酸混合液、可溶性糖混合液及异黄酮、氨基酸和可溶性糖混合液对大豆疫霉游动孢子趋化作用发现,无论是同类还是三类物质混合均发生显著减效作用,说明各组分间发生相互干扰。由于非寄主菜豆根分泌物中氨基酸种类和含量均显著高于感病大豆和抗病大豆,而非寄主菜豆减效程度最强,因此认为减效作用强度与参与混合物质含量和浓度呈正相关,推测这些物质有共用受体,导致作用效果受阻。趋化性试验中,菜豆根分泌物中异黄酮、氨基酸、可溶性糖单独混合仅表现减效作用,但3种物质混合后促进指数为负数(多次重复试验),可视为趋避作用,说明非寄主根分泌物组分之间互作复杂,是菜豆成为非寄主原因之一。
大豆根系分泌物中除本试验异黄酮、氨基酸和可溶性糖外,还包括烃、有机酸、醇、酚、醛、苯、脂肪酸、苯甲酸及其衍生物等有机化合物[17],其中很多物质已证实对微生物有趋化作用,如大豆根分泌物中芳香酸、二羧酸对慢生型大豆根瘤菌(Bradyrhizobium japonicum)有吸引作用,对大豆与根瘤菌共生关系具有重要作用[18]。 腐霉(Pythium)和疫霉(Phytophthora)对根系分泌物中乙醇有趋化性[19]。对微生物有趋化作用化学物质,可能也对大豆疫霉游动孢子有趋化作用。
[1] Duniway J M.Water relations of water molds[J].Annual Review of Phytopathology,1979,17:431-460.
[2] Tyler B M.Phytophthora sojae:Root rot pathogen of soybean and model oomycete[J].Mol Plant Pathol,2007,8(1):1-8.
[3] 文景芝,揭岩,田苗,等.黑龙江省东部大豆疫霉群体结构及其时空动态[J].东北农业大学学报,2017,48(5):1-8.
[4] Deacon JW,Donaldson SP.Molecular recognition in the homing responses of zoosporic fungi,with special reference to Pythium and Phytophthora[J].Molecular Plant Pathology,1993,97(10):1153- 1171.
[5] Zentmyer G A.Chemotaxis of zoospores for root exudates[J].Science,1961,133(3464):1595-1596.
[6] Chi C C,Sabo F E.Chemotaxis of zoospores of Phytophthora megasperma to primary roots of alfalfa seedlings[J].Canadian Journal of Botany,1978,56(7):795-800.
[7] Graham T L.Flavonoid and isoflavonoid distribution in developing soybean seedling tissues and in seed and root exudates[J].Plant Physiology,1991,95(2):594-603.
[8] Morris P F,Ward E W B.Chemoattraction of zoospores of the soybean pathogen,Phytophthora sojae,by isoflavones[J].Physiological and Molecular Plant Pathology,1992,40(1):17-22.
[9] Riggs K.Chemotaxis of Phytophthora sojae zoospores to soybean roots is altered by isoflavone silencing[D].Columbus:Ohio State University,2010.
[10] Latijnhouwers M,Ligterink W,Vleeshouwers V G,et al.A Galpha subunit controls zoospore motility and virulence in the Potato late blight pathogen Phytophthora infestens[J].Molecular Microbiology,2004,51(4):925-936.
[11] Graham M Y.RNA interference of soybean isoflavone synthase genes leads to silencing in tissues distal to the transformation site and to enhanced susceptibility to Phytophthora sojae[J].Plant Physiology,2005,137(4):1345-1353.
[12] Donaldson SP,Deacon JW.Effects of amino acids and sugars on zoospore taxis,encystment and cyst germination in Pythium aphanidermatum(Edson)Eitzp.,P.catenulatum Matthews and P.dissotocum Drechs[J].New Phytologist,1993,123(2):289-295.
[13] Suo B,Chen Q M,Wu W X,et al.Chemotactic responses of Phytophthora sojae zoospores to amino acids and sugars in root exudates[J].Journal of General Plant Pathology,2016,82(3):142-148.
[14] Tyler B M.Molecular basis of recognition between Phytophthora pathogens and their hosts[J].Phytopathology,2002,40(4):137-167.
[15] Hardham A R.Cell biology of plant-oomycete interactions[J].Cell Microbiol,2007,9(1):31-39.
[16] Morris P F,Bone E,Tyler B M.Chemotropic and contact responses of Phytophthora sojae hyphae to soybean isoflavonoids and artificial substrates[J].Plant Physiology,1998,117(4):1171-1178.
[17] 李业成.正茬、连作大豆根系分泌物化感作用的初步研究[D].哈尔滨:东北农业大学,2010.
[18] Singh T,Arora D K.Motility and chemotactic response of Pseudomonas fluorescenstoward chemoattractants present in the exudate of Macrophomina phaseolina[J].Microbiological Research,2001,156(4):343-351.
[19] Allen R N,Newhook F J.Chemotaxis of zoospores of Phytophthora cinnamomi to ethanol in capillaries of soil pore dimensions[J].Transactions of the British Mycological Society,1973,61(2):287-302.
