结核分枝杆菌SYBR Green实时荧光定量PCR快速检测方法的建立
2018-03-22同重湘杨增伟常运朝高恺吴玲车团结
同重湘,杨增伟 ,常运朝,高恺,吴玲,车团结*
1,甘肃省传染病院,甘肃兰州,730000
2,甘肃省功能基因组与分子诊断重点实验室,甘肃兰州,730000
3,甘肃省人民医院检验科,甘肃兰州,730000
在 2000 到 2016 年全球范围内,结核病死亡率下降了 37%。结核病的预防、控制以及治疗挽救了全球 5300 万人的生命[1]。在 2016,报道全世界结核病病例有 1040 万个。其中 620 万例男性,320 万例女性,100 万例儿童。170万人死于肺结核,少数国家肺结核患者病死率低于 5%,但在非洲地区肺结核患者目前诊断传染性肺结核的主要方法是通过胸部×片检查,以及痰涂片染色镜检和PPD试验联合检测。由于胸部×片是根据临床症状来诊断,缺少病原学依据,肺结核和其他肺部疾病在胸片×片的检查结果可能有相似之处,导致误诊和漏诊;临床检测结果显示痰涂片抗酸染色方法的阳性率较低,并且标本的不合格导致阳性率更低,容易产生漏诊;而PPD试验的特异性不强,不足以作为肺结核诊断的依据。因此这三种检测结核分枝杆菌的方法存在较大的缺陷,易导致肺结核病人的漏诊,出现少数肺结核病人和其他部位结核病人的漏诊,降低了结核分枝杆菌检测的效果[4-6]。
实时荧光定量PCR是一种基因定量检测手段,使人们获得了一种从分子水平确定结核的新途径,其方法具有快速、简便、特异性高的特点。研究证明PCR检测结核分枝杆菌敏感性可达到99.1%,本研究建立的SYBR Green实时荧光定量PCR法,一种适合于结核分枝杆菌的快速诊断方法,结果报告如下。
1 材料与方法
1.1标准菌株结核分枝杆菌H37Rv ATCC25177,购自上海北思生物科技有限公司。
1.2 样本确诊肺结核病人培养涂阳的结核痰液标本113份。正常人的痰液58份。戈登分枝杆菌、金黄色葡萄球菌、肺炎克雷伯球菌、表皮葡萄球菌、肺炎链球菌痰液标本共计30份。
1.3主要试剂及仪器Rapid Fungi Genomic DNA Isolation Kit、DNA marker、SYBR@ Premi× E×Taq 、10×loading bufer、SanPrep Column DNA Gel E×traction Kit、pMD Ⅲ 18-T Vector Cloning Kit、SanPrep Column Plasmid Mini-Preps KitDH5α感受态细胞、10×TBE缓冲液均购自杨凌天润奥科生物科技有限公司;BL液体培养基购自广东环凯生物公司;50mg/mL氨苄西林(Ampicillin,Amp)溶液、LB液体培养基、AmP/LB固体培养基均由实验室配制;AceQ qPCR SYBR Green Master Mi×购自南京诺唯赞生物科技有限公司;低温高速离心机购自上海尚道仪器制造有限公司;电热恒温水箱购自北京科伟水兴仪器有限公司; ASA-9600实时荧光定量 PCR仪购自百源基因技术有限公司;低温高速离心机购自江苏海门市其林贝尔仪器制造有限公司;凝胶成像系统购自杭州朗基科学仪器有限公司; ND5000超微量紫外可见分光光度计购自北京百泰克生物技术有限公司;微型离心机购自上海民怡仪器仪表有限公司;DYY-8C型电泳仪购自北京六一仪器厂;混悬仪购自美国赛洛捷克;生物安全柜购自上海力申科学仪器有限公司。
1.4 痰液DNA提取吸取待测痰液标本200uL打入2mL的EP管中,加入5mol/L的NaOH 550uL,混匀后室温中摇动15min。加入1mol/L NaH2PO4750uL,混匀,13680×g离心5min。去上清液,加入200uL的TE,混匀,加入100uL浓度为20mg/mL的溶菌酶。置于37℃消化30min。取1mL消化液加入离心管中,13680×g离心5min。弃上清留沉淀,加入1mL生理盐水洗涤,13680×g离心5min。弃上清留沉淀,再加入1mL生理盐水洗涤,13680×g离心5min。留沉淀,加入500uL DNA提取液,混匀,沸水浴10min,13680×g离心5min。取上清2uL点样上机。
1.5 引物设计与合成查询 NCBI网站GenBank数据库中结核分枝杆菌(Mycobacterium tubercuLosis, M.tubercuLosis)的基因序列分析,找出其特有基因的保守序列设计特异性引物,并且在此区域应用primer3.0和NCBI中primer-BLAST软件设计引物及引物分析。M.tubercuLosis Smc 1322F-1570R为外围引物,M.tubercuLosis Smc 1361F-1462R为SYBR Green实时荧光定量PCR引物,所有引物均由杨凌天润奥科生物科技有限公司合成。引物序列见表1。

表1 M.tubercuLosis Smc基因的引物序列Tab.1 The primer sequences of M.tubercuLosis Smc gene
1.6标准阳性质粒的构建① 以购自上海北思生物科技有限公司的结核分枝杆菌标准菌株H37Rv ATCC25177为扩增模板,用引物M.tubercuLosis Smc 1322F-1570R进行PCR反应。反应体系为25μL,其中含dNTP 0.5μL,10×PCR buffer 2.5μL,Taq酶0.5μL, F-Primer(10 μmol/L)0.5μL,R-Primer(10 μmol/L)0.5μL,模板DNA 1μL,无菌水19.5μL,反应条件:经94℃变性10min;共30个循环,每次循环为94 ℃ 30 s、58 ℃ 30 s、72℃ 30 s;72 ℃延伸10 min。PCR扩增产物取6μL 进行1.5 %琼脂糖凝胶电泳,通过凝胶成像系统观察电泳结果,依据DL2000 Maker鉴定目的片段的大小;②对 PCR产物进按上海生工DNA Gel E×traction Kit说明书进行切胶回收;③pMD18-T Vector与目的回收片段16℃过夜连接,取50μL冰浴上融化的大肠杆菌DH5α感受态细胞,加入目的DNA,轻轻混匀,冰浴中放置30分钟;42℃水浴中热激45s,置于冰上2min后加入500μL不含抗生素的LB液体培养基,混匀后37℃,200rpm振荡培养1小时,取8μL 500mM IPTG和40μL 20mg/mL X-gal混合,均匀地涂在90mm含50μg/mL Amp的平板上,37℃培养箱放置30min。待IPTG和X-gal被吸收后,取200μL菌液涂布在平板上,在37℃培养箱过夜培养,挑取白色单克隆,筛选含有目的片段的单克隆;④提取重组质粒,按照杨凌天润奥科生物科技有限公司Plasmid Mini-Preps Kit说明书进行操作,将得到的重组阳性质粒标准品送至杨凌天润奥科生物科技有限公司进行测序。
1.7 质粒拷贝数换算先通过ND5000测定质粒DNA的浓度,再根据质粒的分子质量将样品浓度换算为拷贝数:每μL样品的拷贝数=浓度(ng/μL)×阿伏伽德罗常数×10-9/(重组质粒碱基数×660)= (6.02 x 10(23)) x (ng/ul x 10(-9)) / (DNA length x 660) ,通过计算获得质粒拷贝数。
1.8 SYBR Green实时荧光定量PCR反应①用ddH2O将重组阳性质粒稀释至1.0×109copies/μL左右,再依次10倍比稀释至1.0×108、1.0×107、1.0×106、1.0×105、1.0×104、1.0×103、1.0×102、1.0×101copies/μL,以这8 个梯度浓度为模板,以M.tubercuLosis Smc 1322F-1570R为上下游引物,通过SYBR Green实时荧光定量PCR扩增,建立标准曲线;②SYBR Green实时荧光定量PCR反应体系为20μL,AceQ qPCR SYBR Green Master Mi× 10μL,模板DNA 1μL,F-Primer(10 μmol/L)0.5μL,R-Primer(10μmol/L)0.5 μL, ddH2O 8 μL。每批反应设立阴性对照均以ddH2O代替模板DNA,反应条件:95℃预变性6min,预变性后进入循环,每个循环为95℃ 10s、58℃ 40 s,共35个循环。将荧光信号采集设在58℃。
1.9 检测线试验测定测序正确的重组阳性质粒的浓度,换算成拷贝数。用ddH2O将重组阳性质粒标准品稀释至1.0×109copies/μL左右,依次以1.0×108、1.0×107、1.0×106、1.0×105、1.0×104、1.0×103、1.0×102、1.0×101copies/μL 8个浓度的质粒为模板进行SYBR Green实时荧光定量PCR反应。
1.10 特异性试验用建立的SYBR Green实时荧光定量PCR法检测已确诊的肺结核病人结核痰液标本113份。正常人的痰液标本58份。戈登分枝杆菌、金黄色葡萄球菌、表皮葡萄球菌、肺炎链球菌、肺炎克雷伯球菌、痰液标本共计30份的基因组DNA,将全部 PCR产物均送至杨凌天润奥科生物科技有限公司进行测序,与标准品序列进行比较,评价该方法的特异性。
1.11 稳定性评价分别选取高(1.0×108copies/μL)、中(1.0×106copies/μL)、低(1.0×104copies/μL)3种重组阳性质粒不同浓度标准品,用SYBR Green实时荧光定量PCR进行检测,分别进行10次重复试验,计算其变异系数(coefficient of variation, CV),评价该方法的稳定性。
1.12 统计学分析建立标准曲线:横坐标为1.0×108、1.0×107、1.0×106、1.0×105、1.0×104、1.0×103、1.0×102、1.0×101copies/μL 8个质粒浓度,纵坐标为SYBR Green实时荧光定量PCR扩增所得Ct值,在Excel表中建立标准曲线,根据函数生成线性关系和相关系数R2,理论上R2越接近1,则表示线性关系越好,可信度越高。变异系数:根据3种不同浓度重组阳性质粒标准品,每种浓度做10次平行,依据10次重复SYBR Green实时荧光定量PCR所得的Ct值,计算其变异系数。变异系数值越小,说明平行样本间的差值越小,即离散程度越小;如果变异系数大于15%,在分析统计数据时则要考虑该数据可能不正常,应该剔除。变异系数的计算公式为:变异系数CV =(标准偏差SD/平均值Mean )× 100%。
2 结 果
2.1定量曲线如图1所示,确诊肺结核病人113例痰液标本DNA和标准结核分枝杆菌DNA在第一个循环结束后测到一个基础吸光值,接下来到第8个循环时都没有明显变化。从第10个循环开始全部标本的吸光值逐渐增大,实时荧光定量曲线依次开始抬头,15个循环(CT值)后,定量曲线走向迅速上扬,至27个循环后全部标本定量曲线达到峰值,随后曲线进入平台期,一直到PCR反应结束。阴性对照未出现扩增曲线。
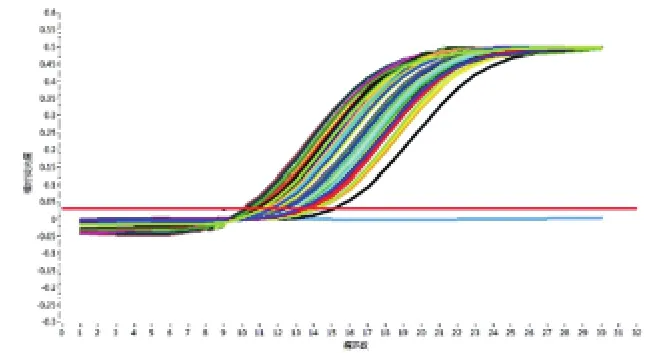
图1 SYBR Green实时荧光定量 PCR检测肺结核病人113例痰液标本扩增曲线Fig.1 Amplification curve for SYBR Green real-time fluorescence quantitative PCR in detection of Sputum samples from 113 patients with puLmonary tubercuLosis
2.2 琼脂糖凝胶电泳结果痰液标本DNA的验证试验,对所获取的PCR产物经胶回收后进行重组阳性标准质粒构建,对其阳性质粒测序,将所得测序结果经NCBI中GENE BANK分析,结果显示该产物为结核分枝杆菌核酸序列。
2.3 特异性实验标本正常人的痰液58份,戈登分枝杆菌、表皮葡萄球菌、金黄色葡萄球菌、肺炎克雷伯球菌、肺炎链球菌痰液标本共计30份。提取DNA后为对照模板进行SYBR Green实时荧光定量PCR未检测到荧光信号。
2.4 检测限实验对重构的阳性质粒进行10倍梯度稀释,然后以稀释液的不同拷贝数为模板进行SYBR Green实时荧光定量PCR检测,荧光定量信号随模板浓度下降而下降,线性范围为l03-108copies/μL,检测下线为l02copies/μL。如图2~3所示,构建的阳性质粒标准品经测序确定为M.tubercuLosis Smc,其质粒浓度通过ND5000微量紫外分光光度计测定核酸为131.34 ng/μL,用过质粒拷贝数的公式计算,得到质粒拷贝数浓度为4.07×1010 copies/μL。对重组阳性质粒10倍比稀释,得到 l08、l07、106、l05、104、103、102、101copies/μL 8个梯度浓度标准品,通过SYBR Green实时荧光定量PCR,得到标准品质粒的荧光定量扩增曲线,规定扩增Ct值>35时,则扩增定义为阴性扩增,见图2。图中扩增曲线呈明显的S型扩增,且指数增长期的扩增曲线趋于平行,说明此SYBR Green实时荧光定量PCR法扩增稳定。所得起始拷贝数与Ct值呈一定的线性相关性,在Excel中制作标准曲线,通过函数呈现线性关系为:y =-1.379ln(×) + 41.056,相关系数R2=0.998,表明线性关系较好,可信度较高。
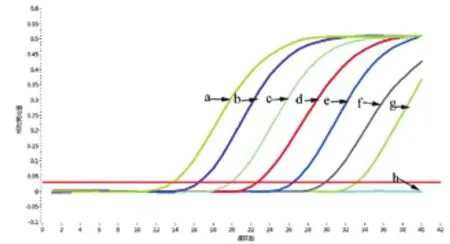
图2 SYBR Green实时荧光定量 PCR检测M.tubercuLosis质粒标准品扩增曲线Fig.2 Amplification curve for SYBR Green real-time fluorescence quantitative PCR in detection of M.tubercuLosis standard plasmid
2.5 稳定性评价选取高(1.0×107copies/μL)、中(1.0×105copies/μL)、低(1.0×103copies/μL)3种不同浓度重组阳性质粒标准品,通过SYBR Green实时荧光定量PCR检测,浓度由高到低的重组阳性质粒分别进行10次重复试验, 3组10倍倍比稀释后的标准品Ct平均值分别是16.83、22.71、29.91,标准差分别是0.61、0.83、0.97,变异系数分别是1.1%、1.7%、2.4%,SYBR Green实时荧光定量PCR结果显示随着标准品拷贝数的降低,Ct值增大,标准差和变异系数也呈逐渐增大的趋势。
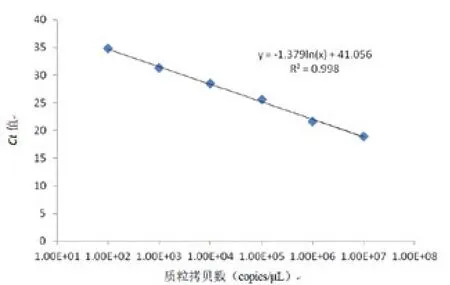
图3 SYBR Green实时荧光定量 PCR检测M.tubercuLosis质粒标准品标准曲线Fig.3 Standard curve for SYBR Green real-time fluorescence quantitative PCR in detection of M.tubercuLosis standard plasmid
2.6灵敏度实验对确诊肺结核病人113例痰液标本分别进行SYBR Green实时荧光定量PCR检测和直接涂片染色法检测。直接涂片染色法检测的灵敏度为42.5%。SYBR Green荧光定量PCR灵敏度为99.1%。
3讨论
肺结核的实验室快速检测对传染肺结核的发现及治疗具有重要的意义,目前,肺结检测的相关方法主要有免疫学检查、细菌学检查和分子生物学检查[7-9]。
检测结核分枝杆菌是临床结核病及时用药的主要方法,传统的检测主要为直接图片法和培养法,但直接涂片法存在特异性差、灵敏度低和不能鉴别抗酸菌死活的不足,而培养法则存在培养时间长和特异性差的缺点,实际临床应用受到限制[10-11]。此方法中113例标本实时PCR阳性113例(99.1%),而直接涂片法只有49例(43.3%)
细菌学检查是目前传染性结核分枝杆菌诊断的金标准,检测结果阳性对肺结核的诊断及治疗具有重大意义,分枝杆菌的监测方法主要是以痰涂片抗酸染色和细菌培养。但是,痰涂片抗酸染色后镜检法检测结果的阳性率不高,一般为百分之18%~49%,且结果受标本质量的影响相差很大。痰标本培养方法检测结果的阳性率稍高于涂片法,能够得到活菌,但结核分枝杆菌培养所需时间较长,传统培养方法需要时间5~8周,实时PCR法与抗酸染色法相比较符合率为99.5%。随着分子生物学的不断发展,实时荧光定量PCR技术已经广泛用于菌种的检测。荧光定量PCR方法与常规的分离培养法相比较,具有操作简便,耗时短,特异性好等特点,参与反应的体系在密闭的PCR管中扩增,实时荧光检测,一定程度上降低了标本污染,并可实时的反映定量监测,为传染病监测提供参考依据。实时荧光定量PCR技术特别是对一些含菌量低的样本(如尿液、胸腹水)检测结果的判定具有非常实用的价值,提高了结核分枝杆菌的检出率[12]。实时荧光定量PCR技术检测结果中会有少数假阳性的结果,但其方法与常规细菌学方法互补使用可提高阳性检出率,不失为一种快速检测结核病的辅助诊断方法。
本研究所建立的一种快速、灵敏、特异的检测结核分枝杆菌的SYBR Green实时荧光定量PCR方法,基于结核分枝杆菌的Smc基因设计引物,并插入pMD18-T载体构建标准阳性质粒,送杨凌天润奥科生物科技有限公司进行测序。并以测序正确的重组阳性质粒作为质粒标准品,质粒标准品稀释进行扩增的曲线平行性比较理想,标准曲线的线性关系较好。SYBR Green实时荧光定量PCR方法的灵敏度较高,该法对重组质粒标准品的检测灵敏度为1.0×102copies/μL;稳定性好,对质粒浓度为1.0×108copies/μL、1.0×106copies/μL、1.0×104copies/μL的标准品重复检测10次,结果显示扩增反应Ct值的CV为1.1 %~2.4 %。用SYBR Green实时荧光定量PCR方法检测M.tubercuLosis总检出率为99.1%,痰涂片抗酸染色镜检阳性率(42.5%)较低,是可能因为抗酸染色需受痰液中细菌数量限制,一般每毫升痰液至少含有(5×103)~(1×104)个细菌方可得出阳性结果,且由于结核病人是间歇性排菌,可能会造成假阴性[13]。这就要求我们在抗酸染色时要严格控制条件,以提高阳性率。而实时荧光定量PCR检测法的阳性率明显高于抗酸染色法和改良罗氏培养法,且特异性为99.1%,这和荧光定量PCR的原理和它所采用的一系列新技术密切相关,实时荧光定量PCR可以做到相对定量,且定量结果可以用于指导临床用药和疗效评估。实时PCR是临床上广泛应用的一种基因定量检测技术,使我们获得一个从分子水平确定结核的新方法,为结核的快速检测提供了有力参考[14]。本研究建立的SYBR Green实时荧光定量PCR法为结核分枝杆菌的检测提供了基础,对结核病的早发现、早治理有一定意义。

