术前营养评估及干预对胃癌疗效的影响
2018-03-22张晓阳边雅静武雪亮张鹏程孙光源
郭 飞, 张晓阳, 边雅静, 武雪亮, 薛 军*, 屈 明, 张鹏程, 孙光源
1. 河北北方学院附属第一医院普通外科,张家口 075000 2. 河北北方学院附属第一医院体检中心,张家口 075000
胃癌系上消化道恶性肿瘤之一。胃癌患者由于厌食、疼痛不适等原因引起不同程度的摄食减少,且消化吸收较差,同时病变组织影响胃壁的机械运动,导致机体营养状况逐步恶化[1]。营养风险对择期手术患者的营养状况、免疫功能、恢复时间、并发症的发生、住院费用等均有一定程度影响,而有效的营养支持可明显降低不良事件的发生,改善患者营养状况,从而提高机体免疫力,促进康复、缩短住院时间,减少费用,提高患者生存质量[2-3]。然而,在临床术前评估中,约52%的患者存在营养风险但被忽视而未给予充分的营养支持。本研究应用NRS 2002营养风险评分系统评估胃癌患者术前的营养状况,并给予有效的营养支持,旨在探讨术前营养评估及干预对胃癌患者术后康复作用。
1 资料与方法
1.1 一般资料 选择2015年1月至2016年12月在河北北方学院附属第一医院普通外科诊治的105例胃癌患者。其中,男性78例,女性27例;平均年龄(56.05±5.11)岁;术前合并糖尿病9例、高血压病18例。纳入标准:病理诊断明确,术前未行新辅助放化疗;无肝、肺、骨等远处转移;择期行根治术、无重要脏器损害等;能够正确理解问卷内容;无精神疾病。排除标准:Ⅳ期以上或伴远处转移无法手术;伴严重心脑血管疾病;肝肾功能异常;免疫系统疾病;重度感染;严重创伤等应激;有精神或心理障碍;不配合相关问卷调查。本研究获得医院伦理委员会批准,患者知情同意并签署知情同意书。
1.2 术前营养评估及分组 参照NRS 2002评分行术前营养评估[4-5],≥3分为存在营养风险,<3分认为营养正常;营养评估均由同一专业团队医师完成。根据NRS 2002评分,将患者分为无营养风险组(n=62)和存在营养风险组(n=43)。每组参照个人情况选择是否给予营养支持,根据是否给予营养支持分为未行营养支持和营养支持两亚组。营养风险组中行营养支持者29例,未行营养支持者14例;无营养风险组中行营养支持者26例,未营养支持者36例。营养支持方式以肠外营养为主,经静脉给予葡萄糖、氨基酸和脂肪乳等,非蛋白热量不低于41.8 kJ/(kg·d),≥3 d;肠内营养以我院营养科配制的营养餐为主。
1.3 观察指标 术前及术后第1、5天清晨抽取静脉血10 mL,全自动生化分析仪检测血清前白蛋白(PAB)、转铁蛋白(TRF)和白蛋白(ALB),应用免疫混悬计检法检测IgA、IgG、IgM,流式细胞仪检测CD3+、CD4+、CD4+/CD8+。观察患者术后恢复情况(下床时间、首次排气、排便时间和住院时间)及并发症发生情况(肺部感染、切口感染延迟愈合、吻合口瘘、肠梗阻、胃肠功能紊乱等)。
2 结 果
2.1 术前营养评估及临床病理特征情况 营养风险组和无营养风险组患者性别、年龄、并发症、肿瘤大小、分化程度、T分期、淋巴结转移差异无统计学意义(表1)。
2.2 术后恢复情况比较 营养风险组中,营养支持患者的首次排气时间、排便时间、下床时间、平均住院时间与未营养支持患者差异有统计学意义(P<0.05),而无营养风险组中上述指标则差异无统计学意义(表2)。
2.3 术后营养指标比较 营养风险组中,两亚组术前和术后第1天营养指标差异无统计学意义;营养支持患者术后第5天的PAB、TRF和ALB明显高于未营养支持患者,差异有统计学意义(P<0.05,表3)。无营养风险组中上述指标差异无统计学意义(表4)。
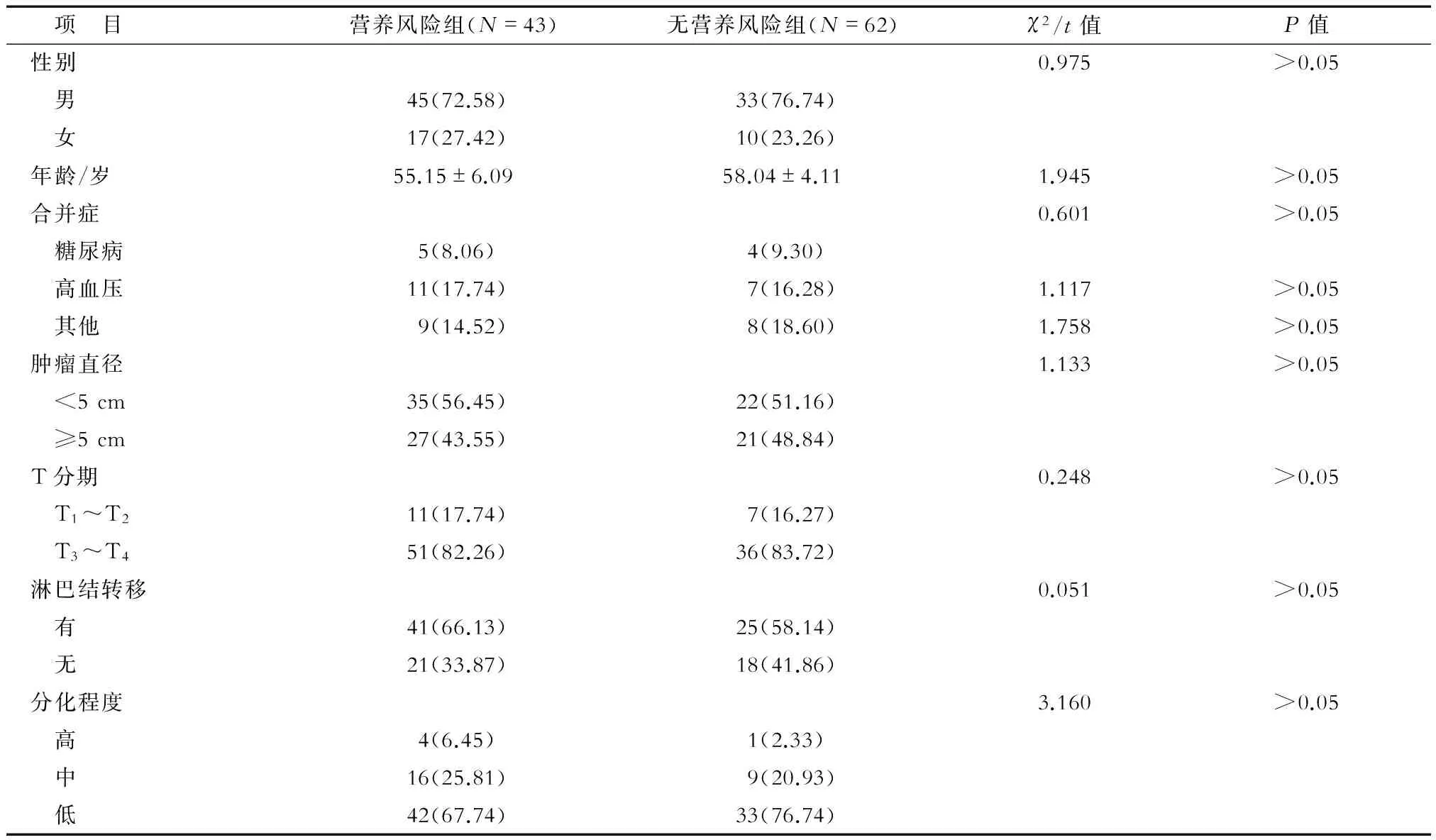
表1 两组患者临床病理特征比较 n(%)

表2 两组患者手术及术后恢复情况比较
*P<0.05与同组未营养支持相比

表3 营养风险组患者术前及术后1、5 d营养指标比较 N=43
PAB:血清前白蛋白;TRF:转铁蛋白;ALB:白蛋白.*P<0.05与未营养支持术后5 d相比
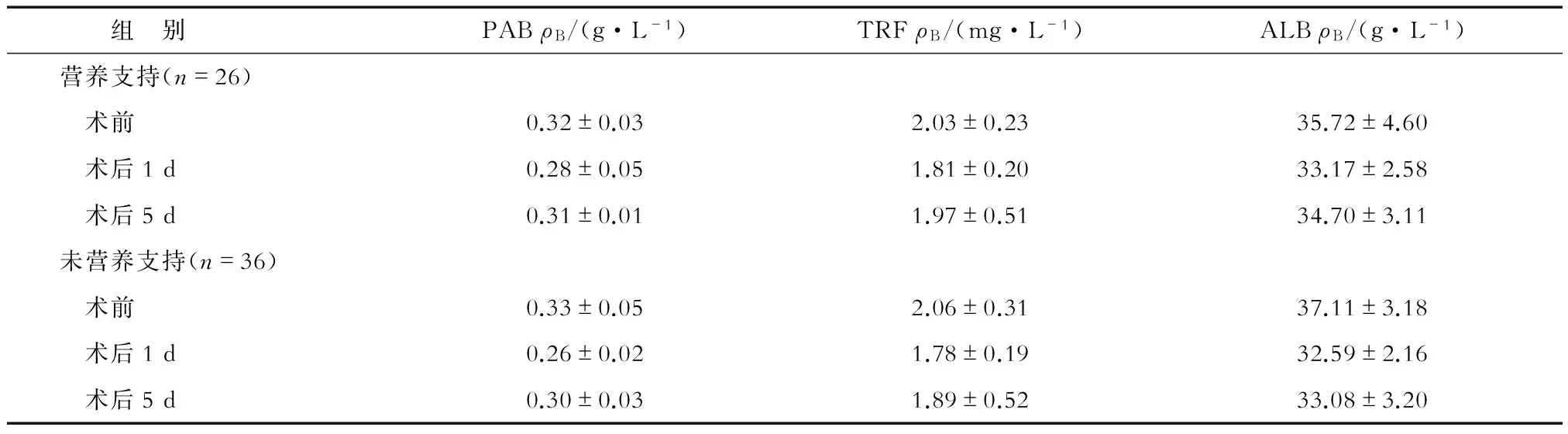
表4 无营养风险组患者术前及术后1、5 d营养指标比较 N=62
PAB:血清前白蛋白;TRF:转铁蛋白;ALB:白蛋白
2.4 两组术后免疫功能比较 营养风险组中,两亚组术前和术后第1天的IgA、IgG、IgM、CD3+、CD4+、CD4+/CD8+差异无统计学意义;营养支持患者术后第5天上述指标明显高于未营养支持患者,差异有统计学意义(P<0.05,表5)。无营养风险组中上述指标差异无统计学意义(表6)。
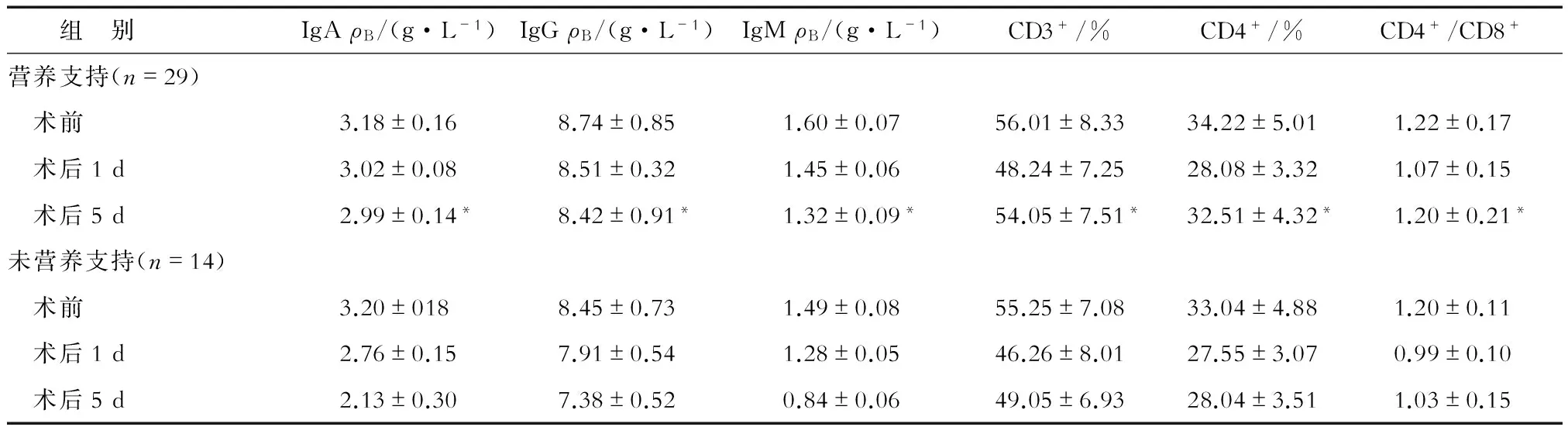
表5 营养风险组患者术后免疫功能比较 N=43
*P<0.05,与未营养支持术后5 d相比
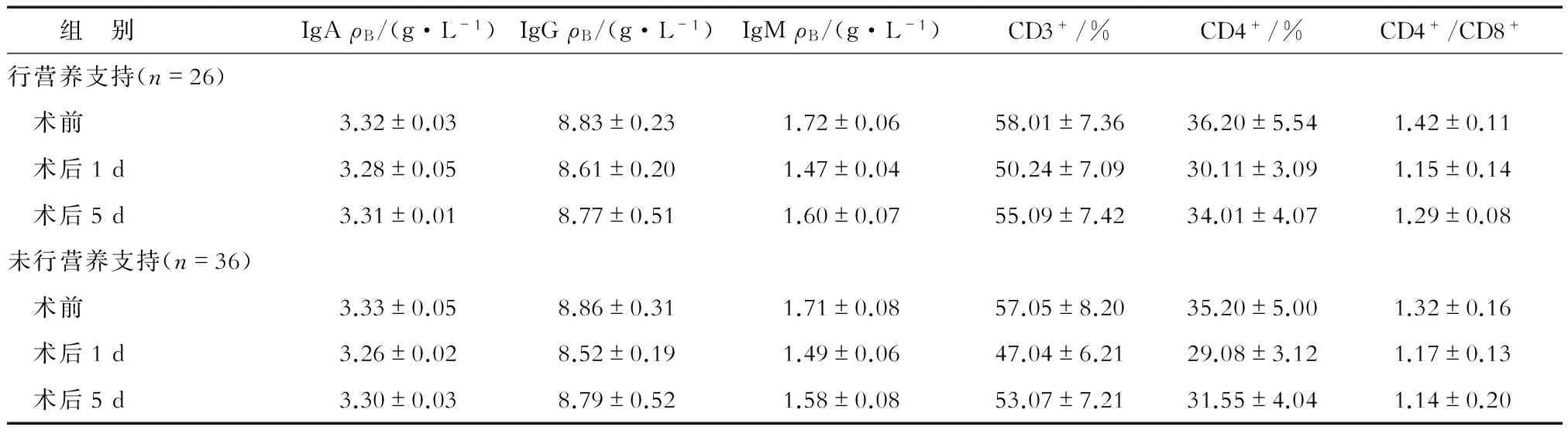
表6 无营养风险组患者术后免疫功能比较 N=62
2.5 两组术后并发症比较 营养风险组中,营养支持患者术后发生肺部感染、切口感染延期愈合、肠梗阻各1例,发生率为10.30%(3/29),未营养支持患者术后发生肺部感染1例、切口感染延期愈合1例、肠梗阻各1例1例、吻合口瘘2例,发生率为35.71%(5/14),差异有统计学意义(P<0.05)。无营养风险组中,营养支持患者术后并发症发生率为7.69%(2/26),未行营养支持患者发生率为8.33%(3/36),差异无统计学意义。
3 讨 论
胃癌患者术前由于长期营养物质摄入减少、消化功能障碍、恶性消耗增加、代谢异常,导致不同程度的营养不良,存在营养风险,影响预后;此外,手术创伤应激及麻醉、输血、感染等因素进一步加重机体的免疫抑制,影响机体对肿瘤细胞的监视和清除,降低机体对肿瘤综合治疗的耐受性,造成预后不良[6-7]。目前,围手术期的营养评估和干预在恶性肿瘤中的应用越来越受到重视。NRS 2002是由丹麦肠内外营养协会研发,是第1个建立在循证医学基础上基于128个随机对照研究的营养风险筛查工具,简便易行,有较好的可信度。欧洲肠外和肠内营养协会(ESPEN)于2002年推荐NRS 2002营养风险评分系统作为住院患者尤其是肿瘤及重度消耗性疾病营养风险筛查的首选工具[8-9]。
本研究发现,营养风险组中营养支持患者术后第1天PAB、TRF和ALB水平较未营养支持患者稍高,但差异不明显,但第5天PAB、TRF和ALB水平明显高于未营养支持患者,表明对于有营养风险的胃癌患者,术前给予有效的营养支持能提高机体抗应激、感染、缺血等能力,明显改善术后患者的营养状况[10],这与郭剑等[11]研究结果一致。营养风险组营养支持患者术后第1天IgA、IgG、IgM、CD3+、CD4+、CD4+/CD8+水平均有不同程度降低,与未营养支持患者差异并不明显,术后第5天上述免疫指标明显高于未营养支持患者,而未营养支持患者各指标均持续下降,表明对于有营养风险的胃癌患者,术前给予有效的营养支持能抑制免疫球蛋白的分解,有利于术后机体免疫功能的恢复,提高机体对肿瘤综合治疗的耐受性,这与鲁力等[12]研究结果一致。
此外,本研究显示,营养风险组中营养支持患者的首次排气时间、排便时间、下床时间和平均住院时间均明显早于未营养支持患者,表明对于存在营养风险的患者,术前给予积极的营养支持干预能加速胃癌患者康复、缩短住院时间,这也符合加速康复外科的理念[13];同时营养风险组营养支持患者术后并发症发生率明显低于未营养支持患者,表明术前给予积极的营养支持干预能降低术后并发症的发生,改善患者预后。
综上所述,对于胃癌患者,术前应给予准确的营养评估;对于评估有营养风险的患者,术前给予充分的营养支持能明显改善患者的营养状况及免疫功能,降低术后并发症,促进康复。
[ 1 ] 宋国栋,王 力,沈 洪,等.预后营养指数在老年胃癌患者治疗与预后中的意义[J].中华普通外科杂志,2017, 32(4):293-197.
[ 2 ] ARRIBAS L, HURTS L, SENDRS M J, et al. NUTRISCORE: a new nutritional screening tool for oncological outpatients[J].Nutrition,2017,33:297-303.
[ 3 ] PAN H, CAI S, JI J, et al. The impact of nutritional status, nutritional risk, and nutritional treatment on clinical outcome of 2248 hospitalized cancer patients: a multi-center, prospective cohort study in Chinese teaching hospitals[J].Nutr Cancer,2013,65(1):62-70.
[ 4 ] KONDRUP J. Nutritional-risk scoring systems in the intensive care unit[J].Curr Opin Clin Nutr Metab Care,2014,17(2):177-182.
[ 5 ] 刘 萍,宋春华,田 丽.两种营养评估方法在原发性肝癌病人中的应用比较[J].肠外与肠内营养,2015, 22(1):26-28.
[ 6 ] 王金庆,李光华,丁印鲁,等.胃癌患者围手术期营养支持的临床分析[J].中国现代普通外科进展,2016, 19(7):584-588.
[ 7 ] 王晓峥,孙春燕.胃癌术后患者营养状况及生存期对生存质量的影响[J].癌症进展,2016,14(11): 1146-1148.
[ 8 ] KONDRUP J, ALLISON S P, ELIA M, et al. ESPEN guidelines for nutrition screening 2002[J].Clin Nutr, 2003,22(4):415-421.
[ 9 ] DAVOODI A, GHOLIZADEH L, REZAZADEH H, et al. Effects of a self-care education program on quality of life of patients with gastric cancer after gastrectomy[J].J Community Support Oncol,2015,13(9):330-336.
[10] JIE B, JIANG Z M, NOLAN M T, et al. Impact of preoperative nutritional support on clinical outcome in abdominal surgical patients at nutritional risk[J].Nutrition,2012,28(10):1022-1027.
[11] 郭 剑,张 彧,田志宏,等.应用患者主管营养评估法PG-SGA评估胃癌患者术前营养状况与术后结局关系的研究[J].国际外科学杂志,2015,42(10):654-657.
[12] 鲁 力,谢 敏,魏少忠,等.术前与术后早期肠内营养对老年胃癌患者术后免疫功能及营养状态的影响[J].中国肿瘤临床,2014,41(18):1170-1175.
[13] 叶景旺,刘宝华,童卫东.加速康复外科在中国中西部地区胃肠外科中应用的问题、策略与展望[J].中华胃肠外科杂志,2017,20(3):263-265.
