18F-FDG PET/CT最大标准摄取值与中低分化肝细胞肝癌临床病理特征的相关性
2018-03-22张一秋李蓓蕾陈曙光石洪成
张一秋, 李蓓蕾, 银 武, 陈曙光, 石洪成*
1. 复旦大学附属中山医院核医学科,上海 200032 2. 复旦大学核医学研究所,上海 200032 3. 上海市影像医学研究所,上海 200032 4. 西藏自治区人民医院影像科,拉萨 850000
原发性肝细胞肝癌(hepatocellular carcinoma,HCC)是中国人群常见的恶性肿瘤,其发病率和死亡率均居于所有恶性肿瘤的第2位。18F-氟代脱氧葡萄糖(fluorine-18 fluorodeoxyglucose,18F-FDG) PET/CT显像在HCC的分期、再分期及预后评价方面具有明显优势,但是对HCC的阳性检测率仅为50%,尤其对于分化程度较低的HCC的诊断,易出现假阴性结果[1]。18F-FDG PET/CT用于肿瘤诊断基于肿瘤摄取18F-FDG的程度。研究[2]显示,HCC病灶摄取18F-FDG的程度与肿瘤的大小及分化程度等有一定关系。肿瘤的分化程度与其恶性程度负相关,而Ki-67表达作为肿瘤细胞增殖活性的标志物,常用来反映肿瘤细胞增殖数量,从而判断肿瘤的恶性程度。本研究旨在探讨中低分化的HCC行PET/CT显像时,最大标准摄取值(maximum standardized uptake value,SUVmax)与肿瘤病灶大小、病理分化程度及Ki-67表达的相关性。
1 资料与方法
1.1 一般资料 回顾性分析2011年1月至2016年10月在复旦大学附属中山医院核医学科行18F-FDG PET/CT显像的187例肝脏内单发HCC患者的相关资料。其中,男性159例,女性28例;年龄为27~82岁,平均(56.53±10.02)岁。按肿瘤病理学分化程度分为中分化组、中-低分化组及低分化组;按病理学大体标本测得的肿瘤最大径分为≤3 cm组、>3 cm但≤5 cm组、>5 cm但≤10 cm组、>10 cm组;按Ki-67表达阳性百分率分级,<10%为-、10%~25%为+、26%~50%为、51%~75%为、>75%为,参照文献[3]将Ki-67表达-和+归为低表达组,把、和归为高表达组。
1.2 检查仪器与方法 PET/CT仪为美国GE公司生产的Discovery VCT 64型和中国上海联影医疗科技有限公司生产的uMI 510型。检查前患者禁食6 h以上,血糖<10 mmol/L;按体质量静脉注射18F-FDG(上海原子科兴药业有限公司提供)4.44 MBq/kg。休息约60 min后显像,扫描范围为颅顶至股骨中部。全身常规CT扫描,电压120 kV,电流140 mA,层厚3.75 mm,螺距0.516。PET扫描以三维(3D)模式采集,2 min/床位,通常6~8个床位。
1.3 图像处理与分析 利用CT 数据对PET图像进行衰减校正。PET图像重建采用滤波反投影法。CT重建采用标准重建法,矩阵512×512,重建层厚1.25 mm。在PET/CT图像中勾画肝脏病灶感兴趣区(region of interest,ROI);肝脏正常本底ROI选取肝脏右叶非肿瘤的正常肝脏组织部分进行勾画。测定肿瘤组织SUVmax及肝脏正常本底SUVmax,并计算两者的比值(tumor to normal background ratio,TNR)。所获图像由2位有经验的核医学科医师共同阅片,得出一致结论。
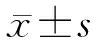
2 结 果
2.1 不同分化程度SUVmax、TNR组间比较 HCC患者行18F-FDG PET/CT显像时,随着肿瘤分化程度降低,SUVmax和TNR逐渐升高;肿瘤细胞中分化组、中-低分化组及低分化组之间SUVmax、TNR差异均有统计学意义(P<0.000 1,表1)。
2.2 不同肿瘤大小组之间SUVmax、TNR比较 HCC患者行18F-FDG PET/CT显像时,随着肿瘤最大径增大,SUVmax和TNR逐渐升高;肿瘤最大径≤3 cm组、>3 cm但≤5 cm组、>5 cm但≤10 cm组、>10 cm组之间的SUVmax、TNR差异均有统计学意义(P<0.000 1,表2)。
2.3 Ki-67不同表达组之间SUVmax、TNR比较 HCC患者行18F-FDG PET/CT显像时,随着Ki-67表达增加,SUVmax和TNR逐渐升高;Ki-67低表达组和高表达组之间的SUVmax、TNR差异均有统计学意义(P<0.000 1,表3)。

表1 不同分化程度组间SUVmax和TNR的比较

表2 不同肿瘤大小组间SUVmax和TNR的比较

表3 不同Ki-67表达程度组间SUVmax和TNR的比较
2.4 相关性分析 Spearman相关分析显示,SUVmax与肿瘤细胞分化程度(r=-0.384 57,P<0.000 1)、肿瘤最大径(r=0.537 27,P<0.000 1)以及肿瘤Ki-67表达(r=0.370 96,P<0.000 1)均显著相关。
3 讨 论
18F-FDG PET/CT用于HCC诊断,主要是依据18F-FDG被肿瘤细胞摄取的程度来判断HCC恶性程度。多数恶性肿瘤的葡萄糖转运蛋白(glucose transport protein,Glut)在18F-FDG的代谢过程中发挥主要作用。18F-FDG进入细胞内,在磷酸己糖激酶的作用下,形成18F-FDG-6磷酸,后者不能进一步参与有氧或无氧代谢;同时由于18F-FDG-6磷酸带负电荷,不能自由进出细胞膜而被滞留在细胞内,PET/CT显像显示18F-FDG摄取增强。研究[4-7]显示,18F-FDG PET/CT显像对HCC的检出率为40.0%~63.1%,高分化HCC的检出率则更低。这可能是由于肝癌细胞中存在大量葡萄糖-6-磷酸酶,后者可使18F-FDG-6 磷酸去磷酸化而生成游离18F-FDG,并释放出细胞,导致组织内18F-FDG含量相对较低;也与Glut-1和Glut-2表达水平低或P-糖蛋白高表达有关;另外,正常肝组织本底18F-FDG摄取量高与糖异生率高有关,这就可能减低肿瘤的TNR,降低HCC的检出率。
本研究结果显示,对于中低分化的HCC,其分化程度越低,恶性程度越高,肿瘤细胞的SUVmax和TNR就越高,且SUVmax与肿瘤细胞分化程度显著相关,提示18F-FDG的摄取程度与HCC的恶性程度正相关。研究[8-10]显示,18F-FDG PET/CT显像时18F-FDG的摄取程度可以作为预测HCC治疗预后的一个重要因素。
研究[2]显示,18F-FDG对最长径≤5 cm的HCC检出率仅为25%,对于>5 cm的HCC检出率则为100%。本研究显示,肿瘤最大径>10 cm组、>5 cm但≤10 cm组、>3 cm但≤5 cm组和≤3 cm组的SUVmax、TNR差异均有统计学意义;且SUVmax与肿瘤最大径显著相关,表明大肝癌尤其是巨块型肝癌的18F-FDG摄取程度明显高于小肝癌,更易被18F-FDG PET/CT检出。
Ki-67基因定位于第10号染色体,其蛋白质产物定位于细胞核,由相对分子质量为3.45×105和3.95×105的两条肽链组成。Ki-67在细胞分裂的G1后期开始出现,在S期和G2期逐渐升高,M期达高峰,有丝分裂结束后降解消失,G0期无表达。Ki-67在HCC中的表达反映肿瘤细胞增殖情况,与HCC分化程度有明显相关性,可作为间接反映HCC患者总生存期及无病生存期的标志[11-12]。本研究结果显示,Ki-67高表达组的SUVmax和TNR均显著高于Ki-67低表达组,且SUVmax与肿瘤组织中Ki-67表达显著相关,也进一步提示18F-FDG摄取程度高的HCC分化程度低、细胞增殖速度较快。
综上所述,中低分化的HCC患者行18F-FDG PET/CT显像时,18F-FDG的摄取程度与肿瘤的大小、分化程度及Ki-67表达均有显著相关性;肿瘤越大、分化程度越低、Ki-67表达越高,其18F-FDG的摄取程度就越高、细胞增殖越快,HCC患者的预后可能越差。
[ 1 ] FLETCHER J W, DJULBEGOVIC B, SOARES H P, et al. Recommendations on the use of18F-FDG PET in oncology[J]. J Nucl Med, 2008, 49(3):480-508.
[ 2 ] WOLFORT R M, PAPILLION P W, TURNAGE R H, et al. Role of FDG-PET in the evaluation and staging of hepatocellular carcinoma with comparison of tumor size, AFP level, and histologic grade[J]. Int Surg, 2010, 95(1):67-75.
[ 3 ] CAO Y, KE R, WANG S, et al. DNA topoisomerase Ⅱα and Ki67 are prognostic factors in patients with hepatocellular carcinoma[J]. Oncol Lett, 2017, 13(6):4109-4116.
[ 4 ] LIU T Q, FAN J, ZHOU L, et al. Effects of suppressing glucose transporter-1 by an antisense oligodeoxynucleotide on the growth of human hepatocellular carcinoma cells[J]. Hepatobiliary Pancreat Dis Int, 2011, 10(1):72-77.
[ 5 ] WU H B, WANG Q S, LI B Y, et al. F-18 FDG in conjunction with11C-choline PET/CT in the diagnosis of hepatocellular carcinoma[J]. Clin Nucl Med, 2011, 36(12):1092-1097.
[ 6 ] TAN C H, THNG C H, LOW A S, et al. Wash-out of hepatocellular carcinoma: quantitative region of interest analysis on CT[J]. Ann Acad Med Singapore, 2011, 40(6):269-275.
[ 7 ] WANG S B, WU H B, WANG Q S, et al. Combined early dynamic18F-FDG PET/CT and conventional whole-body18F-FDG PET/CT provide one-stop imaging for detecting hepatocellular carcinoma[J]. Clin Res Hepatol Gastroenterol, 2015, 39(3):324-330.
[ 8 ] ABUODEH Y, NAGHAVI A O, AHMED K A, et al. Prognostic value of pre-treatment F-18-FDG PET-CT in patients with hepatocellular carcinoma undergoing radioembolization[J]. World J Gastroenterol, 2016, 22(47):10406-10414.
[ 9 ] 许泽清, 张林启, 王晓燕, 等.18氟-氟代脱氧葡萄糖PET/CT显像对评价肝癌肝移植患者预后的价值[J]. 中华医学杂志, 2014, 94(31):2422-2425.
[10] CHO E, JUN C H, KIM B S, et al.18F-FDG PET-CT as a prognostic factor in hepatocellular carcinoma[J]. Turk J Gastroenterol, 2015, 26(4):344-350.
[11] STROESCU C, DRAGNEA A, IVANOV B, et al. Expression of p53, Bcl-2, VEGF, Ki67 and PCNA and prognostic significance in hepatocellular carcinoma[J]. J Gastrointestin Liver Dis, 2008, 17(4):411-417.
[12] 胡志超, 金浩生, 林 叶, 等. Ki-67和Glut1在肝细胞癌中的表达及预后的意义[J].肝脏, 2015, 20(5):393-396.
