高寒区牛内脏组织的采集及其RNA的贮存
2018-03-21侯明杰石福于王虎成草业科学国家级教学示范中心兰州大学甘肃兰州730020草地农业生态系统国家重点实验室兰州大学草地农业科技学院甘肃兰州730020
侯明杰,张 霞,石福于,王虎成(1.草业科学国家级教学示范中心(兰州大学),甘肃 兰州 730020; 2.草地农业生态系统国家重点实验室 兰州大学草地农业科技学院,甘肃 兰州 730020)
牦牛(Bosgrunniens)是青藏高原地区的特有畜种,也是“世界屋脊”著名的景观牛种,主要分布在海拔3 500 m以上的高山草原,是青藏高原牧区人民的主要生活和经济来源[1]。牦牛在高寒、缺氧和枯草期长达半年的严峻自然条件下,经过长期自然选择和自身适应已具有独特的生物学特性[2-3],科学认知并利用这一神奇的物种,研究其高寒营养适应性显得尤为必要,但因牦牛所处环境及生物习性明显不同于普通牛,传统的营养学研究方法在这一物种上的应用受到限制,研究新的方法与技术显得尤为必要。近年来,分子生物技术在动物基因的表达及调控中的应用受到广泛关注,而其研究主要建立在转录组的基础上,得到完整的RNA是试验的关键。但是,动物组织离开活体后RNA极不稳定,极易被广泛存在且难以消除的内源或外源RNA酶降解,使得高质量RNA不易获得,故合理提取并保存组织RNA 至关重要[4-5]。在试验过程中,有时由于样本量较大、提取总RNA时间较长等原因,提取总RNA后不能迅速进行后续试验, 使得提取出的总RNA必须贮存一段时间。研究发现,大鼠海马组织总RNA样品可在-70 ℃下保存60 d,反复冻融3次后总RNA质量基本不变[6];全血RNA在37 ℃保存7 d时发生明显降解[7]。然而,针对高寒区牦牛和本地黄牛总RNA长时间保存后的质量分析未见报道,这势必不利于宝贵资源的高效利用。
此外,在以往的研究中,对RNA浓度及纯度通过Nano-drop 2000来检测[8],RNA的完整性通过凝胶电泳条带,并利用其积分光密度值(integrated optical density,IOD)或灰度值来表示RNA的含量[6,9],研究发现凝胶电泳图的IOD与电泳条带RNA的百分含量具有正比关系[10-11];RNA的百分含量能够直接表现出RNA 28S、18S和5S比例,28S条带亮度是18S的2倍[12-13],且28S和18S的百分含量比接近于2∶1[14-15],利用此优点可更加直观表示RNA各条带百分含量及降解程度。此外,近年来,围绕牦牛营养代谢高寒适应性研究,经常以生活于同一生境的本地黄牛为参照对象[16],鉴于此,本研究以天祝白牦牛及同一生境黄牛为对象,研究其组织RNA质量检测技术以及短期和长期保存RNA的质量的变化,旨在为该区域动物分子营养学研究提供技术支持。
1 材料与方法
1.1 材料
1.1.1试验动物 试验地位于甘肃省天祝藏族自治县乌鞘岭地区(37°12.479′ N,102°51.695′ E),海拔3 154 m,气候寒冷潮湿,昼夜温差大,年均气温-0.1 ℃[17]。2015年9月在试验地选取3周岁体况相近、健康状况良好的天祝白牦牛及本地黄牛各3头做为供试动物,屠宰采样前于乌鞘岭天然草地放牧饲养。
1.1.2仪器和试剂 TGL-16台式高速冷冻离心机(长少平凡仪器仪表有限公司);WD9413C凝胶成像系统(上海楚柏实验室设备有限公司);DYY-6D稳压稳流型电泳仪(北京六一生物科技有限公司);超净工作台(苏净安泰公司);Nano-drop 2000超微量核酸蛋白测定仪(Thermo公司);-86 ℃超低温冰箱(中科美菱低温科技有限责任公司)。
Trizol Universal RNA Extraction Kit购自Invitrogen公司;6×Loading buffer,DEPC均购自TaKaRa公司。
1.2 方法
1.2.1胃肠道及肝肾组织采集与初级保存 前述试验动物经24 h禁食后经颈静脉放血屠宰,分离胃(瘤胃、网胃、瓣胃、皱胃),小肠(十二指肠、空肠、回肠),大肠(盲肠、结肠),肝脏和肾脏组织。其中:胃组织经冷生理盐水冲洗后,钝性剥离上皮层,进一步冲洗后分装于5 mL离心管于液氮罐速冻;每个肠段约20 cm用于肠粘膜采集,先用手术剪纵向切开肠段,冷自来水冲洗内容物,再用生理盐水冲洗后,置于冰冷的玻璃板,用载玻片刮取粘膜组织,粘膜分装于5 mL离心管于液氮罐速冻;切取肝、肾实质,冷生理盐水冲洗后分装于10 mL离心管,于液氮罐速冻,所有样品于离体10 min内完成。前述样品经液氮冻存,于第2天运输至实验室后转入-80 ℃冰箱保存,以备提取RNA[18]。
1.2.2组织RNA的提取与保存 用Trizol Kit提取上述保存样品的RNA。操作步骤:1)称取低温冻结的组织50~100 mg后迅速转移至液氮预冷的研钵中,用研杵研磨组织,期间不断加入液氮,直至研磨成粉末状,转移至1.5 mL离心管中,加1 mL Trizol试剂对组织进行裂解;2)用力混匀至清澈,冰上放置5 min,12 000 r·min-1,4 ℃离心10 min,将上清液转移至另一个1.5 mL离心管中;3)加入0.2 mL氯仿,反复振荡摇匀,室温静置5 min,12 000 r·min-1,4 ℃离心15 min;4)小心吸取上层水相置于另一无菌1.5 mL离心管中,加入0.5 mL异丙醇,轻柔颠倒数次混匀,室温静置15~20 min,12 000 r·min-1,4 ℃离心10 min,弃上清,加1 mL 75%乙醇洗涤两次;5)沉淀的RNA室温自然干燥,用50~70 μL DEPC灭菌水重悬保存。整个操作过程在超净工作台内冰上进行,防止RNase污染。
1.2.3RNA品质检测与分析 提取的组织RNA样品在-80 ℃保存,分别于1个月和23个月测定其浓度及降解程度。
RNA浓度:用Nano-drop 2000超微量核酸蛋白测定仪检测。
RNA的降解程度分析:取RNA样品(23月)5 μL与2 μL上样缓冲液混匀,在含3 μL核酸染料的1.5%琼脂糖凝胶点样,120 V电泳30 min,测定其完整性。
凝胶电泳图分析:利用Gel-pro软件对凝胶电泳图进行分析,测定每个条带28S、18S和5S IOD值及百分含量。
1.2.4数据计算与分析 RNA浓度以均值和标准误表示(mean ± SD),根据食品药品监督管理局(Food and Drug Administration,FDA)标准生物样品规则[6],利用RE表示RNA浓度的稳定性。即:RE=(不同保存时间的样品浓度-初始浓度)/初始浓度,当-15%≤RE≤15%时表明样品浓度稳定。RNA降解程度以28S∶18S来表示。利用SPSS 20软件对RNA浓度,RE和28S、18S、5S百分含量进行均值计算以及对RE和28S∶18S进行配对检验。
2 结果
2.1 贮存时间对牦牛及黄牛组织RNA浓度的影响
牦牛和黄牛胃部RNA在-80 ℃保存23个月后RNA不稳定(RE>15% 或<-15%)(表1)。牦牛所有胃组织样品RNA放置23个月后浓度均增加,而黄牛的瘤胃及瓣胃却呈相反情况;牦牛和黄牛小肠各肠段RNA浓度变化不尽相同;其中,两个基因型牛种空肠及牦牛回肠组织RNA相对稳定;十二指肠RNA浓度变幅最大(RE=288.55%)。黄牛结肠RNA浓度在保存23个月后较保存1个月有所降低,浓度不稳定;牦牛盲肠与结肠和黄牛盲肠RNA浓度有变化,但都相对稳定;牦牛和黄牛大肠RNA在保存23个月后稳定性存在显著差异(P<0.05);黄牛肾脏组织RNA相对稳定,但黄牛肝脏、牦牛肾脏和肝脏均超出了RE所推荐的稳定范围。说明不同品种、不同组织贮存时间对RNA的浓度影响不同。
2.2 贮存时间对RNA降解程度的影响
将-80 ℃保存1个月的所有组织RNA样品进行琼脂糖凝胶电泳,图1为随机抽取样品电泳图。28S、18S两条带清晰,5S条带不清晰,且28S条带亮度约为18S条带亮度的2倍,表明品质良好。
2.2.1超低温贮存23个月后牦牛及黄牛胃部组织RNA降解程度 牦牛和黄牛胃部RNA在-80 ℃保存23个月后的电泳条带显示,5S条带最亮,28S和18S条带较弱(图2和图3)。利用Gel-pro软件对凝胶电泳图分析28S、18S和5S百分含量(表2),结果显示:牦牛瘤胃、网胃、瓣胃和皱胃28S∶18S均小于2,在0.51~0.86,且5S百分含量均高于28S;黄牛瘤胃、网胃、瓣胃和皱胃28S∶18S均小于2,在0.34~0.52,黄牛瘤胃和网胃5S含量高于28S,但瓣胃和皱胃5S含量低于28S。说明牦牛和黄牛胃部RNA发生了明显的降解,但不同品种、不同组织降解程度不同。
2.2.2超低温贮存23个月后牦牛及黄牛小肠组织RNA降解程度 牦牛和黄牛小肠RNA经-80 ℃保存23个月后电泳发现,除黄牛空肠3号样品RNA 5S条带比较明显外,其他组织均不明显,且28S条带和18S条带亮度没有区别(图4)。利用Gel-pro软件对凝胶电泳图分析28S、18S和5S百分含量,结果显示,牦牛空小肠28S∶18S均接近1,说明降解不明显,牦牛和黄牛十二指肠RNA浓度发生了不同的变化(表3)。

表1 贮存时间对牦牛及黄牛胃肠道、肝脏和肾脏RNA浓度的影响Table 1 Effect of storage duration on RNA concentration in the gastrointestinal, liver, and kidney tissues of yak and cattle
同列不同小写字母表示相同组织不同品种间差异显著(P<0.05),下表同。RE,RNA浓度的稳定性。
Different lowercase letters indicate significant difference in the same tissue among different species at the 0.05 leve; similarly for the following tables. RE, stability of RNA concentration.

图1 牦牛及黄牛部分组织RNA电泳图Fig. 1 Image of electrophoresis of RNA from different tissues of yak and cattle
1,表示牦牛瘤胃RNA;2,表示黄牛回肠RNA;3,表示牦牛肝脏RNA。
1, indicate RNA from yak rumina; 2, indicate RNA from cattle ileum; 3, indicate RNA from yak liver.

图2 牦牛及黄牛瘤胃和网胃RNA超低温储存23个月后的降解程度Fig. 2 Degradation degrees of RNA from rumina and reticula of yak and cattle after storage 23 months under ultralow temperature
1、2、3表示黄牛网胃RNA;4、5、6表示牦牛网胃RNA;7、8、9表示黄牛瘤胃RNA;10、11、12表示牦牛瘤胃RNA。
1, 2 and 3 indicate RNA from cattle reticula; 4, 5, and 6 indicate RNA from yak reticula; 7, 8 and 9 indicate RNA from cattle rumina; 10, 11, and 12 indicate RNA from yak rumina.

图3 牦牛及黄牛瓣胃和皱胃RNA超低温储存23个月后的降解程度Fig. 3 Degradation degrees of RNA from omasa and abomasa of yak and cattle after storage 23 months under ultralow temperature
1、2、3表示黄牛皱胃RNA;4、5、6表示牦牛皱胃RNA;7、8、9表示黄牛瓣胃RNA;10、11、12表示牦牛瓣胃RNA。
1, 2, and 3 indicate RNA from cattle abomasa; 4, 5, and 6 indicate RNA from yak abomasa; 7, 8, and 9 indicate RNA from cattle omasa; 10, 11, and 12 indicate RNA from yak omasa.

图4 牦牛及黄牛小肠RNA超低温储存23个月后的降解程度Fig. 4 Degradation degrees of RNA from small intestine of yak and cattle after storage 23 months under ultralow temperature
1、2、3表示黄牛空肠RNA;4、5、6表示牦牛空肠RNA;7、8、9表示黄牛回肠RNA;10、11、12表示牦牛回肠RNA;13、14、15表示黄牛十二指肠RNA;16、17、18表示牦牛十二指肠RNA。
1, 2, and 3 indicate RNA from cattle jejuna; 4, 5, and 6 indicate RNA from yak jejun; 7, 8, and 9 indicate RNA from cattle ilea; 10, 11, and 12 indicate RNA from yak ilea; 13, 14, and 15 indicate RNA from cattle duodena; 16, 17, and 18 indicate RNA from yak duodena.
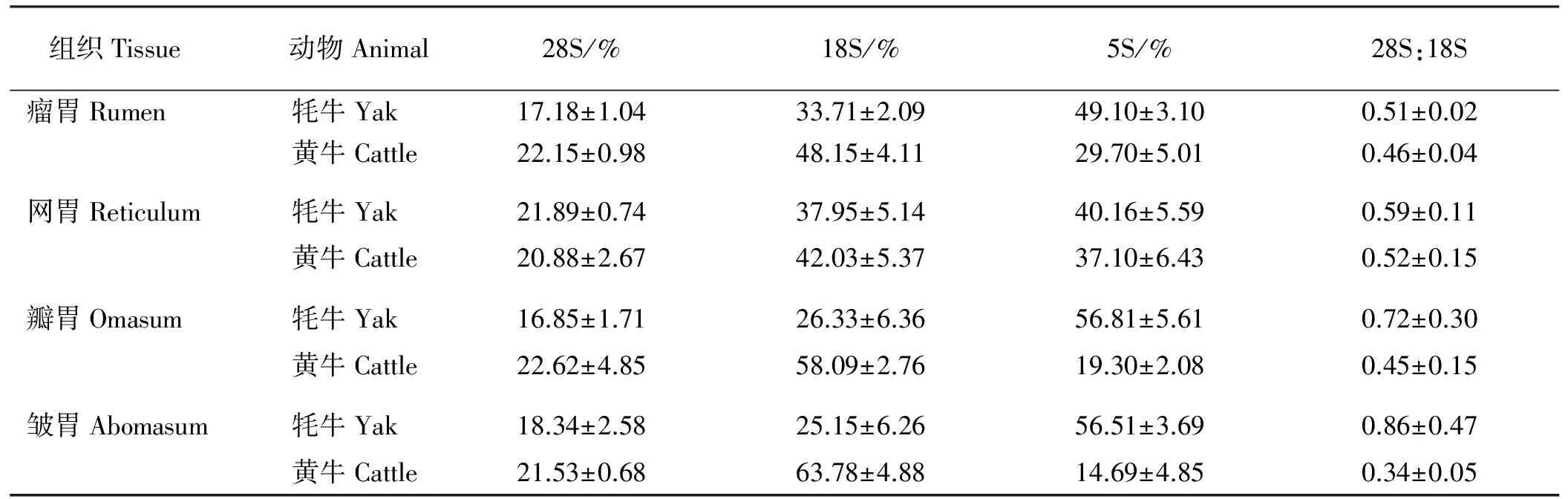
表2 牦牛及黄牛胃部RNA超低温储存23个月后的降解程度Table 2 Degradation degrees of RNA from gastric tissues of yak and cattle after storage 23 months under ultralow temperature

表3 牦牛及黄牛小肠RNA超低温储存23个月后的降解程度Table 3 Degradation degrees of RNA from small intestine of yak and cattle after storage 23 months under ultralow temperature
2.2.3超低温贮存23个月后牦牛及黄牛大肠组织RNA降解程度 牦牛及黄牛盲肠和结肠RNA在经-80 ℃保存23个月后,经电泳发现,RNA 5S条带均不明显(图5)。利用Gel-pro软件分析发现(表4),牦牛盲肠和结肠RNA 28S∶18S值低于黄牛盲肠和结肠,且均小于1,说明RNA产生了降解。
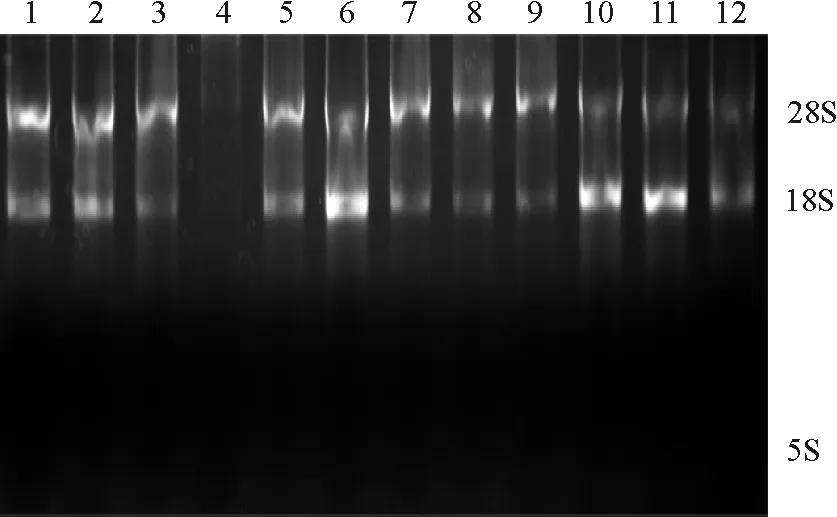
图5 牦牛及黄牛大肠RNA超低温储存23个月后的降解程度Fig. 5 Degradation degrees of RNA from large intestine of yak and cattle after storage 23 months under ultralow temperature
1、2、3表示黄牛结肠RNA;4、5、6表示牦牛结肠RNA;7、8、9表示黄牛盲肠RNA;10、11、12表示牦牛盲肠RNA。
1, 2, and 3 indicate RNA from cattle colons; 4, 5, and 6 indicate RNA from yak colons; 7, 8, and 9 indicate RNA from cattle ceca; 10, 11, and 12 indicate RNA from yak ceca.
2.2.4超低温贮存23个月后牦牛及黄牛肝脏和肾脏组织RNA降解程度 牦牛及黄牛肾脏和肝脏RNA在-80 ℃保存贮存23个月后的电泳条带5S最亮,28S和18S条带较弱(图6)。利用Gel-pro软件对凝胶电泳图28S、18S和5S RNA百分比含量进行分析(表5),结果显示,牦牛及黄牛肝脏和肾脏5S RNA百分含量明显高于18S和28S;牦牛与黄牛肝脏和肾脏28S/18S值在0.50~0.67,说明牦牛及黄牛肝脏和肾脏RNA均发生了不同程度的降解。

图6 牦牛及黄牛肝脏和肾脏RNA超低温储存23个月后的降解程度Fig. 6 Degradation degrees of RNA from livers and kidneys of yak and cattle after storage 23 months under ultralow temperature
1、2、3表示黄牛肾脏RNA;4、5、6表示牦牛肾脏RNA;7、8、9表示黄牛肝脏RNA;10、11、12表示牦牛肝脏RNA。
1, 2, and 3 indicate RNA from cattle kidneys; 4, 5, and 6 indicate RNA from yak kidneys; 7, 8, and 9 indicate RNA from cattle livers; 10, 11, and 12 indicate RNA from yak livers.
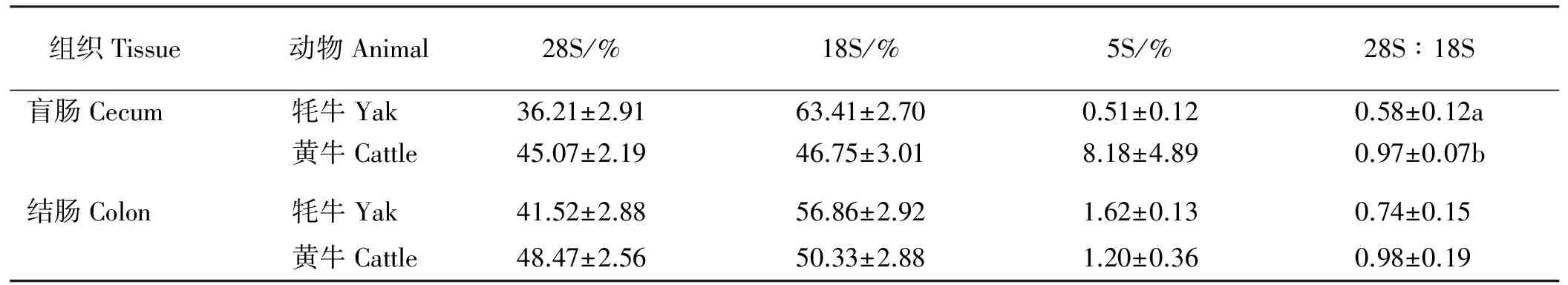
表4 牦牛及黄牛大肠RNA超低温储存23个月后的降解程度Table 4 Degradation degrees of RNA from large intestine of yak and cattle after storage 23 months under ultralow temperature

表5 牦牛及黄牛肝脏和肾脏RNA超低温储存23个月后的降解程度Table 5 Degradation degrees of RNA from livers and kidneys of yak and cattle after storage 23 months under ultralow temperature
3 讨论
3.1 贮存时间对RNA浓度的影响
动物组织离开活体后RNA极不稳定,极易被广泛存在且难以消除的内源或外源RNA酶降解,使得高质量RNA不易获得,故合理采样并保存组织RNA至关重要。此外,由于牦牛所处环境及生物习性明显不同于普通牛,样品获取不易,如何将来之不易的样品最大限度地用于科学研究,长时间高效保存意义重大。李维凯等[6]研究发现,从海马新鲜组织中提取的RNA的浓度最高,不同保存条件及反复冻融3次后RNA浓度均有所降低;研究发现[7],从新鲜全血中提取的RNA浓度最高,不同保存温度及保存时间的RNA浓度较新鲜提取均有所降低,但对于RNA纯度,各组间反复冻融次数对RNA纯度有显著影响,而保存时间对RNA纯度无显著影响;穆龙龙等[19]利用Trizol 法从小体积全血标本中获取足量有效的总RNA,不同保存条件全血中所获取的总RNA浓度存在差异,总RNA在-80 ℃下短期保存略有降解。张杰等[20]研究发现,在25(室温)、4、-20、-80 ℃下放置10 min提取的总RNA质量浓度随放置温度的降低而增加,放置于-80 ℃时,随放置时间的增加,提取的总RNA浓度增加。说明RNA保存条件及保存时间均会对RNA浓度产生影响。本研究发现,与保存1个月相比,在保存23个月后牦牛胃部和十二指肠与黄牛网胃、皱胃和十二指肠和肝脏RNA浓度均有不同程度的增加,可能是RNA降解产生增色效应导致[21-22],但牦牛空肠、回肠、肾脏和黄牛回肠、肾脏RNA浓度有所降低;并且,牦牛和本地黄牛瓣胃、空肠、盲肠、结肠和肾脏RNA在保存23个月后呈现不同的变化趋势。可能由于牦牛和本地黄牛品种不同,其代谢强度不同,所产生的内源酶和外源酶活性不一造成。
3.2 贮存时间对RNA降解程度的影响
路俊峰等[23]研究发现,在-80 ℃保存4个月的肿瘤组织RNA经凝胶电泳发现,部分组织RNA电泳条带均不清晰,甚至无明显条带,RNA出现明显的降解。杨秀荣等[24]研究发现,在低温没有密封储存的情况下,RNA保存较长时间,完整性好;-70 ℃下RNA可以保存8个月,-20 ℃下RNA可以保存4个月;在其他温度条件下,若密封保存,4 ℃下可保存两周,10 ℃下可保存4 d以上,20 ℃下保存3 d时条带清晰,保存4 d时条带模糊,30 ℃下保存2.5 d时条带变得模糊,到3 d时全部降解,40 ℃下保存1 d时条带清晰,保存2 d时条带变得模糊,保存2.5 d时完全降解。毛君婷等[25]研究发现,提取的鸭肝脏组织总RNA在室温保存24 h时只发生了部分降解,-20 ℃保存的RNA,经过很长一段时间后,RNA仍保持着很好的完整性;李维凯等[6]研究发现,大鼠海马RNA在-20 ℃及-70 ℃保存30 d和60 d以及24 h反复冻融3次后经凝胶电泳发现,样品仍有清晰的28S和18S条带出现,说明RNA完整性较好;本研究中,牦牛及黄牛胃部及肝脏和肾脏RNA在保存23个月后经凝胶电泳,5S条带较清晰,28S和18S条带均不清晰,且亮度没有差别,说明RNA发生了明显降解;利用Gel-pro分析发现,牦牛瘤胃、网胃、皱胃和肝脏以及黄牛瘤胃、网胃、皱胃和肾脏5S条带百分含量均高于18S和28S,且28S∶18S在(1∶1.37)~(1∶2.96),说明牦牛和黄牛胃部RNA发生了不同程度的降解。然而,牦牛及黄牛小肠和大肠组织RNA均有28S和18S两个清晰条带出现,但18S条带比28S亮,且牦牛小肠RNA 28S∶18S均接近1,说明降解不明显且存在物种和组织差异。
4 结论
高寒牧区动物胃肠道等组织经现场规范采样后迅速用液氮保存,可异地保存运输至生物实验室,按一定规程可提取到高质量的RNA样品;常规超低温保存1个月提取的内脏组织RNA样品可用于试验研究,但23个月常规方法保存该RNA样品,均会产生不同程度的降解,但降解程度亦存在动物基因型及组织部位的差异性;围绕高寒区反刍家畜内脏组织RNA样品高效保存技术及有效保存时间需做进一步研究。
References:
[1] 王彦星,郑群英,晏兆莉,卢涛.气候变化背景下草原产权制度变迁对畜牧业的影响:以青藏高原东缘牧区为例.草业科学,2015,32(10):1687-1694.
Wang Y X,Zheng Q Y,Yan Z L,Lu T.Institutional transition of grassland property rights and its impact on animal husbandry under the background of climate changes:A case study from eastern Qinghai-Tibet Plateau.Pratacultural Science,2015,32(10):1687-1694.(in Chinese)
[2] 杨志娟,张相锋,董世魁.甘肃临夏农牧交错区牦牛、犏牛易地育肥试验.草业科学,2015,32(1):119-124.
Yang Z J,Zhang X F,Dong S K.Study on the fattening the yak and yak-cattle crossbreed in the agro-pastoral transition zone in Linxia Prefecture of Gansu Province.Pratacultural Science,2015,32(1):119-124.(in Chinese)
[3] 罗惦,柴林荣,常生华,程云湘,侯扶江.我国青藏高原地区牦牛草地放牧系统管理及优化.草业科学,2017,34(4):881-891.
Luo D,Chai L R,Chang S H,Cheng Y X,Hou F J.Yak grazing management system sand optimization on the Qinghai-Tibet Plateau.Pratacultural Science,2017,34(4):881-891.(in Chinese)
[4] 王桂玲,黄东阳,刘戈飞.一种从动物组织中提取高质量总RNA的方法.生命科学研究,2003,7(3):275-278.
Wang G L,Huang D Y,Liu G F.An improved method of extracting high quality total RNA from animal tissues.Life Science Research,2003,7(3):275-278.(in Chinese)
[5] 杜迎彬,王志杰,杨冰,张晓华,黄倢.对虾组织样品中RNA的铵盐常温保存法及其效果.渔业科学进展,2013,34(3):88-96.
Du Y B,Wang Z J,Yang B,Zhnag X H,Huang J.Ammonium preservation of shrimp tissue RNA at normal temperature and its effects.Progress in Fishery Sciences,2013,34(3):88-96.(in Chinese)
[6] 李维凯,霍韬光,畅蓓,杨卉蕾,姜泓.保存条件对大鼠海马组织总RNA质量的影响.化学研究,2012,23(5):93-96.
Li W K,Huo T G,Chang B,Yang H L,Jiang H.Effect of storage condition on mass of total RNA in hippocampus of rat.Chemical Research,2012,23(5):93-96.(in Chinese)
[7] 何松哲,何慧,陈懿,陈羽,余道军.不同保存和处理方式对全血标本总RNA提取的影响.中国微生态学杂志,2015,27(2):223-226.
He S Z,He H,Chen Y,Chen Y,Yu D J.Effects of different preservation and processing methods on RNA isolation from whole blood.Chinese Journal of Microecology,2015,27(2):223-226.(in Chinese)
[8] 阮运杰.DNA凝胶电泳分析系统研究.哈尔滨:哈尔滨工程大学硕士论文,2012.
Ruan Y J.Analysis system of DNA gel electrophoresis.Master Thesis.Harbin:Harbin Engineering University,2012.(in Chinese)
[9] 雷国华,李俊诗.凝胶电泳图像背景影响的蛋白质含量计算方法.中国体视学与图像分析,1999(2):97-101.
Lei G H,Li J S.Effects of the background of gel electrophoresis digital images on the quantification of proteins.Chinese Journal of Stereology and Image Analysis,1999(2):97-101.(in Chinese)
[10] 王文红,张继领,银广悦,张龙.琼脂糖凝胶电泳法测定廊坊地区血清蛋白正常参考值.中国煤炭工业医学杂志,2005(9):957-958.
Wang W H,Zhang J L,Yin G Y,Zhang L.Normal reference values of serum protein with agarose gel electrophoresis in Langfang.Chinese Journal of Coal Industry Medicine,2005(9):957-958.(in Chinese)
[11] 雷国华,李俊诗,周峻岭.通过凝胶电泳数字化图像分析蛋白含量的改进方法.中国医学物理学杂志,1998(3):183-185.
Lei G H,Li J S,Zhou J L.Quantitative analysis of protein with gel electrophoresis digital images.Chinese Journal of Medical Physics,1998(3):183-185.(in Chinese)
[12] 王丹丹,肖向红,吴立舒,柴龙会,张晶钰,张建平.改良TRIzol法高效提取东北林蛙皮肤总RNA.野生动物学报,2012,33(3):127-128.
Wang D D,Xiao X H,Wu L S,Chai L H,Zhang J Y,Zhang J P.An improved TRIzol method to extract total RNA from skin tissue ofRanadybowskii.Chinese Journal of Wildlife,2012,33(3):127-128.(in Chinese)
[13] 易乐飞,穆亮亮,仲改.凡纳滨对虾总RNA完整性的正确评估.浙江农业学报,2016,28(12):2007-2013.
Yi L F,Mu L L,Zhong G.Assessment of integrity of total RNA extrated fromPenaeusvannamei.Acta Agriculture Zhejiang,2016,28(12):2007-2013.(in Chinese)
[14] 王华,李华.保存动物组织内RNA的方法改进.生物技术通报,2010(6):152-155.
Wang H,Li H.Improvement of methods for storing RNA of animal tissues.Biotechnology Bulletin,2010(6):152-155.(in Chinese)
[15] 王桂玲,刘戈飞,黄东阳.从动物组织提取高质量总RNA方法的改进.生物技术通讯,2003,14(6):512-514.
Wang G L,Liu G F,Huang D Y.An improved method of extracting high quality total RNA from animal tissues.Letters in Biotechnology,2003,14(6):512-514.(in Chinese)
[16] 王虎成.尿嘌呤衍生物排出量估测青藏高原牦牛瘤胃微生物蛋白产量研究.兰州:兰州大学博士学位论文,2009.
Wang H C.Urinary purine derivative excretion as a method for estimation of rumen microbial protein production of yak in Qing-hai Tibetan plateau.PhD Thesis.Lanzhou:Lanzhou University,2009.(in Chinese)
[17] 石福于,王毅,付晓悦,侯明杰,王虎成.不同放牧强度下祁连山东段草地生态系统氮磷计量特征.家畜生态学报,2017(3):61-66.
Shi F Y,Wang Y,Fu X Y,Hou M J,Wang H C.Metrological characteristics of nitrogen and phosphorus in grassland ecosystem under different grazing intensity in east of Qilian Mountain.Journal of Domestic Animal Ecology,2017(3):61-66.(in Chinese)
[18] Wang H C,Shi F Y,Hou M J,Fu X Y,Long R J.Cloning of oligopeptide transport carrier PepT1 and comparative analysis on PepT1 mRNA expression response to dietary nitrogen levels of yak (Bosgrunniens) and indigenous cattle (Bostaurus) on Qinghai-Tibetan Plateau.Journal of Animal Science,2016,94:3431-3440.
[19] 穆龙龙,赵志英,朱立.全血标本保存条件对人总RNA提取效率的影响.北京医学,2010,32(10):837-840.
Mu L L,Zhao Z Y,Zhu L.RNA Isolation from human blood:Impacts of sample-storage condition.Beijing Medical Journal,2010,32(10):837-840.(in Chinese)
[20] 张杰,武晶晶,赵飞飞,闫宇翔,赵志强.不同温度和不同放置时间对总RNA提取浓度和纯度的影响.实验技术与管理,2013(11):79-82.
Zhang J,Wu J J,Zhao F F,Yan Y X,Zhao Z Q.Effect of different temperature and different stored time on concentration and purity of total RNA isolation.Experiment Technology and Microecology,2013(11):79-82.(in Chinese)
[21] Sreevalsan T,Jr Lockart R Z,Jr Dodson M L,Hartman K A.Replication of Western equine encephalomyelitis virus.I.Some chemical and physical characteristics of viral ribonucleic acid.Journal of Virology,1968,2(6):558-566.
[22] 曾碧慧,张志刚.盐浓度、酸碱度及DNA浓度对增色效应实验的影响.实验室研究与探索,2001,20(1):43-45.
Zeng B H,Zhang Z G.Effect of different DNA concentration,pH value and salt concentration of solution on DNA hyperchromic experiment.Laboratory Research and Exploration,2001,20(1):43-45.(in Chinese)
[23] 路俊锋,陈宏,吴劲松,毛颖,周良辅.不同保存方法对脑胶质瘤和其周边组织RNA保存的研究.中国临床神经科学,2010,18(2):199-202.
Lu J F,Chen H,Wu J S,Mao Y,Zhou L F.Preservation of RNA for glioma tissue bank:Comparison of snap-frozen and RNA later solid tissue.Chinese Journal of Clinical Neurosciences,2010,18(2):199-202.(in Chinese)
[24] 杨秀荣,王庆容,刘惠茹.保存温度对黄颡鱼肝组织总RNA质量的影响.江苏农业科学,2016,44(11):258-260.
Yang X R,Wang Q R,Liu H R.Effect of storage temperature on total RNA in liver of yellow-head catfish meat.Jiangsu Agricultural Sciences,2016,44(11):258-260.(in Chinese)
[25] 毛君婷,史开志,文明,周碧君.高质量鸭肝脏组织总RNA的提取及稳定性测试.贵州农业科学,2009,37(9):140-142.
Mao J T,Shi K Z,Wen M,Zhou B J.Extraction and stability test of high quality total RNA in duck liver tissue.Guizhou Agricultural Sciences,2009,37(9):140-142.(in Chinese)
