三株甲基营养型芽孢杆菌抑菌活性物质初探△
2018-03-21邵天蔚张晓云丁万隆王蓉李勇
邵天蔚,张晓云,丁万隆,王蓉,李勇*
(1.中国医学科学院北京协和医学院药用植物研究所,北京 100193;2.中国科学院植物研究所,北京 100093)
人参Panax ginseng C.A.Mey.是五加科多年生宿根植物,我国传统名贵中药材。人参病害严重影响人参的产量和品质[1],化学农药长期不规范使用不仅造成自然生态环境严重破坏,同时也导致人参农药残留超标,给人参用药安全带来重大安全隐患[2]。生物防治是解决药用中药材病害防治及农残问题的有效途径之一,芽孢杆菌属是目前研究较为成熟且应用较为广泛的重要生防微生物[3-4]。根据已有研究报道,芽孢杆菌主要通过拮抗作用、竞争作用、溶菌作用、诱导抗性和植物促生长等[5]作用形式表现其生防作用。其中,芽孢杆菌合成具有抑菌活性的次生代谢物质,是抑制植物致病菌生长发育的关键[6]。前期,课题组从商品化微生物菌剂中分离了三株甲基营养型芽孢杆菌,通过对峙培养试验证实了菌株对人参致病菌的抑菌效果,为上述菌剂在人参病害防治中的应用提供了理论依据。在此基础上,本研究通过光学显微镜和扫描电镜观察,研究了对峙培养过程中三株甲基营养型芽孢杆菌对人参锈腐菌Cylindrocarpon destructans、人参黑斑菌Alternaria panax、人参根腐菌Fusarium solan i和人参灰霉菌Botrytis cinerea菌丝生长的影响,并从菌株胞外分泌物中分离提取了粗脂肽、粗蛋白及有机溶剂萃取物,结合抑菌活性检测,初步明确了三株芽孢杆菌的抑菌活性成分的有效部位。
1 材料
1.1 供试菌株
人参锈腐菌 C.destructans、人参黑斑菌A.panax、人参根腐菌 F.solani和人参灰霉菌B.cinerea以及甲基营养型芽孢杆菌 QM、BM2和HZ3均由本课题组保存。
1.2 供试培养基
PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂15~20 g,蒸馏水1 L,pH 7。
LB培养基:蛋白胨10 g,NaCl 10 g,酵母粉5 g,琼脂10~15 g,蒸馏水1 L,pH 7。
1.3 主要仪器及试剂
电热恒温培养箱(DH6000,天津市泰斯特仪器有限公司)
恒温培养振荡器(ZHWY-100H,上海智城分析仪器制造有限公司)
超净工作台(YT-CJ-1D,北京亚泰克科隆仪器技术有限公司)
立式自动电热压力蒸汽灭菌锅(LX-B35L型,合肥华泰医疗有限公司)
光学显微镜(Leica M205C,德国)
飞纳台式扫描电镜(Phenom ProX,原产荷兰)离心机(SIGMA,3K15,德国)旋转蒸发仪(RE-52AA,上海亚荣生化仪器厂)循环水真空泵(SHZ-mD,上海亚荣生化仪器厂)冷冻干燥机(2-4LD plus,德国Christ冻干机有限公司)
冷冻干燥机(LGJ-18,北京松源华兴科技发展有限公司)
牛津杯(内径8 mm,外径9 mm)
血球计数板(0.05 mm×0.05 mm,上海市求精生化试剂仪器有限公司)
PBS缓冲溶液:KH2PO40.27 g,Na2HPO41.42 g,NaCl 8 g,KCl 0.2 g,蒸馏水1 L,高温灭菌后4℃保存
2 方法
2.1 对峙培养
将供试人参锈腐菌、人参黑斑菌、人参根腐菌和人参灰霉菌制成Φ6 mm菌饼,置于PDA平板中央,分别将拮抗菌株接种于距培养皿边缘10mm处,25℃恒温黑暗培养5~7 d。以只接种人参致病菌的平板作为空白对照。每个处理3次重复。
2.2 菌丝形态观察
对峙培养5~7 d后,PDA平板上出现明显的抑菌带。用接种针挑取靠近拮抗菌株抑菌带边缘的致病菌菌丝于载玻片上,放置于样品台的导电胶上,静置片刻后置于台式扫描电镜观察盒内,观察病菌菌丝的显微形态。
2.3 发酵上清液的制备
挑取1环事先活化的芽孢杆菌菌株至100 mL的LB液体培养基中,35℃、150 r·min-1振荡培养24 h作为种子液。按5%接种量将种子液接种到100 mL的LB液体培养基中,相同条件振荡培养48 h,所得发酵液于4℃、10 000 r·min-1离心20 min,上清液经0.22μm微孔滤膜过滤,得发酵上清液。
2.4 粗脂肽提取物的制备
取10 mL发酵上清液,用6 mol·L-1的HCl调节至pH2,4℃静置过夜。4℃,10 000 r·min-1离心20 min。将上清液调节 pH7后即为酸化上清液,4℃保存,备用;所得沉淀用甲醇溶解,抽滤两次,合并滤液,旋转蒸发浓缩后冷冻干燥,所得的干燥样品用 PBS缓冲液(0.02 mol·L-1,pH 7.2)定容至10 mL,经0.22μm微孔滤膜除菌,得脂肽粗提物。
2.5 有机溶剂萃取物
取10 mL发酵上清液3份,分别加入等量的石油醚、乙酸乙酯、水饱和正丁醇,萃取两次后合并有机相,挥干溶剂,用PBS缓冲液(0.02 mol·L-1,pH 7.2)定容至10 mL,经0.22μm微孔滤膜除菌,得有机溶剂萃取物。
2.6 蛋白粗提液的制备
取10 mL发酵上清液,缓慢加入固体硫酸铵颗粒,使其饱和度分别达到40%、50%、60%、70%、80%和90%,4℃静置过夜。4℃,10 000 r·min-1离心20 min,所得沉淀用0.02 mol·L-1的PBS缓冲溶液(pH 7.2)重悬至完全溶解,所得溶液装入透析袋(截留分子量8~14 kD)中除盐,直至1%的BaCl2溶液滴定透析外液无沉淀生成。将透析袋内溶液冷冻干燥,所得的干燥样品用PBS缓冲液(0.02 mol·L-1,pH 7.2)定容至10 mL,经0.22μm微孔滤膜除菌,得粗蛋白提取液。
2.7 抑菌活性检测
在距PDA培养基中心2 cm处按需摆放牛津杯,每孔加入100μL待检测溶液。将Φ6 mm人参根腐菌菌饼接种于平板中央,静置过夜后,取下牛津杯,将PDA平板25℃倒置培养3~5 d后测量菌落半径,根据抑菌率评价不同菌株的抑菌效果。
3 结果与分析
3.1 拮抗菌株对人参致病菌菌丝形态的影响
扫描电镜观察发现,对照组的人参根腐菌(图2I)、人参锈腐菌(图2II)、人参黑斑菌(图2Ⅲ)和人参灰霉菌(图2Ⅳ)生长正常,菌丝表面光滑,粗细均匀。
与QM对峙的人参根腐菌(图2A)菌丝生长扭曲,且结成团块,菌丝粗细不均,有破损现象,菌丝表面有凸起,不光滑;与QM对峙的人参锈腐菌(图2B)菌丝生长扭曲畸形,菌丝中段膨大,部分菌丝末端膨大或扭曲导致不能正常延伸;与QM对峙的人参黑斑菌(图2C)菌丝生长畸形,扭曲导致不能延伸,菌丝表面有瘤状凸起,部分菌丝膨大;与QM对峙的人参灰霉菌(图2D)菌丝生长畸形,表面有颗粒物或瘤状凸起,菌丝断裂和破裂严重,且缠绕成团状。

图1 拮抗菌株对人参致病菌菌丝生长形态的影响
与BM2对峙的人参根腐菌(图2E)菌丝生长扭曲,在中部出现断裂,部分菌丝膨大畸形,并且有瘤状附着物;与BM2对峙的人参锈腐菌(图2F)菌丝生长扭曲畸形,缠绕成团块状,部分菌丝膨大,末端不能延伸;与BM2对峙的人参黑斑菌(图2G)菌丝生长扭曲畸形,末端膨大扭转不能延伸,表面不规则凸起且有大量的颗粒状物;与BM2对峙的人参灰霉菌(图2H)菌丝生长畸形发生扭曲,缠绕成团,且断裂严重,表面有少量颗粒状凸起。
与HZ3对峙的人参根腐菌(图2M)菌丝生长扭曲成团块状,团块内部部分菌丝断裂破损,部分菌丝膨大,有瘤状凸起;与HZ3对峙的人参锈腐菌(图2J)菌丝生长扭曲畸形,菌丝末端膨大导致延伸受阻,表面有大量的颗粒状凸起;与HZ3对峙的人参黑斑菌(图2K)菌丝生长粗细不均,缠绕成团,部分菌丝膨大、空泡化,末端尤为严重导致难以延伸,表面有瘤状或颗粒状凸起;与HZ3对峙的人参灰霉菌(图2L)菌丝生长畸形发生扭曲、折叠和畸形,表面有颗粒状或不规则的凸起。

图2 发酵上清液的抑菌活性
3.2 抑菌活性检测
对峙培养过程中,人参根腐菌生长明显快于其他人参致病菌,故选择该菌作为靶标菌用于的抑菌活性检测。
3.2.1 发酵上清液的抑菌活性 实验结果表明,菌株QM(图2A)、BM2(图2B)和菌株 HZ3(图2C)发酵液对人参根腐菌生长有非常显著的抑制作用。去除菌体后,菌株QM和BM2发酵上清液抑菌活性略有下降,说明发酵上清液中的抑菌活性成分对菌株的抑菌作用贡献较大;菌株HZ3发酵上清液抑菌作用不明显,说明发酵上清液中仅含少量抑菌活性成分。
3.2.2 粗脂肽的制备及其活性检测 菌株发酵上清液酸化后产生明显的絮状沉淀,经甲醇溶解和超低温真空冷冻干燥后得淡黄色脂肽粗提物。实验结果表明,菌株QM(图3A)、菌株BM2(图3B)和菌株HZ3(图3C)脂肽粗提物对人参根腐菌有明显的抑菌效果,其抑菌效果与发酵上清液接近。三株菌的酸化上清液几乎无抑菌效果。

图3 脂肽粗提物的抑菌活性
用对峙培养法检测脂肽粗提物对人参根腐菌的抑菌活性。研究发现,相同的检测浓度下,菌株QM、BM2和 HZ3抑菌率分别为22.39±1.91%、25.83±1.03%和31.46±2.08%(表1)。
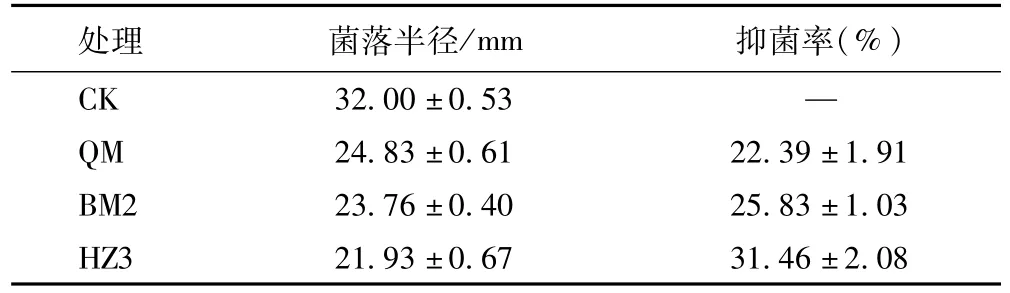
表1 脂肽粗提物对人参根腐菌生长的抑制作用
3.2.3 有机溶剂萃取物及其活性检测 用三种不同极性有机溶剂提取菌株发酵上清液中的抑菌活性成分。实验结果表明,菌株QM(图4A)、BM2(图4B)和菌株HZ3(图4C)发酵上清液的石油醚与乙酸乙酯提取物无明显抑菌活性。三株菌的发酵上清液的水饱和正丁醇提取液有抑菌活性,说明极性较大的水饱和正丁醇能够提取有效活性物质。
3.2.4 蛋白粗提液的制备及其活性检测 实验结果表明,40%~90%不同饱和度硫酸铵盐析出的粗蛋白均有一定的抑菌效果(图5)。相同浓度的粗蛋白提取物的抑菌活性与硫酸铵饱和度存在相关性,菌株QM(图5A,图5B)、菌株HZ3(图5E,图5F)和菌株HZ3(图5E,图5F)的抑菌物质对人参根腐菌的抑制率随硫酸铵饱和度的增加而提高,饱和度为70%时抑菌率达到最大值,之后随硫酸铵饱和度增加,蛋白提取液的活性未发生明显变化。
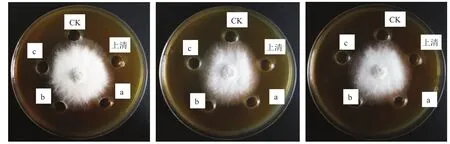
图4 不同有机溶剂萃取液的抑菌活性检验
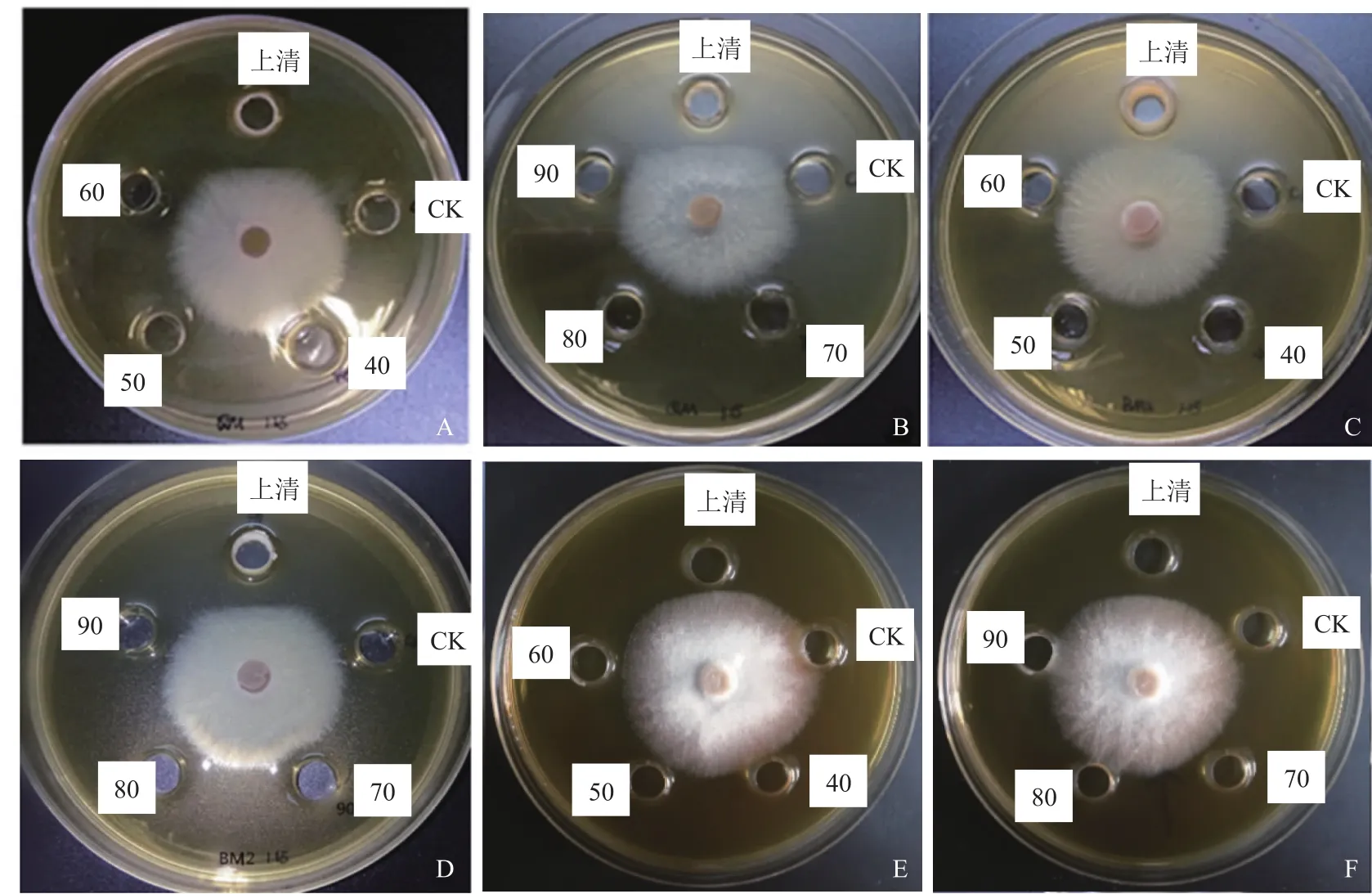
图5 不同饱和度的硫酸铵沉淀的抑菌作用
4 讨论
根据现有研究报道,芽孢杆菌的抑菌机制主要有寄生、竞争、抗生、溶菌作用和诱导抗病性等[7]。甲基营养型芽孢杆菌B.methylotrophicus是Madhaiyan等[8]于2010年从水稻根际土壤中分离获得的,并确认其为芽孢杆菌属的一个新种。研究发现,甲基营养型芽孢杆菌可产生抑菌脂肽、蛋白酶、纤维素酶和嗜铁素等抑菌活性物质[9-10]。进一步研究发现,甲基营养型芽孢杆菌产生的抗菌蛋白对人参锈腐菌菌丝生长也有强烈的抑制作用,可以导致菌丝生长过程中分支增多、断裂和菌丝空洞[11]。
本研究发现,三株供试甲基营养型芽孢杆菌与人参致病菌对峙培养时均产生明显的抑菌带,显微观察发现与甲基营养型芽孢杆菌对峙培养的人参致病菌表现为菌丝表面凹凸不平、膨大泡状、断裂破裂、扭曲缠绕等现象,推测3株芽孢杆菌产生了具有抗生及溶菌作用的抑菌活性物质[12-14]。
另外,本研究还发现,三株供试甲基营养型芽孢杆菌发酵上清液蛋白粗提物、脂肽粗提物以及有机溶剂提取物均有不同程度的抑菌活性,说明三株芽孢杆菌胞外分泌液中的抑菌活性成分并不单一,它们可能单独发挥抑菌作用,也可能多种活性物质协同抑菌,这为揭示生防细菌的抗菌机理提供了参考依据。抑菌活性物质的生物学功能及其作用靶点还有待进一步研究。
[1] 李玉.农业植物病理学[M].长春:吉林科学技术出版社,1992.
[2] 张飞飞,任跃英,王天媛,等.无公害人参生产关键技术[J].现代农业科技,2017(1):70-73.
[3] Hojin R,Hoon P,Dong SS,et al.Biological control of Colletotrichum panacicola on Panax ginseng by Bacillus subtilis HK-CSM-1[J].Journal of Ginseng Research,2014,38(3):215-219.
[4] Jiang C M,Shi J L,Liu Y L,et al.Inhibition of Aspergillus carbonarius and fungal contamination in table grapes using Bacillus subtilis[J].Food Control,2014,35(1):41-48.
[5] 朱玥妍,刘姣,杜春梅.芽孢杆菌生物防治植物病害研究进展[J].安徽农业科学,2012,40(34):16635-16638.
[6] 陈中义,张杰,黄大昉.植物病害生防芽孢杆菌抗菌机制与遗传改良研究[J].植物病理学报,2003,33(2):97-103.
[7] 邵天蔚,李勇.利用生防微生物防治人参根部病害的研究进展[J].中国现代中药,2016,18(3):383-386.
[8] Madhaiyan M,Poonguzhali S,Kwon SW,et al.Bacillus methylotrophicus sp.nov.,a methanol-utilizing,plantgrowth-promoting bacterium isolated from rice rhizosphere soil[J].International Journal of Systematic and Evolutionary Microbiology,2010,60(10):2490-2495.
[9] 康兴娇,申红妙,贾招闪,等.葡萄霜霉病生防菌甲基营养型芽胞杆菌T3的鉴定及其防治效果[J].中国生物防治学报,2016,32(6):775-782.
[10]吕倩,胡江春,王楠,等.南海深海甲基营养型芽孢杆菌SHB114抗真菌脂肽活性产物的研究[J].中国生物防治学报,2014,30(1):113-120.
[11]姜云,许鹏,陈长卿,等.Bacillusmethylotrophicus菌株产抗菌蛋白性质及对人参锈腐病菌抑菌作用[J].农药,2013,52(11):835-838.
[12]黄华毅,王佳琳,马荣,等.枯草芽孢杆菌STO-12抑菌活性及其抑菌物质分析[J].浙江农业学报,2017,29(1):81-88.
[13]邢咏梅,李向东,李莉,等.木霉属真菌拮抗金钗石斛病原菌的研究[J].中国医药生物技术,2017,12(1):35-39.
[14]Chang W T,Chen M L,Wang S L.An antifungal chitinase produced by Bacillus subtilis using chitin waste as a carbon source[J].World Journal of Microbiology and Biotechnology,2010,26(5):945-950.
