吸烟对维持性血液透析患者血尿酸水平的影响
2018-03-20吴开燕唐小玲张瑞瑞张琼
吴开燕 唐小玲 张瑞瑞 张琼
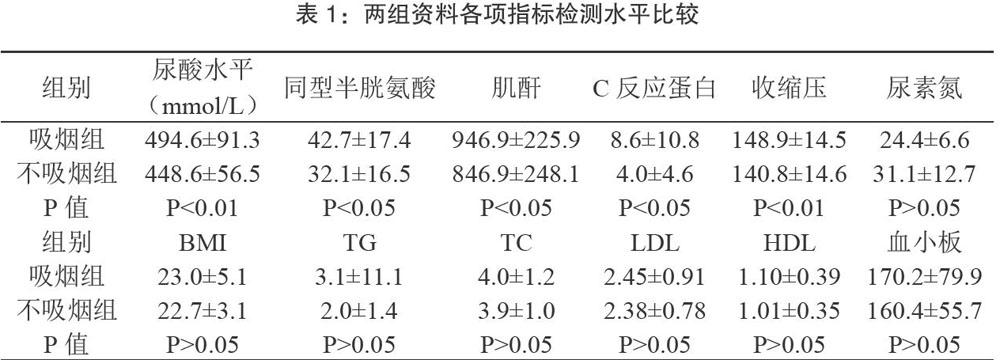
【摘要】目的:探讨吸烟对维持性血液透析(maintenance hemodialysis,MHD)患者血尿酸(UA)水平的影响。方法:选择我院规律透析且病情平稳的MHD患者118例,其中吸烟组41例,均为大量吸烟者,不吸烟组77例,同时检测118例患者血尿酸水平。结果:MHD患者吸烟组血尿酸平均水平(494.6±91.3mmol/L)明显高于不吸烟组血尿酸水平(448.6±56. Smmol/L),P 【关键词】吸烟;血尿酸;维持性血液透析 MHD患者的生活质量及长期生存率目前极不理想,而大量研究表明,心血管疾病(cardiovascular disease,CVD)是引起患者死亡的第一位原因[1]。MHD患者中CVD的死亡率较普通人群高10~20倍。近年来研究发现终末期肾脏病(end-stagerenaldisease ESRD)患者中普遍存在血尿酸升高、高血压、动脉硬化、糖尿病、高脂血症、肥胖等心血管疾病的危险因素。血尿酸己被广泛认定为CVD发展的一个可能的危险因素[2]。高尿酸与高血压、冠状动脉疾病和慢性肾病有关,并可能存在因果关系[3-5]。韩国一项研究表明,血尿酸水平与ESRD患者冠状动脉狭窄呈正相关[6]。我国MHD患者数量庞大,2015年统计,血液透析病人数量己超过38万,而透析病人中吸烟人数不少,本研究旨在研究吸烟对MHD患者血尿酸水平的影响。 1 资料与方法 1.1 一般资料 选择本院病情平稳的维持性血液透析患者118人,通过问卷调查的方式调查患者是否吸烟,吸烟者统计每天吸烟数量、吸烟年限,戒烟者记录戒烟年限等。纳入标准①接受规律的血液透析治疗>3个月,每周3次,每次4小时;②年龄>18岁;⑧自愿参加本研究并签署知情同意书。排除标准:①透析时间<3个月,每周<3次,每次<4小时,②存在急慢性感染性疾病,⑧正在服用影响尿酸代谢药物,④患有恶性肿瘤及血液系统疾病,⑤不愿意参加本研究者。其中每天吸烟>1包,连续吸烟一年以上,或既往有规律吸烟史,但至今戒烟时间<20年者纳入吸烟组,共41例,其中男23例,女18例,年龄29~87岁,平均年龄(58.7土13.4)岁,原发疾病:原发性肾脏病15例,糖尿病肾病12例,原发性高血压II例,慢性梗阻性肾病2例,多囊肾1例。其余患者纳入不吸烟组,共77例,其中男42例,女35例,年龄25~82岁,平均年龄(60.2±11.9)岁,原发疾病:原发性肾脏病34例,糖尿病肾病20例,原发性高血压16例,慢性梗阻性肾病2例,多囊肾5例。两组患者均使用碳酸氢盐进行血液透析治疗,流量为500ml/min,血流量为200-250ml/min,治疗时间为4小时/次。不吸烟组在年龄、性别、原发疾病、透析时间、透析方式等方面与吸烟组差异无统计学意义,P>0.05,具有可比性。 所有患者均根据病情需要使用促红细胞生成素及降压、降糖药物,且1个月内未使用过影响尿酸代谢的药物。 1.2 研究方法 按照标准方法测量身高(m)、体重(kg),并计算体重指数BMI (kg/m2)一体重+身高^2;测量一周首次透析上机前的血压(安静休息30min后测得的上臂血压,反复测量2次取平均值)。收集患者空腹8小时,且为一周首次透析当日采血静脉标本,我院检验科测定血尿酸、同型半胱氨酸、甘油三酯、胆固醇、低密度脂蛋白、高密度脂蛋白、尿素氮、肌酐、血清C反应蛋白和血小板等指标。 1.3 统计学方法 采用SPSS17.0统计学软件分析所得数据,计量资料以均数土标准差(x±s)表示,组间比较采用t检验;计数资料以百分率表示,组间比较采用X2检验。以P<0.05为差异具有统计学意义。 2 结果 两组的各项指标检测结果比较见表l。吸烟组血尿酸平均水平为494.6±91.3mmol/L,不吸烟组血尿酸平均水平为448.6±56.5mmol/L,吸烟组较不吸烟组血尿酸平均水平明显升高,两组比较差异有统计学意义P 3 讨论 调查显示,在CKD患者中,高尿酸血症( Hyperuricemia HUA)的发生率明显高于普通人群,即使是MHD患者己接受充分的血液透析治疗,仍有相当部分患者出现HUA,其发生率可高达50-60%[7]。 吸烟可以导致人体许多疾病的发生,如心脑血管疾病、恶性肿瘤、慢性阻塞性肺疾病以及慢性胃溃疡等。有研究认为吸烟引发的各种疾病与自由基氧化损伤有关,吸烟时产生的有害物质进入人体血液循环能促进自由基生成,而自由基的生成可损伤机体一些物质如脂质、蛋白以及DNA等[8-9]。该研究还显示吸烟对人体的有害作用是造成血管内皮细胞氧化损伤的结果。有研究表明吸烟者体内氧化物与抗氧化物之间的平衡关系的失调在疾病发生发展中起着至关重要的作用[10]。吸烟也能促进人体炎性反应,进一步促进氧化损伤[11]。 尿酸是嘌呤核苷酸代谢的最终产物,溶解度差,是在血液循环中由黄嘌呤氧化酶将黄嘌呤和次黄嘌呤氧化分解所产生,也可从外源性食物中所摄入。大量研究表明,MHD患者血尿酸升高,可能诱导钠依赖性的血压上升,导致小动脉病变,出现不可逆的钠依赖性高血压;尿酸还可通过激活肾素一血管紧张素系统(RAS)刺激血管平滑肌细胞的增殖和氧化应激,导致动脉粥样硬化;也可通过诱导内皮细胞的抗增殖作用和损害一氧化氮的产生而导致内皮功能障碍,而一氧化氮(NO)对人体血管舒缩调节起关鍵作用,而NO缺乏可能加速血管功能的下降,还会导致血管的收缩,导致内皮功能障碍和血管僵硬;尿酸浓度升高与流变学紊乱有关,如血小板粘附和聚集受损;尿酸还参与IL-6、CRP、TNF-α、ICAM-1等炎症因子有关,并且通过触发炎性细胞因子的释放而参与炎症;尿酸还可以引起血脂代谢紊乱,导致血脂升高,加速动脉硬化通过损伤胰岛β细胞,引起胰岛素抵抗,诱发或加重糖尿病[12-22]。
研究表明,吸烟可导致MHD患者尿酸的升高[22]。也有研究显示,吸烟可通过抑制尿酸钠盐的强烈炎症反应,降低高尿酸血症的发病风险,Hanna等研究发现吸烟年限和每日吸烟量与血清尿酸水平存在负相关的剂量反应关系[23]。多项研究表明,吸烟可导致血尿酸的水平较低[23-27]。
根据我院符合条件的118名长期维持血液透析患者数据资料显示,吸烟可导致MHD患者血尿酸水平的升高,可能诱发和加重心脑血管疾病。同时,此次研究发现,吸烟还导致同型半胱氨酸、肌酐、C反应蛋白、收缩压明显高于MHD患者中不吸烟者,两组间比较差异有统计学意义(P<0.05)。
目前,吸烟导致血尿酸升高的机制不详,根据尿酸代谢过程推断,可能原因为:①香烟中有害物质导致次黄嘌呤和-鸟嘌呤磷酸核糖转移酶(HGPRT)活性减少,限制嘌呤核苷酸的补救合成,而间接促进尿酸的生成。②香烟中的有毒物质导致黄嘌呤氧化酶的活性增加,促进次黄嘌呤和鸟嘌呤过多生成黄嘌呤,进而促进尿酸生成。⑧香烟中的毒性成分刺激胃肠道对食物中外源性嘌呤吸收增加。④香烟中的毒性成分入血,导致肾小球功能障碍,对尿酸的滤过减少或导致肾小管功能异常,使得肾小管重吸收和分泌尿酸功能异常。⑤香烟中有害成分进入人体后,促进氧自由基的生成,刺激机体代谢加快,细胞新陈代谢增加,死亡和衰老的细胞增多。⑥香烟中吸收入血的部分有害物质导致尿酸在血液中的溶解度改变,不易被肾小球滤过排出。具体机制,可能需要进一步细胞分子层面实验加以研究证实。
本研究显示,MHD患者吸烟组同型半胱氨酸、血肌酐、C反应蛋白、收缩压均明显高于不吸烟组,P<0.05,差异有统计学意义,而这些因素可能是诱发和加速动脉粥样硬化,导致CVD发生发展的重要因素,应引起重视。吸烟是可控的,应鼓励和劝导MHD患者戒烟,预防心血管事件的发生。
参考文献
[1]李六生,赵鸿飞,陈飞等,维持性血液透析患者死亡原因I临床分析[J].中华全科医学,2012,10 (03): 347-348.
[2] Jeong HY, Cho HJ, Kim SH, etal. Association of serum uricacid level with coronaryartery stenosis severity inKorean end-stage renal diseasepatients. Kidney Res ClinPract,2017: 36(3):282-289.
[3]Johnson RJ, Johnson RJ, Kang DH,Feig D, Kivlighn S, Kanellis J,Watanabe S, Tuttle KR, Rodriguez-Iturbe B. HerreraAcosta J.MazzaliM: Is there a pathogenetic rolefor uric acid in hypertension andcardiovascular and renal disease?Hypertension 41: 118 3-1190,2 003.
[4] Jonasson T,Ohlin AK, Gottsa-. terA, Hultberg B,Ohlin H:Plasmahomocysteine and markers foroxidat ive stress and inflammat ionin patients with coronary arterydisease -a prospective randomizedstudy of vitamin supplementation.Clin Chem Lab Med 43: 628-634,2005.
[5] Niskanen LK, LaaksonenDE,Nyysso--nen K, Alfthan G,Lakka HM, Lakka TA, Salonen JT:Uric acid level as a risk factorfor cardiovascular and all-causemortality in middle-aged men: Aprospective cohort study. ArchIntern Med 164: 1546-1551,2004.
[6] Zhang JW, He LJ, Cao SJ, Yang Q,YangSW, Zhou YJ: Association of serumuric acid and coronary arterydisease in premenopausal women.PLoS One 9:e106130, 2014.
[7]陈涛,李卫,王杨,胡泊,徐涛,刘冰,孙毅,高尿酸血症的患病情况及相关因素分析[J].中华临床医师杂志(电子版),2012 (13): 3526-3529.
[8]Leistikow B N,Tsodikov A.Cancerdeath epidemics in U-nited Statesblack males: evaluating courses.causation, andcures [J] . PrevMed,2005,41(2): 380-385.
[9]Mallampalli A, Guntupalli KK. Smoking and systemic dis-ease [J]. Clin Occup EnvironMed, 2006, 5 (1) : 17 3-192.
[10]马玉玲,李士玉. 吸烟对氧自由基及抗氧化酶活性影的研究 [J].中国行为医学科学雜志 ,2001,10(01):65-67.
[ll]van der Vaart H,Postma D S,Timens W, et al. Acuteeffects ofcigarette smoke on inflammationand oxidativestress: a review[J].Thoras, 2004, 59 (8): 713-721.
[12]Mazzali M,Kanellis J,Han L,FengL,Xia YY,Chen Q, Kang DH, GordonKL,
Watanabe S, Nakagawa T, LanHY, Johnson RJ. Hyperuricemiainduces a primary renalarteriolopathy in rats by ablood pressure-independentmechanism. Am J Physiol RenalPhysiol (2002) 282: F991-997.
[13] Yu MA, Sanchez-Lozada LG,Johnson RJ, Kang DH: Oxidativestress with an activation of thereninangiotensin system in humanvascular endothelial cells as anovel mechanism of uric acid-induced endothelial dysfunction.JHypertens 2010; 28:1234-1242.
[14] Corry DB, Eslami P, YamamotoK, Nyby MD, Makino H, Tuck ML: Uricacid stimulates vascular smoothmuscle cell proliferation andoxidative stress via the vascularreninangiotensin system. JHypertens 26: 269-275, 2008.
[15]Kanellis J,Kang DH: Uric acidas a mediator of endothelialdysfunction, inflammation,andvascular disease. Semin Nephrol25: 39-42, 2005.
[16]Khosla UM, Zharikov S, FinchJL, Nakagawa T, Roncal C, Mu W,Krotova K, Block ER, Prabhakar S,Johnson RJ: Hyperuricemia inducesendothelial dysfunction. KidneyInt 67:1739-1742, 2005
[17] Johnson RJ, Kang DH, FeigD, Kivlighn S, Kanellis J, WatanabeS, Tuttle KR, Rodriguez-IturbeB,HerreraAcosta J,Mazzali M: Isthere a pathogenetic role foruric acid in hypertension andcardiovascular and renal disease?Hypertension, 2003; 41: 118 3-119 0.
[18] Lobo JC, Stockler-Pinto MB, daN 6 brega AC, et al. Is thereassociation between uric acidand inflammation in hemodialysispatients?Ren Fail, 2013; 35 (3) : 361-366.
[19]1washima Y, Horio T, Kamide K,Rakugi H, Ogihara T, Kawano Y:Uric acid, left ventricular massindex, and risk of cardiovasculardisease in essential hypertension.Hypertension, 2006; 47: 195-202.
[20] Nakagawa T, Hu H, Zharikov S, TuttleKR, Short RA, Glushakova O,Ouyang X, Feig DI, Block ER,HerreraAcosta J, Patel JM, JohnsonRJ: A causal role for uric acidin fructose-induced metabolicsyndrome. Am J Physiol RenalPhysiol 2006; 290: F625-631.
[21]Yamamoto Y, Ogino K, Igawa G,Matsuura T, Kaetsu Y, SugiharaS, Matsubara K, Miake J, HamadaT, Yoshida A, Igawa 0, YamamotoT, Shigemasa C, Hisatome I:Allopurinol reduces neointimalhyperplasia in the carotid arteryligation model in spontaneouslyhypertensive rats. Hypertens Res2006; 29: 915-921.
[22]L1 L, Yang C, Zhao Y, Zeng X, Liu F,FuP.Is hyperuricemia an independentrisk factor for newonset chronickidney disease?A systematicreview and meta-analysis based onobservational cohort studies. BMCNephrol, 2014: 15: 122-134.
[23] Hanna BE, Hamed JM, Touhala LM.Serum uric acid in smokers [J].Oman Med J,2008,23(4):269-274.DOI: 10. 5812/numonthly. 20746.
[24] Tomita M,Mizuno S,Yokota K.Increased levels of serum uricacid among ex-smokers [J]. JEpideml01,2008,18 (3):132-134.
[25] naj MD,Ezzaher A,NeffatiF, et al. Effect of cigarettesmoking on plasma uric acidconcent rations [J].
Envi ron
Heal thPrev Med, 201 1,16 (5): 307-312.DOI: 10. 1007 s12199. 010. 0198.2.
[26]王玉蘭,刘斌,吸烟对血浆尿酸水平的影响[J].首都医科大学学报,2013, 34 (06): 856-859.
[27]陈亨贵,盛丽婷,万真真等,中国居民吸烟与高尿酸血症的相关性分析[J].中华预防医学杂志,2018, 52 (05): 524-529.
