不同宽叶蓝靛果种群遗传多样性的ISSR分析
2018-03-20张巍孟庆彬郭兴李金禹
张巍,孟庆彬,郭兴,李金禹
0 引言
宽叶蓝靛果忍冬(Lonicera edulis var.turczaninowii(Pojark.))为忍冬科忍冬属植物[1]。笔者于2010年开始对小兴安岭伊春林区的宽叶蓝靛果种源进行调查[2-3],共确定三处野生分布。三个种源地均为伊春林区海拔较高地区,平均海拔分布高度约为550~1 400m左右[3-5]。为揭示宽叶蓝靛果不同种源间的遗传差异,运用ISSR-PCR分子标记分析方法对高海拔地区宽叶蓝靛果各野生分布种群的遗传多样性水平和遗传距离进行标记分析,希望可以为宽叶蓝靛果不同种源的综合评价及利用提供参考和理论依据。
1 材料与方法
1.1 供试样本
所用供试蓝靛果分别来自带岭大菁山、南岔黄花山、桃山平顶山三个种源地。其中,带岭大菁山选取2个种源地,每个种源各采集10个样本,南岔黄花山选取1个种源地共采集10个样本,桃山平顶山选择2个种源地各采集6个样本。样本收集后马上置于-20℃低温保存。各样本的名称和采集地参见表1。
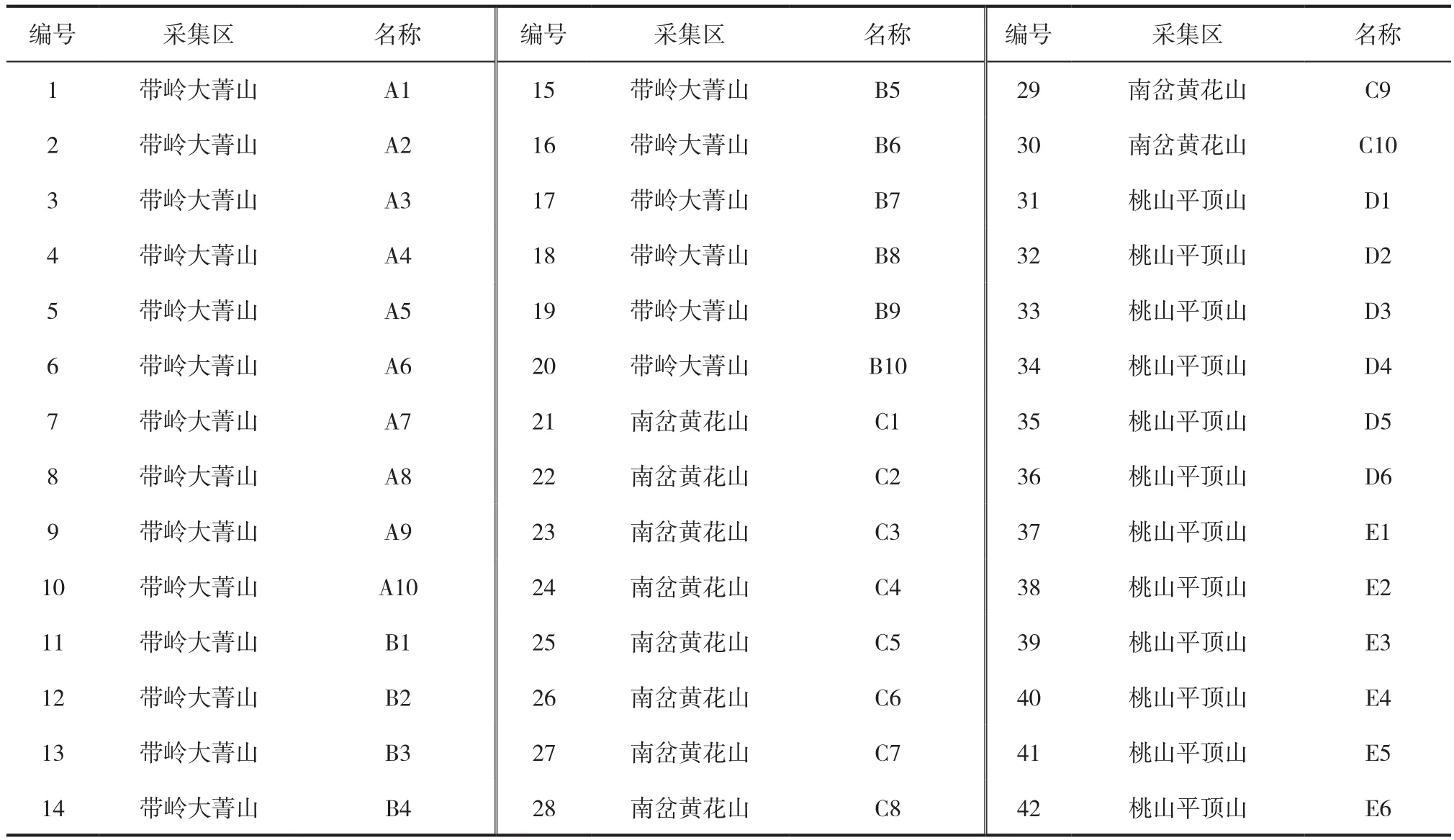
表1 供试样本及采集地Tab.1 Sample and collection site
1.2 引物筛选
试验用引物编号及其核酸序列(上海生工生物工程公司,Sangon)见表2。
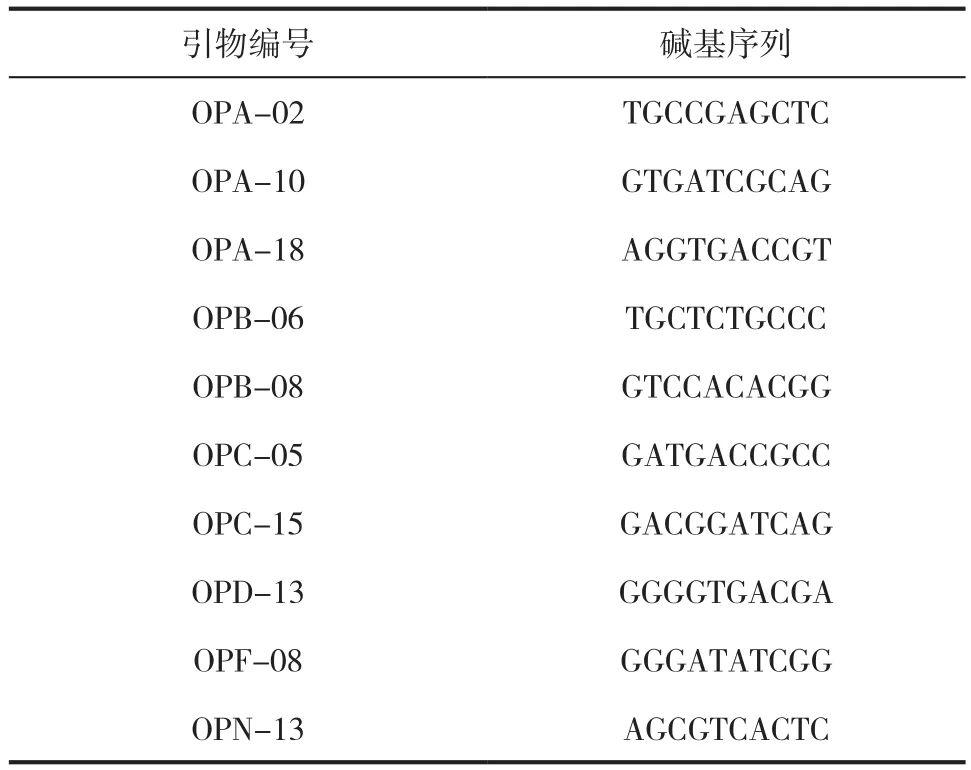
表2 供试引物Tab.2 Test primers
1.3 蓝靛果总DNA提取
试验参考霍俊伟等的试验方法[6-10]。采用CTAB提取宽叶蓝靛果叶片总DNA,从上清液中获取的DNA得率高,DNA电泳条带清晰[11-12]。
1.4 ISSR-PCR
反应体系为20 μL,包括1×Buffer,2.0 mmol/L MgCl2,引物1.5 ng/μL,dNTP的浓度为0.2 mmol/L,TaqDNA聚合酶的用量为1U,模板DNA的用量为20~40 ng,TaqDNA聚合酶、引物、dNTP由上海生工生物工程(Sangon)公司提供。
PCR反应程序为:94℃变性4 min,94℃变性1 min ,36℃退火 40s,72℃延伸1 min,40个循环;72℃延伸8 min;4℃保存。
1.5 电泳检测及数据处理
PCR产物用2.0%琼脂糖凝胶于不超过5 V/cm的电压下电泳,电极缓冲液为1×TAE,在含有0.5 ug/mlEB中染色30 min,凝胶成像系统拍照记录。将琼脂糖凝胶上出现DNA片段的计为1,不出现的为0,各数据计算公式如下:
(1)遗传相似系数(genetic similarity,GS)公式[6]:
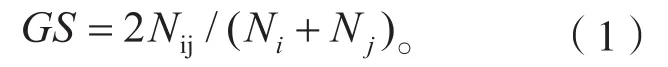
式中:Nij为基因型间共有带数目;Ni和Nj为两基因型各自的条带数目。
(2)遗传距离(genetic distance,GD)公式:

(3)有效等位基因数公式:

式中:fi2为第i个等位基因的频率。
(4)Nei’s基因多样性指数He(Nei,1978)[11-13]

式中:Pi为单个位点上的等位基因的频率。
(5)Nei’s标准遗传指数公式[8]:
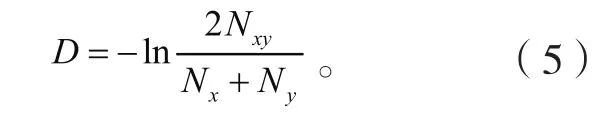
式中:Nxy为材料X、Y公共带数;Nx为材料X的带数;Ny为材料Y的带数。
以上数据经统计后输入电脑,用NTSYS聚类分析软件进行UPGMA法聚类分析并构建聚类图谱。
2 结果与分析
2.1 种源间的ISSR多态性分析
某个位点有两个以上等位基因,该位点就称为多态性位点。多态性位点占同工酶分析的总位点数的百分比即为多态性位点百分率[8-10]。对采自不同海拔区域野生群落的42个宽叶蓝靛果单株进行分子标记分析。结果表明,试验所选用的10个引物所扩增出的条带稳定性及可重复性均表现显著。试验共扩增出68个条带,特异性位点百分率54.41%,其中特异性条带数37个,平均每个引物共产生3.7个特异性条带(表3)。
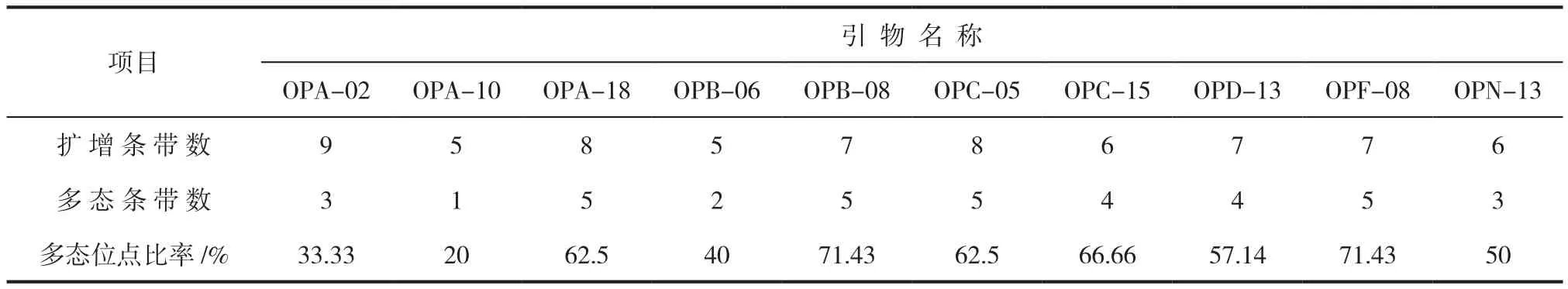
表3 ISSR分析的10条引物及其扩增产物Tab.3 ISSR analysis of 10 primers and their amplification products
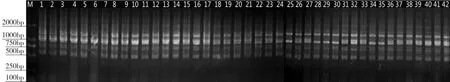
图1 ISSR电泳图谱(引物OPA-02)Fig.1 ISSR electrophoresis pattern (primer OPA-02)
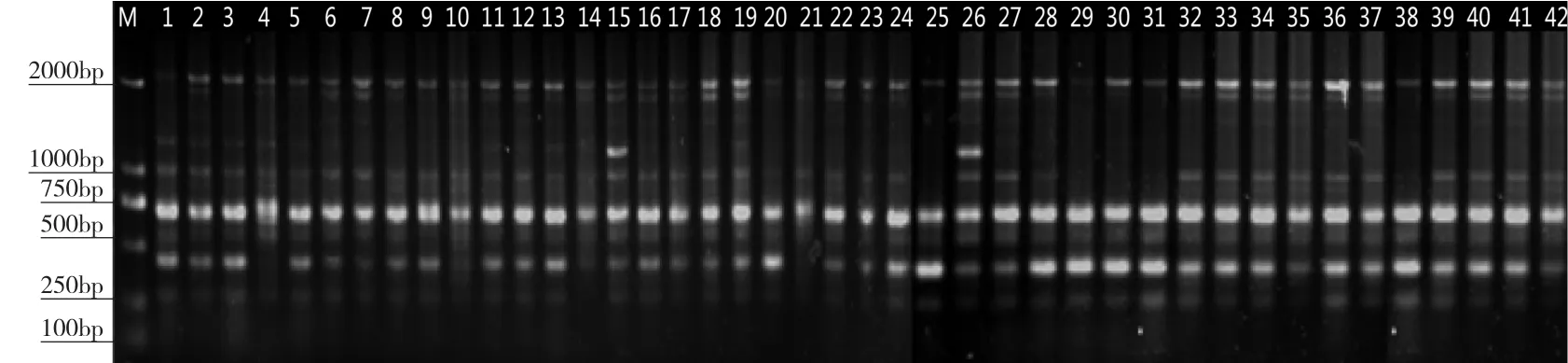
图2 ISSR电泳图谱(引物OPF-08)Fig.2 ISSR electrophoresis pattern (primer OPF-08)
由表3可知,10个引物中,OPA-02引物扩增的条带数最多(图1),但多态位点比率相对较少。而OPB-08和OPF-08两个引物多态位点比率均达到71.43%,表明上述两个引物可以检测到更为丰富的多态性(图2)。同时,以上数据也表明,宽叶蓝靛果种间在分子水平上的多态性是丰富的,这为今后蓝靛果ISSR引物的定向开发奠定了基础。
2.2 遗传多态位点分析
遗传多样性是生物多样性的基础,也是生物多样性最重要的部分[11-13]。通过对大菁山、黄花山和平顶山三处种源地的遗传多样性进行统计分析表明,平顶山种源区遗传丰富度最高,共检测出遗传多态性位点24个,多态性位点比率达到35.29%。而黄花山和大菁山两处种源地检测出的遗传多态性位点同为19个,多态性位点比率同为27.94%(表4)。
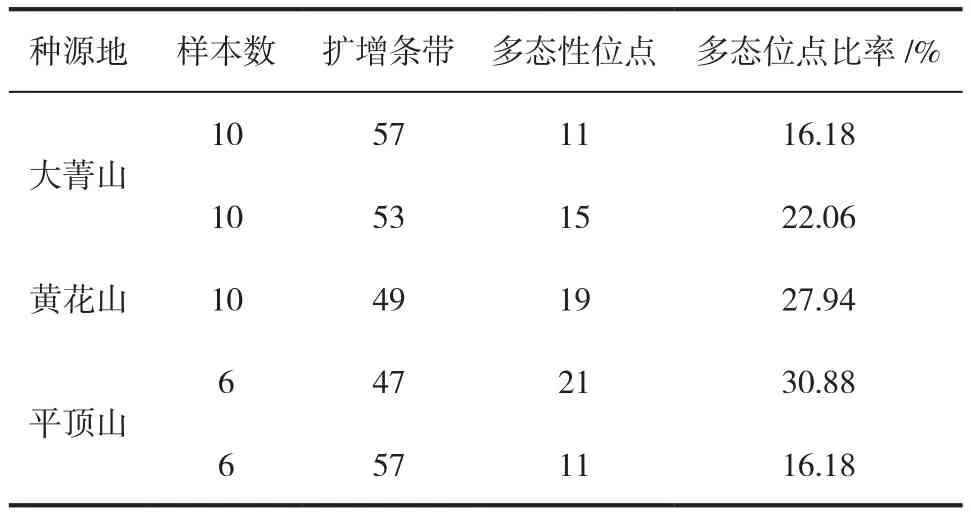
表4 各种群多态位点统计Tab.4 Statistical analysis of polymorphic loci
从表4可知,不同种群的多态位点比率在16.18%~30.88%。通过对三个种源区划的5个宽叶蓝靛果天然群落的检测表明,大菁山和黄花山的遗传丰富度相近,平顶山遗传丰富度相对较高。在本次试验中,出现了同一种源区划的两个采集样方多态位点比率相差较大的情况,这可能因为宽叶蓝靛果种群受高海拔自然因子局限,导致不同样区遗传丰富度产生差异。
通过GPS定位测距表明,黄花山种源带与大菁山种源带地理位置直线距离为27 km,大菁山种源带与平顶山种源带的地理直线距离为53 km,而黄花山种源带与平顶山种源带地理直线距离为76.9 km。卫星地图观测,各种源地山系间均有天然地貌阻隔,独立成峰未交集。伊春林区地处小兴安岭南坡的中心地带,其群落构成、山脉走向、成土结构等均具有小兴安岭山脉的典型特征。三处种源地共同处于小兴安岭山脉,属于同一地理区划。经计算,亲源关系也维持在0.83水平。但另一方面,三处种源地海拔高度有所差异,黄花山海拔高度600 m左右,为三个种源地最低。大菁山种源地海拔1 000 m左右,平顶山种源平均分布在海拔1 400m左右。在对不同海拔群落多样性的调查表明,不同海拔宽叶蓝靛果群落生物多样性有明显差异,而海拔1 000m为宽叶蓝靛果林型过渡带[4]。由此可见,不同群落的遗传差异有可能是海拔高度差异、群落自身大小及地理距离差异共同作用的结果。
2.3 遗传距离和亲缘关系分析
Nei指数(H)、Shannon指数(I)和有效等位基因数(Ne)是衡量种源遗传多样性的重要参数[12-15]。以相似性系数公式(GS)对三处种源进行遗传相似系数计算,结果表明,大菁山和黄花山两处种源遗传相似系数为0.27,遗传距离为0.73,表明两处种源亲源关系较近。而平顶山与大菁山、黄花山种源地的遗传系数均为0.5,表明平顶山种源区与其它两处种源的亲源关系较远。用 Nei指数(H)对种群间遗传距离进行测算表明,大菁山与黄花山种源的亲源关系最近,其测算值为0.349,与平顶山亲源关系最远,其测算值为0.534。而黄花山与平顶山测算的遗传指数为0.39。
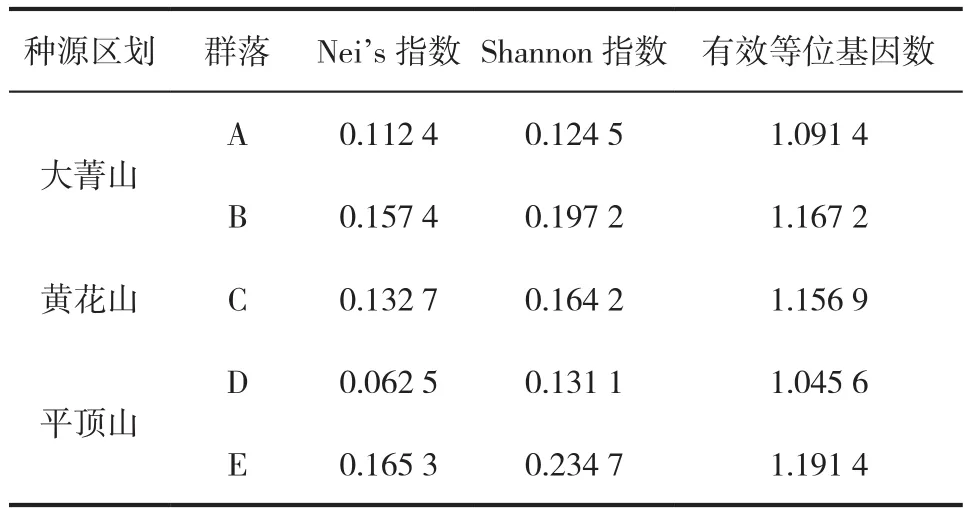
表5 各种源多态性统计Tab.5 Various sources of polymorphism statistics
进行遗传多样性分析结果表明(表5),Shannon多态性总体处于0.124 5~0.234 7,总体平均值为0.170 3,其中平顶山多态性最为丰富。Nei指数总体分布于0.062 5~0.065 3,总体平均值为0.126 1。Nei指数测算得到的结果与Shannon指数所得到的测算结果基本一致。
对42个单株进行聚类分析并建立树状图(图3),结果表明各单株的遗传距离总体分布在0.80~0.99。其中A4、A5单株,B7、B9单株,C9、C10单株及E3、E5单株等遗传距离都达到了0.99,表明具有效高的亲源关系,而D4、D5单株在此次分析中与其它单株的遗传距离最远。总体分析,各单株的遗传距离分布基本与种源分布密切相关。其中,大菁山A和B两处分布单株亲源关系较为集中,达到0.92水平。而黄花山各单株组内相对集中,组间的遗传距离与大菁山更为接近,这也与之前笔者对各种源进行遗传系数测算的结果一致。
3 结论与讨论
(1)利用所筛选出来的10个引物运用ISSR分子标记手段对宽叶蓝靛果不同海拔种源进行分析,共检测到68个位点,多态位点比率在20%~71.43%。其中,平顶山群落多态位点比率最高为30.88,最低为16.18,表明组内遗传差异较大。而大菁山和黄花山组内差异相对较小。
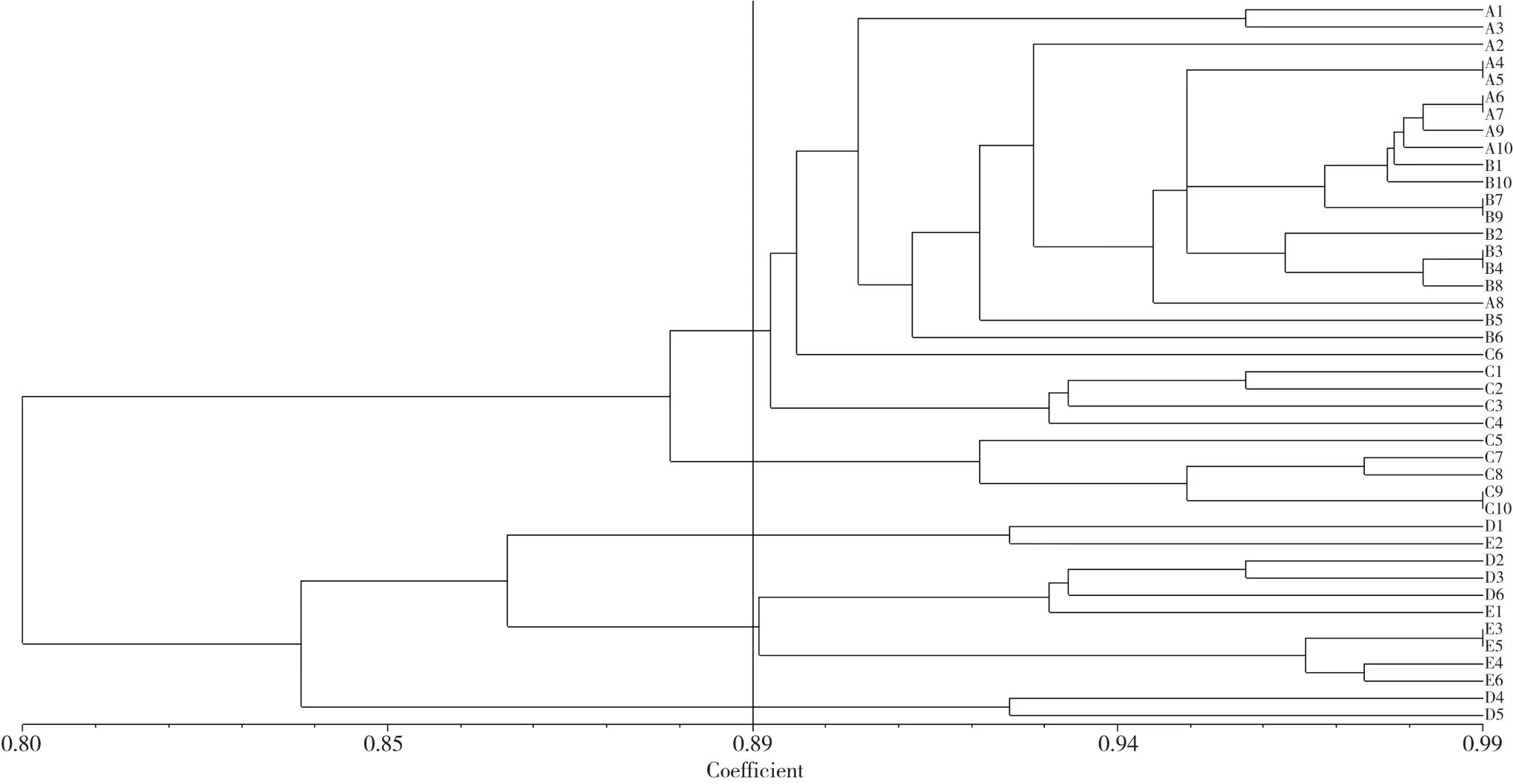
图3 宽叶蓝靛果42个品种聚类分析树状图Fig.3 The broad leaf of Lonicera edulis 42 varieties of the dendrogram of cluster analysis
(2)通过本次检测证明,宽叶蓝靛果不同种源间存在一定差异性。其中大菁山与黄花山亲源关系更为接近,而平顶山亲源关系较远。产生这一结果的原因可能与地理距离及海拔高度有关。
(3)对3个种源分布的遗传距离进行测算表明,平顶山遗传丰富度明显高于其它种源,证明种群内基因流较强,种群总体处于活跃状态。同时也证明宽叶蓝靛果种群在长时间的进化过程中已经完成了对高海拔地区环境因子的适应。
[1]周以良, 董世林, 聂绍荃.黑龙江树木志[M].哈尔滨:黑龙江科学技术出版社, 1986.
[2]张巍, 王洪学, 王洪刚, 等.伊春林区蓝靛果种质资源调查研究 [J].森林工程 , 2014, 30(1):46-48.
[3]李红莉, 龙作义, 逄宏扬.东北地区野生蓝靛果忍冬果实形态变异研究[J].安徽农业科学, 2014, 42(30) : 10705 -10707.
[4]张巍, 孟庆彬, 王洪刚, 等.宽叶蓝靛果在不同海拔分布的生物多样性分析[J].森林工程, 2017, 33(3): 28-32.
[5]兰士波.蓝靛果忍冬生态耦合性分析与遗传效应评价[J].安徽农业科学, 2013, 41(33):12843-1284.
[6]霍俊伟.蓝靛果忍冬(Lonicera L.subsect.Caeruleae)生物学特性及种质资源的RADP研究 [D].哈尔滨:东北农业大学,2004.
[7]刘万勃, 宋明, 刘富中, 等.RAPD和ISSR标记对甜瓜种质遗传多样性的研究[J].农业生物技术学报, 2002, 10(3): 231-236.
[8]赵雷, 张继兰.云南松ISSR-PCR反应体系建立及优化[J].北方园艺, 2012(12):130-133.
[9]霍俊伟, 睢薇.蓝果忍冬种间遗传多样性及亲缘关系的ISSR研究 [J].吉林农业大学学报, 2009, 31(5):516-520.
[10]孙岳, 李景鹏, 金元昌, 等.南、北五味子ISSR鉴别研究[J].中医药学报, 2003, 31(1):29-31.
[11]刘万勃, 宋 明, 刘富中, 等.GAPD和ISSR标记对甜瓜种质遗传多样性的研究[J].农业生物技术学报, 2002,10(3): 231-236.
[12]徐娜, 夏秀英, 徐大可, 等.越橘基因组DNA的快速提取及分析[J].果树学报2007, 24(5):714-717.
[13]谢运海.东北地区水曲柳地理种源遗传多样性分析及优良种源选择 [D].哈尔滨:东北林业大学, 2005.
[14] 周延清, 杨清香, 张改娜.生物遗传标记与应用 [M].北京,化学工业出版社, 2008.
[15]张巍, 王清君, 郭兴.红松不同种源的遗传多样性分析[J].森林工程, 2017, 33(2): 17-21.
[16]颜承云, 杨治伟, 刘娟.黑龙江省蓝靛果忍冬的资源调查[J].中国野生植物资源, 2002, 21(2):18-19.
