UBE2C对肺癌PC9细胞增殖及迁移能力的影响
2018-03-20武艳周宁郭纪伟杨丽娟代娟娟陈微微
武艳,周宁,郭纪伟,杨丽娟,代娟娟,陈微微
(滨州医学院附属医院,山东滨州256600)
泛素结合酶E2C(UBE2C)又称为UbcH10或dJ447F3.2,属于E2家族成员,其基因位于染色体20q12.13,在人类中UBE2C有6种同源异构体,最常见的同源异构体含197个氨基酸,相对分子质量为19 652 Da,在不同种属之间高度同源[1]。细胞周期后期促进复合物(APC/C)是目前惟一被发现可以介导UBE2C向靶蛋白传递泛素分子的E3酶,通过泛素化促进细胞周期蛋白A、细胞周期蛋白B、p21等细胞周期相关蛋白的降解,从而促进细胞周期M期的进程。UBE2C通过中和USP44的去泛素化作用,并促进APC/C上纺锤体检查点组分的解离,参与细胞周期纺锤体装配检查点的调控,因此,UBE2C在细胞整倍体的维持中起重要作用。UBE2C在正常组织中表达较低,在肺癌、乳腺癌、卵巢癌、肝癌等多种肿瘤中表达水平较高。已有研究表明,UBE2C的过表达能够促进细胞增殖,增强肿瘤细胞的迁移及侵袭能力。本课题组在2017年1~6月通过构建UBE2C的真核表达载体,并验证其对人肺癌细胞系(PC9)增殖、迁移能力的影响,为进一步研究UBE2C在肺癌中的作用机制奠定基础。
1 材料与方法
1.1 材料 PC9细胞系购于美国ATCC细胞库;pcDNA3.1载体购于Gromega公司;胎牛血清、RPMI1640培养基、胰酶购自美国Gibco公司;Lipofectamine 2000购于Invitrogen公司;限制性内切酶Kpn I、Xba I和T4 DNA连接酶购自NEB公司;TRIzol试剂,PCR所需引物购于上海生物工程有限公司;逆转录试剂购于Thermo公司;PCR Mix,T-载体试剂盒购于Transgen公司;质粒提取试剂盒购于Axygen公司;Flag单克隆抗体购自Santa Cruz公司,Tubulin抗体、辣根过氧化物酶标记的羊抗兔IgG抗体购于Proteintech公司;CCK-8试剂购于碧云天公司。
1.2 真核表达载体pcDNA3.1-Flag-UBE2C的构建 根据Genbank提供的UBE2C基因信息,设计合成上下游引物,并在上游引物中引入Flag标签的碱基序列和Kpn I 酶切位点,下游引物中引入Xba I酶切位点,上下游引物序列分别为: P1:5-′GGGTACCCCATGGATTACAAGGATGACGACGATAAGGCTTC-CCAAAACCGCGACCCAG-3′;P2:5-′GCTCTAGAGC-TTAATATCTAGGGCTCCTGGCTGGTGAC-3′。以PC9细胞的cDNA为模板,配制反应体系,通过PCR反应获得UBE2C的全长DNA序列,反应条件:95 ℃ 5 min、95 ℃ 10 s、56 ℃ 30 s、72 ℃ 60 s,30个循环,72 ℃ 10 min,置于4 ℃备用。将PCR产物回收后,先与T-载体、反应缓冲液混合,25 ℃反应10 min,转化入大肠杆菌DH5α中,涂到含有氨苄青霉素的LB平板中,培养过夜,挑取菌落,振荡培养,提取T-UBE2C质粒,并通过Kpn I和Xba I进行酶切鉴定,并将鉴定为阳性的质粒送至上海生物工程有限公司进行序列测定,通过DNAMAN软件对测序结果与UBE2C的CDS序列进行比对。将序列比对完全一致的T-Flag-UBE2C质粒、pcDNA3.1载体酶切后分别进行切胶回收,通过T4 DNA连接酶进行连接,转化入DH5α中,涂到含有氨苄青霉素的LB平板中,37 ℃培养过夜,次日挑取菌落,振荡培养,提取重组质粒,并进行酶切鉴定。结果成功扩增出UBE2C基因片段,产物大小为591 bp,将其成功连入T载体中,经酶切鉴定,并且重组T-载体中序列完全正确的UBE2C基因片段成功连入线性化的pcDNA3.1中,提示UBE2C的真核过表达载体已构建成功。将鉴定正确的重组质粒pcDNA3.1-Flag-UBE2C,通过Nanodrop测定浓度,置于-20 ℃备用。
1.3 分组及处理 将PC9细胞系分为重组质粒组(pcDNA3.1-Flag-UBE2C)和空质粒组(pcDNA3.1),将1.5 μg质粒与Lipofectamine 2000 4 μL混合后,加入培养基100 μL,室温孵育25 min,加入到细胞生长密度为60%~80%的培养板中,继续培养24~48 h,以便进行后续实验。
1.4 细胞UBE2C mRNA的检测 采用RT-PCR法。细胞转染48 h后,收集细胞,TRIzol法提取细胞总RNA,将提取的RNA逆转录成cDNA,应用Transgen公司的2×EasyTaq PCR SuperMix进行PCR验证,并进行3次重复实验,通过Image J软件分析灰度值,并以GAPDH作为内参,计算目的基因的表达量。PCR鉴定引物:UBE2C:上游引物: 5′-GGATTTCTGCCTTCCCTGAA-3′,下游引物:5′-GATAGCAGGGCGTGAGGAAC-3′, GAPDH 上游引物:5′-CTCCTCCTGTTCGACAGTCAGC-3′,下游引物:5′-CCCAATACGACCAAATCCGTT-3′。
1.5 细胞UBE2C蛋白的检测 采用Western blotting法。转染48 h后,收集细胞沉淀,NP-40裂解液裂解细胞,BCA法测定蛋白浓度。取蛋白上样30 μg,进行SDS-PAGE电泳;转膜,封闭后分别孵育抗-UBE2C(1∶1 000)、抗-Tubulin(1∶1 000)抗体过夜,次日孵育HRP标记的羊抗兔IgG抗体(1∶1 000),加入ECL显色底物,应用成像系统进行成像拍照,实验重复3次,以目的蛋白灰度值比内参蛋白灰度值作为目的蛋白相对表达量。
1.6 细胞增殖能力的检测 采用CCK-8法。将细胞以5×103/孔接种于96孔板,培养过夜后进行转染,每组设置3个平行孔,每过12 h加入CCK-8继续培养3 h,采用酶标仪测定各孔在450 nm波长处的吸光度值,共测定至60 h,绘制不同组随时间变化的增殖曲线。
1.7 细胞迁移能力的检测 采用细胞划痕试验。细胞转染48 h后,用200 μL枪头进行划痕,PBS洗涤后,加入新鲜无血清培养基后继续培养,分别在0、24、48 h进行拍照。分别进行3次重复试验,应用Image J软件对划痕距离进行统计分析。
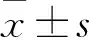
2 结果
2.1 UBE2C在PC9细胞中的表达 细胞转染48 h后,空质粒组、重组质粒组UBE2C的mRNA相对表达量分别为0.679±0.024、2.349±0.154,二者比较,P<0.01;UBE2C蛋白相对表达量分别为0.581±0.018、2.284±0.017,二者比较,P<0.01。
2.2 过表达UBE2C对PC9细胞增殖、迁移能力的影响 细胞转染60 h后,空质粒组、重组质粒组的OD450值分别为1.201±0.123、1.627±0.01,重组质粒组的增殖能力高于空质粒组(P<0.05);重组质粒组和空质粒组在划痕后培养24 h时的伤口愈合率分别为46.322%±3.388%、29.576%±3.229%,48 h的愈合率分别为76.995%±3.338%、38.362%±3.358%,重组质粒组迁移能力高于空质粒组(P<0.01)。
3 讨论
肺癌是世界范围内最普遍的恶性肿瘤。据统计,在2012年新增病例180万,死亡病例160万[2,3]。在中国,肺癌是最常见癌症,被确诊时患者多处于肺癌晚期,已经失去了手术治疗机会。近年来,由于诊断方法、外科技术的提高,很大程度上延长了患者的寿命,但是由于缺少有效的靶向治疗,五年内多数患者均会出现复发的现象,因此寻求有效、特异性治疗非小细胞肺癌的靶点至关重要。
UBE2C已被证明是肿瘤发展中的重要功能性基因之一。其表达水平与肿瘤的恶性程度及病理分级密切相关。有研究表明,降低UBE2C的表达水平后,肿瘤细胞的增殖和克隆形成能力明显被抑制,肿瘤细胞的衰老加速[4,5]。在乳腺癌细胞中,降低UBE2C表达能明显增强表柔比星耐药细胞对表柔比星的敏感性[6]。有研究者检测了结直肠癌患者中UBE2C的表达,结果显示,肿瘤组织中UBE2C的mRNA及蛋白表达均明显高于正常组织,并且其表达水平与患者对化疗或靶向药物的临床反应密切相关,是潜在的生物标志物[7]。有文献报道,在神经胶质瘤中,下调UBE2C的表达能够通过抑制PI3K-Akt-mTOR信号通路,促进细胞自噬,进而降低细胞的生存能力[8];但是UBE2C在肺癌发生发展中的功能知之甚少,其作用机制还需进一步深入探讨。我们前期研究发现,UBE2C在肺癌组织中过表达;RNA干扰实验显示,下调UBE2C的表达可以抑制肺癌细胞的恶性生物学行为。鉴于前期的研究成果,尚需通过过表达UBE2C进一步鉴定其在肺癌细胞中的功能及作用。因此,本研究通过PCR方法扩增获得带有Flag标签的UBE2C基因全序列,限制性内切酶作用后将其克隆到真核细胞表达载体上,获得能够在真核细胞中表达的重组载体,为研究UBE2C的作用机制奠定基础;并且通过该重组载体上调UBE2C的表达后,能显著增加肺癌PC9细胞的增殖及迁移能力。本研究为进一步探讨UBE2C基因在肺癌发生发展及迁移浸润中的作用机制奠定了基础。
