SCC水平对宫颈癌和卵巢癌患者手术联合新辅助化疗敏感性及疗效预测价值的比较分析
2018-03-20陈君茂
陈君茂 徐 策
宫颈癌和卵巢癌是女性生殖系统常见的两种恶性肿瘤,严重危害妇女健康[1-3]。最近一些国家和地区宫颈癌发生有所增加[3-5]。卵巢癌发病率和死亡率也居妇科恶性肿瘤之首,发病率也呈逐年上升趋势[6-8]。对于这种恶性肿瘤来说提高早期诊断水平、争取治疗时机至关重要。鳞状上皮细胞癌抗原(SCC)、癌胚抗原(CEA)等都目前比较公认的肿瘤标志物,可以协助早期发现与诊断[9-11]。研究提示,很多子宫颈鳞癌患者治疗前会表现出特征性的血清SCC水平升高,且SCC与肿瘤分期、瘤的大小以及淋巴结转移情况关联甚密[10-13]。 本研究就SCC表达水平及其抗原阳性状况对宫颈癌和卵巢癌患者术后新辅助化疗敏感性及疗效预测价值进行了比较分析。
1 资料与方法
1.1 一般资料
本研究选取本院就诊的确诊宫颈癌患者和卵巢癌患者252例作为研究对象,其中宫颈癌患者127例,卵巢癌患者125例。诊断标准均以病理诊断作为确诊手段,宫颈癌Ⅰb2期~Ⅱa期的患者选择新辅助化疗后病灶缩小后手术。纳入标准:确诊的宫颈癌或卵巢癌患者,病理分期为Ⅰb2~Ⅱa的患者,且均于本院接受了手术联合新辅助化疗,全部患者能够配合本研究相关工作。排除标准:排除宫颈和卵巢的良性肿瘤或其他疾患,排除未接受手术联合新辅助化疗的两类肿瘤患者,排除各种情况不能配合研究的受试对象。全部患者知情同意。2组患者在年龄、BMI水平、血糖状态以及肿瘤直径分布上也未见显著差异,可比性良好。见表1。
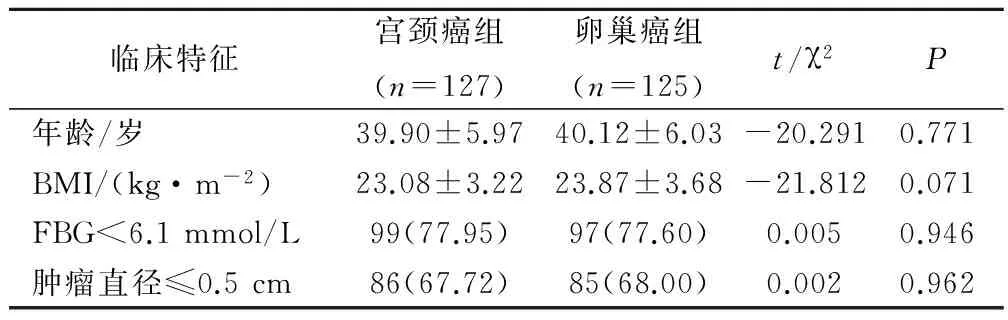
表1 受试患者基线信息以及一般情况特征比较
1.2 方法
研究中收集化疗前后患者相关基线信息以及血清SCC水平以及SCC-Ag阳性信息,并与化疗后进行相关水平的对比分析,全部研究对象随访5年。采用酶联免疫吸附法检测血清SCC等水平。
1.3 统计学方法

2 结果
2.1 宫颈癌、卵巢癌患者治疗前后SCC情况分析
手术联合新辅助化疗治疗前,宫颈癌患者中血清SCC阳性率为100.0%,手术联合新辅助化疗后阳性率降至17.32%,P<0.01,有105例患者转阴。卵巢癌患者中治疗前后SCC阳性率分别为14.40%和5.60%,P<0.01,有11例患者转阴。治疗前和治疗后,SCC阳性率均见宫颈癌组较高,P<0.01。
SCC-Ag水平在宫颈癌患者中由治疗前的(3.79±0.76) ng/mL降至治疗后的(3.31±0.72) ng/mL,P<0.01。卵巢癌组也见治疗后SCC-Ag表达水平的显著下降,P<0.01。2种肿瘤患者之间比较,SCC-Ag也均见在宫颈癌组水平较高。见表2。
2.2 SCC与宫颈癌、卵巢癌患者预后的关系
SCC-Ag>3.5 ng/mL组的宫颈癌患者的3年生存率较SCC-Ag≤3.5 ng/mL组患者差;且SCC-Ag高表达患者3年和5年生存率均显示宫颈癌组优于卵巢癌组,SCC-Ag低表达患者中也发现了生存率的类似上述变化状态。见表3。
3 讨论
女性肿瘤中宫颈癌和卵巢癌均占有相当大的比例,其中卵巢上皮癌死亡率占各类妇科肿瘤的首位,由于卵巢的组织解剖及内分泌功能较复杂,早期症状不典型,且容易转移与扩散,所以在早期诊断上是一大难题。治疗上放疗的效果及应用也很有限,因此全身性化疗是一项重要的辅助治疗方法[9-12]。全球每年死于宫颈癌的患者超过二十万人,且近年来宫颈癌的发生呈年轻化的趋势,原位癌高发年龄为30~35岁,浸润癌为45~55岁。近几十年宫颈细胞学筛查的普遍应用,使宫颈癌和癌前病变得以早期发现和治疗,该病的发病率和死亡率有所降低[13-15]。新辅助化疗是指在实施局部手术或放疗之前进行的全身化疗,主要目的是使肿块缩小、及早杀灭转移细胞等,为后续的手术、放疗等治疗铺平道路。手术联合新辅助化疗主要是用于某些中期肿瘤患者,以期通过先做化疗使肿瘤缩小,再通过手术或放疗等治疗方法治愈肿瘤[12-15]。多种恶性肿瘤,其中也包括卵巢癌等都适宜使用手术配合新辅助化疗。鳞状上皮细胞癌抗原(SCC)不仅作为诊断宫颈癌等肿瘤的肿瘤标志物而存在,同时有研究提示其在治疗效果评价中也有一定价值。本研究中对比SCC对宫颈癌和卵巢癌患者手术配合敏感性情况,结果提示作为宫颈癌的肿瘤标志物,新辅助化疗治疗前,宫颈癌患者中血清SCC阳性率为100.00%,新辅助化疗后阳性率降至17.32%。卵巢癌患者中治疗前后SCC阳性率分别为14.40%和5.60%,有11例患者转阴。治疗前和治疗后,SCC阳性率均见宫颈癌组较高。另外,SCC-Ag水平在宫颈癌患者中由治疗前的(3.79±0.76)ng/mL降至治疗后的(3.31±0.72)ng/mL。卵巢癌组也见治疗后SCC-Ag表达水平的显著下降。2种肿瘤患者之间比较,SCC-Ag 也均见在宫颈癌组水平较高。宫颈癌组不同SCC-Ag水平组见淋巴转移的发生率在SCC-Ag高表达组较高,显著高于低表达组;宫颈癌组的3年和5年生存率在SCC-Ag高表达组均低于低表达组。可见SCC在2种肿瘤的疗效评价以及预后评价中的价值所在,这种肿瘤标志物最初是一种从子宫颈鳞状上皮细胞癌组织中分离出的糖蛋白,是目前临床上一种特异性很好的鳞癌肿瘤标志物。鳞状上皮细胞癌抗原最早用于诊断鳞癌,比如宫颈癌、肺癌、头颈部癌等等,此外血清鳞状上皮细胞癌抗原增高,其浓度随病情加重而增高,所以其也可作为监测这些肿瘤的疗效、复发、转移及预后的评价指标。

表2 宫颈癌和卵巢癌患者治疗前后SCC情况分析
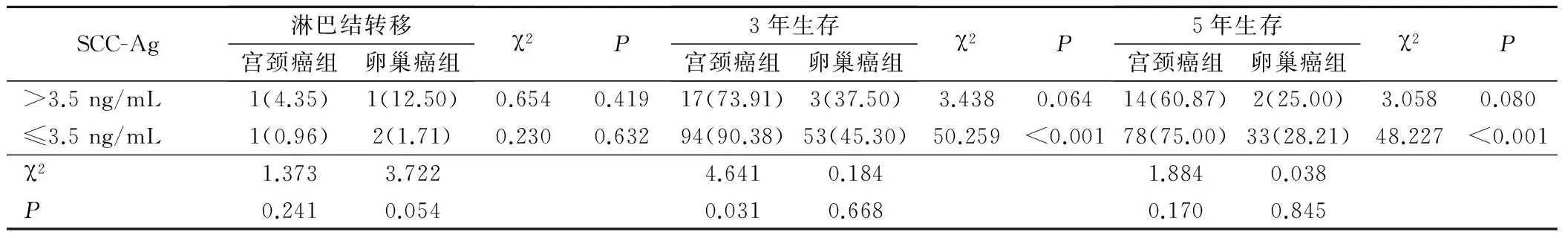
表3 SCC与宫颈癌和卵巢癌患者预后的关联分析(例,%)
综上,SCC不仅作为宫颈癌的肿瘤标志物在早期诊断宫颈癌中发挥重要作用,而且对卵巢癌的治疗效果评价也具有一定的临床价值,其还可同时作为宫颈癌和卵巢癌的预后评价参考,为临床治疗提供辅助信息。
[1] 郭芝亮,季 冰,龙燕芬.新辅助化疗单用及联合术前放疗治疗宫颈癌的疗效对比分析〔J〕.实用癌症杂志,2014,29(5):535-537.
[2] 李惠卿.阴道镜联合HPV检测对宫颈癌及宫颈上皮内瘤变的诊断价值〔J〕.实用癌症杂志,2014,29(10):1250-1252.
[3] 韩 萍,邢 军,陈 昭.女性生殖系统肿瘤〔M〕.科学技术文献出版社,2011:238-298.
[4] 方三高,石群立,周晓军,等.解读2014年WHO女性生殖器官肿瘤分类(子宫体)〔J〕.重庆医学,2016,45(15):2017-2031.
[5] 张爽爽,夏庆民,郑荣寿,等.中国2010年卵巢癌发病与死亡分析〔J〕.中国肿瘤,2016,25(3):169-173.
[6] 涂彬彬,吴令英,李 宁.血清肿瘤标志物诊断早期卵巢癌的相关研究进展〔J〕.癌症进展,2014,12(4):346-350.
[7] 侯娟娟,虎淑妍,刘婷婷,等.血清肿瘤标志物在卵巢癌早期诊断中的临床价值〔J〕.中国免疫学杂志,2014,30(8):1101-1104.
[8] 赵海建,张传宝,汪 静,等.全国肿瘤标志物不同检测系统质量水平分析〔J〕.检验医学,2014,29(5):545-548.
[9] 颜 萍,龚旭华.多种血清肿瘤标志物检测在早期宫颈癌诊断中的意义〔J〕.实用癌症杂志,2014,29(7):741-743.
[10] 殷卓敏,吴红娟,方 静,等.血清肿瘤标志物对Ⅰ~Ⅱ期宫颈小细胞癌预后的预测价值〔J〕.中国医药导报,2015,12(5):22-27.
[11] 努尔兰,余莹莹,韩文广,等.中央型肺鳞癌、小细胞肺癌CT征象与血清肿瘤标志物的关系及联合诊断的价值〔J〕.中国CT和MRI杂志,2015,13(9):57-61.
[12] 郑晓荣.舒适护理在新辅助化疗的卵巢癌患者中的应用〔J〕.中国医药指南,2011, 9(1):146-147.
[13] 马 丁.上皮性卵巢癌组织起源与肿瘤发生新进展——“二元论”学说〔J〕.中国实用妇科与产科杂志,2014,30(1):8-11.
[14] 陈军莹,姚德生.宫颈癌血清肿瘤标志物临床应用概况〔J〕.医学综述,2015,21(19):3501-3504.
[15] 王丽君.上皮性卵巢癌相关肿瘤标志物的研究新进展〔J〕.中国生育健康杂志,2015,26(1):95-97.
