多西他赛、奥沙利铂、替吉奥联合治疗127例晚期胃癌患者的临床疗效
2018-03-20吴朝阳
戴 兴 吴朝阳
胃癌是危害波及世界范围的恶性肿瘤之一,而中国更是发病率和死亡率极高的胃癌大国[1]。早期接受了胃癌根治术也有50%~60%的患者在术后两年出现原位复发或转移[2]。对于晚期的胃癌患者来说,以全身化疗为基础的综合治疗是重要的治疗手段,而且临床资料显示联合化疗的效果优于单药化疗[3]。我院2012年4月至2016年10月收治了127例使用多西他赛、奥沙利铂、替吉奥3种药物联合治疗的晚期胃癌患者127例,现报告如下。
1 资料与方法
1.1 临床资料
回顾分析2012年4月至2016年10月期间我院肿瘤内科收治的晚期胃癌患者227例,其中使用多西他赛、奥沙利铂、替吉奥3种药物联合化疗的患者127例,为观察组;使用奥沙利铂、替吉奥两种药物联合化疗的患者100例,为对照组。所有患者均发现病灶,且化疗前心、肝、肾功能均正常。两组患者在年龄、性别、病理分型等基本资料比较中均无统计学差异。所有患者均签订了知情同意书,且治疗方法通过医院伦理学证明。
1.2 治疗方法
1.2.1 对照组 奥沙利铂:静脉滴注,剂量130 mg/m2,1次/天,持续2 h;替吉奥胶囊:餐后口服,剂量80 mg/m2,2次/天。
1.2.2 观察组 多西他赛:静脉滴注,剂量60 mg/m2,共1次,持续1 h;奥沙利铂:静脉滴注,剂量100 mg/m2,共1次,持续2 h;替吉奥胶囊:餐后口服,剂量60 mg/m2,2次/天。
两种化疗方法均是3周为1个疗程,化疗过程中定期检测心电图、肝肾功能,如有不良反应发生,则及时对症治疗,出现不能耐受者,立刻停止用药。
1.3 观察指标
所有患者均至少经过2个周期的化疗,治疗期间观察患者以下指标。
1.3.1 疗效指标 按照RECIST 1.1标准,将患者的治疗效果分为完全缓解、部分缓解、稳定、进展。其中总有效率=(完全缓解+部分缓解)/总人数,疾病控制率=(总人数-进展)/总人数。随访两组患者的生存时间,计算中位生存时间。近期疗效评价标准分为疾病进展PD、部分缓解PR、完全缓解CR、病情稳定SD。有效率RR=(CR+PR)/所有病例100%。疾病控制率=(CR+PR+SD)/所有病例100%。治疗开始至疾病进展时间为无进展生存时间。
1.3.2 免疫指标 治疗前后抽取患者外周血,检测外周血的淋巴细胞中CD4+、CD8+、CD4+/CD8+的变化。
1.3.3 不良反应 观察患者化疗期间发生的不良反应情况,并根据WHO抗癌药物常见的毒性分级标准,将不良反应毒性分为0~Ⅳ度。
1.4 统计学分析
应用SPSS 19.0分析数据,计量资料用t检验,技术资料用χ2检验,P<0.05表示差异有统计学意义。
2 结果
2.1 两组患者的近期和远期疗效比较
对照组100例患者中,有3例完全缓解,24例部分缓解,24例稳定,49例进展,总有效率27%,中位生存时间为8个月;观察组127例患者中,有5例完全缓解,47例部分缓解,53例稳定,22例进展,总有效率41%,中位生存时间为10个月。通过比较发现,两组患者的总有效率无统计学差异(P>0.05),但观察组的疾病控制率和中位生存时间均显著优于对照组(P<0.05)。具体见表1。

表1 两组患者的总有效率、疾病控制率、中位生存时间比较/%
2.2 两组患者的免疫指标比较
治疗前组间各指标无统计学差异(P>0.05)。两组治疗前后CD3+无明显变化(P>0.05)。与治疗前相比,两组患者治疗后的CD4+、CD4+/CD8+均显著升高,P<0.05),CD8+无统计学差异(P>0.05)。观察组患者治疗后的CD4+、CD4+/CD8+水平均显著升高,P<0.05,见表2。
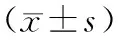
表2 两组患者淋巴细胞变化情况的比较
注:*为同组中治疗前与治疗后相比,P<0.05;#为治疗后组间相比,P<0.05。
2.3 两组患者的不良反应比较
观察组患者的不良反应均为Ⅰ~Ⅲ度,不影响治疗,对照组中有3例患者的脱发为Ⅳ度,经对症治疗后缓解,其余均为Ⅰ~Ⅲ度。两组不良反应发生中,除恶心呕吐和肝功能损害无统计学差异外,其余均有显著差异,且观察组显著少于对照组(P<0.05),见表3。

表3 两组患者的不良反应发生情况比较/例
注:*表示组间相比,P<0.05。
2.4 治疗效果
观察组化疗平均周期为3.3个月,对照组为3.1个月(P=0.037),观察组和对照组的部分缓解率分别为47.2%和43.0%。疾病控制率分别为87.4%和81.0%,见表4。

表4 两种方案一线治疗后的近期疗效比较(例,%)
2.5 总体生存率
两组中位总生存期无明显差异(观察组:7.3个月,对照组: 7.0个月,P=0.63),1年生存率(观察组:34%,对照组:31%)。PS 0~1分患者生存期(观察组:8.7个月,对照组:7.7个月,P=0.51),PS 2分患者生存期(观察组:4.3个月,对照组:5.1个月,P=0.54),见图1。
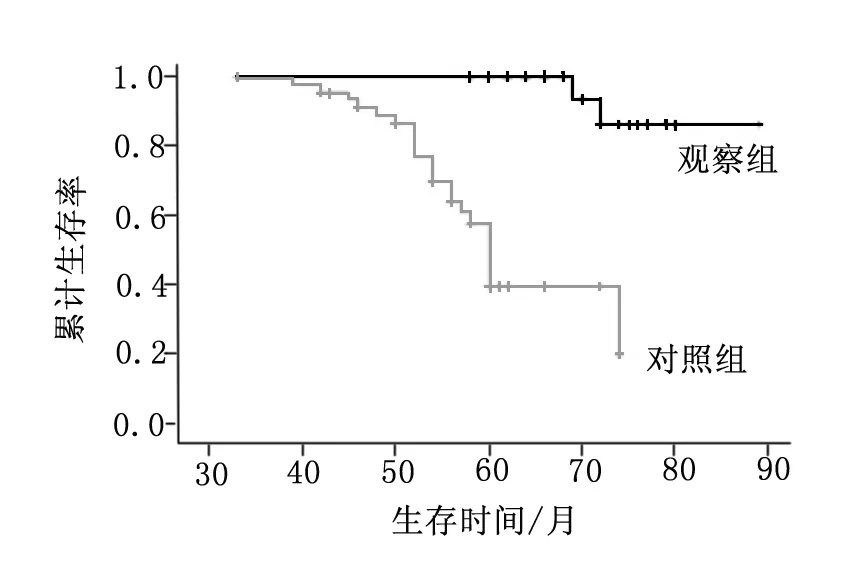
图1 两组总体生存情况比较
3 讨论
化疗是晚期胃癌的常用治疗方法,但目前有关化疗的标准尚未统一,临床首选的化疗方案是多以氟尿嘧啶类药物为基础。随着新药的不断研发,奥沙利铂、替吉奥等被发现对胃癌有较好的抗癌活性。
替吉奥是新一代氟尿嘧啶衍生物,为口服抗癌药,主要成分为替加氟、吉美思特、奥替拉西钾,其中奥替拉西钾可特异性的降低替加氟引起的胃肠道反应[4],提高患者的耐受程度。研究报道[5],替吉奥可提高疾病有效率和控制率,并可降低不良反应发生率。奥沙利铂是第三代铂类抗癌药,与顺铂相比其与抗癌活性更强,不良反应更小,是目前临床常用的胃癌化疗药物,奥沙利铂与氟尿嘧啶及其衍生物为基础的化疗方案被NCCN指南推荐为2A证据的化疗方案[6-8]。多西他赛是半合成的紫杉类抗癌药,其作用类似于紫杉醇,可通过抑制肿瘤细胞分化而发挥抗癌作用,具有高效低毒的特点,是消化道肿瘤常用化疗药物。研究表明,多西他赛单药使用即可有效治疗胃癌进展期和转移的患者,两药或三药联合治疗可使临床缓解率达26%~60%[9-10]。
Oh等[11]通过分析41例接受奥沙利铂和替吉奥联合化疗的患者,结果显示治疗的有效率达53.7%,中位生存时间为7.8个月。Yang[12]的报道显示奥沙利铂和替吉奥联合化疗的治疗有效率为55.8%,中位无进展时间为7.0个月。多西他赛、奥沙利铂、替吉奥三药联合化疗的报道较少,Zhou等[13]的研究显示,疾病有效率为66.7%,中位无进展时间为7.1个月。本研究结果表明,对照组(奥沙利铂+替吉奥)的总有效率为27%,中位生存时间为8个月;观察组(多西他赛+奥沙利铂+替吉奥)的总有效率41%,中位生存时间为10个月,观察组的疾病控制率和中位生存时间均显著高于对照组(P<0.05)。
研究发现,多种药物联合化疗在提高化疗效果的同时,也增加了化疗相关毒副反应的发生率[14],因此,合理的联合使用化疗药物并尽量减轻毒副反应是目前胃癌治疗的研究热点。本研究结果显示,观察组患者的不良反应均为Ⅰ~Ⅲ度,不影响治疗,对照组中有3例患者的脱发为Ⅳ度,经对症治疗后缓解,其余均为Ⅰ~Ⅲ度。两组不良反应发生中,除恶心呕吐和肝功能损害无统计学差异外,其余均有显著差异,且观察组显著低于对照组(P<0.05)。说明三药联合化疗可显著降低患者化疗期间的不良反应发生率。此结果与其他学者的研究结果相似[15-16]。同时,本研究对患者化疗期间的免疫指标进行了检测,发现两组患者治疗后的CD4+、CD4+/CD8+均比治疗前显著升高,且观察组患者治疗后的CD4+、CD4+/ CD8+显著高于对照组,说明两种化疗方案均可增强患者的免疫功能,但是三药联合使用的效果更佳。
综述所述,多西他赛、奥沙利铂、替吉奥三药联合化疗可提高晚期胃癌患者的临床疗效,增强免疫功能,降低不良反应的发生,可在临床推广使用。
[1] McGuire S.World Cancer Report 2014.Geneva,Switzerland: World Health Organization,International Agency for Research on Cancer,WHO Press,2015〔J〕.Adv Nutr,2016,7(2):418-419.
[2] Park SC,Chun HJ.Chemotherapy for advanced gastric cancer: review and update of current practices〔J〕.Gut liver,2013,7(4):385-393.
[3] Wang X,Wang ML,Zhou LY.Randomized phase II study comparing paclitaxel with S-1 vs.S-1 as first-line treatment in patients with advanced gastric cancer〔J〕.Clin Transl Oncol,2013,15(10):836-842.
[4] 曹桂侠,程朝辉,周东梅.替吉奥联合奥沙利铂治疗晚期胃癌的临床观察〔J〕.肿瘤基础与临床,2011,24(1):27-29.
[5] 张星霖.替吉奥胶囊治疗老年晚期胃癌的临床观察〔J〕.现代肿瘤医学,2011,19(6):1189-1190.
[6] Nishina T,Kato T,Yamazaki K, et al.A phase II study of S-1,oxaliplatin,oral leucovorin,and bevacizumab combination therapy (SOLA) in patients with unresectable metastatic colorectal cancer〔J〕.Cancer Chemother Pharmacol. 2015,76(3):547-553.
[7] Xu R,Ma N,Wang F,et al.Results of a randomized and controlled clinical trial evaluating the efficacy and safety of combination therapy with Endostar and S-1 combined with oxaliplatin in advanced gastric cancer〔J〕.Oncol Targrts Ther,2013,25(6):925-929.
[8] Skulsky SL,O'Sullivan B,McArdle O, et al.Review of hig-
h-risk features of cutaneous squamous cell carcinoma and discrepancies between the American Joint Committee on Cancer and NCCN Clinical Practice Guidelines In Oncology〔J〕.Head & neck,2017,39(3):578-594.
[9] Lee JH,Kim SH,Oh SY,et al.Third-line docetaxel chemotherapy for recurrent and metastatic gastric cancer〔J〕.Korean J Intern Med,2013,28(3):314-321.
[10] Kunisai C,Takahashi M,Makino H,et al.Phase Ⅱ study of bi.Weekly docetaxel and S-1 combination chemotherapy as first-line treatment for advanced gastric cancer〔J〕.Cancer Chemother Pharmacol,2011,67(6):1363.
[11] Oh SY,Kwon HC,Jeong SH,et al.A phase Ⅱ study of S-1 and oxaliplatin(SOX) combination chemotherapy as a first-line therapy for patients with advanced gastric cancer〔J〕.Invest New Drugs,2012,30:350-356.
[12] Nishikawa K,Yamada Y,Ishido K,et al.Impact of progression type on overall survival in patients with advanced gastric cancer based on randomized phase III study of S-1 plus oxaliplatin versus S-1 plus cisplatin〔J〕.Gastric cancer,2017,20(4):640-645.
[13] Miyamoto Y,Tsuji A,Tanioka H,et al.S-1 and irinotecan plus bevacizumab as second-line chemotherapy for patients with oxaliplatin-refractory metastatic colorectal cancer: a multicenter phase II study in Japan (KSCC1102)〔J〕.International journal of clinical oncology,2016,21(4):705-712.
[14] Amaral L,Mendes J,Martins P,et al.Survival benefits of palliative gastric cancer resection --a regional center experience〔J〕.Hepatogastroenterology,2012,59(117):1651-1656.
[15] 李 阳.替吉奥、多西他赛联合奥沙利铂治疗进展性胃癌临床观察〔J〕.承德医学院学报,2014,31(6):482-484.
[16] 李建旺,黄春珍,李建华.替吉奥联合奥沙利铂及多西他赛治疗晚期及复发性胃癌的临床观察〔J〕.实用癌症杂志,2012,27(1):67-69.
