腹腔镜保脾脾门淋巴结清扫术在局部进展期胃上部癌根治术中的安全性
2018-03-20王金榜
王金榜
胃上部癌指的是胃上1/3部肿瘤,对进展期胃上部癌,在临床上仍以全胃切除术或近侧胃大部切除术为准,且近些年随着研究深入,发现保脾淋巴结清扫在并发症和5年生存率上和切脾相似[1]。故目在基层医院仍以保脾为常见手术方式。且脾门位置深在,血管变异多,术者操作空间小,且脾脏质地脆弱,毗邻关系复杂,在开放手术时要将脾、胰尾充分游离才能彻底行脾门淋巴结清扫。但操作难度大,术中易损伤脾动脉,并发症多。李恩等[2]称,腹腔镜下操作视野增大,且超声刀良好止血分离效果,使得在术中能清晰辨认筋脉、血管等,能清晰进行脾门淋巴结清扫,且并发症显著下降。但目前争议点在于腹腔镜保脾脾门淋巴结清扫在进展期胃上部癌根治术适应症问题,是否所有进展期胃上部癌根治术患者均能适宜,本次研究基于此进行探讨,为临床诊治提供循证医学依据。
1 资料与方法
1.1 病例来源
前瞻性选择2010年1月至2013年6月118例进展期胃上部癌根治术患者为研究对象,按照住院号单双平均分成2组,对照组59例,男性32例,女性27例;年龄45~79岁,平均(57.9±2.1)岁;肿瘤大小43.4~76.2 mm,平均(53.7±6.7)mm;病理组织学类型:分化型胃癌41例,未分化型胃癌18例;TNM分期:Ⅰ期19例,Ⅱ期26例,Ⅲ期14例;手术类型:根治性全胃切除术55例,近侧胃大部切除术4例。观察组59例,男性30例,女性29例;年龄47~80岁,平均(57.7±2.3)岁;肿瘤大小43.6~76.4 mm,平均(53.9±6.5)mm;病理组织学类型:分化型胃癌43例,未分化型胃癌16例;TNM分期:Ⅰ期21例,Ⅱ期25例,Ⅲ期13例;手术类型:根治性全胃切除术53例,近侧胃大部切除术6例。两组患者在性别、年龄、肿瘤大小、TNM分期、病理类型等方面比较差异无统计学意义(P>0.05)。
纳入标准[3]:术前经内镜下活检证实为胃上部癌;无远处转移;腹主动脉周围无明显肿大淋巴结、无肿瘤侵犯胰腺,脾脏等;术后病理学诊断胃切缘显微镜无癌细胞。
排除标准:术中见肿瘤腹腔播散或远处转移;病理学资料不完善者;未签署知情同意书者。
1.2 治疗方案
观察组行腹腔镜保脾脾门淋巴结清扫术。全身麻醉成功后患者取人字头高脚低15~20度体位,采用五孔法,术者立于患者左侧,助手置于右侧,扶镜手置于患者两腿中间。首先由横结肠上缘无血管区开始分离胃结肠韧带,向左至结肠脾曲,分离脾结肠韧带,充分暴露胰尾、脾下极,用超声刀分离血管表面脂肪和淋巴组织,胰尾处分离胃网膜病结扎,清扫脾门淋巴结。然后按照“从下至上、由右至左”原则分离胃后壁胰腺被膜至胰腺上缘,显露腹腔干、脾动脉近端,胃左动静脉,在根部结扎切断胃左动静脉,清扫7、8、9、11组淋巴结,沿此上缘进入食管裂孔,向左至脾门分离,解剖出脾动静脉,结扎胃后动脉血管,清扫11淋巴结。将胃向右上当倾斜45°并牵拉,用超声刀裸化脾门及血管,结扎胃短血管,彻底清扫脾门前脂肪和淋巴组织,结束手术,关闭创面。
对照组予全胃切除术并脾门淋巴结清扫。术前准备同观察组,采用传统手术入路,逐层暴露,彻底止血,暴露食管并切断,左手触及脾-膈韧带后方后将脾脏托起,切断脾-膈韧带,充分游离脾脏上极,脾窝垫湿沙垫后沿胰腺尾部和脾脏切开,游离周围脂肪和淋巴组织,切断胃-脾韧带并结扎,将脾门淋巴结连同脾脏切除。
术后两组均常规应用抗菌药物预防感染治疗3 d,观察生命体征变化,对出现体温升高、切口周围红肿等进行细菌培养和药敏试验,选择敏感抗菌药物;予奥美拉唑40 mg配0.9%氯化钠注射液250 ml静脉注射,每天一次;予10%葡萄糖注射液500 ml加入维生素C2.0和维生素B60.2补充能量等治疗,糖尿病者禁用。
1.3 观察指标
参考相关文献[4-5],观察两组手术时间、术中出血量、输血例数、首次下床活动时间、肛门排气时间、首次进流质时间、首次进半流质时间、住院时间变化。观察术后1年内相关并发症发生率,如感染、出血等情况。以电话或门诊随访形式观察两组患者在出院前、术后6个月、12个月、18个月、24个月、30个月生存率比较。
1.4 统计学处理

2 结果
2.1 两组围术期相关指标比较
观察组在手术时间、术中出血量、输血、首次进半流质时间、住院时间上显著优于对照组,两组比较差异显著(P<0.05),而在首次下床活动时间、肛门排气时间、首次进流质时间相近,比较无差异性(P>0.05),见表1。
2.2 两组术后并发症比较
对照组术后并发症发生率为18.63%,观察组为8.46%,观察组显著低于对照组,两组比较差异显著(P<0.05),见表2。
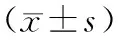
表1 两组围术期相关指标比较

表2 两组术后并发症比较(例,%)
2.3 两组生存期比较
全组无失访,两组出院前、术后6个月、12个月、18个月、24个月、30个月生存率比较无显著差异,无统计学意义(P>0.05),见表3。

表3 两组生存期比较(例,%)
3 讨论
随着临床上对进展性胃上部癌的认识加深,以及外科器械和技术不断发展进步,手术理念逐渐趋向创伤小,恢复快,安全性高,对全身脏器损伤小的手术方式。传统全胃切除术已经不能满足人民需求[6]。脾脏是人体最大外周免疫器官,能参与调节血液、免疫和内分泌运转,其内有大量的免疫细胞,在抗肿瘤免疫上有重要价值,这为保脾肿瘤胃上部癌提供了理论依据[7-8]。腹腔镜下进行保脾脾门淋巴结清扫作为近些年治疗进展期胃上部癌的标准治疗方案,其手术视野明显扩大,超声刀有很好的止血分离作用,术中对胃周筋脉、筋脉间隙、血管和分支等均能显著分辨出来,能全程显露脾血管和各分支,能顺利、高效精准完成对脾动脉旁和脾门淋巴结清扫[9]。结果显示,采用腹腔镜保脾脾门淋巴结清扫在手术时间、术中出血量、首次进半流质时间、住院时间上显著缩短,输血例数明显减少,这说明该术后创伤小,手术切口小,出血量少,加上在并发症上仅为8.46%,未出现胰瘘、残胃无力、肠梗阻等并发症,这说明安全性高。
在手术操作流程上,张广坛[10]、于波等[11]指出采用黄氏三步法,即第一步清扫脾下极区域淋巴结,第二步清扫脾动脉干区域淋巴结,第三步清扫脾上极区域淋巴结,该方式能将原来复杂步骤简单化,而本次研究中采用的是胰后入路方式,即先离断脾胃韧带和胃短血管,游离胰腺下缘等后在清扫淋巴结。Ting-Yu Mou[12]指出,该术式不符合肿瘤整块原则。但笔者认为,此方式能借助韧带进行牵拉,有助于保证手术局部区域张力,且在腹腔镜下视野清晰,对肿瘤能显示清楚,某些程度上也符合整块切除概念。而这点在出院前、术后6个月、12个月、18个月、24个月、30个月生存率上能明显体现出来,和开腹比较,其在生存率上无明显差异性,可见腹腔镜保脾脾门清扫淋巴结对进展期胃上部癌的远期效果是相近的。结合经验和Kosuga[13]、Chen,Rui-Fu[14]报道,该术式强调团队协作性,因脾门位置深在,腹腔镜在左上腹处容易因器械较多产生筷子效应,此时扶镜手可通过旋转光纤和镜头,通过调整角度,获得最佳手术视野。另外,该术式要求对解剖结构清楚,脾门位置深,且质地脆,和毗邻组织器官关系复杂,术中容易出现出血等并发症,且脾门血管解剖变异常见,在临床上术前要完善相关检查,如血管造影并重建,以明确脾血管分布,减少脾门周围组织损伤[15-16]。同时,腹腔镜手术为微创,对手术医师要求高。学习曲线长,笔者认为对初学者可在有经验医师指导下,选择全身情况好、年轻、合并症少、肿瘤体积小等患者积累经验,以降低手术操风险性,增加手术医师信心,从而获得更好成长。
[1] 陈起跃,黄泽宁,黄昌明,等.“黄氏三步法”在进展期胃上部癌腹腔镜保脾脾门淋巴结清扫术中的应用〔J〕.中华消化外科杂志,2015,14(3):187-191.
[2] 李 恩,吴祖光,李志旺,等.腹腔镜与开腹保脾脾门淋巴结清扫在进展期胃中上部癌中的疗效评价〔J〕.新医学,2016,47(7):485-489.
[3] 李 平,黄昌明,林建贤,等.腹腔镜胃中上部癌保脾脾门淋巴结清扫手术时间延长的相关因素分析及其对患者疗效的影响〔J〕.中华消化外科杂志,2016,15(1):58-63.
[4] 张俊榕.346例胃上部癌腹腔镜下保脾的脾门淋巴结清扫术的临床分析〔D〕.福建医科大学,2014.
[5] 陈起跃,黄昌明.进展期胃上部癌腹腔镜保脾脾门淋巴结清扫的价值与策略〔J〕.福建医科大学学报,2015,8(5):294-297.
[6] 孙 轶,梁天伟,韦永成,等.保脾脾门淋巴清扫在进展期近端胃癌根治术中的应用〔J〕.局解手术学杂志,2014,23(1):66-67,68.
[7] 黄昌明,林建贤.腹腔镜胃上部癌保脾手术的脾门区淋巴结清扫技术〔J〕.中华胃肠外科杂志,2012,15(8):784-786.
[8] 徐 彬.胃癌根治术患者保留脾脏的脾门淋巴结清扫疗效观察〔J〕.山东医药,2014,54(33):103-104.
[9] 秦环龙,林超鸿.胃癌根治术保留胰脾功能清除脾门和脾动脉干淋巴结的临床意义〔J〕.中华外科杂志,2011,39(12):904-907.
[10] 张广坛,宋玉成,袁 远,等.手助腹腔镜保脾的脾门淋巴结清扫在胃上部癌根治术中的应用〔J〕.中华普通外科杂志,2013,28(7):546-547.
[11] 丁 波,李 忠,刘元直,等.进展期胃癌根治术中脾门淋巴结清扫的临床意义〔J〕.中国普通外科杂志,2014,23(1):133-135.
[12] Mou TY,Hu YF,Yu J,et al.Laparoscopic splenic hilum l-
ymph node dissection for advanced proximal gastric cancer:A modified approach for pancreas- and spleen-preserving total gastrectomy〔J〕.World J Gastroenterol,2013,19(30):4992-4999.
[13] Kosuga T,Ichikawa D,Okamoto K,et al.Survival benefits from splenic hilar lymph node dissection by splenectomy in gastric cancer patients:relative comparison of the benefits in subgroups of patients.〔J〕.Gastric cancer,2011,14(2):172-177.
[14] Chen RF,Huang CM,Chen QY,et al.Why the Proximal Splenic Artery Approach is the Ideal Approach for Laparoscopic Suprapancreatic Lymph Node Dissection in Advanced Gastric Cancer? A Large-Scale Vascular-Anatomical-Based Study〔J〕.Medicine,2015,94(18):832.
[15] Hasegawa S,Yoshikawa T,Rino Y,et al.Priority of lymph node dissection for siewert type II/III adenocarcinoma of the esophagogastric junction〔J〕.Ann Surg Oncol,2013,20(13):4252-4259.
[16] Wang W,Luo L,Zheng Y,et al.Curettage and aspiration in splenic hilar lymph node dissection for spleen-preserving radical D2 gastrectomy〔J〕.Chin J Cancer Res,2013,25(4):471-473.
