大鼠原代肝星状细胞分离、鉴定及培养方法的研究
2018-03-20乾勇
, , , ,乾勇,
[陆军军医大学(第三军医大学)军事预防医学院营养与食品安全研究中心,重庆市营养与食品安全重点实验室,重庆 400038]
肝是由多种细胞构成,除了肝实质细胞外,还存在大量的非实质细胞,如肝星状细胞(hepatic stellate cell,HSC)、各种免疫细胞(如T细胞、B细胞、自然杀伤细胞、巨噬细胞等)、血管内皮细胞、胆管上皮细胞等[1]。HSC细胞是肝内重要的非实质细胞,不仅是人体维生素A的主要储存场所,而且与多种肝疾病尤其是肝纤维化的发生密切相关[2-3]。在肝纤维化发生过程中,HSC细胞是肝内细胞外基质(extracellular matrix,ECM)的主要来源,其细胞活化、分化和表型转化对于肝纤维化疾病进程、诊断和治疗具有重要意义[4]。由于人体活体肝组织标本来源有限,小动物(特别是小鼠和大鼠)是HSC细胞的主要来源。但是因为肝细胞种类的多样性、HSC细胞数量有限以及HSC细胞分离纯化具有较高的技术要求,获得足够数量的具有良好细胞活力的HSC细胞成为开展相关肝疾病研究的前提条件。大鼠是多种肝疾病研究的重要动物模型,本实验室在既往大鼠原代HSC分离培养方法的基础上[5-8],对灌注、消化、纯化等多个操作步骤进行了进一步的探索和方法优化,建立了稳定、高效的HSC细胞分离方法,获得了数量更多、活力更高、表型稳定的HSC细胞,为肝相关疾病研究奠定了实验基础。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 清洁级SD大鼠12只(12周龄),购自陆军军医大学(第三军医大学)实验动物中心,体质量400~600 g,常规喂养。
1.1.2 主要试剂 Ⅳ型胶原酶(Collagenase Ⅳ)、链蛋白酶(Pronase E)购自美国Sigma公司;DNA聚合酶Ⅰ(DNase Ⅰ)购自美国Roche公司;乙二胺四乙酸(ethylene diamine tetraacetic acid,EGTA)购自美国Sigma公司;Percoll密度梯度离心分离液购自上海前程生物科技有限公司;HBSS缓冲液、台盼蓝染色液购自上海碧云天生物技术公司;HEPES、胰蛋白酶、DMEM 培养液、胎牛血清(fetal bovine serum)为美国Hyclone公司产品;青霉素/链霉素双抗溶液购自Gibco公司;兔抗鼠结蛋白(Desmin)单抗和兔抗鼠平滑肌蛋白(α-SMA)单抗购自美国Abcam公司;FITC标记的羊抗兔IgG二抗购自北京博奥森生物技术有限公司。
1.1.3 主要仪器 注射泵(兰格恒流泵有限公司,LSP01-1A)、倒置相差显微镜(Olympus公司)、倒置荧光显微镜及影像采集系统(Olympus公司)、台式低速水平离心机(Cence湘仪离心机仪器有限公司,L530)、流式细胞仪(BD FACSAria Ⅲ)、酶标仪(美国,SpectraMax M5多功能酶标仪)、CASY快速细胞计数仪(Roche公司)。
1.2 实验方法
1.2.1 试剂配置 消化酶稀释液:500 mL的HBSS缓冲液中添加HEPES 1 190 mg和CaCl2280 mg,混匀,4 ℃保存。EGTA液:500 mL不含Ca2+和Mg2+的HBSS液中添加EGTA 95 mg、HEPES 1 190 mg及1%体积的双抗溶液,混匀,4 ℃保存。Pronase E液:称取28 mg Pronase E,溶解于70 mL消化酶稀释液,现配现用,用前40 ℃预热。Collagenase Ⅳ液:称取40 mg Collagenase Ⅳ,溶解于80 mL消化酶稀释液,现配现用,用前40 ℃预热。Pronase E/Collagenase Ⅳ肝组织体外消化液:称取25 mg Pronase E和25 mg Collagenase Ⅳ溶解于50 mL消化酶稀释液,现配现用。临用前再加入0.5 mL DNase Ⅰ液混匀。GBSS-B离心稀释液:CaCl2225 mg,葡萄糖 991 mg,KCl 370 mg,KH2PO430 mg,MgCl2210 mg,MgSO470 mg,Na2HPO475 mg,NaHCO3227 mg,NaCl 8 g加双蒸水至1 L。过滤除菌待用,4 ℃保存。DNase Ⅰ液:称取20 mg DNase Ⅰ,加入10 mL GBSS-A溶液中,混匀溶液,分装为1 mL/管,-20 ℃保存。密度梯度离心液:9 mL Percoll与1 mL 10倍浓度PBS混匀配制生理浓度的Percoll(Stock Isotonic Percoll),使用前用完全培养基和PBS分别稀释到40%和60%的浓度。HSC细胞完全培养基:高糖DMEM培养基中添加20%胎牛血清、10 mmol/L HEPES及1%双抗。上述液体以pH计调节pH值为7.35~7.4后,0.22 μM除菌过滤器过滤除菌。
1.2.2 肝原位灌注 5%水合氯醛麻醉大鼠(按体质量8 μL/g)并固定在手术板上,75%乙醇消毒大鼠腹部。“工”形打开腹腔,暴露下腔静脉及肝。下腔静脉插管,夹闭上腔静脉,剪开门静脉。分别采用以下3种灌注方式灌入消化液,比较不同灌注方法对于肝细胞消化的效果:①严格控制灌注液体的温度、流速和总灌注量。利用注射泵从下腔静脉灌注预热到40 ℃的EGTA液,匀速灌注(20 mL/min),至肝完全变白,总灌注体积约200 mL;再灌注预热至37 ℃的Pronase E溶液约50 mL,匀速灌注(10 mL/min);进而灌注70 mL Collagenase Ⅳ溶液,匀速灌注(10 mL/min),进行肝原位消化。灌注过程中,需要严格控制灌注液的温度、速度及灌注液总体积,并注意观察是否有渗漏。②灌注液体的温度为室温,不预热,其他操作相同[9]。③采用注射器人工灌注,未使用注射泵,灌注速度非匀速,其他操作相同[10]。
1.2.3 肝组织离体消化 将肝从大鼠腹腔分离,放置于100 mm培养皿中,分别加入5 mL的Pronase E/Collagenase Ⅳ消化液或Collagenase Ⅳ液消化肝组织,比较2种消化方法对HSC细胞分离效果的差异。用眼科剪剪碎肝并用弯头吸管充分吹打分散肝细胞,将不同消化液消化后的肝细胞悬液分别转移到50 mL的离心管中,平板摇床缓慢振荡消化25 min。向锥形瓶内加入4 ℃预冷的完全培养基10 mL以终止消化,混匀后用70 nm筛网将细胞悬液过滤分装于2个50 mL离心管中。
1.2.4 肝星状细胞分离与纯化 将上一步收集的肝细胞悬液于4 ℃、50×g低速离心5 min,收集上清液,并再以4 ℃、580×g离心10 min,小心吸弃大部分上清液,仅留约10 mL并加入120 μL的DNaseⅠ溶液,充分混匀。再加入GBSS-B溶液至50 mL,4 ℃、580×g离心10 min。弃上清,加入120 μL的DNaseⅠ溶液,混匀。取15 mL离心管依次缓慢加入60% Percoll 3 mL、40 % Percoll 3 mL及细胞悬液3 mL。将离心管放于低温水平离心机中,1 380×g离心20 min。离心完毕后,可见离心管中部出现“戒指样”乳白色环状即为HSC细胞。小心吸取中间层HSC细胞至50 mL离心管,用GBSS-B溶液洗涤细胞。4 ℃、580×g离心10 min,加入完全培养基重悬。细胞分离流程如图1所示。采用CASY快速细胞计数仪测定每只大鼠收获的HSC细胞数量,实验至少重复3次,计算平均值。
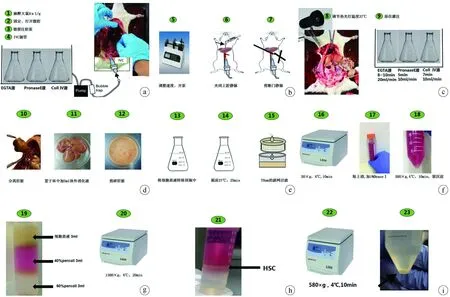
a:下腔静脉插管;b:灌注前准备;c:原位消化;d:分离肝脏;e:体外消化;f:离心和洗涤细胞;g:密度梯度制备及离心;h:吸取中间层HSC;i:离心洗涤细胞
图1大鼠肝星状细胞分离示意图
1.2.5 原代细胞培养及生长状态观察 HSC细胞原代培养:用含20% FBS的DMEM培养基重悬细胞并计数,细胞以4×105/mL接种于50 mL培养瓶中,置于5%CO2、37 ℃、100%饱和湿度的CO2培养箱中培养。36~48 h后更换培养基,改用含10%FBS的DMEM培养液进行培养,以后每2 d更换1次培养液。倒置相差显微镜观察原代HSC细胞形态学变化。台盼蓝拒染实验:吸取40 μL细胞悬液,加入0.4%台盼蓝溶10 μL,混匀后倒置显微镜下未着色者为活细胞,计数活细胞数量。细胞存活率=(光镜下一个视野中活细胞数/视野中细胞总数)×100%。随机选择10个视野,计算细胞存活率并取平均值。CCK-8实验:原代HSC细胞以0.25%胰酶消化液消化后,用DMEM完全培养液稀释细胞悬液至5×104/mL,接种于96孔培养板,每孔100 μL,每天按照每孔10 μL加入CCK-8溶液,孵育1 h,用酶标仪在波长为450 nm测定各孔吸光度值,根据测定结果制做HSC细胞生长曲线。
1.2.6 细胞鉴定 流式细胞术检测细胞纯度:取刚分离的原代HSC细胞,离心后用1 mL PBS重悬细胞,调整细胞浓度为107/mL,于流式细胞仪计数荧光细胞数,并通过流式细胞仪测定HSC细胞纯度,实验至少重复3次,取平均值。免疫荧光细胞化学染色检测细胞纯度:原代HSC细胞以0.25%胰酶消化液消化后,用DMEM完全培养液稀释细胞悬液至5×104/mL,接种于放有爬片的24孔培养板中,培养24 h。吸弃培养基,PBS漂洗3次,用固定液固定10 min后,再用PBS漂洗3次,羊血清封闭30 min;分别加入抗-Desmin或抗-α-SMA一抗工作液,4 ℃孵育过夜。然后,以PBS轻洗细胞3次,每次5 min后,加入FITC标记的羊抗兔IgG二抗工作液,室温孵育60 min。PBS轻洗细胞3次,每次5 min。加入细胞核染液DAPI,室温孵育5 min;PBS轻洗细胞3次,每次5 min,甘油封片。置于荧光显微镜下观察、照相并分析HSC细胞内Desmin和α-SMA的表达情况。根据Desmin阳性细胞数计算细胞纯度,细胞纯度=(结蛋白阳性细胞/细胞总数)×100%,实验至少重复3次,取平均值。
1.3 统计学方法
2 结果
2.1 HSC细胞形态学观察
置于倒置相差显微镜下,观察到新分离的HSC细胞呈圆形,折光性强,悬浮于培养液中(图2a)。24 h后大部分细胞已贴壁,呈扁圆型,内含光亮的脂滴,少量细胞已开始伸展(图2b);培养7 d后,HSC细胞已充分展开,体积明显增大,细胞呈典型的星形或多边形;细胞内颗粒明显减少,细胞逐渐融合,增殖速度加快,并呈局灶性生长,呈完全活化状态(图2c);传代后,HSC细胞体积逐渐变大,成纤维化发展,单层生长,铺满瓶底,细胞呈典型的成纤维细胞样形态(图2d)。HSC细胞在培养过程中,其形态发生明显改变,即由静息状态向活化的肌成纤维细胞样转化。
2.2 HSC细胞生长曲线
根据CCK-8实验结果制作HSC细胞生长曲线(图3),结果表明,在接种后至第3天,细胞生长较缓慢,逐渐贴附于培养瓶底并伸展开;从第3天起,细胞进入指数生长期,细胞数量迅速增加;至第9天,细胞生长进入平台期;至第11天后细胞生长逐渐减慢。

a:刚分离的原代HSC细胞;b:原代HSC细胞培养24 h;c:原代HSC细胞培养7 d;d:原代HSC细胞传代培养第1代
图2倒置相差显微镜观察原代培养的大鼠HSC细胞(×200)

图3 原代HSC细胞生长曲线
2.3 不同灌注和分离方法的比较
采用3种不同灌注方法分离肝HSC细胞并比较细胞收获数量,结果显示,采用严格控制灌注液体的温度和流速,分离得到的大鼠HSC细胞数量最多,采用Pronase E/Collagenase Ⅳ联合消化液(联合组)每只大鼠约收获(2.1±0.2)×107个,而采用Collagenase Ⅳ消化液(单独组)每只大鼠约收获(1.7±0.2)×107个,均分别显著高于采用相同消化方法条件下的其他两种灌注方法(不控制温度/控流、控温/不控制流速),差异具有统计学意义(P<0.05),见表1。同时,在控温/控流速条件下,使用Pronase E/Collagenase Ⅳ联合消化液和单独使用Collagenase Ⅳ消化液相比,前者收获的HSC细胞更多,差异具有统计学意义(P<0.05)。
分离的HSC细胞经台盼蓝染色,结果显示,采用控温/控流速的灌注方法,在使用Pronase E/Collagenase Ⅳ联合消化液条件下获得的HSC细胞存活率和使用Collagenase Ⅳ消化液条件下获得的HSC细胞存活率,均分别显著高于采用相同消化方法条件下的其他两种灌注方式,差异具有统计学意义(P<0.05),见表1。利用流式细胞仪检测新鲜分离的HSC细胞在荧光显微镜下(405 nm)能自发出蓝色荧光的细胞数(图4a),比较不同灌注和消化方法得到的细胞纯度的差异。结果显示:采用控温/控流速的灌注方法,在使用Pronase E/Collagenase Ⅳ联合消化液条件下收获的HSC细胞纯度显著高于相同消化方法条件下的其他两种灌注方式,差异具有统计学意义(P<0.05)。以上结果表明,严格控制灌注液体的温度、流速和灌注量(即控温、控流、控时)的方式分离HSC细胞,以及采用Pronase E/Collagenase Ⅳ联合消化液,获得的HSC细胞数量更多,且HSC细胞存活率和纯度也显著提高。
2.4 HSC细胞鉴定
2.4.1 流式细胞仪鉴定HSC细胞 HSC细胞具有自发荧光特性,能够在405 nm波长的激发光下发出极易淬灭的蓝色荧光。利用此自发荧光特性,检测经流式细胞仪分选收获的HSC细胞,发现具有自发荧光特性的细胞所占比例为96.3%(图4b);将分选的细胞在荧光显微镜下观察,可见HSC细胞(图4c)。结果表明,通过前述方法分离的细胞为HSC细胞,并且具有较高细胞纯度。
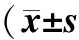
表1 不同灌注和消化方法对分离原代HSC细胞的收获数量、存活率和纯度的影响)
a:与相同消化方法不控制温度/控流速比较,P<0.05;b:与相同消化方法下控温/不控制流速比较,P<0.05;c:与同灌注方法下,单独组比较,P<0.05

a:流式细胞分选后光镜下观察HSC细胞(×100);b:流式细胞仪测定自发荧光细胞比例;c:流式细胞分选后荧光显微镜下见HSC细胞(×100)
图4流式细胞仪鉴定分离的原代HSC细胞
2.4.2 免疫荧光细胞化学染色鉴定HSC细胞 如图5所示,将HSC细胞进行免疫荧光细胞化学染色,结果显示,刚分离的HSC细胞Desmin表达呈阳性,α-SMA表达呈阴性(图5a、e)。传代培养的HSC细胞,α-SMA和Desmin染色均呈阳性(图5b、c、e、f)。根据HSC细胞的表型特征,证实分离获得的细胞为HSC细胞。
3 讨论
肝细胞由实质细胞和非实质细胞组成。在各种非实质细胞中,HSC细胞具有重要的生物学作用,与多种肝疾病特别是肝纤维化发生密切相关[11-12]。HSC细胞是肝内ECM的主要来源,对维持肝内微环境的动态平衡有重要作用,因此在肝纤维化发生中起核心作用[13]。因此,肝纤维化研究通常以HSC细胞作为研究对象,探讨其在肝纤维化发生中的作用机制,并寻找有效的防治方法。原代HSC细胞主要来源于实验动物的肝,获得足够的高纯度的HSC是顺利开展肝纤维化相关研究的重要保证。因此,建立稳定、高效、经济、可靠的HSC分离、培养技术,对研究肝疾病特别是肝纤维化具有重要意义。

a:原代培养2 d α-SMA表达(×200);b:传代培养第2代α-SMA的表达(×200);c:传代培养第2代α-SMA的表达(×630);d:原代培养2 d Desmin表达(×200);e:传代培养第2代Desmin的表达(×200);f:传代培养第2代Desmin的表达(×630)
图5免疫荧光细胞化学染色显示大鼠HSC细胞Desmin和α-SMA的表达
HSC细胞位于肝的Disse间隙内,在正常肝组织中,占肝细胞总数的5%~15%[14]。在正常肝内,HSC细胞被认为处于静息状态。此时HSCs细胞胞质富含维生素A和脂质小滴,储备着人体80%左右的维生素A,高表达GFAP、Desmin等蛋白。当各种因素如病毒感染、炎症因子等刺激下,HSC细胞可由静息型转化为活化型表型,且胞质内维生素A逐渐丢失,高表达α-SMA,同时其具有收缩和分泌胶原的特性,能产生大量ECM[15-17]。HSC细胞的分离在国外最早始于1876年[18],但其分离的细胞得率和纯度均较低。我国到90年代开始探索HSC的分离方法,但不同实验室采用的分离方法在纯度、得率、存活率等方面均有不同程度的欠缺[7,10,19-21]。本实验室长期开展肝相关疾病的研究,在既往大鼠原代HSC分离培养方法的基础上,对灌注、消化、纯化等多个操作步骤进行了进一步的探索和方法优化,建立了稳定、高效的HSC细胞分离方法,获得了数量更多、活力更高、表型稳定的HSC细胞,为肝相关疾病研究奠定了实验基础[22-23]。
为提高HSC细胞的收获数量和纯度,我们率先采用控温、控流、控时的肝逆向两步酶灌流法进行原位组织消化;进而用Percoll密度梯度离心分离纯化HSC细胞;最后采用流式自荧光分选大大提高了细胞纯度。本实验改良了大鼠HSC的分离方法,具体技术要点改进如下:①采用控温、控流、控时的肝逆向两步酶灌流法大大提高了可重复性和细胞收获数量。由于温度对酶的活性影响较大,对灌注的液体温度严格控制在37 ℃,可以大大减少温度变化对酶活力的影响,维持酶的最大消化效果[7]。②在灌注的不同阶段,对灌注液体速度进行了严格控制。灌注EGTA液时要求压力高、速度快,有利于快速冲洗出肝中的血液及其他杂质;而灌注胶原酶时,需要酶液和肝充分接触。因此,采用注射泵严格控制灌流速度,灵活控制酶与肝组织的接触时间,通过多次探索确定了最优化的灌注参数,从而达到更好的消化效果。③严格控制灌注时间,防止过度消化,提高细胞活力。④密度梯度介质的选择及密度梯度离心体系的建立是纯化HSC细胞、提高HSC细胞收获数量和细胞纯度的重要步骤。本研究选用Precoll密度离心液,与其他文献中使用的密度梯度离心材料(如Optiprep[10]、Nycodenz[24]梯度离心分离液等)相比,Precoll具有相对更多的优点。Precoll是一种被乙烯吡咯烷酮包被的硅胶颗粒,无毒性,能形成连续梯度和不连续的两种梯度。梯度的稳定性意味着可以实现混合细胞中不同细胞种类的有效分层。而且Percoll很容易从被纯化细胞中去除,不影响被分离细胞进一步的研究[25]。另外,选择水平低温离心机及正确的离心转数也非常重要,梯度离心时将离心机调节为无刹车状态更加利于形成梯度离心后的细胞分层。⑤采用流式细胞仪鉴定和纯化细胞,根据HSC细胞表型分选HSC细胞,可以有效提高HSC细胞纯度。
本实验通过对大鼠HSC细胞分离、纯化、鉴定等方法进行了改进,建立了较稳定的大鼠HSC细胞分离和培养方法,为进一步开展针对HSC细胞的相关研究奠定了基础,该分离培养方法值得推广和应用。
[1] 俞富祥,苏龙丰,季世强,等.改良小鼠肝星状细胞的分离、培养及性质鉴定[J].肝胆胰外科杂志,2010,22(6):457-459.doi:10.396/j.issn.1007-1954.2010.06.006.
[2] Tang G,Weng Z,Song J,et al.Reversal effect of Jagged1 signaling inhibition on CCl4-induced hepatic fibrosis in rats[J].Oncotarget,2017,8(37):60778-60788.doi.10.18632/oncotarget.18484.
[3] Puche JE,Saiman Y,Friedman SL.Hepatic stellate cells and liver fibrosis[J].Compr Physiol,2013,3(4):1473-1492.doi.10.1002/cphy.c120035.
[4] Zhang CY,Yuan WG,He P,et al.Liver fibrosis and hepatic stellate cells:Etiology,pathological hallmarks and therapeutic targets[J].World J Gastroenterol,2016,22(48):10512-10522.doi.10.3748/wjg.v22.i48.10512.
[5] 李玉莲,宋正己,范 红,等.建立一种改良方法分离大鼠肝星状细胞[J].昆明医科大学学报,2012,33(6):18-20.doi:10.396/j.issn.1003-4706.2012.06.005.
[6] 赛 雪,何 兴,潘卫庆.日本血吸虫感染小鼠肝星状细胞的分离[J].中国热带医学,2013,13(8):915-917.doi:10.13604/j.cnki.46-1064/r.2013.08.031.
[7] Mederacke I,Dapito DH,Affò S,et al.High-yield and high-purity isolation of hepatic stellate cells from normal and fibrotic mouse livers[J].Nature Protocols,2015,10(2):305-315.doi.10.1038/nprot.2015.017.
[8] Maschmeyer P,Flach M,Winau F.Seven steps to stellate cells[J].J Vis Exp,2011(51):e2710.doi.10.3791/2710.
[9] 蔡伟祥,方建凤,庄 伟,等.分离、鉴定与培养大鼠肝细胞、肝星状细胞和Kupffer细胞[J].温州医科大学学报,2016,46(9):638-643.doi:10.3969/j.issn.2095-9400.2016.09.004.
[10] 戴春蕾,陈少隆,陈黎黎,等.Optiprep梯度离心法提取大鼠肝星状细胞的研究[J].医学研究杂志,2013,42(1):142-144.doi:10.3969/j.issn.1673-548x.2013.01.044.
[11] Moran-Salvador E,Mann J.Epigenetics and Liver Fibrosis[J].Cell Mol Gastroenterol Hepatol,2017,4(1):125-134.doi.10.1016/j.jcmgh.2017.04.007.
[12] 毕晓娟,张传山,李 亮,等.转化生长因子β1刺激改良培养小鼠原代肝星状细胞的活化[J].中国组织工程研究,2015,19(51):8234-8240.
[13] Huang Y,Deng X,Liang J.Modulation of hepatic stellate cells and reversibility of hepatic fibrosis[J].Exp Cell Res,2017,352(2):420-426.doi.10.1016/j.yexcr.2017.02.038.
[14] 李 洋,蔡双明,张莉莉,等.大鼠原代肝细胞、星状细胞、枯否细胞和肝窦内皮细胞的同步分离与培养[J].南方医科大学学报,2014,34(4):532-537.doi:10.3969/j.issn.1673-4254.2014.04.020.
[15] de Oliveira DSB,Ramos LF,Moraes K.Molecular interplays in hepatic stellate cells:apoptosis,senescence,and phenotype reversion as cellular connections that modulate liver fibrosis[J].Cell Biol Int,2017,9(41):946-959.doi.10.1002/cbin.10790.
[16] Li M,Hong W,Hao C,et al.SIRT1 antagonizes liver fibrosis by blocking hepatic stellate cell activation in mice[J].FASEB J,2017,10(31):1-12.doi.10.1096/fj.201700612R.
[17] Senoo H,Mezaki Y,Fujiwara M.The stellate cell system(vitamin A-storing cell system)[J].Anat Sci Int,2017,92(4):387-455.doi.10.1007/s12565-017-0395-9.
[18] Friedman SL,Roll FJ.Isolation and culture of hepatic lipocytes,Kupffer cells,and sinusoidal endothelial cells by density gradient centrifugation with Stractan[J].Anal Biochem,1987,161(1):207-218.
[19] Panebianco C,Oben JA,Vinciguerra M,et al.Senescence in hepatic stellate cells as a mechanism of liver fibrosis reversal:a putative synergy between retinoic acid and PPAR-gamma signalings[J].Clin Exp Med,2017,17(3):269-280.doi:10.1007/s10238-016-0438-x.
[20] 李海媛,王 雪,时永全,等.建立同时分离培养小鼠肝细胞及肝星状细胞的技术[J].现代生物医学进展,2014,14(16):3033-3037.doi:10.1324/j.cnki.pmb.2014.16.009.
[21] 刘 幸,田 甜,余 蕾,等.辛二酰苯胺异羟肟酸诱导大鼠原代肝星状细胞凋亡[J].中国病理生理杂志,2017,33(5):913-918.
[22] Shi L,Zhang T,Liang X,et al.Dihydromyricetin improves skeletal muscle insulin resistance by inducing autophagy via the AMPK signaling pathway[J].Mol Cell Endocrinol,2015,409:92-102.doi.10.1016/j.mce.2015.03.009.
[23] Shi L,Zhang T,Zhou Y,et al.Dihydromyricetin improves skeletal muscle insulin sensitivity by inducing autophagy via the AMPK-PGC-1alpha-Sirt3 signaling pathway[J].Endocrine,2015,50(2):378-389.doi:10.1007/s12020-015-0599-5.
[24] Zhu YJ,Hu XL,Men RT,et al.Role of macrophage migration inhibitory factor in hepatic stellate cells activation[J].Sichuan Da Xue Xue Bao Yi Xue Ban,2013,44(3):352-356.
[25] 朱永军,胡晓琳,门若庭,等.巨噬细胞游走抑制因子参与肝星状细胞活化的实验研究[J].四川大学学报(医学版),2013,44(3):352-356.
