奶牛脐带间充质干细胞介导PI3K/Akt/mTOR信号通路对乳腺上皮细胞凋亡调控研究
2018-03-20王立文赵艳坤
王立文,余 雄,赵艳坤,李 杨,邵 伟
(新疆农业大学动物科学学院,新疆肉乳用草食动物营养实验室,新疆乌鲁木齐 830052)
本课题组研究发现,将间充质干细胞应用到畜牧生产能够显著促进动物体的生长发育,提高机体免疫能力[1],可修复乳腺炎模型大鼠的乳腺组织,促进乳腺组织形态发育[2],具有非常重要的作用。磷脂酰肌醇3-激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白(PI3K/Akt/mTOR)信号通路是机体内一条重要的信号通路,参与多种细胞生物学过程,包括转录、翻译、代谢、血管生成、细胞周期以及细胞增殖、凋亡等,由于具有多种生物学作用,已经被应用到生理学、细胞学、临床医学、生物化学、组织遗传学等方面并取得了一定的进展[3]。研究发现,PI3K/Akt/mTOR信号通路是调节细胞增殖、分化和调亡的重要信号转导通路。AKT可调控多个与细胞凋亡有关的家族从而抑制细胞凋亡[4],例如可抑制Forkhead家族转录因子的活性,下调Fas/FasL诱导的凋亡过程;抑制前凋亡蛋白BAD及caspase-9的活性,阻止其促凋亡作用[5]。间充质干细胞能够通过自分泌和旁分泌作用分泌一些细胞因子,作用于一些相关的受体,可将质膜上PIP2磷酸化为PIP3,从而激活PI3K/Akt/mTOR信号通路[6]。研究发现,IGF-1等生长因子可激活 PI3K/Akt信号,下游效应蛋白mTORC1 / S6K1 能促进成骨细胞分化[7],并抑制其凋亡[8]。
目前认为PI3K/Akt/mTOR信号通路的上游刺激因子主要有4类,即生长因子与胰岛素、营养因子、能量以及压力[9]。众所周知,脐带间充质干细胞(Umbilical Cord Mesenchymal Stem Cells,UC-MSCs)可以分泌多种细胞活性因子,这些因子可以激活相关信号通路参与细胞生活动的调控。本研究首次利用UC-MSCs独特的生物学特性,研究是否可以通过PI3K/Akt/mTOR信号通路调控乳腺上皮细胞(Bovine Mammary Gland Epithelial Cells,BMECs)的凋亡,为在细胞和分子水平上寻求泌乳生物学与乳腺功能调控的新方法、新途径奠定理论基础。
1 材料与方法
1.1 实验材料
1.1.1 细胞来源 奶牛UC-MSCs来自于本实验室培养鉴定的荷斯坦奶牛[10],奶牛BMECs购自于广州吉尼欧公司(MEC,GZ/JNO-2015)。
1.1.2 主要仪器和试剂 台式低速离心机(湘仪,TD5A-WS);流式细胞仪(美国BD,Becton Dickinson Facscalibour); 倒 置 显 微 镜( 日 本,Motic-AE31);洁净工作台(上海博讯,SW-CJ-1F);二氧化碳培养箱(上海博讯,HF151UV);H-DMEM、胎牛血清(美国,Gibco);MTT、0.01% PBS、0.25%胰蛋白酶+EDTA(美国,Hyclone);LY294002、Ra-Pamycin(美国,Gene Operation);FITC-Annexin V(宝灵曼公司)。
1.2 实验分组及设计 将复苏后的P3代生长状态良好的BMECs细胞和培养至 P3 代的UC-MSCs分别按照1:2的比例接种于培养瓶内培养,细胞总数为1×106/瓶,设单纯 UC-MSCs和单纯BMECs对照组,细胞总数为1×106/瓶。将BMECs细胞分别接种于4个培养瓶中,每个培养瓶接种6.7×105个细胞,随机选取其中2个培养瓶,在培养液中加入LY294002(50 µmol/mL),另外2个培养液内加入RAPA(50 nmol/mL),作用48 h,倒掉4个培养瓶内的培养液,用PBS冲洗2次,然后随机选取1个加入LY294002的培养瓶和1个加入RAPA的培养瓶,分别接种3.3×105个UCMSCs,4个培养瓶内均加入5 mL完全培养基。7个试验组分别为UC-MSCs组、BMECs组、共培养组、BMECs+LY294002组、BMECs+RAPA组、 共 培 养+LY294002组、共培养+RAPA组。均放置于37℃、5%CO2细胞培养箱内常规培养。
1.3 细胞凋亡检测 悬浮细胞直接收集到10 mL的离心管中,每样本细胞数为(1~5)×106/mL,500~1 000 r/min离心5 min,弃去培养液,用孵育缓冲液洗涤1次,500~1 000 r/min离心5 min,用100 μL的标记溶液重悬细胞,室温下避光孵育 10~15 min,500~1 000 r/min 离心5 min 沉淀细胞孵育缓冲液洗1次,加入荧光(SAFLOUS)溶液4℃下孵育20 min,避光并不时振动,流式细胞仪分析:流式细胞仪激发光波长用488 nm,用一波长为515 nm的通带滤器检测FITC荧光,另一波长大于560 nm的滤器检测PI。
1.4 统计分析 实验数据以平均值±标准差表示,使用SPSS 16.0软件进行统计学分析,组间比较采用单因素方差分析,用Duncan's进行多重比较,P<0.05表示差异有统计学意义。
2 结果与分析
2.1 PI3K/Akt/mTOR信号通路对BMECs凋亡的调控作用 应用Annexin V/PI双染法联合流式细胞仪检测各组细胞在72 h时的凋亡情况(每个试验组重复3次,取平均值)。如表1所示,BMECS+LY294002组和BMECS+RAPA组的细胞凋亡率极显著高于BMECs组(P<0.01),说明当抑制剂阻断 PI3K/Akt/mTOR信号通路时BMECs细胞凋亡率增加。

表1 抑制剂对BMECs凋亡的影响(n=3) %
2.2 UC-MSCs对PI3K/Akt/mTOR信号通路调控BMECs的影响 如表2所示,BMECs+LY294002组和BMECs+RAPA组的细胞凋亡率极显著高于BMECs组和共培养组(P<0.01);BMECs+LY294002组的细胞凋亡率极显著高于共培养+LY294002组(P<0.01);BMECs+RAPA组的细胞凋亡率极显著高于共培养+RAPA组(P<0.01),说明与UC-MSCs共培养能够降低抑制剂对BMECs凋亡的影响。
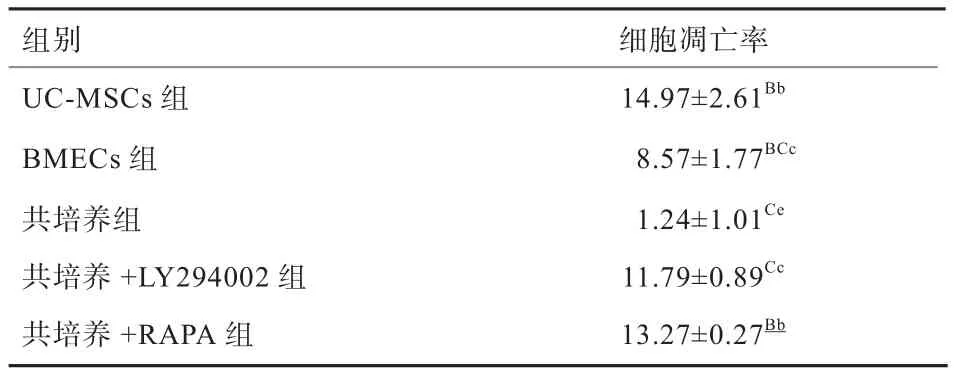
表2 Annexin V/PI双染法检测各组细胞凋亡率(n=3) %
应用Annexin V/PI双染法联合流式细胞仪检测各组细胞在72 h时的凋亡结果显示(图1),细胞分群明显,明显分开于4个象限中,说明用Annexin V/PI双染法联合流式细胞仪检测各组细胞在72 h时的凋亡情况操作正确,结果可靠。
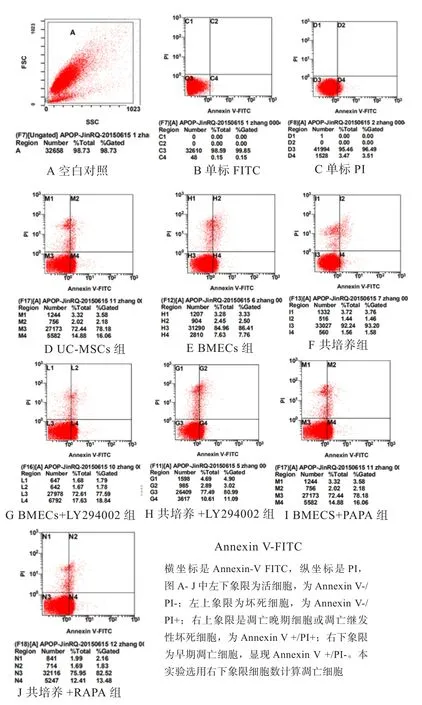
图1 流式细胞术检测各组细胞凋亡情况
3 讨 论
3.1 UC-MSCs和BMECs共培养抑制BMECs凋亡 在本实验中,将UC-MSCs和BMECs按照 1:2 浓度比混合共培养后,能够明显抑制BMECs细胞凋亡,说明UC-MSCs和BMECs共培养能够抑制BMECs凋亡。研究表明,细胞凋亡普遍存在于机体细胞中,受多种因素调控,如激素和生长因子失衡,高温、强酸、强碱等理化因素,抗癌药物,免疫性因素,细菌、病毒等微生物学因素[11]。凋亡的抑制因素包括IL-2、神经生长因子等细胞因子、某些激素、某些二价金属阳离子、药物等[12]。研究表明,UC-MSCs能够抑制肿瘤坏死因子的分泌,而肿瘤坏死因子能诱导某些正常细胞凋亡,当机体处于炎症等多种病理状态下,体内肿瘤坏死因子合成和分泌增加,诱导细胞凋亡[13]。本实验结果表明,与UC-MSCs共培养能够抑制BMECs细胞凋亡,推测主要原因为UC-MSCs抑制了肿瘤坏死因子等促进细胞凋亡的生长因子的分泌,后期将进一步实验证实。
3.2 UC-MSCs细胞通过激活PI3K/Akt/mTOR信号通路抑制BMECs凋亡 本实验中,将UC-MSCs和BMECs按照1:2的比例共培养,能够抑制BMECs凋亡,但其作用机制尚不明确。为探究UC-MSCs抑制BMECs凋亡的具体机制,探讨了PI3K/Akt/mTOR信号通路在其中所发挥作用。PI3K和Akt是抗细胞凋亡作用的重要调节因子,在调节多种细胞增殖、抑制细胞凋亡中发挥作用[14]。PI3K被激活后,可把底物PIP2转化为PIP3,PIP3作为第二信使激活信号通路下游的众多信号分子,可参与细胞的增殖、分化凋亡、存活和迁移等的信号传递[15]。Akt可调控多个与细胞凋亡有关的家族从而抑制细胞凋亡,例如可抑制Forkhead家族转录因子的活性,下调Fas/FasL诱导的凋亡过程[16];抑制前凋亡蛋白BAD及caspase-9的活性,阻止其促凋亡作用[17];正调节转录核因子NF-κB和bcl-2,从而抑制细胞凋亡[18];上调IAPs(Inhibitor of Apoptosis Proteins,IAPs)的表达,发挥其抑凋亡作用[19];也能通过磷酸化mTOR及其下游分子p70S6K、4E-BP1下传生存信号,抑制不依赖p53的细胞凋亡,促进细胞生存[20]。因此,可以推测UC-MSCs可能通过旁分泌和自分泌作用分泌的细胞因子,激活PI3K/Akt/mTOR信号通路,从而调控BMECs的凋亡。而PI3K和mTOR属于PI3K/Akt/mTOR信号通路上、下游信号分子,为了验证上述推测,本实验设计用PI3K抑制剂LY294002和mTOR抑制剂RAPA孵育细胞,发现加入抑制剂LY294002和RAPA后,BMECs组凋亡率均显著高于抑制剂处理前,说明PI3K/Akt/mTOR可能参与BMECs凋亡的抑制调控过程。值得一提的是,BMECs与UCMSCs共培养再加入PI3K抑制剂LY294002后凋亡率降低到5.79%,加入mTOR抑制剂RAPA的组凋亡率降低到5.87%,说明UC-MSCs不仅能够激活PI3K,活化下游信号通路,同时能够重新活化mTOR,即UCMSCs能够再次激活被阻断的PI3K/Akt/mTOR信号通路,或者可以说,UC-MSCs能够“修复”PI3K/Akt/mTOR信号通路,抑制BMECs凋亡,使其重新参与到细胞的正常生命活动中去。
4 结 论
将UC-MSCs和BMECs按照1:2浓度比混合共培养,能够抑制BMECs细胞凋亡,PI3K抑制剂LY294002和mTOR抑制剂RAPA孵育BMECs显著提高了BMECs细胞凋亡率,与UC-MSCs共培养能够消减抑制作用。
[1] 邵伟. 静脉注射脐带间充质干细胞对哈萨克羔羊生长发育及血清生化指标的影响[D]. 乌鲁木齐: 新疆农业大学, 2012.
[2] 古再丽努尔·艾麦提. 不同生长发育阶段两种途径移植骨髓间充质干细胞对大鼠乳腺发育的影响[D]. 乌鲁木齐: 新疆农业大学, 2013.
[3] 陈旭晓, 陈拥军. 磷脂酰肌醇-3激酶/蛋白激酶B/哺乳动物雷帕霉素靶蛋白信号通路在肝胆恶性肿瘤发生发展中的作用[J]. 临床肝胆病杂志, 2015, 31(6): 989-991.
[4] Yap T A, Garrett M D, Walton M I,et al. Targeting the PI3KAKT-mTOR pathway: progress, pitfalls, and promises[J]. Curr Opin Pharmacol, 2008, 8(4):393-412.
[5] Jiri P, Filip J. Molecular targets for cancer therapy in the PI3K/Akt/mTOR pathway[J]. Pharmacol Therapeut, 2014, 142(2):164-175.
[6] Gu Y X, Du J, Si M S,et al. The roles of PI3K/Akt signaling pathway in regulating MC3T3-E1 preosteoblast proliferation and differentiation on SLA and SLActive titanium surfaces[J]. J Biomed Mater Res A, 2013, 101A(3): 748-754.
[7] Ximeng L, Bruxvoort K J, Zylstra C R,et al. Lifelong accumulation of bone in mice lacking PTEN in osteoblasts[J]. P Natl Acad Sci USA, 2007, 104(7): 2259-2264.
[8] Buitenhuis M, Coffer P J. The role of the PI3K-PKB signaling module in regulation of hematopoiesis[J]. Cell Cycle, 2009,8(4): 560-566.
[9] 王立文, 邵伟, 赵艳坤, 等. 奶牛脐带间充质干细胞的体外培养与鉴定[J]. 新疆农业科学, 2014, 51(11): 2099-2104.
[10] 王立文, 邵伟, 赵艳坤, 等. 奶牛脐带间充质干细胞的体外培养与鉴定[J]. 新疆农业科学, 2014, 51(11): 2099-2104.
[11] Yin X M. Bid, a critical mediator for apoptosis induced by the activation of Fas/TNF-R1 death receptors in hepatocytes[J]. J Mol Med, 2000, 78 (4): 203-211.
[12] Kitajima I, Soejima Y, Takasaki I,et al. Ceramide-induced nuclear translocation of NF-kappa B is a potential mediator of the apoptotic response to TNF-alpha in murine clonal osteoblasts[J]. Bone, 1996, 19 (3): 263-270.
[13] Volbracht C, Leist M, Kolb S A,et al. Apoptosis in caspase inhibited neurons[J]. Mol Med, 2001, 7(1): 36-48.
[14] Hennessy B T, Smith D L, Ram P T,et al. Exploiting the PI3K/AKT pathway for cancer drug discovery[J]. Nat Rev Drug Discov, 2005, 4(12): 988.
[15] Carnero A, Blancoaparicio C, Renner O,et al. The PTEN/PI3K/AKT signalling pathway in cancer, therapeutic implications[J].Curr Cancer Drug Tar, 2008, 8(3): 187.
[16] Seongmi P, Ramnarain D B, Hatanpaa K J,et al. The death domain-containing kinase RIP1 regulates p27(Kip1) levels through the PI3K-AKT-forkhead pathway[J]. Embo Reports,2008, 9(8): 766-773.
[17] Wong W R, Chen Y Y, Yang S M,et al. Phosphorylation of PI3K/Akt and MAPK/ERK in an early entry step of enterovirus 71[J]. Life Sci, 2005, 78(1): 82-90.
[18] Yin D, Woodruff M, Zhang Y,et al. Morphine promotes Jurkat cell apoptosis through pro-apoptotic FADD/P53 and antiapoptotic PI3K/Akt/NF-kappaB pathways[J]. J Neuroimmunol,2006, 174(1-2): 101-107.
[19] Hu R, Li J, Liu Z,et al. GDC-0152 induces apoptosis through down regulation of IAPs in human leukemia cells and inhibition of PI3K/AKT signaling pathway[J].Tumor Biol, 2014, 36(2):1-8.
[20] Trigka E A, Levidou G, Saetta A A,et al. A detailed immunohistochemical analysis of the PI3K/Akt/mTOR pathway in lung cancer: correlation with PIK3CA, AKT1,K-RAS or PTEN mutational status and clinicopathological features[J]. Oncol Rep, 2013, 30(2): 623-636.
