microRNA-31对胃癌细胞系AGS迁移的影响
2018-03-20孙玉成金恩鸿
孙玉成 金恩鸿
(延边大学附属医院普外一科,吉林 延吉 133000)
胃癌早期很难被发现,发展到晚期时有较高的转移率,这也是胃癌死亡率高的重要原因之一〔1〕。文献报道,胃癌的发生主要是由遗传和环境等多因素所致〔2〕。microRNA(miRNA)是由内源基因转录的约22个核苷酸的非编码单链RNA,在基因组中高度保守且在基因表达的调节过程中具有组织特异性和时间性〔3〕。目前发现的miRNAs与人类肿瘤的形成及发生发展密切相关〔4〕。研究报道microRNA(miR)-31通过抑制TIAM1促进结肠癌细胞的侵袭和转移〔5〕。在乳腺癌细胞中,miR-31通过靶向特异AT序列结合蛋白(SATB)2基因抑制乳腺癌的迁移和浸润〔6〕。然而,MiR-31对胃癌细胞迁移的作用未见报道。本研究采用实时定量(qRT)-PCR检测miR-31在胃癌组织中的表达水平,并通过体外实验验证miR-31对胃癌细胞系AGS迁移的影响。
1 材料和方法
1.1主要试剂和仪器 qRT-PCR试剂盒购自瑞士ROCHE公司,逆转录试剂盒购自北京全式金(TRANSGENE)公司,RNA裂解液Trizol Reagent购自日本TaKaRa公司,RPMI1640培养液、胎牛血清、青霉素和链霉素购自美国Gibco公司,Lipofectamine2000转染试剂购自美国Invitrogen公司,Transwell小室购自美国Corning Costar公司。MiR-31模拟物(miR-31mimics)购自广州锐博生物公司。紫外可见分光光度计、倒置荧光显微镜及照相机、BioRad CFX-96型号的PCR仪、生物安全柜和二氧化碳培养箱〔MCO-18AIC(UV)〕等,分别购于德国eppendorf公司、日本OLYMPUS公司和尼康公司、美国BIO-RAD公司、江苏净化和日本三洋公司等。
1.2细胞培养和转染 胃上皮细胞系GES-1、胃腺癌细胞系AGS、SGC7901、MGC、BGC、HGC均购于中国科学院上海细胞库,其中人胃癌细胞HGC是未分化的胃腺癌细胞系。细胞培养于10%胎牛血清(FBS)的RPMI1640培养液中,放入37℃、5%CO2培养箱中培养。取对数期细胞按3×105个/孔铺6孔板,24 h后进行瞬时转染,转染体系按照Lipofectamine2000的说明制备转染液,将转染miR-31mimics组设为实验组,未经处理的胃癌细胞组设为对照组,对照组成分为转染试剂和广州锐博生物公司合成的无义RNA片段。加入转染液后6 h对细胞换液处理,转染48 h后进行下一步处理。
1.3胃癌组织样本 收集2015年1~12月延边大学附属医院胃肠外科胃癌患者27例的胃癌组织和对应的正常组织,液氮保存。18例术前经过化疗和放射治疗,未经过治疗的有9例。男15例,女12例,年龄27~63岁,平均(42.70±9.05)岁。肿瘤组织样本的收集均经过患者的同意且肿瘤组织样本切片均已经过病理学证实。
1.4RNA的提取定量 采用RNA裂解液Trizol Reagent裂解细胞,按照Trizol提取总RNA的说明书提取胃癌组织和对应正常组织中总RNA。体外培养GES-1、AGS、SGC7901、MGC、BGC、HGC 6种细胞系,待细胞生长至对数期时提取细胞系中的总RNA。用TE做标准体进行定量,测定得总RNA的浓度,-80℃保存。
1.5逆转录反应 将上述提取的总RNA吸取2.0 μg,按照逆转录试剂盒说明书先将RNA逆转录为cDNA(42℃ 30 min,85℃ 5 min),逆转录反应体系:2×TS Reaction Mix 10.0 μl,TransScript RT/RI Enzyme Mix 1.0 μl,Oligo(dT)1.0 μl,总RNA 2.0 μg,RNase-free Water补足至20.0 μl。
1.6qRT-PCR反应 采用茎环法测量miRNA的相对表达量,所用引物购自广州锐博生物科技有限公司,检测组织样本中GES-1、AGS、SGC7901、MGC、BGC、HGC中miR-31的表达量。将上述cDNA进行50倍稀释,采用ROCHE相对定量试剂盒进行目的基因的定量。通过ct值进行相对定量的计算。qRT-PCR主要体系:反应体系SYBR Premix EX TapⅡ10 μl,Primer mix 2.0 μl,cDNA 2.0 μl,ddH2O 6 μl。
1.7细胞划痕实验 在未接种细胞的培养板后面做好标记,转染48 h后细胞均匀铺满整个12孔板,待细胞长满板底后,用已灭菌的尺子和10 μl枪头进行划痕,在整个划痕过程中保持快速均匀,使划出的痕道大小一致,弃掉培养板中培养液,在此过程中尽量把划掉的细胞全部吸出,加入全新培养液,拍照记为0 h;并分别在12、24、36、48 h进行拍照观察。
1.8Transwell小室实验 将已转染的AGS细胞进行趋化计数处理,采用无血清培养液调整AGS细胞浓度,在聚碳酸酯膜上室接种已转染的AGS细胞3×104/100 μl,嵌入24孔板上,在24孔板加入500 μl含有20%的FBS培养液作为趋化剂,放入培养箱内培养24 h后,将小室内细胞擦拭掉,用0.4%的多聚甲醛固定30 min,0.1%结晶紫染色20 min,磷酸盐缓冲液(PBS)清洗2次,然后在显微镜下观察并计算迁徙通过的细胞数,找穿过细胞数符合比例的视野进行拍照。
1.9统计学方法 应用SPSS18.0软件行配对样本t检验、单因素方差分析。
2 结 果
2.1miR-31在胃癌组织中的表达水平 miR-31在胃癌组织中的表达水平为(0.23±0.03),明显低于对应正常组织的(0.36±0.04,t=13.510,P=0.000)。(以U6为内参,2-ΔΔCt法定量)。
2.2qRT-PCR检测细胞系中miR-31的表达水平 以GES-1的miR-31的表达量(1.00)为对照,胃癌细胞系AGS、SGC7901、MGC、BGC、HGC中miR-31呈低表达,分别为(0.59±0.08),(0.19±0.04),(0.60±0.13),(0.32±0.08),(0.49±0.07),与GES-1比较差异均有统计学意义(t=3.514,8.214,3.241,8.214,3.954;均P=0.000),其中AGS细胞内的表达水平最低(以U6为内参,2-ΔΔCt法定量)。
2.3检测miR-31瞬时转染AGS细胞系的表达 在miR-31表达水平较低的AGS细胞内转染miR-31mimics,结果提示,与对照组(1.00)相比,实验组中表达水平(8.2±1.5)显著升高(t=11.521,P=0.000)(以U6为内参,2-ΔΔCt法定量)。
2.4过表达miR-31对AGS细胞迁移的影响
2.4.1划痕实验 miR-31mimics和对照组分别转染AGS细胞36 h后,实验组迁移距离(310.0±11)μm明显小于对照组(690.0±0.2)μm(t=30.121,P=0.000),提示miR-31抑制AGS细胞的迁移水平。见图1。
2.4.2Transwell小室实验 对照组上穿过的细胞多于实验组,证明过表达miR-31抑制AGS细胞的迁移水平。见图2。
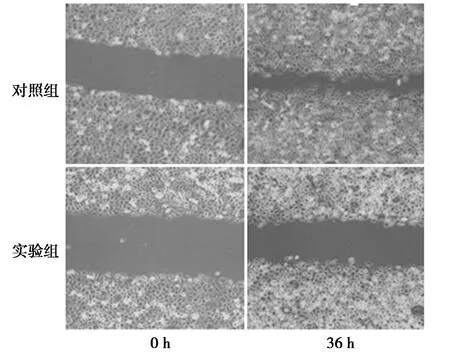
图1 划痕实验中过表达miR-31对AGS细胞迁移水平的影响(×200)
3 讨 论
胃癌的发生发展是个多基因互相调控的过程,基因的表达主要通过各种调节机制的影响以及表观遗传学的改变,主要概括为抑癌基因失活和原癌基因的激活。miRNA是一类在机体起重要调控作用的非编码RNA,占人类基因的1%,调控着人类近30%的基因表达〔7〕。关于miRNA在胃癌中的功能研究已有很多报道,其转录后的调控网络几乎参与了各项生理活动,包括细胞增殖、凋亡、侵袭、迁移等过程〔8〕。
本课题主要在胃癌组织中检测miR-31的表达水平,阐释miR-31在胃癌发生发展中的作用。miR-31作为miRNA家族的一员,在多种肿瘤组织中表达异常,通过与靶基因mRNA的3′UTR区域结合,调控靶基因的表达。本研究使用qRT-PCR的方法检测组织中miR-31的表达水平,发现miR-31的低表达可能与胃癌的发生发展有关。
文献报道〔9〕,与正常组织相比,miR-31在卵巢癌细胞和前列腺癌细胞中呈低表达,在卵巢癌细胞中,miR-31能够抑制肿瘤细胞的增殖,通过天冬氨酸特异性半胱氨酸蛋白酶(caspase)介导促进细胞的凋亡。在前列腺癌细胞中,miR-31可以通过介导E2F6增强前列腺癌细胞系的耐药性〔10〕。miR-31可能作为一个抑癌基因存在于胃癌组织细胞中。本研究通过划痕实验和Transwell小室实验证明,在胃癌细胞系AGS细胞中过表达的miR-31可以抑制AGS细胞的迁移,而其作用机制有待继续研究。在乳腺癌细胞中,已经被证实miR-31通过靶向SATB2、RhoA、ITGA5和RDX等基因抑制乳腺癌的迁移和浸润〔6,11〕。在卵巢癌细胞中,miR-31抑制卵巢癌细胞的迁移和克隆形成〔12〕。暗示了miR-31很有可能作为一个重要调控因子参与胃癌迁移过程。在整个迁移过程中,同一种miRNA在不同肿瘤细胞中不一定有相同的作用,而作用的靶点也不一定是同一个靶点,还应进一步证实miR-31参与胃癌迁移的作用机制,寻找miR-31作用机制过程中的重要靶点。
1毛玉娣,丁西平,王 华,等.微小RNA与胃癌关系的研究进展〔J〕.中国药理学通报,2016;32(6):756-9,760.
2乔 炜,琚 坚,罗金波,等.胃癌相关基因及其在治疗中应用的研究进展〔J〕.胃肠病学,2012;17(1):53-5.
3Aaldering LJ,Tayeb H,Krishnan S,etal.Smart functional nucleic acid chimeras:enabling tissue specifc RNA targeting therapy〔J〕.RNA Biol,2015;12(4):412-25.
4尹凌帝,孙 倩,孙 明,等.人类癌症中长链非编码RNA与miRNA相互作用的研究进展〔J〕.临床肿瘤学杂志,2014;19(7):662-6.
5罗云春,刘志苏,钱 群,等.微小RNA-31靶向作用Ras p21蛋白活化子1对结肠癌细胞增殖和迁移的影响〔J〕.中华实验外科杂志,2016;33(1):93-6.
6Luo LJ,Yang F,Ding JJ,etal.MiR-31 inhibits migration and invasion by targeting SATB2 in triple negative breast cancer〔J〕.Gene,2016;594(1):47-58.
7朱 磊,路瑛丽,冯连世,等.mic roRNA调节脂代谢的研究进展〔J〕.中国体育科技,2016;52(3):61-8.
8Yang Q,Zhang RW,Sui PC.Dysregulation of non-coding RNAs in gastric cancer〔J〕.World J Gastroenterol,2015;21(39):10956-81.
9张 伟,谭永胜,马和平,等.miR-31协同5-Fu发挥抗肿瘤作用的体内研究〔J〕.河北医药,2016;38(22):3395-400.
10丁 翔,崔凤梅,侯建全,等.前列腺癌患者血清微小RNA表达谱的初步研究〔J〕.中华泌尿外科杂志,2015;36(3):225-8.
11王文江.新辅助化疗对晚期乳腺癌患者血浆microRNA及肿瘤相关指标的影响〔J〕.海南医学院学报,2015;21(11):1509-11,1515.
12Ibrahim FF,Jamal R,Syafruddin SE,etal.MicroRNA-200c and microRNA-31 regulate proliferation,colony formation,migration and invasion in serous ovarian cancer〔J〕.J Ovarian Res,2015;8(1):56.
