组织化胰腺的体外构建及其在细胞移植中的作用
2018-03-20杨战锋李晓勇周百中陈升阳尚文俊
杨战锋 李晓勇 周百中 陈升阳 尚文俊
(郑州大学第五附属医院肝胆胰腺外科,河南 郑州 450052)
临床对糖尿病的治疗主要通过药物或胰岛素注射控制血糖水平,但并不能完全控制血糖及并发症的发生。胰岛细胞移植研究已有30多年,成为近年来治疗胰岛素依赖型糖尿病的一种很有前途的治疗方法〔1~4〕。组织工程是结合生命、工程科学,以生物相容性良好的载体,与细胞结合而成的细胞-支架复合体,不但具有全新、独特的组织结构,而且仍然保持拥有生物活性,使复合体可应用于多种组织或器官损伤的修复。本实验采用在微重力环境下共培养大鼠胰岛和辜丸支持细胞,形成胰岛-睾丸支持细胞复合物,同时使其拥有内分泌功能及免疫豁免特性。通过移植于糖尿病大鼠体内,探讨组织工程化胰腺的体外构建及其在细胞移植中的实验研究。
1 材料与方法
1.1实验动物 2月龄SD大鼠60只,其中8只用于睾丸组织细胞及胰岛的分离,由军事医学科学院动物中心提供。实验中对大鼠的处置符合国家标准〔5〕。
1.2主要试剂及设备 旋转壁式生物反应器(美国),恒温培养箱、无菌操作台(上海一恒),台式冷冻高速离心机(日本),BM-V型生物组织包埋机(北京佳源兴业科技有限公司),M199培养基(Sigma公司),大鼠胰岛素试剂盒、兔抗Fas-L抗体、小鼠抗胰岛素单克隆抗体(上海蓝基生物科技有限公司)。
1.3方法
1.3.1SD大鼠胰岛细胞的分离、纯化与培养 取SD大鼠,注射戊巴比妥钠进行腹腔麻醉,处死后打开腹腔,摘取完整胰腺组织,放于培养瓶中,37℃消化30 min,用解剖剪剪碎胰腺组织,加入0.5 mg/ml的胶原酶4 ml,37℃震荡消化8 min,经60目筛网过滤,置于预冷的Hank盐溶液(含有灭活胎牛血清)终止消化。消化后,2 000 r/min低温离心10 min,除去上清液,加入25% Dextran溶液,均匀后置于EP离心管中,然后依次加入25%、20%、10% Dextran溶液,然后2 000 r/min低温离心10 min,吸取细胞层,立即用适量培养基润洗2遍,得到的胰岛中加入培养基(含10%胎牛血清),于培养基中进行培育。
1.3.2支持细胞的分离、纯化与培养 将1周龄大鼠麻醉后处死,75%乙醇灭菌后,于腹股沟处解剖,摘取大鼠睾丸组织,轻轻除去附睾和脂肪,称重,置于预冷的Hank盐溶液中,慢慢剥离外层白膜,用解剖剪将睾丸剪成糊状,加入1 mg/ml胶原酶溶液,37℃震荡消化8 min,过200目筛网过滤,置于预冷的Hank盐溶液(含有灭活胎牛血清)中终止消化。1 500 r/min低温离心10 min,轻轻吸去上清液,加入0.5 mol/L低渗缓冲液1 ml,静置1 min,1 500 r/min低温离心5 min,吸去上清液,加入M199培养基(含10%体积分数灭活胎牛血清),混匀后接种培养瓶中,于培养箱中进行培养,观察贴壁情况,及时除去未贴附细胞,培养1 d后,加入0.5 mol/L低渗缓冲液3 ml处理5 min,纯化细胞。
1.3.3细胞复合体的制备和检测 取纯化的2 000 IEQ胰岛与5.0×106原代睾丸支持细胞接种共培养于旋转壁式生物反应器中,以20 r/min为初始速度,置于培养箱中培养6 d,随着支持细胞-胰岛复合物的增大,逐步提高旋转壁式生物反应器转速。分别取细胞复合物进行DTZ染色及HE染色,于光镜下观察其形态学。同时,以同样方法培养胰岛、原代睾丸支持细胞作为对照组。
1.3.4糖尿病大鼠模型的建立及细胞复合物移植 建模方法参考文献〔6〕。取SD雄性大鼠,禁食12 h后,以体质量6 mg/100 g腹腔注射50 mg/ml链脲佐菌素柠檬酸钠溶液,连续腹腔注射5 d,每日检测血糖变化,当连续7 d检测大鼠血糖>16.7 mmol/L时,表明大鼠糖尿病建模成功。将模型大鼠禁食12 h后,乙醚麻醉后于大鼠肾被膜下移植复合物(胰岛量为2 000 ICQ/只)。采用同样方法将新鲜胰岛、单独培养的胰岛,睾丸支持细胞分别移植入模型大鼠作为移植对照组,未移植模型大鼠作为空白对照组。
1.3.5移植后各组大鼠血糖监测及葡萄糖耐受实验 各组移植后,经大鼠尾静脉采血,1次/2 d,监测各组大鼠血糖水平:(1)血糖连续2次均<7.0 mmol/L为正常;(2)血糖连续2次均>11.4 mmol/L为糖尿病复发。对血糖恢复正常并保持20 d的大鼠,禁食8 h后进行葡萄糖耐受试验,按体质量200 mg/100 g腹腔内注射25%葡萄糖溶液,每15 min检测1次血糖(检测至2 h)。
1.3.6移植物检测与鉴定 移植后,检测各组大鼠血糖水平,摘取血糖30 d以上保持正常水平的大鼠肾脏组织,清洗后,用Bouin溶液固定,包埋、切片,进行HE染色,显微下观察,并进行Fas-L、胰岛素免疫组化法染色,对大鼠移植物进行鉴定。
1.4统计学分析 采用SPSS17.0软件行t检验。
2 结 果
2.1胰岛形态学检测结果 摘取SD大鼠胰岛组织,经化学方法纯化,显微镜下观察结果显示:胰岛细胞团结构完整,表面光滑,可见胰岛被膜,染色后颜色显示丰富,表明实验纯化得到的胰岛纯度很高。采用DTZ特异性染色分离纯化得到的胰岛呈不透光的鲜红色。见图1。

图1 胰岛细胞团形态学检测结果
2.2睾丸支持细胞形态学检测结果 睾丸细胞贴壁后于培养箱中继续培养24 h,细胞基本已全部贴壁生长,细胞立体感较强,显微镜下可见极少量球形精细胞贴附于睾丸细胞上,经台盼篮染色后活细胞透亮,总数占95%以上,少数死细胞染成蓝色。HE染色可见细胞生长旺盛,形态呈宽大柱状或纤维样,排列紧密,多个同时存在时融合成片,界限不清,呈单层膜状,一般有3~4个突起,突起相互连接,胞质铺展较大,可见有多量大小不一的空泡状结构。见图2。
2.3支持细胞-胰岛复合物形态学检测结果 培养24 h后,睾丸支持细胞-胰岛球形细胞复合物逐步形成。培养5 d后,细胞复合物结构稳定且致密,HE染色后,显微镜下可见细胞复合物呈球形,且无坏死细胞;DTZ染色后显微镜下可见复合物被支持细胞包裹;Fas-L免疫组织切片染色后,可见在整个细胞复合物中,支持细胞呈阳性,胰岛素阳性的β细胞检测结果与透射电镜观察结果一致,结果显示共培养的胰岛生长状态相对较好。见图3。
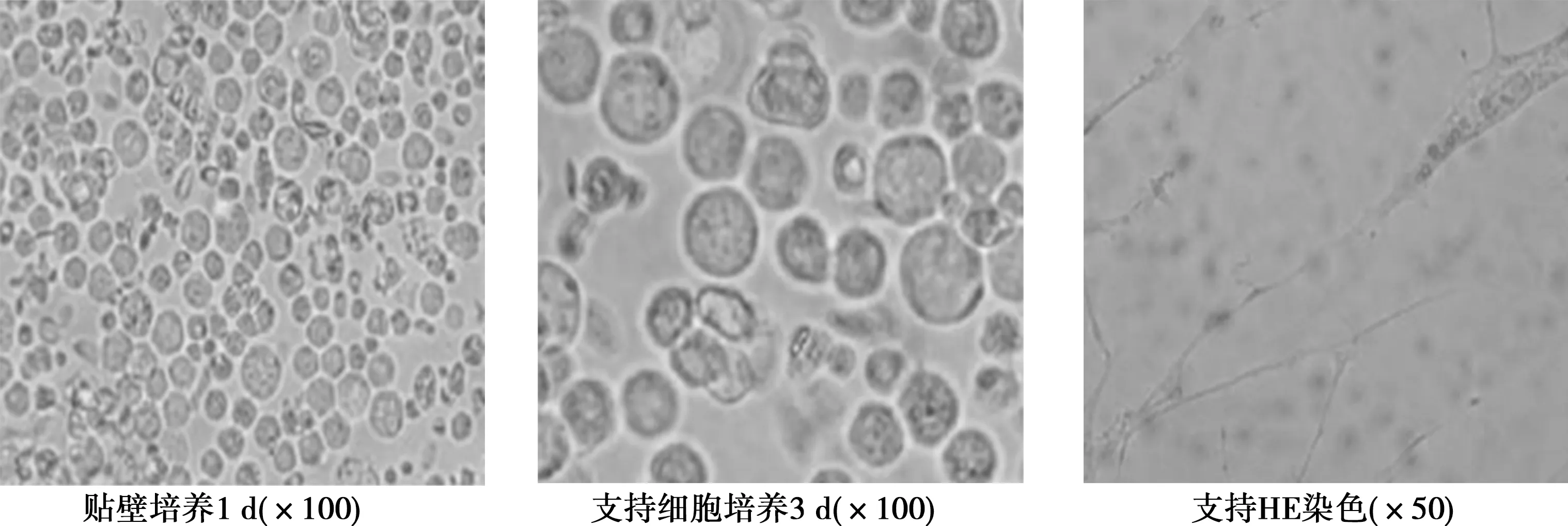
图2 睾丸支持细胞形态学检测结果
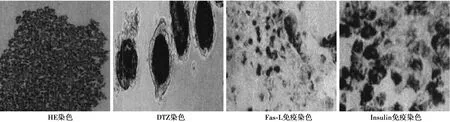
图3 支持细胞-胰岛复合物采用不同染色检测结果(×100)
2.4移植后模型大鼠血糖检测结果 移植后3 d血糖恢复正常,其保持正常血糖水平均超过30 d;仅接受胰岛移植(经过生物反应器培养)的模型SD大鼠,在移植后4 d血糖水平也达到正常,但仅保持10 d后,血糖水平又逐渐升高,并出现SD大鼠相继死亡的现象。移植新鲜胰岛的模型SD大鼠,2~3 d内血糖恢复正常,但维持在正常血糖水平仅4 d。接受睾丸支持细胞移植的模型SD大鼠,移植后未出现血糖下降,大鼠因高血糖而相继死亡。未接受移植的模型SD大鼠血糖水平始终较高,且模型大鼠相继死亡较快。移植睾丸支持细胞-胰岛细胞复合物的正常SD大鼠,移植前后大鼠血糖水平无显著变化,且没有出现低血糖水平。从血糖水平结果总结,微重力环境下共培养睾丸支持细胞-胰岛细胞复合物能够提高胰岛的活性,降低其免疫原性,与接受新鲜胰岛移植的SD大鼠相比,复合物移植使模型大鼠保持血糖正常的时间明显更久。见图4。
2.5移植物HE染色及免疫组化染色结果 大鼠解剖后,摘取肾脏组织,HE染色可见睾丸支持细胞-胰岛细胞复合物移植组模型大鼠肾被膜下有明显的移植物存在,未发现明显的淋巴细胞浸润。胰岛素免疫染色和Fas-L染色均可见阳性细胞的存在。仅接受胰岛移植(经过生物反应器培养)的模型SD大鼠的肾被膜被淋巴细胞明显浸润。见图5,图6。

图4 移植后模型大鼠血糖检测结果
2.6移植后SD大鼠葡萄糖耐受实验 接受睾丸支持细胞-胰岛细胞复合物移植后的模型SD大鼠,在基本保持正常血糖水平均超过30 d后,进行葡萄糖耐受实验。移植睾丸支持细胞-胰岛细胞复合物的模型大鼠体内胰岛对葡萄糖仍保持明显的敏感性,与正常组大鼠葡萄糖的耐受能力相比,复合物移植组大鼠平均血糖基本在2 h内可以恢复正常,与正常检测结果接近。见图7。
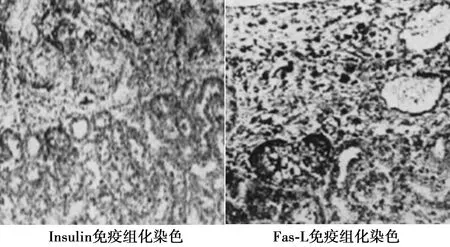
图6 移植有睾丸支持细胞-胰岛细胞复合物的肾组织免疫组化检测结果(×200)
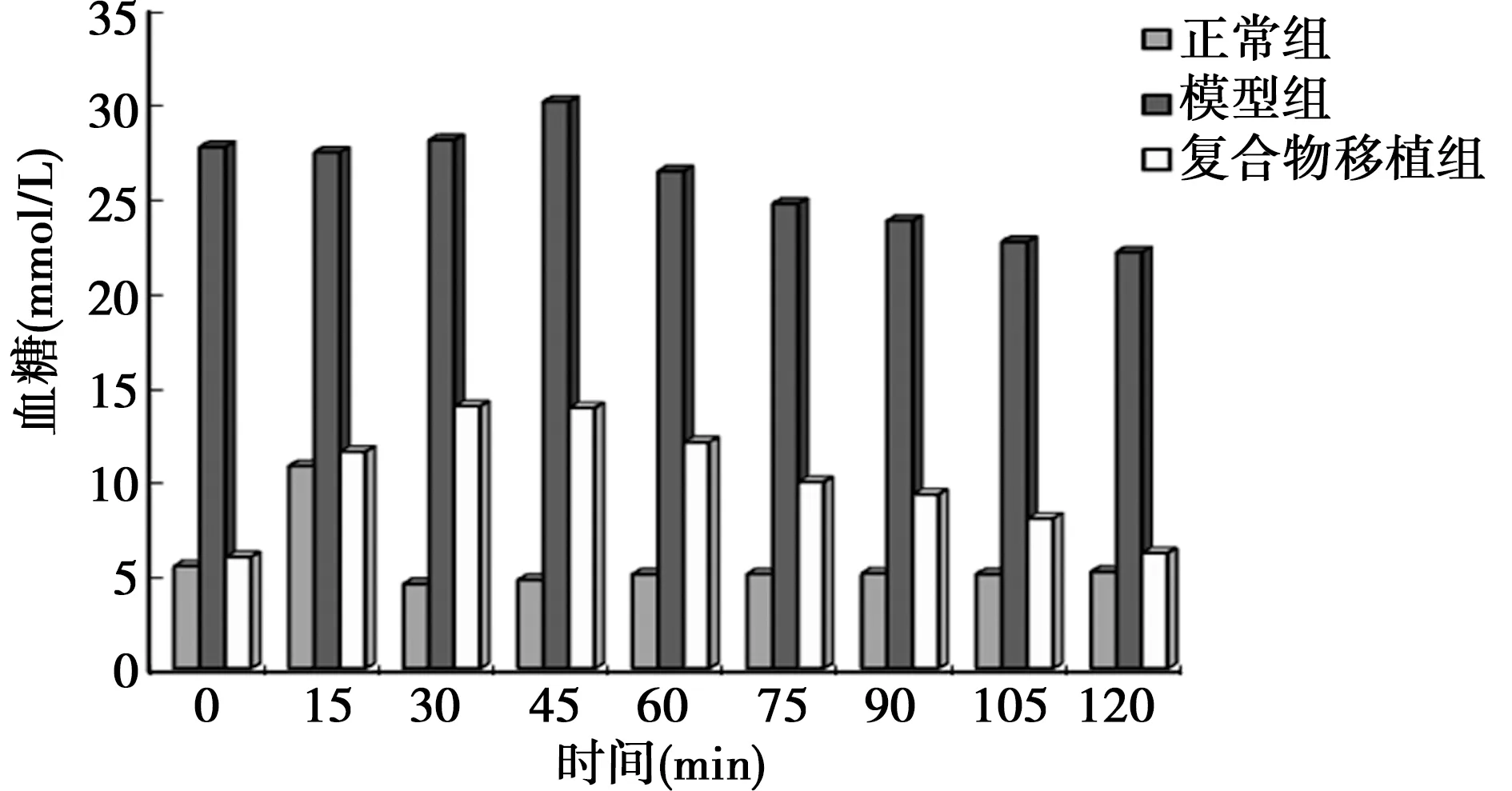
图7 葡萄糖耐受实验检测不同时间点血糖水平(mmol/L)
3 讨 论
获得高纯度的胰岛是胰岛移植治疗成果的关键。分离、纯化胰岛的方法有很多,但都有各自的优缺点,如机械剪切分离法、胶原酶消化法、自动机械分离法等〔7~10〕。睾丸支持细胞是生殖系统的重要组成部分。离体的胰岛细胞团只有在一定的微环境下才能保证其正常功能状态。可与胰岛细胞团共培养的细胞有很多,如小肠黏膜细胞、神经胶质细胞等,但都对胰岛细胞的 存活有一定的促进作用〔11,12〕。本研究胰岛与辜丸支持细胞接种后共培养,结果显示共培养的胰岛生长状态相对较好。葡萄糖耐受实验显示,移植睾丸支持细胞-胰岛细胞复合物的模型大鼠体内胰岛对葡萄糖仍保持明显的敏感性。实验结果提示:微重力环境下培养睾丸支持细胞-胰岛细胞可以提高胰岛在移植体内的活性,降低其免疫原性,同时保持良好的胰岛素分泌功能及对葡萄糖的敏感性,并且存活时间保持较长。
1徐 刚,袁敏生.胰岛细胞移植的现状与前景〔J〕.中国糖尿病杂志,2001;9(1):49-51.
2金 光,路 中,戚 丽.胰岛移植进展〔J〕.国外医学·内分泌学分册,2004;24(1):70-1.
3Rieordi C,Strom TB.Clinieal islet transplantation:advances and immunological challenges〔J〕.Nature Rev,2004;4(4):259-68.
4Sassa M,Fukuda K,Fujimoto S,etal.A single transplantation of the islets can produce glycemic stability and reduction of basal insulin requirement〔J〕.Diabetes Res Clin Pract,2006;73(3):235-40.
5中华人民共和国科学技术部.关于善待实验动物的指导性意见〔S〕.2006-09-30.
6Kaza AK,Wamala I,Friehs I,etal.Myocardial rescue with autologous mitochondrial transplantation in a porcine model of ischemia/reperfusion〔J〕.J Thor Cardiovasc Surg,2017;153(4):934-43.
7张 梅,杨金奎,陈家伟.胰岛移植治疗Ⅰ型糖尿病的研究进展〔J〕.国外医学·内分泌分册,2002;22(4):204-6.
8孙俊州,李 敏,程宝莺.动物细胞培养技术〔M〕.广州:华南理工大学出版社,2002:103-31.
9薛庆善.体外培养的原理与技术〔M〕.北京:科学出版社,2001:90.
10贾 秀,保庭毅.大鼠胰岛分离与纯化的实验研究〔J〕.第四军医大学学报,2001;22(4):383.
11Chen Q,Gauger P,Stafne M,etal.Pathogenicity and pathogenesis of a United States porcine deltacoronavirus cell culture isolate in 5-day-old neonatal piglets〔J〕.Virology,2015;482(1):51-9.
12王立芹.星形胶质细胞与神经干细胞共培养对神经干细胞分化影响的实验研究〔D〕.沈阳:中国医科大学,2010.
