镁肥对葡萄光合速率和叶绿素荧光特性的影响
2018-03-20马晓丽黄本义吕秀兰刘雪峰袁项成
马晓丽,黄本义,黄 艳,吕秀兰*,刘雪峰,袁项成
(1.四川农业大学果蔬研究所,四川 成都 611130;2.重庆三峡农业科学院,重庆 404155)
镁在植物生理作用中有着其它阳离子不可替代的重要地位,参与光合作用、碳氮代谢等[1-2]。我国南方地区受气候及土壤酸性较强等因素的影响,土壤中的镁容易因迁移和淋溶而损失,土壤供镁能力降低,作物缺镁现象日益严重[3-4]。葡萄对镁需求量大,缺Mg全年都可发生,葡萄缺镁时,会改变叶绿素结构、降低光合效率、蛋白质合成受阻,影响对其他矿质元素的吸收,并导致果实品质的降低[5-6]。国内外有很多对镁素营养的研究,但大多集中在缺镁对植物光合作用以及酶系统等的影响上,并且在盆栽蔬菜及沙培果树幼苗研究方面较多[7-8],在大田条件下,对缺镁多年生果树土施及叶面喷施镁肥对植株叶绿素含量、光合特性,特别是PSⅡ原处光能转换效率和潜在活性等叶绿素荧光参数的研究报道相对较少。因此,本文拟在田间条件下,对已缺镁的葡萄园进行土施和叶面喷施镁肥,分析叶片叶绿素含量、光合参数、叶绿素荧光参数的差异显著性,评价土施与叶面喷施对光合特性的影响,并分析叶片镁含量与光合特性的相关性。
1 材料与方法
1.1 试验地概况
试验地位于四川省龙泉驿区洛带镇宝胜村,属亚热带湿润气候,气候温和,雨量充沛,四季分明。年平均日照1 032.9 h,8月最多,12月最少。年平均气温16.5℃,无霜期年平均297 d,年降水量平均为895.6 mm,年均相对湿度81%。试验的前一年对该地土壤和葡萄成熟叶片进行了营养诊断,试验土壤为平地红色砂土,其基本理化性状为pH值5.56、有机质19.76 g/kg、铵态氮8.56 mg/kg、硝态氮18.29 mg/kg、有效磷20.76 mg/kg、速效钾104.34 mg/kg、速效钙342.35 mg/kg、速效镁40.79 mg/kg、有效锌1.23 mg/kg、有效铁34.78 mg/kg、有效锰17.89 mg/kg;该地葡萄成熟叶片元素含量为钾5.93 g/kg、钙14.84 g/kg、镁1.6 g/kg、铁74.34 mg/kg、锰48.36 mg/kg、锌24.78 mg/kg、铜12.36 mg/kg。参考李港丽等[9]葡萄叶片营养分级标准,发现该地葡萄钾、钙、锌、铁、铜元素均在适量水平,但镁含量缺乏严重。
1.2 试验设计
采用裂区试验设计,主区设4个土施硫酸镁(MgSO4·7H2O)水平,分别是0、112.5、150、187.5 kg/hm2,用S0、S1、S2、S3表示,副区设3个叶面喷施硫酸镁浓度,分别是0%、0.2%、0.4%,用F0、F0.2、F0.4表示,共计12个处理,依次为S0F0、S0F0.2、S0F0.4、S1F0、S1F0.2、S1F0.4、S2F0、S2F0.2、S2F0.4、S3F0、S3F0.2、S3F0.4。每个小区选10株葡萄,重复3次,360株葡萄,土施硫酸镁在秋季随基肥施入,然后进行旋耕;叶面喷施则分3次,分别为5月中旬、6月中旬、7月中旬,以叶片滴水为限。自2014年10月开始,试验连续进行2年。
1.3 测定项目与方法
2016年8月15日,即果实着色期,选择坐果位点的叶片测定叶绿素荧光和光合的相关指标,每个处理随机测定4株,每株重复3次。测定结束后立即采集,塑封袋标号,并放入冰盒,用于叶片镁含量、叶绿素含量的测定。
1.3.1 叶片镁含量的测定
根据中国农业大学制定的标准进行洗涤:① 0.1 mol/L盐酸溶液洗涤叶片30 s;② 0.1%洗净剂洗涤30 s;③ 取出并用自来水冲洗;④ 用无离子水冲洗,用滤纸吸去表面水分。将洗涤后的叶片置于105℃烘箱中杀酶20 min,之后在70~80℃下烘干。用不锈钢植物磨碎机磨碎后过0.25 mm孔径筛,贮于干燥器中待测。叶片镁通过550℃马弗炉灼烧,制成灰分,用稀盐酸溶解、火焰原子吸收光谱法[10]测定。
1.3.2 叶绿素含量的测定
将所采集叶片剪碎混匀,参照张宪政[11]方法—丙酮乙醇混合液法,用电子天平准确称0.2 g葡萄叶片,无损地放入有塞的刻度试管中,加入20 mL 1∶1无水乙醇及丙酮混合液,室温下(10~30℃)放暗处提取,至叶片完全变白后取上清液,用分光光度计测定645、663 nm下的吸光值,按公式计算得到叶绿素a、叶绿素b、类胡萝卜素及叶绿素总量。
1.3.3 光合参数的测定
光合指标的测定参照许大全[12]的方法,于晴天的8:30~11:00,用Li-6400XT便携式光合仪(LI-COR)测定叶片的净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)及蒸腾速率(Tr)等参数。水分利用效率(WUE)=净光合速率(Pn)/蒸腾速率(Tr)。测定时用红蓝光源叶室,光
照强度设为1 600 μmol/(m2·s),气温为30~35℃,CO2气体由小钢瓶提供,控制浓度为400 μmol/(m2·s),每个测定重复3次。
1.3.4 叶绿素荧光参数的测定
叶绿素荧光参数测定采用便携式调制叶绿素荧光仪PAM-2500测定,先将叶片暗适应20 min,测量利用饱和脉冲模式,首先打开测量光[强度为0.5 μmol/(m2·s),脉冲频率为1 Hz],测定初始荧光(F0),然后照射强饱和脉冲光[强度为2 500 μmol/(m2·s),脉冲光时间为0.8 s],测定最大荧光(Fm),随后打开光化光[40 μmol/(m2·s)],诱导荧光动力学动态变化,间隔20 s打开一系列饱和脉冲,测定光化学淬灭(qP)、非光化学淬灭(qN)、实际光量子产量(Yield)、表观光合电子传递速率(ETR)等荧光参数。计算暗适应下叶片PSⅡ最大光化学效率Fv/Fm=(Fm-F0)/Fm。
1.4 数据处理与分析
试验数据采用Excel 2010软件进行处理并绘制相关图表,采用SPSS 18.0软件进行统计分析。
2 结果与分析
2.1 施镁对缺镁葡萄叶片镁与叶绿素含量的影响
由图1可以看出,施镁后,叶片镁含量显著增加,均达到了适量标准,处理S3F0.4镁含量最高,达到了4.65 g/kg,与处理S2F0.4差异不显著,较其他处理差异显著。当土施量一定时,叶片镁含量表现出F0.4>F0.2>F0,当叶面喷施浓度一定时,表现出S3>S2>S1>S0。
施镁后,叶片中叶绿素a、叶绿素b、叶绿素总量均较未施镁肥的S0F0显著提高,其中处理S2F0.4各指标含量均最高,当叶面喷施浓度一致时,土施量在0~150 kg/hm2内,土施量越大,叶绿素含量越高,当土施量为187.5 kg/hm2时,叶绿素含量出现一定程度降低,当土施量一定时,发现叶面喷施效果F0.4>F0.2>F0,说明叶面喷施硫酸镁能够显著提高叶片叶绿素含量,喷施浓度0.4%对叶绿素提升效果最好。
表1为土施和叶面喷施对叶片镁和叶绿素含量的效果,可以看出,土施和叶面喷施对叶片镁和叶绿素各指标的影响均达到极显著水平,且两者存在极显著交互效应,说明两者配合施用对叶片镁和叶绿素含量有相互促进的作用。

图1 施镁对缺镁葡萄叶片镁和叶绿素含量的影响

方差分析F值镁含量叶绿素a叶绿素b叶绿素总量土施(S)36079∗∗10039∗∗18490∗∗11814∗∗叶面喷施(F)73902∗∗13025∗∗19571∗∗14662∗∗S×F5484∗∗858∗∗625∗∗789∗∗
注:**表示F检验达极显著水平(P<0.01)。下同。
2.2 施镁对缺镁葡萄光合参数的影响
由图2可以看出,施镁后,叶片净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)和水分利用效率(WUE)均较未施镁肥的S0F0增加,而胞间CO2浓度(Ci)则出现降低趋势。当土施量在0~150 kg/hm2时,缺镁葡萄叶片Pn、Gs、Tr和WUE表现出F0.4>F0.2>F0,当叶面喷施浓度一定时,各指标均随着土施量的增加出现先升高后降低的趋势,叶片Pn、Gs、Tr和WUE均在处理S2F0.4达到最高。Ci与之相反,随着施镁量的增加出现先降低后升高的趋势,处理S2F0.4浓度最低。
表2为土施和叶面喷施对叶片光合参数的效果鉴定,可以看出,土施对叶片Pn、Gs、Ci和WUE有极显著影响,对Tr有显著影响;叶面喷施对叶片Pn、WUE有极显著影响,对Tr有显著影响,但对Gs、Ci影响不显著;土施和叶面喷施对叶片Pn、Ci和WUE有极显著交互效应,对Tr有显著交互效应,而对Gs交互效应不显著。

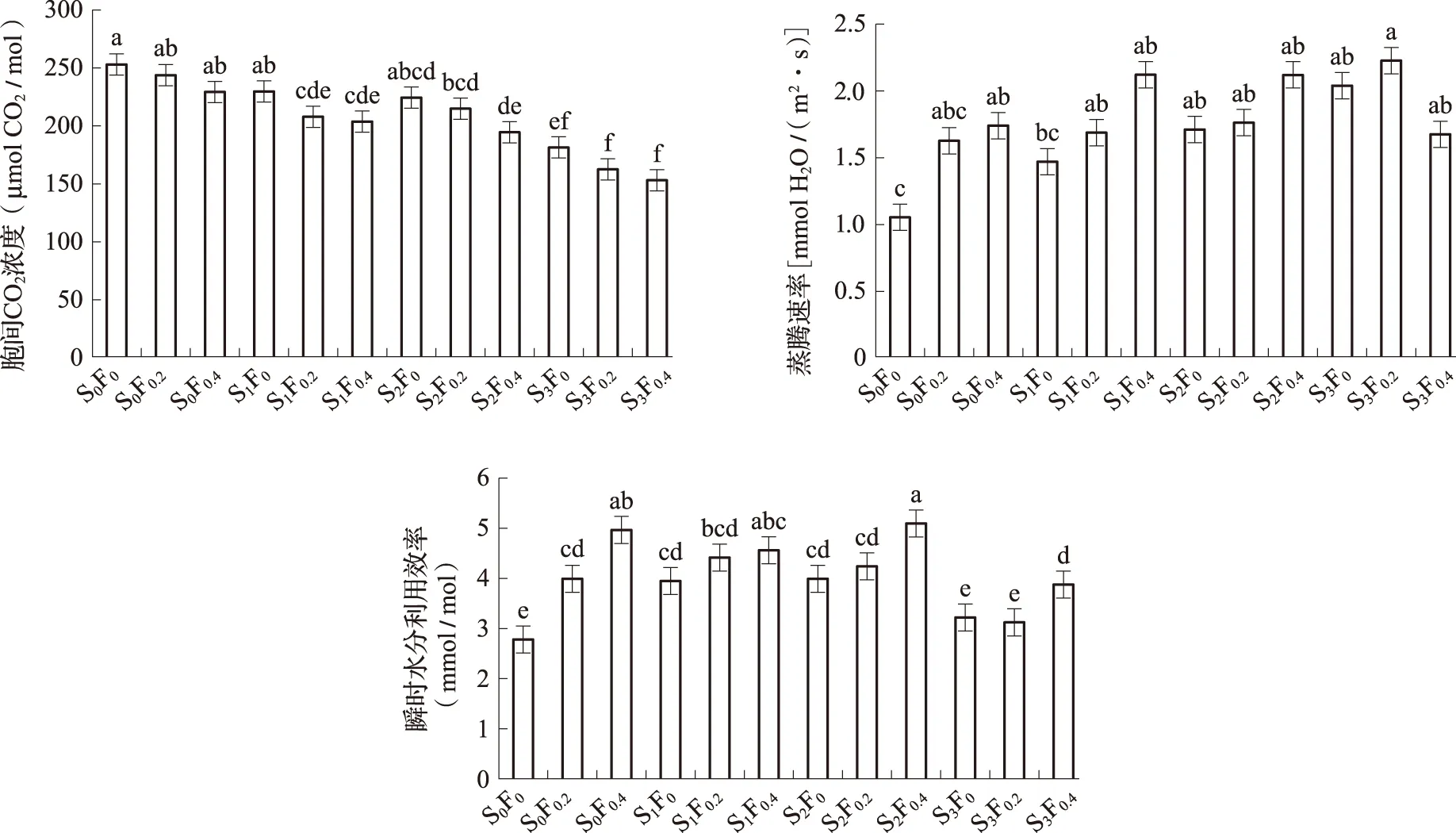
图2 施镁对缺镁葡萄光合参数含量的影响

方差分析F值净光合速率气孔导度胞间CO2浓度蒸腾速率瞬时水分利用效率土施(S)9930∗∗8686∗∗19038∗∗4535∗15913∗∗叶面喷施(F)37968∗∗285528293945∗32202∗∗S×F5748∗∗09396500∗∗2561∗3913∗∗
注:*表示F检验达显著水平(P<0.05)。下同。
2.3 施镁对缺镁葡萄叶绿素荧光的影响
2.3.1 施镁对缺镁葡萄叶片实际光量子产量的影响
Yield能够反映PSⅡ反应中心在部分关闭情况下的实际原初光能捕获效率,用来衡量植物光合电子传递的量子产量,可以作为植物叶片光合电子传递速率快慢的相对指标[13]。由表3可以看出,未施镁肥处理S0F0的Yield值最低,叶面喷施量一定时,Yield值大小为S2>S3>S1>S0,土施对叶片中Yield达到极显著影响,表明土施量在0~150 kg/hm2能够提高缺镁葡萄叶片光合电子传递速率,但土施量为187.5 kg/hm2时叶片光合电子传递速率降低;当土施量在0~150 kg/hm2范围时,叶面喷施浓度对叶片Yield影响表现出F2>F1>F0,而当土施量为187.5 kg/hm2时表现出F0>F1>F2,叶面喷施对叶片Yield有显著影响;处理S2F0.4值最高,达到了0.607,土施和叶面喷施结合使用对叶片Yield有显著交互效应。
2.3.2 施镁对缺镁葡萄叶片表观光合电子传递速率的影响
ETR在一定程度上可以反映PSⅡ反应中心的电子捕获效率[14],和叶片Yield值变化相似,叶片ETR也是未施镁肥的S0F0值最低,随着镁肥的施入表现出先升高后降低的趋势,处理S2F0.4值最高,表明镁肥的施入提高了缺镁葡萄光合作用光系统Ⅱ反应中心的电子捕获效率,但施入过量表现出一定程度的抑制。土施和叶面喷施对叶片ETR值均有极显著影响,并有极显著交互效应。
2.3.3 施镁对缺镁葡萄叶片荧光淬灭的影响
荧光淬灭包括光化学淬灭和非光化学淬灭,PSⅡ天线色素吸收的光能用于光化学电子传递,即为光化学淬灭,用qP表示,不能用于光合电子传递,以热形式耗散掉,即为非光化学淬灭,其热耗散能力可以用qN表示[15]。由表3可以看出,未施镁肥的处理S0F0的qN和qP均最低,随着镁肥的施入,出现先升高后降低的趋势,处理S2F0.2的qP值最高,与未土施镁肥的处理S0F0、S0F0.2、S0F0.4及施肥量最大的S3F0.4差异显著,较其他处理差异不显著。处理S2F0.4的qN值最高,但与土施量为150和187.5 kg/hm2的各处理差异不显著。进一步鉴定土施和叶面喷施对叶片荧光淬灭的影响,发现土施能够极显著影响qN和qP,叶面喷施能够极显著影响qN,而对qP的影响不显著。
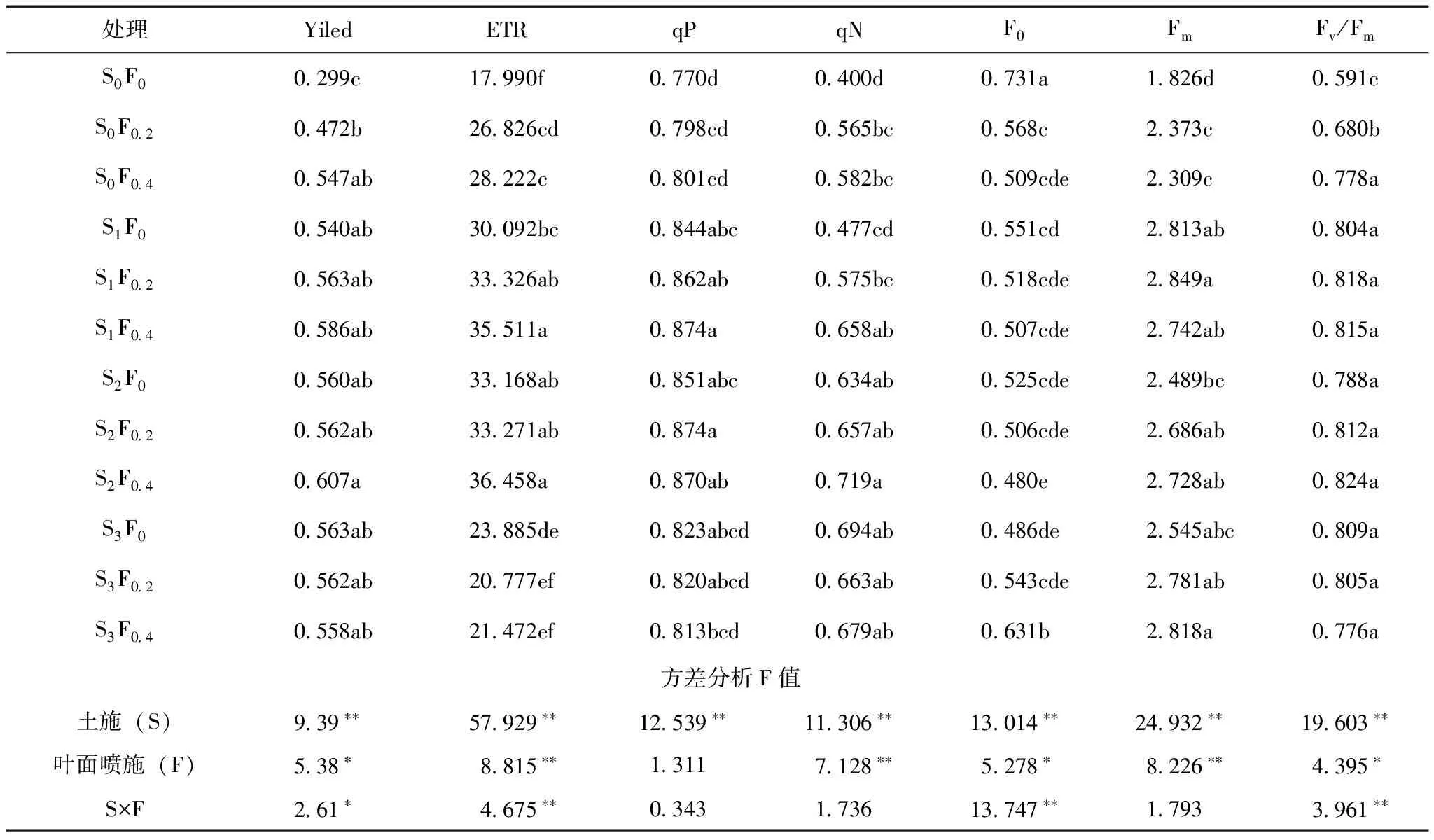
表3 土施和叶面喷施镁肥对缺镁黄化葡萄叶绿素荧光参数的影响
注:各处理多重比较采用DUCAN法,不同的小写字母表示各处理在P<0.05水平下差异显著。
当叶片吸收光能后,若不能及时耗散掉过剩光能,将对光合系统造成破坏,在本试验中,施入镁肥后qN和qP增加,表明施肥后叶片耗散其吸收的过剩光能的能力增强,保护了光合系统免受强光破坏,降低产生活性氧的比例。
2.3.4 施镁对缺镁葡萄叶片荧光动力学参数F0、Fm、Fv/Fm的影响
F0是指PSⅡ反应中心处于完全开放时的荧光产量。F0大小主要与PSⅡ天线色素内的最初激子密度、天线色素以及PSⅡ反应中心的激发能传递速率的结构状态及叶绿素含量有关[16]。由表3可以看出,未施镁肥时,F0最高,随着镁肥施入量的增加,叶片中F0出现先降低后增加的趋势,说明在缺镁情况下PSⅡ反应中心受到一定破坏,施镁后得到一定的缓解,但施镁量过高时缓解效果降低。
Fm指PSⅡ反应中心完全关闭时荧光的产量,其反映PSⅡ电子传递情况[17],未施镁肥时Fm最低,随着镁肥施入量的增加Fm增大,处理S1F0.2最高。Fv/Fm反映了当所有的PSⅡ反应中心均处于开放态时的量子产量,可以直接作为原初光化学效率的指标[18]。未施用镁肥时,Fv/Fm值最低,随着施用量的增加值变大,土施镁肥的各处理差异不显著,说明施镁后缺镁葡萄原初光化学效率明显提高,但土施量大于112.5 kg/hm2时,增加效果不显著。
进一步鉴定土施和叶面喷施对F0、Fm和Fv/Fm的效果发现,土施能够极显著影响叶片F0、Fm和Fv/Fm,叶面喷施极显著影响Fm,显著影响F0和Fv/Fm,两者配合使用对Fm交互效应不显著,对F0和Fv/Fm存在极显著交互效应。
2.4 叶片镁含量与叶绿素、叶绿素荧光及光合参数的相关性
表4和表5为叶片中镁含量与叶绿素含量、光合参数及叶绿素荧光的相关分析,可以看出,对缺镁葡萄土施和叶面喷施硫酸镁后,叶片中镁含量与叶绿素含量及光合参数中的净光合速率、气孔导度、蒸腾速率及瞬时水分利用速率极显著正相关,与胞间CO2浓度极显著负相关;叶片镁含量与叶绿素荧光参数中Yiled、qP、qN、Fm、Fv/Fm极显著正相关,与ETR显著正相关,与F0显著负相关。

表4 叶片中镁含量与叶绿素含量和光合参数的相关性分析

表5 叶片中镁含量与叶绿素荧光的相关性分析
3 讨论
镁是叶绿素的重要成分,存在于植物体内叶绿素分子中心,对维持叶绿体结构有重要的作用。叶绿体结构在缺镁状态下会受到破坏,致使叶片内叶绿素含量下降[19]。本试验发现,土施和叶面喷施适量镁肥能够显著提高叶片镁和叶绿素含量,叶片中镁含量与叶绿素含量存在极显著正相关关系,这与朱立保等[13]在镁对厚皮甜瓜坐果节位叶片叶绿素含量的研究和林丽琳等[20]在镁对‘新天玲’西瓜叶片光合色素的研究一致。
镁的主要功能是在叶绿素的合成及植物的光合作用中起重要作用,因为它是chla和chlb卟啉环的中心原子,只有当Mg与叶绿素分子结合后,才具备吸收光量子的必要结构,进而有效地吸收光量子且进行光合碳同化作用[21]。植物缺镁时光合速率受到抑制,这在龙眼[22]、柑橘[23]、黄瓜[7]、菜薹[8]、菊芋[24]等多种植物上已被证实。本试验发现,未施镁肥时,缺镁葡萄叶片净光合速率很低,土施和叶面喷施适量镁肥后叶片净光合速率显著升高,叶片镁含量与净光合速率极显著正相关,可能是因为补镁促进叶绿素含量的增多,导致捕捉和传递到PSⅡ反应中心的光能增加,同时气孔导度增大促进了CO2和水分进入叶片,当镁肥施入量继续加大,土施量达到150 kg/hm2时,叶片净光合速率降低,逆境条件下植物叶片光合速率降低的因素分为气孔限制和非气孔限制,Farquhar等[25]认为,当胞间CO2浓度和气孔导度同时下降时,净光合速率的下降主要是由气孔限制引起的,而本试验中胞间CO2浓度和气孔导度也出现下降,表明镁施入量过大时,净光合速率的降低主要是由于气孔原因,可能过量施镁时,镁与钾离子产生拮抗作用,降低了植株对钾元素的吸收,抑制了气孔的开放。
未施镁肥时,叶片Yield、ETR、Fv/Fm、qP、qN最低,而F0最高,说明缺镁时,PSⅡ反应中心受到损伤,光合活性下降,原初光能转换效率降低,电子传递能力变弱,PSⅡ潜在活性受到抑制。该结论与在黄瓜[26]、脐橙[27]、烟草[14]、玉米[28]等上的研究结论类似。而土施150 kg/hm2同时叶面喷施0.4%硫酸镁肥后,叶片Yield、ETR、Fv/Fm、qP、qN维持在较高水平,F0降低,说明适量施镁增加了PSⅡ天线色素的非光化学能力耗散,缓解了光系统受损程度,同时保持PSⅡ原处光能转换效率和潜在活性,这一结果与在厚皮甜瓜[13]上的研究相符。
4 结论
缺镁时,葡萄叶片叶绿素含量低,PSⅡ反应中心受到损伤,光合活性下降,原初光能转换效率降低,电子传递能力变弱,PSⅡ潜在活性受到抑制;而土施和叶面喷施适量镁肥能够显著提高叶片镁和叶绿素含量,增大气孔导度,提高净光合速率,增加了PSⅡ天线色素的非光化学能力耗散,缓解了光系统受损程度,同时保持PSⅡ原处光能转换效率和潜在活性,以土施150 kg/hm2同时叶面喷施0.4%硫酸镁肥时表现最好;当施镁量过大,叶片气孔开放受到抑制,光合速率降低。
[1] Beale S.Enzyrnes of chlorophyll biosynthesis[J].Photosynthesis Research,1999,60:43-73.
[2] 王芳,刘鹏,朱靖文.镁对大豆游离脯氨酸、可溶性糖和可溶性蛋白质含量的影响[J].河南农业科学,2004,(6):35-38.
[3] Guo J H,Liu X J,Zhang Y,et al.Significant acidification in major Chinese croplands[J].Science,2010,327:1008-1010.
[4] 白由路,金继运,杨俐苹.我国土壤有效镁含量及分布状况与含镁肥料的应用前景研究[J].土壤肥料,2004,(2):3-5.
[5] 韩艳婷,杨国顺,石雪晖,等.不同镁营养水平对红地球葡萄叶绿体结构及光合响应的影响[J].果树学报,2011,28(4):603-609.
[6] Yang G H,Yang L T,Jiang H X,et al.Physiological impacts of magnesium deficiency in Citrusseedlings:photosynthesis,antioxidant system andcarbohydrates [J].Trees,2012,26:1237-1250.
[7] 谢小玉,刘晓建,刘海涛.不同温度下镁胁迫对黄瓜光合特性和活性氧清除系统的影响[J].植物营养与肥料学报,2009,15(5):1231-1235.
[8] 刘厚诚,陈细明,陈日远,等.缺镁对菜薹光合作用特性的影响[J].园艺学报,2006,33(2):311-316.
[9] 李港丽,苏润,宇沈隽.几种落叶果树叶内矿质元素含量标准值的研究[J].园艺学报,1987,14(2):81-88.
[10] 鲍士旦.土壤农化分析(第三版)[M].北京:中国农业出版社,2000.67-72.
[11] 张宪政.植物叶绿素含量测定—丙酮乙醇混合液法[J].辽宁农业科学,1986,(3):26-28.
[12] 许大全.光合作用效率[M].上海:上海科学技术出版社,2002.84-88.
[13] 朱立保,刘海河,张彦萍,等.镁对厚皮甜瓜坐果节位叶片叶绿素荧光特性和活性氧清除系统的影响[J].植物营养与肥料学报,2015,21(5):1279-1285.
[14] 关广晟,屠乃美,肖汉乾,等.镁对烟草生长及叶片叶绿素荧光参数的影响[J].植物营养与肥料学报,2008,14(1):151-155.
[15] 尤鑫,龚吉蕊.叶绿素荧光动力学参数的意义及实例辨析[J].西部林业科学,2012,10(5):90-94.
[16] Demmig B,Bjorkman O.Comparison of the effect of excessive light on chlorophyll fluorescence(77K)and photon yield of O2evolution of leaves of higher plants[J].Planta,1987,171(2):171-184.
[17] Ji X B,Hollocher T C.Reduction of nitrite to nitricoxide by enteric bacteria[J].Biochem Biophys Res Commun,1988,157(1):106-108.
[18] Demmig-Adams B,Adams W W,Barker D H,et al.Using chlorophyll fluorescence toassess the fraction of absorbed light allocated to thermal dissipation of excess excitation[J].Physiologia Plantarum,1996,98(2):253-264.
[19] 汪洪,褚天铎.植物镁素营养的研究进展[J].植物学通报,1999,16(3):245-250.
[20] 林丽琳,陈晟,施木田,等.镁对新天玲西瓜叶片光合色素、可溶性蛋白含量和硝酸还原酶活性的影响[J].热带农业科学,2015,35(1):26-31.
[21] 韩艳婷.葡萄镁营养生理机制研究[D].长沙:湖南农业大学,2011.3-4.
[22] 李延,刘星辉,庄卫民.缺镁对龙眼光合作用的影响[J].园艺学报,2001,28(2):101-106.
[23] 凌丽俐,彭良志,曹立,等.缺镁对北碚447锦橙光合作用特性的影响[J].果树学报,2009,26(3):275-280.
[24] 孙晓娥,刘兆普,隆小华,等.不同供镁水平对两菊芋品种幼苗生物量、光合和叶绿素荧光特性的影响[J].生态学杂志,2012,31(4):823-829.
[25] Farquhar G D,Sharkey T D.Stomatal conductance and photosynthesis[J].Ann Rev.Physiol,1982,33:317-345.
[26] 杨广东,朱祝军,计玉妹.不同光强和缺镁胁迫对黄瓜叶片叶绿素荧光特性和活性氧产生的影响[J].植物营养与肥料学报,2002,8(1):115-118.
[27] 凌丽俐,黄摇翼,彭良志.镁缺乏和过量胁迫对纽荷尔脐橙叶绿素荧光特性的影响[J].生态学报,2014,4(34):1672-1679.
[28] 苏仲,曹敏建,盛耀辉,等.镁肥对玉米功能叶光系统Ⅱ荧光特性的影响[J].浙江大学学报(农业与生命科学版),2011,37(5):540-544.
