KDM2B过表达慢病毒载体构建及其在人卵巢癌细胞中的表达
2018-03-19蒙家华况燕卢芳芳易叶叶徐红
蒙家华,况燕,卢芳芳,易叶叶,徐红
(广西医科大学第一附属医院,南宁530021)
表观遗传机制包括DNA甲基化、非编码RNA调节、染色质重塑和组蛋白修饰,参与调节真核细胞的多种生理功能。因此,细胞调控任何部分的表观遗传变化都可能导致细胞功能异常,引起多种疾病。其中赖氨酸特异性脱甲基酶2B(KDM2B)是组蛋白H3第36位赖氨酸残基和第4位赖氨酸残基的特异性去甲基化酶,通过影响组蛋白的甲基化状态对其靶基因的表达发挥表观调控作用。研究发现,组蛋白甲基化异常参与调控多种恶性肿瘤的发生发展。组蛋白甲基化是由组蛋白去甲基化酶和组蛋白甲基转移酶的动态调节过程。KDM2B是含有JmjC、CXXC-ZF结构域的组蛋白去甲基化酶[1],能通过催化H3K36me3和H3K4me3去甲基化影响多种基因的表达,促进肿瘤的发生。有研究表明,KDM2B为抑制rRNA转录的核仁蛋白,参与细胞的增殖,促进细胞永生化,抑制细胞衰老,并在细胞形态学、趋化因子表达和成纤维细胞的代谢控制中起调节作用[2]。2016年7~11月,本研究通过构建KDM2B过表达慢病毒载体并稳定感染卵巢癌细胞株A2780及SKOV3,为进一步研究KDM2B对卵巢癌生物学行为的影响奠定基础。
1 材料与方法
1.1 材料 人卵巢癌A2780、SKOV3细胞获赠于华中科技大学同济医学院协和医院妇瘤实验室。GV358载体、AgeI/AgeI酶购自上海吉凯基因有限公司。引物设计和合成、对GV慢病毒载体的改造和病毒包装由上海吉凯基因有限公司完成。嘌呤霉素购自北京Solarbio科技有限公司,RPMI Medium 1640购于GIBCO公司,胎牛血清购于杭州四季青公司,总RNA提取试剂盒购于Axygen公司,逆转录试剂盒购于TAKARA公司,SYBR Gree Real Time PCR Mix 购于Roche 公司。PCR引物由TAKARA公司合成。细胞蛋白提取试剂盒购于北京Solarbio科技有限公司,兔抗人KDM2B多克隆抗体购于Abcan公司,兔抗人Actin抗体购于Abcan公司,辣根过氧化物酶标记的羊抗兔IgG抗体购于CST公司。
1.2 KDM2B目的片段获取 根据GeneBank提供的KDM2B信息数据(序列号NM_032590),用限制性内切酶消化获得线性化载体。PCR扩增制备目的基因片段。设计、合成含交换配对碱基、酶切位点及目的基因5′端部分序列的同源重组序列,用PCR钓取目的基因序列,KDM2B(21416-11) P1:GAGGATCCCCGGGTACCGGTCGCCACCATGGCGGGTCC-
GCAAATGGGGGGATCTGCAG,KDM2B(21416-11)
P2:TCCTTGTAGTCCATACCACTCAGTTTTTGCAGG-
AGTTTTTCTTCTAC。配制反应体系50 μL,反应条件:98 ℃ 5 min、98 ℃ 10 s、55 ℃ 10 s、72 ℃ 90 s,30个循环,72 ℃ 8 min。
1.3 KDM2B过表达慢病毒重组质粒构建 获取的PCR产物与线性化表达载体进行交换重组,重组产物进行转化,挑选阳性克隆进行PCR鉴定,并进行测序及结果分析。PCR鉴定引物,KDM2B(21416-11) P3:CAGATGGAGCGCCATGTGATC;FLAG-R-2:CCTTATAGTCCTTATCATCGTC。将正确克隆菌液扩大培养、抽提,获得高纯度质粒。对产物进行琼脂糖凝胶电泳,回收目的条带。将鉴定阳性的克隆转化子接种于适量含相应抗生素的LB液体培养基中,于37 ℃培养12~16 h,取适量菌液进行测序。
1.4 A2780、SKOV3细胞感染 感染前1 d将对数生长期的A2780及SKOV3细胞用胰酶消化,调整细胞密度,以8×104/孔接种于6孔板,于37 ℃、5% CO2培养箱内培养24 h,待细胞生长至50%~60%时,更换ENi.s培养基800 μL。根据Polybrene感染试剂说明书进行操作。以30的感染指数用LV-KDM2B过表达慢病毒感染A2780、SKOV3细胞(LV-KDM2B感染组),同时感染LV-CON作为阴性对照(LV-CON感染组),以未感染的A2780、SKOV3细胞作为空白对照组。感染72 h后电子显微镜下观察绿色荧光蛋白(GFP)的表达,并拍照。待细胞长满后,置于培养瓶中扩大培养。感染72 h后,荧光显微镜下可观察到明显的绿色荧光,GFP荧光发光率达95%以上,表明成功构建KDM2B过表达慢病毒细胞株。并于感染72 h后加入含终浓度为3 μg/mL嘌呤霉素的完全培养基培养3~5 d,获稳转细胞株。
1.5 A2780A及SKOV3细胞内KDM2B mRNA表达检测 采用RT-qPCR技术。感染96 h,收集嘌呤霉素筛选后的A2780、SKOV3细胞,TRIzol法提取细胞总RNA,Thermo NANODROP 2000f分光光度计检测RNA浓度与纯度。用Takara逆转录试剂盒将总RNA逆转录为cDNA。以cDNA为模板,扩增KDM2B及内参基因。KDM2B上游引物:5′-CTCACTGCTGTTGGCACCAC-3′、下游引物:5′-TGCTTGCAGTACCTCAGGTCAATA-3′。β-actin为内参,上游引物:5′-GCCAACACAGTGCTGTCTGG-3′、下游引物:5′-GCTCAGGAGGAGCAATGATCTTG-3′。反应体系在Agilent Mx3000p实时荧光定量PCR仪上完成。反应条件:95 ℃ 预变性10 min,95 ℃变性15 s,60 ℃退火、延伸 60 s,共40个循环,4 ℃终止。2-ΔΔCt法计算基因相对表达量。实验重复3次。
1.6 A2780A及SKOV3细胞内KDM2B蛋白表达检测 采用Western blotting法。感染96 h,收集细胞,提取细胞总蛋白,BCA法测蛋白浓度。SDS-PAGE分离胶浓度为8%,浓缩胶浓度为5%,上样孔加入变性后的蛋白样品40 μg和预染分子量Marker,电压120 V,溴酚蓝前沿到达分离胶底端处停止电泳,转移至PVDF膜上,用5% BSA封闭液封闭1 h,将膜置于一抗(Anti-KDM2B兔多克隆抗体1∶1 000,兔抗人ACTIN抗体1∶2 000)中,4 ℃孵育过夜,TBST每次5 min,漂洗膜3次,加入二抗(羊抗兔IgG 1∶1 000)中室温摇床避光孵育1 h,TBST漂洗膜3次,采用Odyssey红外荧光扫描系统扫膜并拍照。以目的蛋白灰度值比内参蛋白灰度值作为目的蛋白相对表达量。实验重复3次。
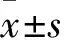
2 结果
2.1 KDM2B过表达慢病毒载体的构建结果 PCR产物进行琼脂糖凝胶电泳分析结果显示,PCR产物大小为4 052 bp,与预期大小一致。线性化载体和目的基因扩增产物实现环化后,挑取单克隆行PCR鉴定显示阳性转化子产物大小为964 bp,与预期相符。挑取出的阳性克隆子测序结果显示,与目标序列完全一致,表明KDM2B过表达重组质粒已成功构建。
2.2 各组A2780、SKOV3细胞中KDM2B mRNA表达比较 以LV-CON感染组细胞KDM2B mRNA表达量为1,LV-KDM2B感染组A2780细胞中KDM2B mRNA表达升高(77.59±13.67)倍,SKOV3细胞中升高(57.96±8.76)倍,较空白对照组亦有上调,比较差异均有统计学意义(P均<0.05);而LV-CON组与空白对照组比较差异无统计学意义(P均>0.05)。
2.3 各组A2780、SKOV3细胞中KDM2B蛋白表达比较 以 LV-CON组细胞KDM2B蛋白表达量为1,感染组A2780细胞中KDM2B蛋白表达升高(4.34±1.16)倍,SKOV3细胞中升高(3.93±1.6)倍,较空白对照组亦有上调,差异有统计学意义(P均<0.05);空白对照组与LV-CON组比较差异无统计学意义(P均>0.05)。
3 讨论
卵巢癌是常见的女性生殖器官恶性肿瘤之一,发病率仅次于子宫颈癌和子宫体癌[3]。因其生长部位隐蔽,早期症状及体征不明显,且缺乏简便实用的诊断方法,病死率居高不下。研究卵巢癌的发病机制,寻找有效的治疗靶点是目前亟待解决的问题。随着表观遗传学的发展及其对肿瘤调控机制不断深入研究,组蛋白修饰在肿瘤发生发展中的作用也引起重视。组蛋白修饰能够介导抑癌基因的沉默失活,激活癌基因。恶性肿瘤的发生及进展依赖于连续的遗传和表观遗传改变,这些变化可能以细胞自主的方式发生,或者来自周围基质的环境信号。多项研究表明,表观遗传学改变可能是多种恶性肿瘤发生发展的重要分子机制。
KDM2B是含有JmjC、CXXC-ZF结构域的组蛋白去甲基化酶,具有H3K4me3、H3K36me2去甲基化酶活性,通过影响组蛋白甲基化水平调节基因表达。近年来对KDM2B在癌症中的作用和机制已进行了较多的研究,但其在机体中的生物学行为及作用相当复杂。研究结果表明,KDM2B在多种恶性肿瘤细胞中高表达[4]。近年来的研究显示,KDM2B在人类睾丸、脾脏和胸腺组织中表达最高[5],在乳腺癌、膀胱癌和胰腺癌组织中亦有较高表达[4,6,7]。Andricovich等[8]研究证明,KDM2B在造血系统恶性肿瘤的进展中起关键作用。Zhao等[9]发现,KDM2B在胃癌细胞中表达升高,KDM2B表达下调可诱导肿瘤细胞自噬,抑制细胞增殖。过表达KDM2B可通过与迁移相关基因启动子区域结合,在迁移中起关键作用,从而使细胞更具侵袭性[10]。但KDM2B在早期脑瘤组织中低表达,且过表达KDMB可抑制HeLa细胞生长和增殖[11]。有报道称,KDM2B表达下调导致女性X染色体失活特异性转录物过度表达,引起胚胎发育异常和早期死亡[12]。而最近研究发现,KDM2B表达下调可抑制卵巢癌细胞在体内外的增殖与迁移[13],与上述研究结果相反。KDM2B沉默可提高肿瘤坏死因子相关凋亡诱导配体敏感性、活化Caspase-8、Caspase-7及PARP切割,进而促进细胞凋亡[14]。Frescas等[2]还观察到,KDM2B可通过抑制核糖体RNA的转录,干扰肿瘤细胞的增殖和代谢;并认为KDM2B在人类胶质母细胞瘤中起抑制肿瘤的作用。综合以上研究,推测KDM2B的生物学功能在不同组织学类型的肿瘤中是有区别的,其确切机制有待进一步研究。
尽管研究发现KDM2B与肿瘤的发生发展密切相关;但其在卵巢癌细胞中的作用仍未阐明。我们前期研究发现,KDM2B在卵巢癌组织中过表达;体外敲低实验显示,沉默KDM2B的表达可以抑制卵巢癌细胞的生物学行为。鉴于前期研究的成果,尚需通过过表达KDM2B进一步鉴定其在卵巢癌细胞中的生物学行为,论证其在卵巢癌中的功能及作用。本研究构建了KDM2B过表达慢病毒载体LV-KDM2B,感染并获得稳定表达KDM2B的A2780、SKOV3细胞株。结果表明,细胞KDM2B mRNA及蛋白表达均增加。成功构建的KDM2B过表达慢病毒载体,可用于后续的实验研究。
本研究成功构建了过表达KDM2B的A2780/SKOV3稳定细胞株,通过慢病毒介导的方法,提高KDM2B在卵巢癌细胞中的表达,为探明卵巢癌发生发展的分子机制及精准靶基因治疗的研究开发提供新思路。
[1] Tsukada Y, Fang J, Erdjument-Bromage H, et al. Histone demethylation by a family of JmjC domain-containing proteins[J]. Nature, 2006,439(7078):811-816.
[2]Frescas D, Guardavaccaro D, Bassermann F, et al. JHDM1B/FBXL10 is a nucleolar protein that represses transcription of ribosomal RNA genes[J]. Nature, 2007,450(7167):309-313.
[3] 张青冬,汪萍萍,冯晓萍.miR-204在卵巢癌中的表达及对卵巢癌细胞增殖、侵袭的影响[J].现代肿瘤医学,2017,25(16):2632-2635.
[4] Kottakis F, Foltopoulou P, Sanidas I, et al. NDY1/KDM2B functions as a master regulator of polycomb complexes and controls self-renewal of breast cancer stem cells[J]. Cancer Res, 2014,74(14):3935-3946.
[5] Pfau R, Tzatsos A, Kampranis SC, et al. Members of a family of JmjC domain-containing oncoproteins immortalize embryonic fibroblasts via a JmjC domain-dependent process[J]. Proc Natl Acad Sci U S A, 2008,105(6):1907-1912.
[6] Kottakis F, Polytarchou C, Foltopoulou P, et al. FGF-2 regulates cell proliferation, migration, and angiogenesis through an NDY1/KDM2B-miR-101-EZH2 pathway[J]. Mol Cell, 2011,43(2):285-298.
[7] Tzatsos A, Paskaleva P, Ferrari F, et al. KDM2B promotes pancreatic cancer via Polycomb-dependent and -independent transcriptional programs[J]. J Clin Invest, 2013,123(2):727-739.
[8] Andricovich J, Kai Y, Peng W, et al. Histone demethylase KDM2B regulates lineage commitment in normal and malignant hematopoiesis[J]. J Clin Invest, 2016,126(3):905-920.
[9] Zhao E, Tang C, Jiang X, et al. Inhibition of cell proliferation and induction of autophagy by KDM2B/FBXL10 knockdown in gastric cancer cells[J]. Cell Signal, 2017,36:222-229.
[10] Rohde M, Sievers E, Janzer A, et al. Overexpression of histone demethylase Fbxl10 leads to enhanced migration in mouse embryonic fibroblasts[J]. Exp Cell Res, 2016,348(2):123-131.
[11] Pothof J, van Haaften G, Thijssen K, et al. Identification of genes that protect the C. elegans genome against mutations by genome-wide RNAi[J]. Genes Dev, 2003,17(4):443-448.
[12] Boulard M, Edwards JR, Bestor TH. Abnormal X chromosome inactivation and sex-specific gene dysregulation after ablation of FBXL10[J]. Epigenetics Chromatin, 2016,9:22.
[13] Kuang Y, Lu F, Guo J, et al. Histone demethylase KDM2B upregulates histone methyltransferase EZH2 expression and contributes to the progression of ovarian cancer in vitro and in vivo[J]. Onco Targets Ther, 2017,10:3131-3144.
[14] Kurt IC, Sur I, Kaya E, et al. KDM2B, an H3K36-specific demethylase, regulates apoptotic response of GBM cells to TRAIL[J]. Cell Death Dis, 2017,8(6):e2897.
