pIRES2-EGFP-prnd真核表达载体的构建及其在BHK细胞中的表达
2018-03-19程艳芬宁章勇冯翠萍赵孟孟安玉甫吴新涛
程艳芬 ,宁章勇 ,冯翠萍 ,赵孟孟 ,安玉甫 ,吴新涛
(1.山西农业大学食品科学与工程学院,山西太谷 030801;2.华南农业大学兽医学院,广东广州 510642)
传染性海绵状脑病(Transmissible spongiform encephalopathy,TSE)是人与动物共患的神经性疾病[1]。许多研究表明,该病是由朊蛋白质错误折叠引起的,即正常细胞内源性的朊蛋白PrPc翻译后变为富含β折叠PrPsc引起的[2-3]。但其发病机理仍然不清楚。叠朊蛋白(Prnp downstreamprion-like protein,Doppel)是由prnd基因编码的,位于朊蛋白基因的下游,与朊蛋白基因具有生化及结构的同源性,由于PrPsc是PrP的同工型,被认为是朊病毒病的病原[4],因此,分离并纯化Dpl蛋白被认为能够帮助进一步描绘PrP的功能,并鉴定PrP和Doppel与TSE的潜在相关性,然而,Doppel是否参与TSE的发生依然是一个有争议的问题。已有研究表明,Doppel参与了多种神经细胞的死亡、凋亡与退化的过程[5-7]以及多种组织学来源的肿瘤的发生[8]。因此,获得Doppel的生理生化表达是深入研究Doppel功能的必要步骤。
Doppel与PrPc虽然结构上极为相似,但是组织学分布和生理功能有明显差异[8]。目前,Doppel蛋白还无法大量从组织中纯化,而获得较纯的Doppel蛋白对于研究其结构和功能及在相关疾病中的作用至关重要。原核表达的Doppel蛋白由于缺乏翻译后折叠、加工、修饰和转运,无法精准地展示其生物学特性及生理生化功能,因此,不是研究Doppel蛋白结构和功能的首选。BHK细胞为幼地鼠肾细胞,其本身没有叠朊蛋白的表达,为实验室一直保存,转染相应表达质粒后,所检测到的叠朊蛋白全都来自克隆的载体。
本研究构建BALB/c小鼠Doppel基因prnd的重组真核表达质粒pIRES2-EGFP-prnd,并使其在BHK细胞中获得表达,为进一步研究Doppel蛋白的结构、正常的生理生化功能及其与相关疾病的关系提供了重要工具。
1 材料和方法
1.1 材料
1.1.1 质粒、菌株和细胞 BHK细胞系、大肠杆菌JM109和pMD18-T Vector为华南农业大学兽医学院病理教研室保存;pIRES2-EGFP Vector购自Clonetech公司。
1.1.2 BALB/c小鼠 其购自中山大学医学院实验动物中心,6周龄,雄性,SPF级。
1.1.3 主要试剂 DMEM等细胞培养相关试剂购自Gibco公司;RNA提取、DNA连接酶等基因克隆相关试剂购自大连宝生物工程有限公司;prnd多克隆抗体购自ProteinTech Group公司;其余试剂均为国产分析纯。
1.2 方法
1.2.1BALB/c小鼠睾丸总RNA的提取 将BALB/c小鼠麻醉后处死,取睾丸组织,按照试剂盒说明书进行总RNA提取,-80℃冰箱保存备用。
1.2.2 cDNA第一链的合成和PCR反应 按照试剂盒说明书提取cDNA,于-20℃保存。
参照GenBank登录的BALB/c小鼠prion protein-likeproteinmRNACDS区(登录号 GQ245668.1)设计1对引物,上游引物:5′-CCGCTCGAGAGGGG CATAAAGCATAGGTTC-3′,含有 Xho I位点;下游引物:5′-ATAACTGCAGGGCTCCCCTTTCCAGCCA GA-3′,含有Pst I位点。目的片断长度约为400 bp。引物由Takara公司合成。PCR反应总体积为25 μL,其中,cDNA模板2 μL,prnd基因上下游引物稀释至 12.5 pmol/L,各加 1 μL,Ex Taq 酶 0.2 μL,dNTP Mixture 2 μL,10×PCR Buffer 2.5 μL。反应条件为:94℃ 5 min;94℃ 1 min,66 ℃ 40 s,72℃ 50 s,38 个循环;最后72℃延伸10 min。
1.2.3 pMD18-T-prnd的构建和鉴定 按照常规方法构建重组质粒,经酶切和测序鉴定正确的质粒命名为pMD18-T-prnd。
1.2.4 pIRES2-EGFP-prnd的构建 对pIRES2-EGFP和pMD18-T-prnd同时进行Xho I,Pst I双酶切,常规方法进行连接、转化、提取质粒。酶切并测序确认目的片段正确插入,鉴定正确的质粒命名为pIRES2-EGFP-prnd。
1.2.5 重组质粒的转染 用常规方法复苏BHK细胞,参照转染试剂盒说明书将pIRES2-EGFP-prnd转染细胞,24,48 h后用荧光显微镜观察。
1.2.6 IFA检测 用100%甲醇固定[9]转染后24,48 h的BHK细胞,常规方法进行IFA检测,荧光显微镜观察。
2 结果与分析
2.1 prnd基因RT-PCR产物的克隆鉴定
经扩增得到1条约500bp的清晰条带。pMD18-T-prnd 经 XhoI,PstI双酶切后,获得约 500,2900bp的2条酶切片段(图1),测序结果也表明克隆成功。
2.2 pIRES2-EGFP-prnd的构建
pIRES2-EGFP-prnd的双酶切鉴定结果表明,pIRES2-EGFP-prnd构建成功(图1)。
2.3 BALB/c小鼠基因prnd在BHK细胞中的表达
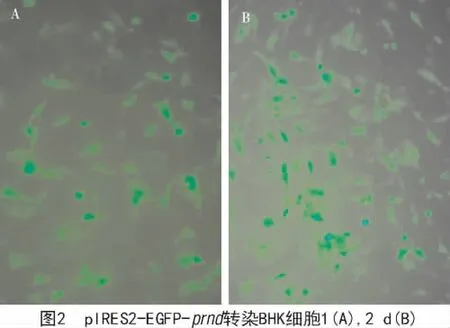
转染表达质粒到BHK细胞1,2 d后,分别用荧光显微镜观察到非常明显的荧光(图2),表明prnd基因和EGFP基因可以在BHK细胞内融合表达。
2.4 转染后BHK细胞的IFA检测
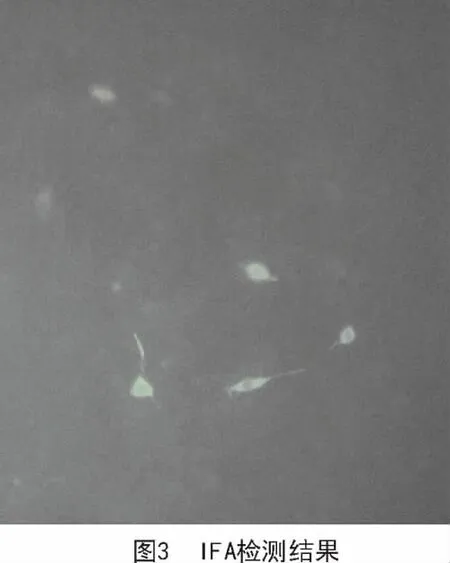
对100%甲醇固定的BHK细胞进行间接免疫荧光(IFA)检测,结果如图3所示。在荧光显微镜下,可以看到BHK细胞有荧光的表达,表明pIRES2-EGFP-prnd质粒中的prnd基因在BHK细胞中进行了转录表达,产生Doppel蛋白。

3 讨论
Doppel是朊蛋白家族的成员,至今仍不清楚其正常的生理功能。对其正常生理功能的正确诠释是研究其在相关疾病发生过程中的作用必不可少的。已有研究表明,Doppel在正常的骨髓细胞中难以被检测到,而几乎所有的骨髓疾病患者如急性骨髓白血病和骨髓发育异常综合症患者的骨髓细胞中都能检测到Doppel的表达[10-11],统计数据表明,Doppel的表达水平与骨髓疾病相关的临床或实验室指标关系不大,不能用来预测骨髓疾病的发生。但是,在骨髓发育异常综合症发展为急性骨髓白血病的过程中,Doppel的表达水平显著升高,可以作为评估临床骨髓疾病发展的依据[12]。此外,Doppel在星形细胞瘤及其他组织来源肿瘤的患者体内表达显著升高,其在这些肿瘤的发生发展过程中的功能还需要进一步研究[11,13]。获得Doppel的正常表达水平以及其表达水平升高导致的生理功能的改变是深入研究其在TSE及肿瘤等相关疾病诊断中功能的必要步骤。本研究初步构建了Doppel蛋白的基因工程细胞,为进一步研究在细胞水平上Doppel蛋白的正常结构和生物学意义以及其与相关疾病发生、发展的关系奠定了基础。
prnd的转录产物和表达产物的分布在不同组织、不同发育阶段差异很大[14]。在新生叙利亚仓鼠的大脑皮层中,只能检测到prnd mRNA的表达,Doppel蛋白的表达无法用现有手段检测到;成年后,其大脑皮层中prnd mRNA的表达也检测不到。而无论新生的还是成年的叙利亚仓鼠,睾丸是包括心、脾、脑、骨髓、肌肉中prnd mRNA及其相关蛋白的表达量最高的组织[15]。BALB/c小鼠是研究神经退行性疾病的重要动物模型,因此,用发育成熟的BALB/c小鼠的睾丸组织是提取prnd基因的最佳材料选择。
本研究将目的基因插到质粒pIRES2-EGFP绿色荧光蛋白的启动子后,与绿色荧光蛋白的基因紧密连锁,使目的基因和绿色荧光蛋白同步表达,检测灵敏度高,非常适合基因功能的研究[16-18]。BHK细胞在被甲醇固定时其内质粒载体所带的绿色荧光猝灭,不影响做IFA时用绿色荧光二抗[19-20]。
[1] PRUSINER S B.Novel proteinaceous infectious particles cause scrapie[J].Science,1982,216:136-144.
[2] PRUSINER S B.Prion protein biology[J].Cell,1998,93(3):337-348.
[3]马倩.朊蛋白错误折叠分子机制及翻译后修饰研究 [D].武汉:武汉大学,2013.
[4]XUK,WANGX,TIANC,et al.Transient expressions of doppel and its structural analog prion Delta32-121 in SH-SY5Y cells caused cytotoxicity possibly by triggering similar apoptosis pathway[J].Mol Biol Rep,2010,37(5):2549-2558.
[5] HEITA S,GRANT N J,BAILLY Y.Doppel induces autophagic stress in prion protein-deficient Purkinje cells[J].Autophagy,2009,5(3):422-424.
[6]GROSCHUP M H,BUSCHMANN A.Rodent models for prion diseases[J].Vet Res,2008,39(4):32-45.
[7]SBALCHIERO E,AZZALIN A,PALUMBO S,et al.Altered cellular distribution and sub-cellular sorting of doppel(Dpl)protein in human astrocytoma cell lines[J].Cell Oncol,2008,30(4):337-347.
[8] INVERNIZZI R,TRAVAGLINO E,BENATTI C,et al.Prion-like Doppelgene (PRND)aberrantexpression inacutemyeloid leukemias and myelodysplastic syndromes[J].Leukemia Research,2007,31:76.
[9]李颖平.间接免疫荧光抗体技术检测猪肺炎支原体 [J].山西农业科学,2016,44(11):1702-1703.
[10]王艳,李改英,张静楠,等.叠朊蛋白编码基因在白血病中的表达及意义[J].解放军医学杂志,2008,33(9):1159.
[11] TRAVAGLINO E,COMINCINI S,BENATTI C,et al.Over expression of the Doppel protein in acute myeloid leukaemias and myelodysplastic syndromes[J].Br J Haematol,2005,128:877-884.
[12]COMINCINI S,FACOETTI A,DEL VECCHIO I,et al.Differential expression of the prion-like protein doppel gene(PRND)in astrocytomas:a newmolecular marker potentially involved in tumorprogression[J].Anticancer Res,2004,24:1507-1517.
[13] FEDEROFF H J.Development of vaccination approaches for the treatment of neurological diseases[J].J Comp Neurol,2009,515(1):4-14.
[14] ROSSI D,COZZIO A,FLECHSIG E,et al.Onset of ataxia and Purkinje cell loss in PrP null mice inversely correlated with Dpl level inbrain[J].EMBOJ,2001,20:694-702.
[15]LI YR,LI Q,YANGJ M,et al.Expression patterns ofDoppel gene in golden hamster:Quantification using real-time RT-PCR[J].Molecular and Cellular Probes,2008,22:255-258.
[16]刘通,王恒,李运生,等.克隆山羊成纤维细胞系的建立与生物学特性的研究[J].华北农学报,2015,30(5):77-82.
[17] MEZENTSEV A,MASTYUGIN V,SETA F,et al.Transfection of cytochrome P4504B1 into the cornea increases angiogenic activity of the limbal vessels[J].J Pharmacol Exp Ther,2005,315(1):42-50.
[18]刘中成,王园园,邹民吉,等.pIRES2-EGFP-IL-1ra-Fcε真核表达载体的构建及鉴定 [J].分子细胞生物学报,2008,41(4):309-316.
[19]李荣芳,袁慧,刘定干.甲醇固定导致绿色荧光蛋白的荧光消失[J].细胞生物学杂志,2007,29(2):303-304.
[20]张广峰,陈祥贵,帅培强,等.细胞固定剂对GFP发光特性的研究[J].化学与生物工程,2010,27(12):38-40.
