食管鳞癌组织中ABCG2、p16表达变化及意义
2018-03-15陈晓依吕洋刘博李秀娟刘军超常楚迪
陈晓依,吕洋,刘博,李秀娟,刘军超,常楚迪
(1河北北方学院,河北张家口075000;2河北北方学院附属第一医院)
食管癌是临床常见的消化系统恶性肿瘤。研究显示,我国食管癌发病率占全部恶性肿瘤的第5位,病死率占第4位,其最常见的组织学类型为鳞状细胞癌(ESCC)[1]。目前外科手术仍为其治疗的首选方法,但早期食管癌患者术后5年总生存率仅30%;手术治疗效果差的原因主要为局部复发、远处转移,而且术后患者机体免疫力低下[2]。ABC跨膜转运体家族是人类最大的转运蛋白基因家族,其中三磷酸腺苷结合盒转运体蛋白2(ABCG2)是ABC家族转运蛋白G族第2个成员,在多种肿瘤组织中呈高表达[3]。p16基因是近年来发现的继p53基因之后的又一抑癌基因,又称为多肿瘤抑制基因,属于cyclin-CDK复合物的特异性抑制剂,且为细胞周期调控的分子开关[4]。本研究主要观察ABCG2、p16在ESCC组织中的表达变化,并探讨其临床意义。
1 资料与方法
1.1 临床资料 选择2008年1月~2009年12月河北北方学院附属第一医院行手术治疗的原发性ESCC患者136例,均经病理检查确诊,男91例、女45例,年龄27~80岁、中位年龄61岁,术前均未接受过治疗。术中留取ESCC组织。另取性别、年龄相匹配ESCC患者的正常食管黏膜组织(距癌组织>5 cm)37例份作对照。本研究患者均知情同意,且经医院伦理委员会批准。
1.2 ESCC组织及正常食管黏膜组织中ABCG2、P16蛋白表达检测 采用免疫组化SP染色法,严格按试剂盒说明书操作。取石蜡切片,经柠檬酸缓冲液(pH 6.0)高压抗原热修复,阴性对照用PBS代替。结果判定:ABCG2蛋白主要定位于细胞膜,p16蛋白主要定位于细胞核,以呈现棕黄色颗粒为细胞染色阳性。高倍镜下,每样本随机选取5个视野,计算阳性细胞百分比。阳性细胞百分比<25%计1分,25%~50%计2分,≥50%计3分;着色强度为无色计0分,灰黄色计1分,金黄色计2分,棕黄色计3分。将以上两项评分相加,<3分为表达阴性,≥3分为表达阳性[5]。以上均至少由两名病理医师在双盲条件下观察。
1.3 ESCC组织及正常食管黏膜组织中ABCG2、p16 mRNA表达检测 采用qRT-PCR法。将组织置于液氮中充分研磨,用TRIzol法提取组织细胞总RNA,参照TaKaRa试剂盒说明书进行反转录和目的基因ABCG2和p16(大连宝生物公司)的扩增,以GAPDH(大连宝生物公司)为内参。ABCG2引物(280 bp):上游5′-GGTCAGAGTGTGGTTTCTGTAGCA-3′、下游5′-GTGAGAGATCGATGCCCTGCTTTA-3′;p16引物(522 bp):上游5′-TGGCTCTGACCATTCTGT-3′、下游5′-AGCTTTGGAAGCTCTCAG-3′;GAPDH引物(452 bp):上游5′-GAAGGTGAAGGTCGGAGTC-3′、下游5′-GAAGATGGTGATGGGATTTC-3′。扩增反应体系试剂盒(大连宝生物公司)20.0 μL:SYBR®Premix Ex TaqTMⅡ 10.0 μL,Rox Reference Dye 0.4 μL,sense primer(10 pmol/μL)0.8 μL,antisense primer(10 pmol/μL)0.8 μL,dH2O 7.0 μL,cDNA模板1 μL。扩增条件:预变性95 ℃、30 s,1个循环。PCR反应:95 ℃、10 s,60 ℃、32 s,40个循环。用2-ΔΔCt法计算目的基因相对表达量。
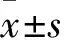
2 结果
2.1 ESCC组织及正常食管黏膜组织中ABCG2、p16蛋白阳性表达率比较 ESCC组织及正常食管黏膜组织中ABCG2蛋白阳性表达率分别为62.5%(85/136)、24.3%(9/37),p16蛋白阳性表达率分别为32.4%(44/136)、56.8%(21/37)。与正常食管黏膜组织比较,ESCC组织中ABCG2蛋白阳性表达率高(P<0.05)、p16蛋白阳性表达率低(P<0.05)。
2.2 ESCC组织及正常食管黏膜组织中ABCG2、p16 mRNA表达比较 ESCC组织及正常食管黏膜组织中ABCG2 mRNA相对表达量分别为0.76±0.06、0.58±0.04,p16 mRNA相对表达量分别为0.39±0.03、0.62±0.05。与正常食管黏膜组织比较,ESCC组织中ABCG2 mRNA相对表达量高(P<0.05)、p16 mRNA相对表达量低(P<0.05)。
2.3 ABCG2及p16蛋白阳性表达与患者临床病理参数的关系 ABCG2及p16蛋白阳性表达与肿瘤浸润深度、TNM分期及淋巴结转移有关(P均<0.05),与患者性别、年龄及肿瘤组织学分级无关(P均>0.05)。见表1。
2.4 ESCC组织中ABCG2与p16蛋白表达的相关性 ABCG2与p16蛋白在ESCC组织中的表达呈负相关(r=-0.438,P<0.05)。
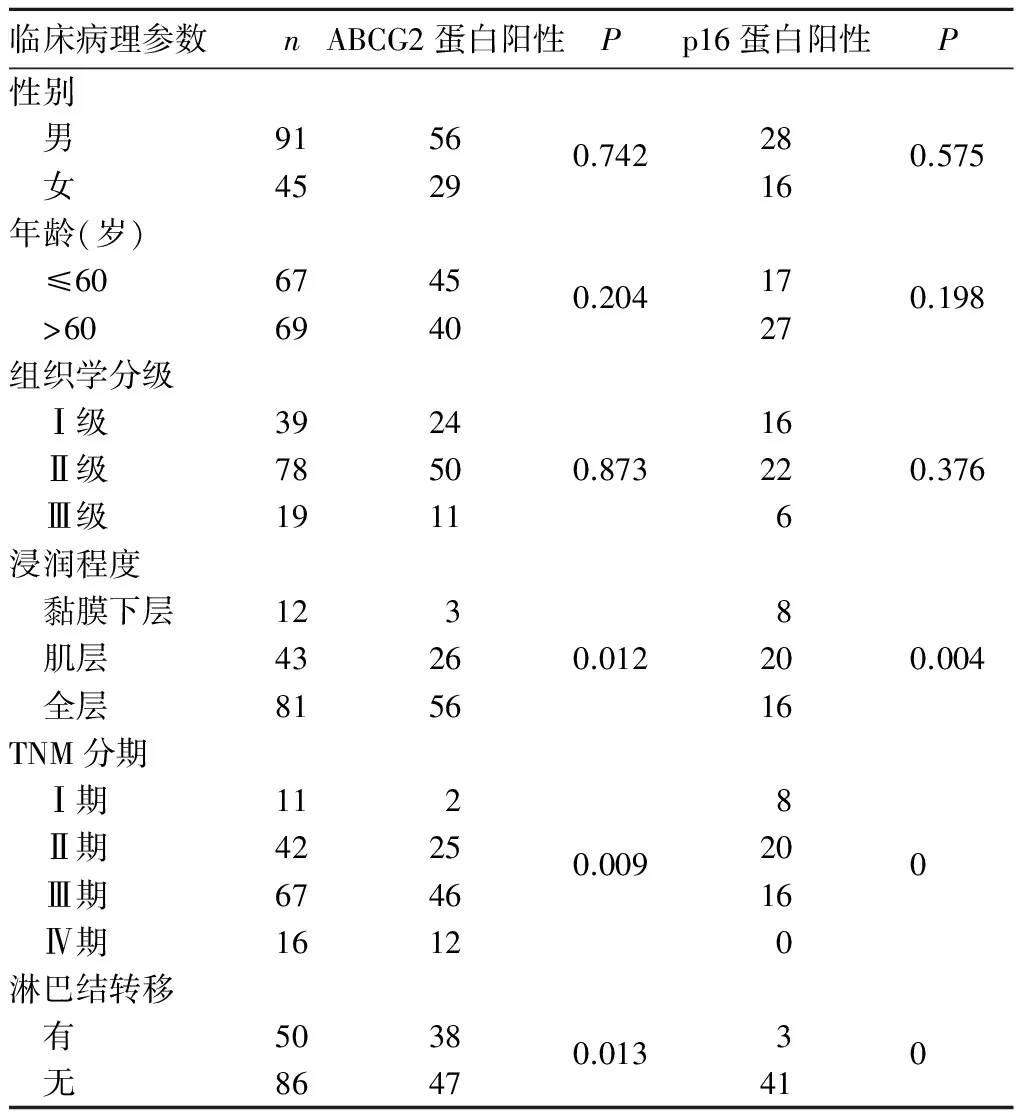
表1 ABCG2及p16蛋白阳性表达与患者临床病理参数的关系(例)
3 讨论
近年来,随着化疗药物及方案的改进,食管癌的化学治疗取得了很大的进步,但耐药仍是肿瘤化疗的主要难题之一,其对化疗效果和患者预后有较大影响。多重耐药的形成与多药耐药基因、蛋白的高表达有密切联系[6]。ABCG2又称乳腺癌耐药蛋白,是近年来发现的ABC超家族成员之一,定位在人体染色体4q22中,具有1个ATP结合位点和1个跨膜区[7]。其主要通过参与泵出细胞内的化疗药物,降低胞内药物含量,引起耐药[8]。本研究检测发现,ABCG2在ESCC组织中的阳性表达率高于正常食管黏膜组织。进一步研究发现,ABCG2蛋白阳性表达与ESCC患者性别、年龄及组织学分级无关,与肿瘤的浸润深度、TNM分期及淋巴结转移有关,肿瘤侵至全层、TNM分期高、有淋巴结转移的患者ABCG2的阳性率高。同时发现,ESCC组织中ABCG2 mRNA的相对表达量高于正常食管黏膜组织,进一步提示ABCG2高表达可能与ESCC的发生发展相关。
p16是近年来发现的抑癌基因,由148个氨基酸构成,位于9号染色体短臂21~22区(9p21~22),编码产物为含有4个独特的锚蛋白重复结构。p16在肿瘤发展过程中发生突变、缺失及甲基化导致失活,最终引起肿瘤的发生[9]。Mathew等[10]研究显示,p16的缺失与ESCC病理分期及远处器官转移相关。本研究发现,p16蛋白在ESCC组织中的阳性表达率低于食管正常黏膜组织。这说明与恶性黑色素瘤、尿路上皮癌、神经胶质瘤、前列腺腺癌和透明细胞性肾细胞癌等恶性肿瘤类似,p16在ESCC组织中的表达低于其在正常黏膜组织中的表达[11]。另外,肿瘤侵至全层、TNM分期高、有淋巴结转移的患者p16的阳性率低,这与赵醒等[12]的研究结果一致。同时发现,ESCC组织中p16 mRNA的相对表达量低于正常食管黏膜组织,以上结果均说明p16基因的低表达可能与ESCC的恶性程度有关。相关分析显示,ABCG2与p16在ESCC组织中的表达呈负相关,说明二者在ESCC的发生发展过程中可能协同作用,共同影响肿瘤的进展。
综上所述,ABCG2和p16在ESCC组织中的异常表达可能与肿瘤的发生发展相关,研究两者的表达情况有助于ESCC的辅助诊断及指导治疗。
[1] 陈万青,郑荣寿,张思维.2012年中国恶性肿瘤发病和死亡分析[J].中国肿瘤,2016,25(1):1-8.
[2] Song Y, Li L, Ou Y, et al. Identification of genomic alterations in oesophageal squamous cell cancer[J]. Nature, 2014,509: 91-95.
[3] Lagergren J, Lagergren P. Oesophageal cancer[J]. BMJ, 2010,341(261):c6280.
[4] 姚尧,邹扬.Bmi-1、p16基因与实体瘤关系的研究进展[J].实用医学杂志,2009,25(18):3162-3164.
[5] 马大烈,白辰光.免疫组织化学阳性标记结果的观察和判断[J].临床与实验病理学杂志,2003,19(5):557-559.
[6] 刘亮,左静,赵丽,等.ABCBl、ABCG2与食管癌患者多药耐药的关系[J].中国老年学杂志,2011,31(1):15-17.
[7] Joshi AA, Vaidya SS, St-Pierre MV, et al. Placental ABC transporters: biological impact and pharmaceutical significance[J]. Pharm Res, 2016,33(12):2847-2878.
[8] Stacy AE, Jansson PJ, Richardson DR.Molecular pharmacology of ABCG2 and its role in chemoresistance[J].Mol Pharmacol, 2013,84(5):655-669.
[9] 刘芳,康雪,刘晓燕,等.食管鳞状细胞癌组织P16基因启动子区CpG单位甲基化状态检测及意义[J].山东医药,2015,55(32):5-7.
[10] Mathew R, Arora S, Khanna R, et al. Alterations in p53 and pRb pathways and their prognostic significance in oesophageal cancer[J]. Eur Cancer, 2002,38(6):832-841.
[11] Al-Ansari MM, Hendrayani SF, Tulbah A, et al.p16INK4A represses breast stromal fibroblasts migration /invasion and their VEGF-A-dependent promotion of angiogenesis through Akt inhibition[J]. Neoplasia, 2012,14(12):1269-1277.
[12] 赵醒,赵宇阳,王军,等.食管鳞状细胞癌中细胞周期素D1和P16蛋白的表达及意义[J].广东医学,2015,36(2):273-276.
