三七皂苷R1不同给药方式对皮肤创伤愈合作用的影响
2018-03-15朱婷,冯玉,肖静,孙冰
朱 婷,冯 玉,肖 静,孙 冰
(1. 中国医学科学院北京协和医学院药用植物研究所药理毒理中心,北京 100193; 2. 山东中医药大学药学院,山东 济南 250355)
伤口愈合是一个复杂、动态、有序的过程,包括3个不同又相互关联的阶段,即炎症阶段、新组织形成阶段及组织重塑阶段。首先,组织损伤引发急性炎症反应,其中中性粒细胞、单核细胞和肥大细胞渗入损伤部位,并产生多种细胞因子。释放的细胞因子能够刺激多种细胞如角质细胞、成纤维细胞的增殖和迁移。最后,细胞外基质重塑、血管生成和再上皮化促使伤口闭合和疤痕形成[1-3]。
三七总皂苷是人参属中药三七的主要有效活性成分[4],具有抗炎、抗氧化、抗凋亡活性[5-7]。之前的研究表明,三七皂苷R1能明显抑制多种炎症因子的产生[8],但其对皮肤创伤愈合的影响少有报导。因此,本实验旨在通过制备小鼠皮肤创伤模型,观察三七皂苷R1对皮肤创伤愈合的影响。首先,采用3种不同给药方式(灌胃给药、腹腔给药、皮肤给药)给予三七皂苷R1,观察不同给药方式对皮肤创伤愈合的影响。基于炎症反应在皮肤组织损伤过程中占有重要地位,我们进一步从组织形态学、分子生物学等多个水平,探讨三七皂苷R1对皮肤创伤愈合及创面炎症反应的作用,为进一步深入研究其机制提供理论参考。
1 材料与方法
1.1材料
1.1.1实验动物 SPF级ICR小鼠,♂,8周龄,体质量(23±2) g,购自北京维通利华动物技术有限公司。饲养条件:于实验前1周购进ICR小鼠,动物置于温度(25~27)℃ SPF级动物实验室内,动物自由摄食,饮水。
1.1.2药品与试剂 三七皂苷R1,购自上海融禾医药科技发展有限公司,产品批号:160902;脂多糖(lipopolysaccharide,LPS),购自Sigma公司;ELISA试剂盒、RT-PCR试剂盒及引物均购自鼎国昌盛生物技术有限公司。其他试剂均为国产分析纯,水为去离子水。
1.1.3仪器 BDS200型显微镜(OPTEC公司);M1000多功能连续波长酶标仪(瑞士Tecan公司);7500型实时荧光定量PCR仪(美国Applied Biosystems公司)。
1.2方法
1.2.1动物模型的建立 ICR小鼠40只,0.5%戊巴比妥钠15 mg· kg-1腹腔注射麻醉,用电动理发器对小鼠整个背部剃毛,涂抹脱毛膏将剩余毛发除尽。背部皮肤酒精消毒后,用生理盐水对背部皮肤进行擦拭,提拉皮肤中线,用直径为5 mm的圆形打孔器对小鼠背部皮肤进行打孔,左右各1孔。酒精消毒,致伤后单笼饲养。将打孔成功的小鼠随机分为4组,每组10只: ①对照组 (Control组):腹腔注射氯化钠溶液;②灌胃组(ig组): 每天灌胃给予三七皂苷R1;③腹腔注射组(ip组):每天腹腔注射三七皂苷R1;④经皮给药组(tdd组):创面每天涂抹三七皂苷R1。各给药组三七皂苷R1剂量为每天30 mg·kg-1,持续给药14 d,分别于d 0、1、3、5、7、9、11、13、14进行拍照,采用Image-J软件计算伤口面积,并按下列公式进行计算,结果以百分数表示。伤口面积/%=实际伤口面积 /d 0伤口面积。统计d 13、14伤口完全闭合老鼠只数,按下列公式计算伤口闭合率:伤口闭合率=伤口完全闭合只数/总只数×100%。
1.2.2病理组织学切片HE染色 取腹腔注射组d 7皮肤伤口边缘及周围0.5 cm 左右宽的组织,将组织块置于4%多聚甲醛中固定5 d后,常规石蜡包埋后备用。将蜡块常规脱水,包埋,切片后,行HE染色,光镜观察皮肤及肉芽组织结构改变[9]。对伤口再上皮化百分比进行统计,再上皮化百分比=(真皮边缘间距-上皮边缘间距)/真皮边缘间距×100%。
1.2.3ELISA分析 ELISA法检测腹腔注射组d 1、3、7,肿瘤坏死因子-α (tumor necrosis factor-alpha, TNF-α)、白介素-1β (interleukin-1 beta,IL-1β)、血管细胞黏附因子-1 (vascular cell adhesion molecule-1,VCAM-1)、细胞间黏附分子-1 (intercellular cell adhesion molecule-1,ICAM-1) 蛋白表达变化。将皮肤伤口组织剪碎,匀浆器匀浆,离心取组织液上清。根据试剂盒说明书操作,酶标仪450 nm波长处测定吸光度(A)值[8]。
1.2.4实时定量RT-PCR分析 实时定量RT-PCR法检测腹腔注射组d 7的I型胶原α1链 (collagen type Ⅰ alpha 1 chain,COL1A1)、Ⅲ型胶原α1链(collagen type Ⅲ alpha 1 chain,COL3A1)、转化生长因子-β1 (transforming growth factor-beta 1,TGF-β1)、血小板源性生长因子 (platelet derived growth factor,PDGF)、血管内皮生长因子 (vascular endothelial growth factor,VEGF) 的mRNA表达水平。使用TRIzol试剂分离皮肤样品的总RNA。用Prime Script RT Master Mix试剂盒合成cDNA。使用SYBR green premix进行实时聚合酶链反应。引物序列见Tab 1[10]。 使用delta delta CT方法,所有基因表达均与内参照基因(β-actin)的标准化相同。实验结果由荧光定量PCR分析软件 Applied Biosystems Primer Express Software (version 2.0) 自动进行统计和计算[8]。

Tab 1 Primer sequence of qRT-PCR
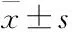
2 结果
2.1三七皂苷R1不同给药方式对小鼠皮肤伤口闭合的影响
2.1.1小鼠创面形态学观察 如Fig 1A所示,手术后d 3,给药组较对照组皮肤创面渗出液减少,伤口周围干燥,肿胀范围较小,且红色肉芽组织开始生长,表面红润,伤口周围上皮开始收缩。这些症状于手术后d 7更为明显。随着时间的延长,给药组伤口面积减少速度明显高于对照组,而腹腔注射给予三七皂苷R1在不同给药方式中效果最明显。
2.1.2对小鼠伤口面积统计 对术后d 1、3、7、14小鼠伤口面积进行计算,由Fig 1B结果可见,与对照组相比,手术后d 3、7三七皂苷R1各不同给药方式组伤口面积均有不同程度减小。手术后d 14,腹腔注射组与灌胃组差异明显,具有统计学意义(P<0.05)。
2.1.3总闭合率的统计 对手术后d 13、14伤口总闭合情况进行统计,如Fig 2所示,手术后d 13时,伤口总闭合率虽有提升,但并不明显;手术后d 14,各种给药方式给予三七皂苷R1伤口总闭合的比例均有增加。腹腔注射组接近90%的小鼠伤口全部闭合,而对照组只有25%,差异具有统计学意义(P<0.05)。
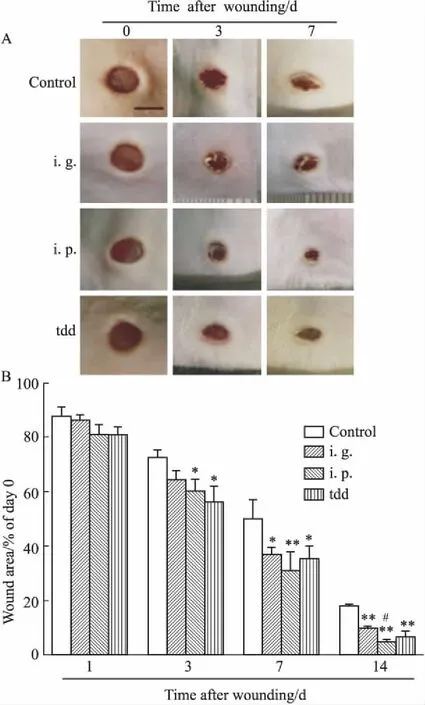
Fig 1 Effect of R1 on wound area in ICR mice by different ways of administration
A: Photographs of healing wounds of control and notoginsenoside R1 mice up to 7 days after wounding(scale bar=5 mm); B: Changes in wound area compared to day 0 (n=10).*P<0.05,**P<0.01vscontrol group;#P<0.05vsig. group.
Fig 2 Mice with total wound closure on day 13 and 14 after injury
Day 13: Control (2/8), ig. (4/8), ip. (6/8), tdd (5/8); Day 14: Control (2/8), ig. (6/8), ip. (7/8), tdd (6/8).*P<0.05vscontrol group.
2.2三七皂苷R1对小鼠皮肤伤口再上皮化的影响在伤口重新上皮化和肉芽组织形成过程中,角质细胞迁移是评估伤口愈合成功的早期标记[2]。Fig 3A的HE染色结果显示,与对照组相比,手术后d 7腹腔注射三七皂苷R1组角质细胞的迁移速度较快,以左侧图片粗细箭头之间的距离增大为证;Fig 3B进一步对伤口再上皮化过程进行定量分析,结果同样证实三七皂苷R1腹腔注射治疗的伤口重上皮化的比率明显高于对照组。
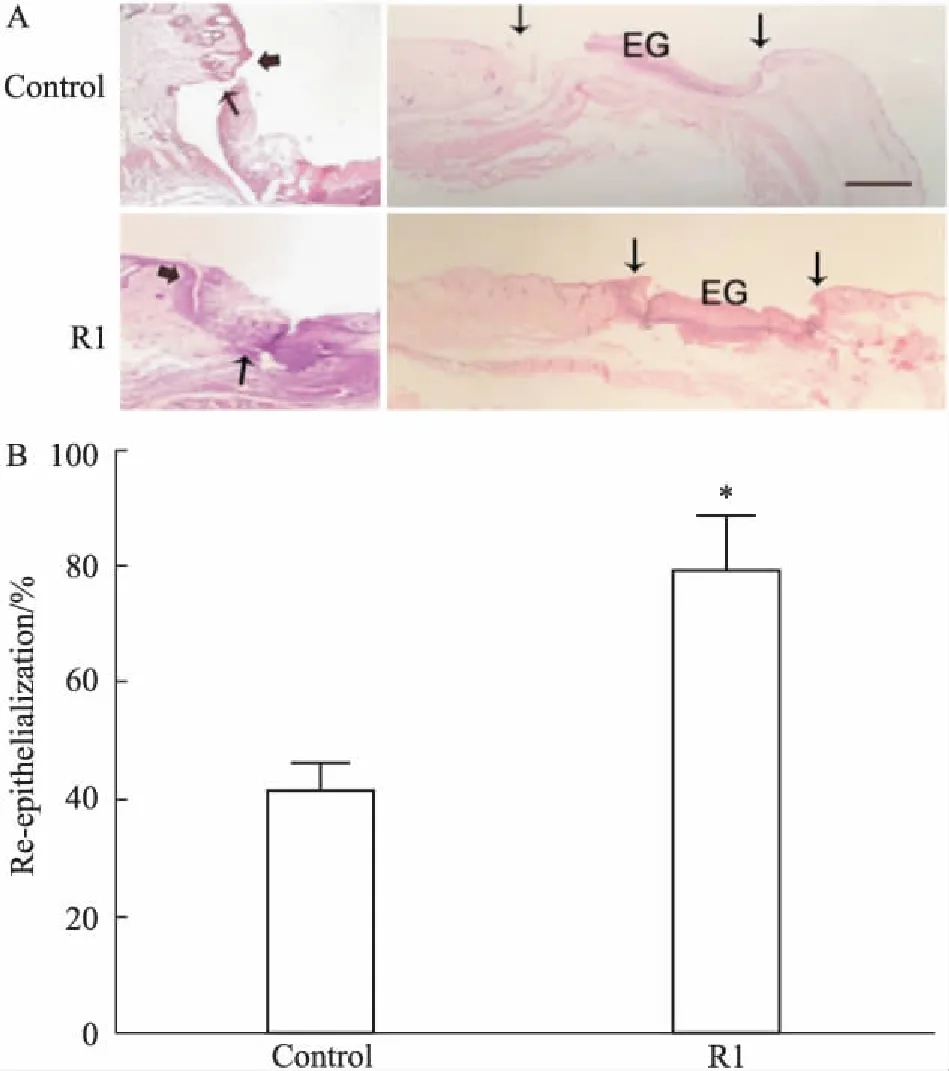
Fig 3 HE staining of wounds on day 7 post injury in ICR mice
A: Black arrowheads indicate edges of epithelium (right images), scale bar= 1 mm. Left images indicate migration of keratinocytes. Thick arrowhead indicates the beginning of migration, and thin arrowhead indicates the end of migration. Scale bar=0.2 mm. EG: epithelial gap. B: The quantified data for re-epithelialization(n=4).*P<0.05vscontrol group. R1 indicates notoginsenoside R1.
2.3三七皂苷R1对小鼠皮肤伤口TNF-α、IL-1β、ICAM-1和VCAM-1蛋白表达水平的影响Fig 4的ELISA检测结果显示,与对照组相比,腹腔注射三七皂苷R1组皮肤伤口组织的TNF-α含量在d 3、7时均降低(P<0.05),且d 3时差异较明显(P<0.01);IL-1β水平在d 3、7稍有降低,但差异无统计学意义;与对照组相比,腹腔注射三七皂苷R1组皮肤伤口组织ICAM-1和VCAM-1蛋白表达在d 3、7时均降低(P<0.05),且VCAM-1水平在d 7差异明显(P<0.01)。以上数据表明,在伤口形成后d 3、7,腹腔注射三七皂苷R1明显降低除IL-1β以外的炎症因子水平。
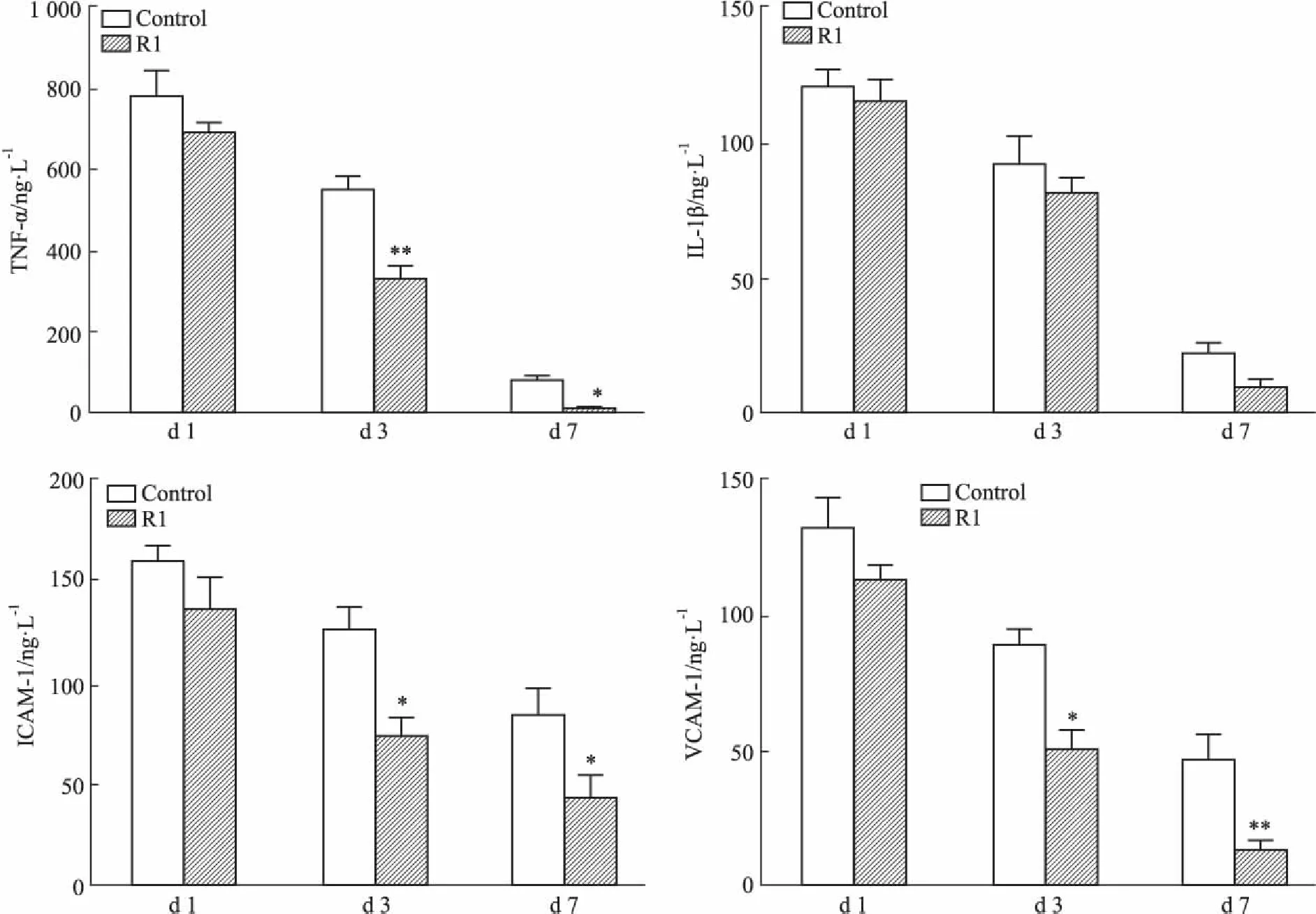
Fig 4 Effect of R1 on inflammation in ICR wounds
Wound tissues were collected on day 1, 3 and 7 for ELISA analysis. Inflammatory mediators were evaluated.*P<0.05,**P<0.01vscontrol group. R1 indicates notoginsenoside R1.
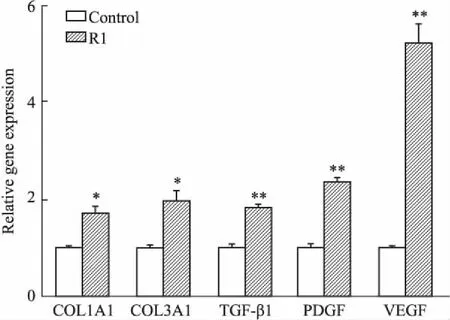
Fig 5 Effect of R1 on collagen production and neovascularization in ICR wounds
mRNA expression of COL1A1, COL3A1, TGF-β1, PDGF and VEGF in wounds on day 7 post-injury were analyzed.*P<0.05,**P<0.01vscontrol group. R1 indicates notoginsenoside R1.
2.4三七皂苷R1对小鼠皮肤伤口组织COL1A1、COL3A1、TGF-β1、PDGF、VEGF基因表达的影响Fig 5实时定量RT-PCR检测结果显示,与对照组相比,手术后d 7腹腔注射三七皂苷R1组COL1A1、COL3A1 mRNA表达水平均有不同程度的升高。腹腔注射三七皂苷R1同样可以上调TGF-β1、PDGF、VEGF的mRNA表达水平。
3 讨论
伤口愈合是指机体受到外力的作用,皮肤等组织表现出缺损后的愈合修复过程。延迟伤口愈合通常会导致局部感染,并可能潜在地导致慢性、无法愈合的伤口[11]。由巨噬细胞分泌的炎症因子,特别是TNF-α,对于真皮成纤维细胞和上皮细胞的功能起到了关键的调控作用,因此,巨噬细胞在创伤愈合过程中具有中心调节地位。研究已证实,TNF-α可以抑制伤口中I型胶原蛋白的表达,并且能够抑制TGF-β1诱导的肌成纤维细胞分化[12]和真皮成纤维细胞中胶原蛋白表达[13]。这些细胞实验结果提示,伤口组织局部TNF-α增强可以直接影响真皮成纤维细胞功能,从而抑制皮肤伤口的愈合。创伤后,为了维持内环境的稳定,机体产生先天免疫防御反应,在抵抗机体损伤、修复创伤的同时,产生一系列急性期反应。在此过程中,巨噬细胞被活化,并诱导产生多种生物活性物质(TNF-α等)。在本研究中,三七皂苷R1可以有效抑制伤口皮肤中的TNF-α表达,这说明三七皂苷R1对皮肤伤口的炎症反应具有抑制作用。另外,研究已证实,ICAM-1、VCAM-1能够与白细胞上的相应受体结合,进而调控白细胞黏附、迁移。本研究发现,伤口形成后,VCAM-1和ICAM-1的蛋白水平明显升高,腹腔注射三七皂苷R1可有效抑制二者的表达。因此,我们推测三七皂苷R1参与抑制炎症细胞的黏附,从而促进皮肤伤口的愈合。
成纤维细胞是伤口愈合过程中肉芽组织形成的主要细胞,负责合成胶原等细胞外基质(extracellular matrix, ECM)并进行伤口的重塑[14]。它们在伤口愈合中起重要作用,包括促进胶原合成和一系列生长因子的分泌。我们的研究结果表明,在小鼠的切除伤口中,腹腔注射三七皂苷R1可以增加胶原(COL1A1、COL3A1)的mRNA表达,因此,我们推测三七皂苷R1可能通过促进胶原合成,加速皮肤伤口肉芽组织形成,进而促进伤口愈合。
新生血管形成被认为在伤口修复中发挥关键的病理生理作用[1]。血管生成对于滋养新形成的肉芽组织和角质细胞的存活至关重要。在本研究中,腹腔注射三七皂苷R1可以诱导创伤组织中多种血管生成因子,如TGF-β1、VEGF、PDGF mRNA水平的明显升高。因此,我们推测三七皂苷R1可能通过影响血管生成加速伤口愈合。
从伤口面积百分比及闭合率统计结果可明显看出,3种给药方式虽都可以有效加速伤口愈合,但腹腔注射作用最为明显。原因可部分归结于腹腔注射给药,药物通过腹膜吸收,吸收面积大,药物直接吸收入血,快速调动机体先天免疫系统,控制炎症反应,从而加速皮肤伤口愈合。另外两种给药方式,灌胃给药影响药物吸收的因素较多,肝脏消除等在一定程度上影响药效。而经皮给药,因药物直接接触伤口表面,虽可以局部控制炎症反应,但同时可造成伤口表面湿润,抑制结痂,不利于伤口愈合。综上,三七皂苷R1能够抑制伤口组织炎症因子释放,在创伤损伤的炎症期降低炎症反应,减少炎性渗出,促进伤口再上皮化。这些作用有利于肉芽组织形成、胶原的合成及新血管生成,是三七皂苷R1促进创面愈合的潜在机制。根据本研究的结果,我们将应用腹腔注射三七皂苷R1进行后续研究,以深入研究三七皂苷R1加速皮肤伤口愈合的具体机制。
(致谢:本研究在中国医学科学院药用植物研究所药理毒理中心孙冰课题组实验室完成,衷心感谢课题组人员给予的大力支持与帮助。)
[1] Gurtner G C, Werner S, Barrandon Y, et al. Wound repair and regeneration [J].Nature, 2008,453(7193): 314-21.
[2] Trautmann A, Toksoy A, Engelhardt E, et al. Mast cell involvement in normal human skin wound healing: expression of monocyte chemoattractant protein-1 is correlated with recruitment of mast cells which synthesize interleukin-4invivo[J].JPathol, 2000,190(1): 100-6.
[3] Peppa M, Stavroulakis P, Raptis S A. Advanced glycoxidation products and impaired diabetic wound healing [J].WoundRepairRegen, 2009,17(4): 461-72.
[4] 王瑞幸,戴 耄,穆云萍,等. 三七皂苷R1对肺高压大鼠肺动脉平滑肌细胞 SOCE 的抑制作用[J]. 中国药理学通报,2015,31(10): 1463-8.
[4] Wang R X, Dai M, Mu Y P, et al. Inhibition of notoginsenoside R1 on SOCE in pulmonary arterial smooth muscle cells of pulmonary hypertension rats [J].ChinPharmacolBull, 2015,31(10): 1463-8.
[5] Zhang H S, Wang S Q. Notoginsenoside R1 from Panaxnotoginseng inhibits TNF-alpha-induced PAI-1 production in human aortic smooth muscle cells[J].VasculPharmacol, 2006,44(4): 224-30.
[6] Chen W X, Wang F, Liu Y Y, et al. Effect of notoginsenoside R1 on hepatic microcirculation disturbance induced by gut ischemia and reperfusion [J].WorldJGastroenterol, 2008,14(1): 29-37.
[7] Liu W J, Tang H T, Jia Y T, et al. Notoginsenoside R1 attenuates renal ischemia-reperfusion injury in rats[J].Shock, 2010,34(3): 314-20.
[8] Sun B, Xiao J, Sun X B, et al. Notoginsenoside R1 attenuates cardiac dysfunction in endotoxemic mice: an insight into oestrogen receptor activation and PI3K/Akt signalling [J].BrJPharmacol, 2013,168(7): 1758-70.
[9] 姜霁洋,徐 涵,白雪婷,等. 朱槿花苞提取物治疗皮肤疖痈溃疡及其机制研究[J]. 中国药理学通报,2015,31(8): 1085-91.
[9] Jiang J Y, Xu H, Bai X T, et al. Research in skin healing and repair function and mechanism of Hibiscus rosasinensis Linn bud extract [J].ChinPharmacolBull, 2015,31(8): 1085-91.
[10] Zhang E, Gao B, Yang L, et al. Notoginsenoside Ft1 promotes fibroblast proliferation via PI3K/Akt/mTOR signaling pathway and benefits wound healing in genetically diabetic mices [J].JPharmacolExpTher, 2016,356(2): 324-32.
[11] Lai J J, Lai K P, Chuang K H, et al. Monocyte/macrophage androgen receptor suppresses cutaneous wound healing in mice by enhancing local TNF-α expression [J].JClinInvest, 2009,119(12): 3739-51.
[12] 李汉清,可 燕. 上皮间质转化的机制研究进展 [J]. 中国药理学通报,2017,33(10): 1342-4.
[12] Li H Q, Ke Y. Mechanism of epithelial-mesenchymal transition [J].ChinPharmacolBull, 2014,33(10): 1342-4.
[13] Goldberg M T, Han Y P, Yan C, et al. TNF-alpha suppresses alpha-smooth muscle actin expression in human dermal fibroblasts: an implication for abnormal wound healing [J].J.InvestDermatol, 2007,127(11): 2645-55.
[14] Mansbridge J N, Liu K, Pinney R E, et al. Growth factors secreted by fibroblasts: role in healing diabetic foot ulcers [J].DiabetesObesMetab, 1999,1(5): 265-79.