氮素胁迫对水稻根系影响的转录组分析
2018-03-15邵彩虹钱银飞陈先茂关贤交刘光荣彭春瑞邱才飞
邵彩虹,李 瑶,钱银飞,陈 金,陈先茂,关贤交,刘光荣,彭春瑞,邱才飞
(1.江西省农业科学院 土壤肥料与资源环境研究所,江西 南昌 330200;2.农业部长江中下游作物生理生态与耕作重点实验室,江西 南昌 330200)
水稻根系不仅仅是作为植株养分和水分的吸收器官,还是包括植物激素在内的多种活性物质的合成器官,根系与地上部农艺性状密切相关,其发育状况直接影响地上部分的生长发育,尤其是根尖合成的细胞分裂素(CTK)、赤霉素(CA)能有效提高地上部的抗衰老能力[1-2]。相对于地上部位,根系有较高的可塑性,可通过改变形态和结构来适应环境的变化[3-5]。众多研究者也从植物生理学、蛋白质组学等角度对逆境条件下水稻根系生长发育特性开展了研究,结果表明,养分缺乏引起叶片合成生长素向根系极性运输发生变化,而淀粉、糖类在根系积累增加,引起根冠比增加,侧根密度降低[6-9];水稻生育后期对地上部进行适度遮荫可刺激根系生长、延缓衰老[10];蛋白质组分析显示,养分胁迫可诱导根系中参与细胞分裂、分化的蛋白质表达上调,参与木质素合成的蛋白质表达量增强,呼吸代谢减弱,是养分胁迫下水稻根系发生衰老的内在机理[11]。
长期以来,养分管理作为栽培调控的重要手段,对水稻生长发育的影响一直是栽培学研究的热点,其中对根系的研究近年来逐渐得到重视。目前,关于氮素胁迫对根系影响的研究更多的是侧重于生理方面,分子水平研究相对较少。近年来,蛋白质组学、基因组学及转录组学技术在揭示生命活动机理的研究中得到了快速发展,其中,转录组研究是通过测序技术揭示同一细胞在不同生长时期及生长环境下基因表达(RNA)情况的差异,并逐渐发展为应用最为广泛的技术[12]。研究表明,逆境条件下,植物可通过调控相关转录因子表达提高植物对逆境的耐受力,通过转录因子表达差异分析,可获得更全面的生物学信息[13-17],在揭示植物相关逆境适应机理方面具有重要的意义。
鉴于根系逆境环境响应和转录因子研究的重要性,本研究拟对氮素胁迫下水稻根系的转录组表达变化进行分析,以揭示氮素胁迫下水稻根系应答的分子机理,为栽培调控提供理论参考。
1 材料和方法
1.1 材料培养
以筛选出的不耐养分胁迫易早衰水稻品种威优916为材料,三叶一心期移栽至水培桶(15 L),每桶3苗,采用霍格兰全营养液培养,每3 d更换一次营养液;至五叶一心期设置2个处理:①对照:继续全营养液培养;②氮素胁迫:采用缺氮霍格兰营养液进行养分胁迫。每个处理设置5个重复。处理7 d后,取水稻根系,液氮速冻后保存备用。
1.2 试验方法
1.2.1 RNA提取及处理 取每个处理根尖部混合样品1 g左右,参考TaKaRa全RNA提取试剂操作说明进行根系RNA提取。
1.2.2 文库的构建及测序 水稻根系cDNA文库构建及测序均委托深圳华大公司完成。
1.2.3 转录组数据组装及基因功能注释 对水稻根系的转录组测序及对获得的数据库Unigene的全面分析和注释,均委托深圳华大公司完成。具体的数据分析流程如图1所示。
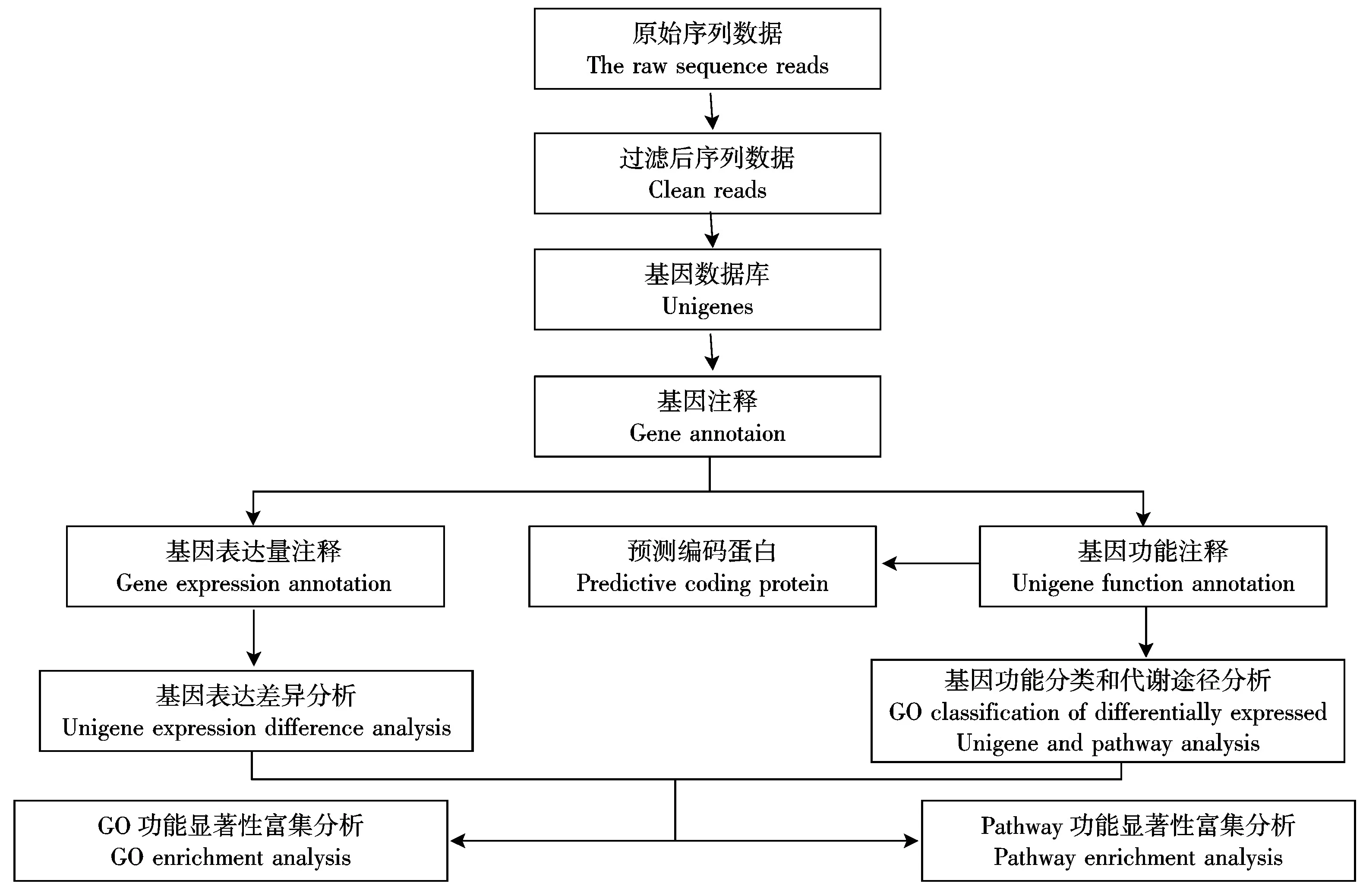
图1 转录组数据库分析Fig.1 Data analysis of digital transcriptome
2 结果与分析
2.1 根系转录组数据组装
对照根系(CKR)及氮素胁迫下处理根系(SR)转录组经测序,分别得到58 113 122,58 972 912条Raw reads,去除含adaptor的reads、N的比例(过滤后不确定的碱基比例)大于5%的reads及低质量reads,分别得到52 816 936,53 170 968条Clean reads,Q20的百分率(过滤后质量不低于20的碱基的比例)分别达到97.69%和97.57%,均大于90%,质量合格,符合后续分析要求(表1)。GC 含量(过滤后碱基G和C数占总碱基数的比例)是基因组碱基序列的重要特征之一,好的测序质量GC含量接近正态分布,本研究中,不同处理下水稻根系的 GC 含量平均值为49.61%和49.88%,显示本次测序质量较好。
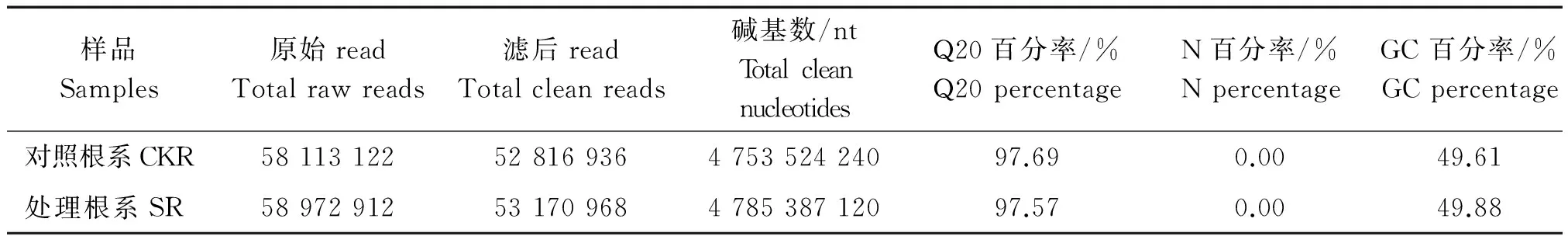
表1 测序产量统计Tab.1 Output statistics of sequencing
对获得的不同处理下威优916根系reads片段采用over-lap的方法进行拼接(表2),分别获得了106 103,107 488个Contig片段,序列长度分别达到了46 993 431,47 068 436 nt,平均长度及N50分别为443 nt、950和438 nt、938。其中,长度在200~500 nt的Contig片段分别为82 262,83 934条,比例达到了78%,长度在600~1 200 nt的Contig片段所占比例为13%,长度大于1 200 nt的Contig片段所占比例为9%(图2)。
在获得了Contig数据的基础上,进一步进行拼接,分别获得了74 239,75 006个Unigene片段(表2),其中,属于同源基因分别有19 539,19 522个,属于单独基因的分别有54 700,55 484个;序列长度达到61 524 187,62 720 962 nt。
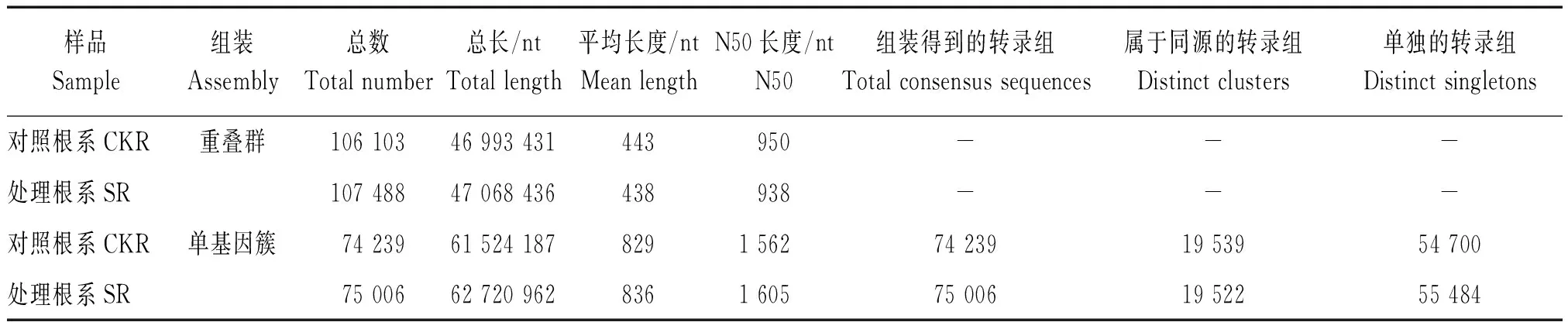
表2 组装质量统计Tab.2 Statistics of assembly quality
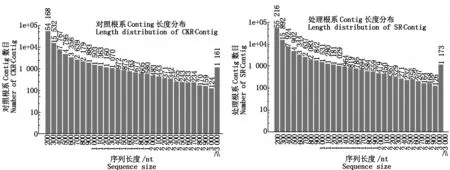
图2 根系转录组的Contig数据长度分布Fig.2 Conting data length distribution for digital transcriptome of rice root
2.2 Unigene功能注释及GO分类
数据分析显示,氮素胁迫诱导了威优916根系中4 072个Unigene的表达量发生了变化,其中,上调表达的有1 933个,下调表达的有2 139个(图3)。以log2 Ratio(SR/CKR)>2作为基因表达显著差异判断标准;共获得了2 270个在转录水平上差异显著的Unigene(表3),其中,上调表达的有1 176个,以变化为4>log2 Ratio(SR/CKR)>2的Unigene为主,占81%,下调表达的有1 094个,4>log2 Ratio(SR/CKR)>2的Unigene占53.8%,变化在12>log2 Ratio(SR/CKR)>4的占36.1%,log2 Ratio(SR/CKR)>12的占10.5%。
通过数据比对工具BlastX将Unigene序列比对到蛋白数据库NR、Swiss-Prot、KEGG及COG(evalue<0.000 01),并通过数据比对工具Blast将Unigene比对到核酸数据库Nt(evalue<0.000 01),从而获得跟给定Unigene具有最高序列相似性的蛋白,得到该Unigene的蛋白功能注释信息。
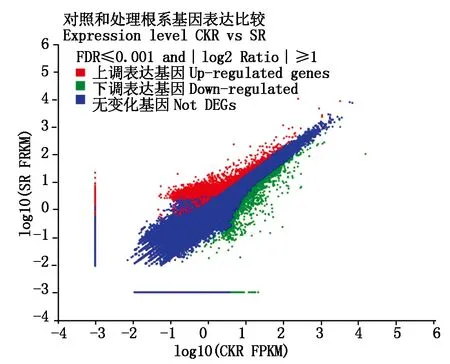
图3 不同处理下水稻根系基因差异表达Fig.3 Differentially expressed genes inrice root under different treatment
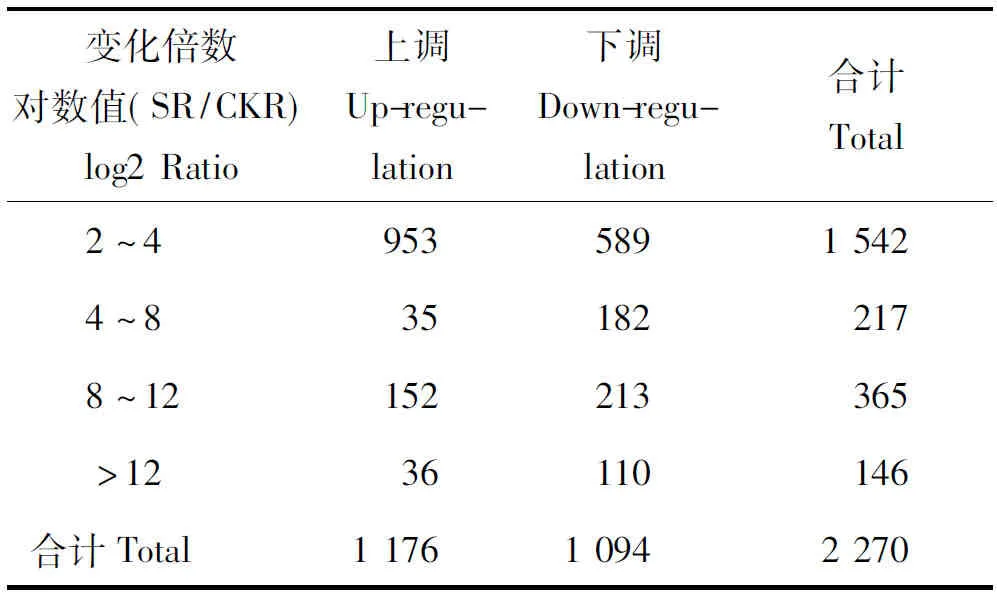
变化倍数对数值(SR/CKR)log2Ratio上调Up-regu-lation下调Down-regu-lation合计Total2~495358915424~8351822178~12152213365>1236110146合计Total117610942270
根系差异表达基因根据GO功能分类,可分为分子功能(Molecular function)、细胞组分(Cellular component)及生物学过程(Biological process)三大类,涉及48条功能分支(图4),其中,样本基因数量在1 000条以上参与生物学过程的主要聚集于细胞过程(Cellular process)和代谢过程(Metabolic process);参与细胞组分的主要聚集于细胞(Cell)、细胞组分(Cell part)、隔膜(Membrane)及细胞器(Organelle);参与分子功能的差异表达基因主要为结合(Binding)和催化活性(Catalytic activity)相关代谢途径。
2.3 根系差异表达Unigene的KEGG代谢通路分析
为进一步分析差异表达基因的生物学行为,结合KEGG数据库,对氮素胁迫下水稻根系差别异表达基因的Pathway注释进行分析。结果显示,根系差异表达Unigenes参与的主要生化代谢途径有118条(表4)。其中,涉及差异表达基因(GEGs)最多的代谢通路是核糖体(ko03010),共有404条Unigene;其次是RNA转运(ko03013,392条Unigene)、mRNA监视系统(ko03015,322条Unigene)及次生代谢生物合成(ko01110,299条Unigene),这意味着在根系mRNA监视体统下,氮素胁迫诱导根系中RNA合成大量新生的蛋白质,形成各种酶类,促使新的RNA合成,从而合成更多的新生蛋白质,线粒体及核糖体也同时形成[18],根系表现出受养分胁迫刺激而发生了伸长生长[11];而次生代谢途径相关基因的差异表达,是植株响应环境养分胁迫,提高自身生存适应性,协调植株与环境关系的重要体现[19]。
2.4 根系分化伸长相关基因的表达
养分胁迫诱导水稻根系发生了伸长生长,是一系列基因表达发生了变化,从而引起代谢变化的结果,其中生长素的变化对水稻根系的生长发育具有重要的作用。本研究中,检测到根系中负责生长素极性运输的生长素外流蛋白基因OsPIN家族基因的表达量发生了变化,基因OsPIN2、OsPIN1b及OsPIN1c的表达量均显示出受氮素胁迫诱导上调, 根系自身合成IAA途径之一是乙醛脱氢酶通过催化吲哚-3-乙醛生成吲哚乙酸,氮素胁迫下,水稻根系的乙醛脱氢酶基因CYP71A1表达量发生了下调,这些与IAA生成相关基因的变化表明,氮素胁迫诱导根系IAA积累更多来自极性运输,自身IAA合成能力下降;植物源内切β葡聚糖酶(EGase)与植物细胞伸长发育密切相关,基因EGase在氮素胁迫的水稻根系中表达量高于全营养处理,是全营养处理根系的2倍,EGase基因的表达量(Rawfragment)高达2 278,从而诱导根系细胞发生伸长,根系表现出快速生长;木质素是根系的重要组成成分,伴随大量新生根系的分化伸长,根系中参与木质素合成的肉桂酰辅酶A还原酶(CCR1)表达量在氮素胁迫下发生了上调变化,从而满足新生根系生长发育的需求(图5)。
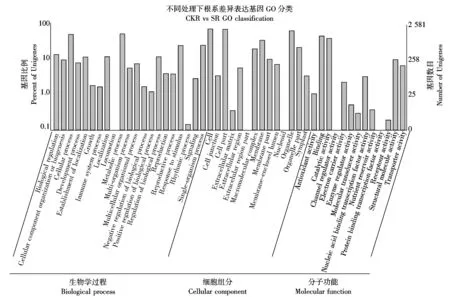
Biological regulation.生物调节;Cellular component organization or biogenesis.细胞组分组织或生物形成; Cellular process.细胞过程; Developmental process.发育过程; Establishment of localization.定位建成; Growth.生长; Immune system process.免疫系统过程; Localization.定位; Locomotion.运动力;Metabolic process.代谢过程;Multi-organism process.多-有机体过程;Multicellular organismal process.多细胞有机体过程;Negative regulation of biological process.被动的生物学调控过程;Positive regulation of biological process.主动的生物学调控过程;Regulation of biological process.生物学调控过程;Reproduction.复制;Reproductive process.复制过程;Response to stimulus.刺激反应;Rhythmic process.节律性过程;Signaling.信号;Single-organism process.单生物过程;Cell.细胞;Cell junction.细胞连接;Cell part.细胞组分;Extracellular matrix.细胞外基质;Extracellular region.胞外区; Extracellular region part.胞外区部分;Macromolecular complex.高分子复合物;Membrane.隔膜;Membrane part.隔膜部分;Membrane-enclosed lumen.膜蛋白;Nucleoid.拟核;Organelle.细胞器;Organelle part.细胞器部分;Symplast.共质体;Antioxidant activity.抗氧化剂活性;Binding.结合;Catalytic activity.催化活性;Channel regulator activity.通道调节活性;Electron carrier activity.电子载体;Enzyme regulator activity.酶调节活性;Molecular transducer activity.分子传导活性;Nucleic acid binding transcription factor activity.核酸结合的转录因子活性;Nutrient reservoir activity.营养库活性;Protein binding transcription factor activity.蛋白结合的转录因子活性;Receptor activity.受体活性;Structural molecule activity.结构分子活性;Transporter activity.转运活性。
图4 根系转录组48种GO功能分类Fig.4 48 types of gene ontology classification of the rice root transcriptome
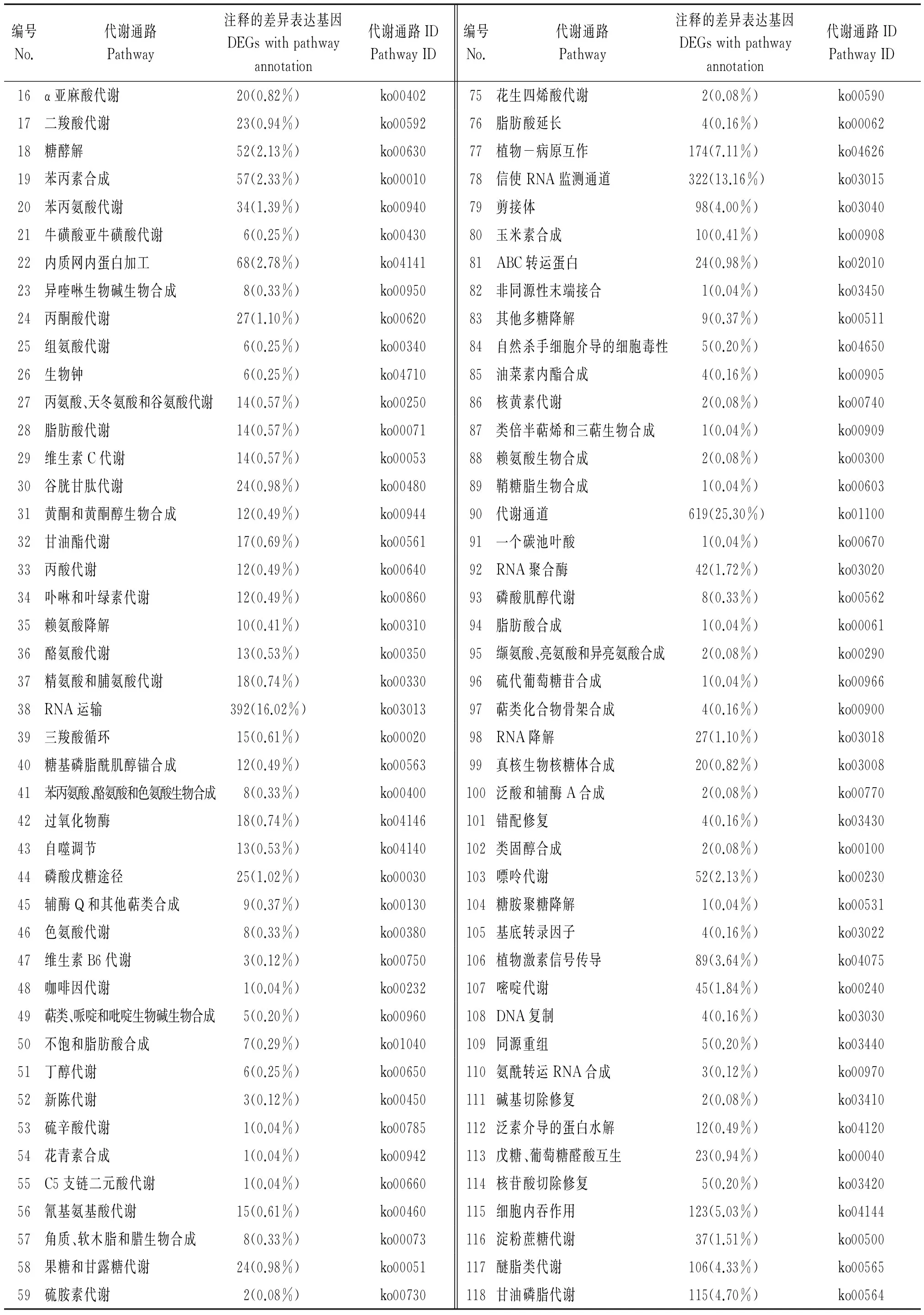
表4(续)
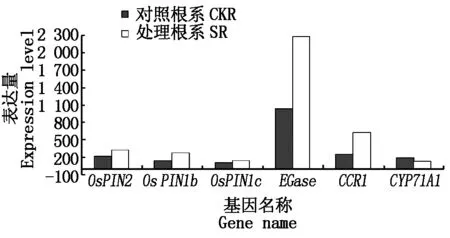
图5 水稻根系生长相关基因表达Fig.5 The growth genes expression level of rice root
3 讨论与结论
已有的研究显示,逆境条件(养分胁迫、水分胁迫)可以诱导水稻根系在短期内发生伸长生长,根冠比显著增加。生长素影响植物细胞的伸长和分裂,对植物的发育和形态建成具有重要的作用。研究显示,逆境胁迫促进生长素在根系的积累,是导致水稻根系伸长生长的内在机理之一,水稻根系的生长素一部分来自根系自身生物合成,另一部分是由地上部极性运输到根系[20],这一极性运输过程是由根系的外流运输蛋白PIN的不对称分布引起的[21]。在本研究中,检测到了外流运输蛋白PIN家族中的OsPIN2、OsPIN1b及OsPIN1c基因表达量均显示出受氮素胁迫诱导发生上调变化,另检测到与根系生长素直接合成相关的CYP71A1基因表达发生了下调变化,这些基因的变化表明,氮素胁迫引起根系自身IAA合成能力减弱,但IAA由地上部向根系极性运输增强,是根系IAA积累并引起根系快速伸长的重要因素,这一结果与Liu等[20]在玉米上采用同位素研究的结果一致。孙虎威等[6]研究结果显示,低氮胁迫诱导水稻的根冠比增加,相关基因表达检测结果表明,根系外流运输蛋白PIN家族中除OsPIN1c的表达量上调外,OsPIN1a-b、OsPIN5a-b及OsPIN9基因表达发生下调,同时根系中的生长素浓度降低。这些研究结果显示,外流运输蛋白PIN家族中相关基因表达量的变化与IAA积累密切相关,相关基因的相反变化引起了外流运输蛋白PIN的不对称分布,引起生长素的极性运输,从而引起根系发生伸长生长。
生长素作用机理基因活化学说表明,IAA的生长效应是在转录和翻译水平上促进核酸和蛋白质的合成而影响生长的,当IAA与激素受体蛋白结合后,可激活细胞内第二信使,基因开始转录和翻译,合成新的mRNA和蛋白质[22]。在本研究中,根系发生差异表达基因涉及最多的代谢通路是核糖体,其次是RNA转运、mRNA监视系统及次生代谢生物合成,这意味着氮素胁迫下,IAA通过活化相关基因,合成大量新的mRNA和新生的蛋白质,形成各种酶类,促使新的RNA合成,从而合成更多的新生蛋白质,根系大量发生,根冠比增加,这些基因的变化也印证了生长素作用机理基因活化学说。
植物源内切β葡聚糖酶(EGase)在植物的生长发育过程中具有广泛的作用,从豌豆正在伸长的黄化苗上胚轴、拟南芥的花序柄伸长区及烟草植株和根系的伸长区分离到编码EGase的相关基因,在植物的延伸区域高量表达,且与细胞伸长的快慢相对应,但在已经停止伸展的区域则不表达或低表达,表明EGase在参与植物细胞伸长发育中发挥了重要作用[23-25],而且可能直接参与了组织中的纤维素生物合成[26]。本研究中,EGase在氮素胁迫下表达量明显上调,表达量是正常氮素供应情况的2倍,这一变化结果表明,氮素胁迫诱导EGase在水稻根系发生高表达,从而引起根系细胞的伸长发育,这也是养分胁迫诱导根系快速生长的内在机理之一。
木质素是形成植物骨架的主要成分,对于植物的抗倒、抗逆和抗病起到举足轻重的作用[27],而肉桂酰辅酶A还原酶(CCR)是参与木质素特异合成途径的关键酶[28],其中基因CCR1表达部位集中在木质化程度高的部位,直接参与木质素合成[29]。本研究中,检测到参与木质素合成的基因CCR1在水稻根系中因养分胁迫诱导而发生表达量上调,参与根系细胞分化伸长的木质化过程,增强根系细胞的韧性和强度。
为深入系统地了解短期氮素胁迫对水稻根系生长发育的影响,本研究以氮素胁迫下水稻根系为材料,对水稻根系转录组表达差异进行分析,经Illumina Hiseq2000平台测序,分别获得了52 816 936,53 170 968条Clean reads,Q20的百分率分别达到97.69%和97.57%(>90%),质量合格,满足后续分析要求。数据分析结果表明,根据GO功能分类,根系发生差异表达的基因可分为生物学过程、细胞组分及分子功能三大类48个分支,经Pathway功能注释,这些差异表达基因可归类到118条生化代谢及信号转导途径。根系中参与生长素积累、细胞分化伸长、木质素合成及新生蛋白质合成的相关基因发生差异表达,是引起根系伸长的重要因素之一。为进一步验证分析根系转录组数据结果,笔者将对获得的与能量代谢 、氨基酸代谢、氮代谢及信号传导等相关的基因表达情况进行定量PCR分析,以揭示并分析氮素胁迫诱导对水稻根系生长发育影响的分子机理,为生产栽培提供理论依据。
[1] 王彦荣,华泽田,陈温福,等.粳稻根系与叶片早衰的关系及其对籽粒灌浆的影响[J].作物学报,2003,29(6):892-898.
[2] Liang Y S,Gao Z Q,Zhang X D,et al.Phenotypic correlation among root and shoot traits in an elite Chinese hybrid rice combination and its three derived populations[J].Acta Agronomica Sinica,2011,37(10):1711-1723
[3] 徐春梅,陈丽萍,王丹英,等.低氧胁迫对水稻幼苗根系功能和氮代谢相关酶活性的影响[J].中国农业科学,2016,49(8):1625-1634.
[4] 肖清铁,王经源,郑新宇,等.水稻根系响应镉胁迫的蛋白质差异表达[J].生态学报,2015,35(24):8276-8283.
[5] Lynch J.Root architecture and plant productivity[J].Plant Physiology,1995,109(1):7-13.
[6] 孙虎威,王文亮,刘尚俊,等.低氮胁迫下水稻根系的发生及生长素的响应[J].土壤学报,2014,51(5):1096-1103.
[7] Cai J,Chen L,Qu H Y,et al.Alteration of nutrient allocation and transporter genes expression in rice under N,P,K,and Mg deficiencies[J].Acta Physiologiae Plantarum,2012,34(3):939-946.
[8] 库文珍,彭克勤,萧浪涛,等.低钾胁迫对不同基因型水稻苗期根系生长和内源激素含量的影响[J].亚热带植物科学,2008,37(1):21-24.
[9] 黄 荣,孙虎威,刘尚俊,等.低磷胁迫下水稻根系的发生及生长素的响应[J].中国水稻科学,2012,26(5):563-568.
[10] 王 丽,邓 飞,郑 军,等.水稻根系生长对弱光胁迫的响应[J].浙江大学学报:农业与生命科学版,2012,38(6):700-708.
[11] 邵彩虹,李 瑶,钱银飞,等.养分胁迫对威优916生育后期根系衰老影响的蛋白质组学分析[J].华北农学报,2013,28(2):12-19.
[12] Shu S,Chen B,Zhou M,et al.De novo sequencing and transcriptome analysis ofWolfiporiacocosto reveal genes related to biosynthesis of triterpenoids[J].PLoS One,2013,8(8):e71350.
[13] Cominelli E,Galbiati M,Vavasseur A,et al.A guard-cell-specific MYB transcription factor regulates stomatal movements and plant drought tolerance[J].Current Biology,2005,15(13):1196-1200.
[14] Kim S,Kang J Y,Cho D I,et al.ABF2,an ABRE-binding bZIP factor,is an essential component of glucose signaling and its overexpression affects multiple stress tolerance[J].The Plant Journal:for Cell and Molecular Biology,2004,40(1):75-87.
[15] Zhou Y,Yang P,Cui F,et al.Transcriptome analysis of salt stress responsiveness in the seedlings of dongxiang wild rice (Oryzarufipogongriff.) [J].PLoS One,2016,11(1):e0146242.
[16] 马廷臣,陈荣军,余蓉蓉,等.全基因组分析PEG胁迫下水稻根系转录因子表达变化[J].作物学报,2009,35(6):1030-1037.
[17] Sandhu N,Raman K A,Torres R O,et al.Rice root architectural plasticity traits and genetic regions for adaptability to variable cultivation and stress conditions[J].Plant Physiology,2016,171(4):2562-2576.
[18] 谭保才,梁厚果.激动素对绿豆子叶多聚核糖体形成的促进作用及其与RNA合成的关系[J].植物学报,1992,34(10):764-770.
[19] 阎秀峰,王 洋,李一蒙.植物次生代谢及其与环境的关系[J].生态学报,2007,27(6):2554-2562.
[20] Liu J,An X,Cheng L,et al.Auxin transport in maize roots in response to localized nitrate supply[J].Annals of Botany,2010,106(6):1019-1026.
[21] Dharmasiri S,Swarup R,Mockaitis K,et al.AXR4 is required for localization of the auxin influx facilitator AUX1[J].Science,2006,312(5777):1218-1220.
[22] 王 忠.植物生理学[M].北京:中国农业出版社,1999:273-274.
[23] Shani Z,Dekel M,Tsabary G,et al.Cloning and characterization of elongation specific endo-1,4-beta-glucanase (cel1) fromArabidopsisthaliana[J].Plant Molecular Biology,1997,34(6):837-842.
[24] Wu S C,Blumer J M,Darvill A G,et al.Characterization of an endo-beta-1,4-glucanase gene induced by auxin in elongating pea epicotyls[J].Plant Physiology,1996,110(1):163-170.
[25] Shani Z,Dekel M,Roiz L,et al.Expression of endo-1,4-beta-glucanase (cel1) inArabidopsisthalianais associated with plant growth,xylem development and cell wall thickening[J].Plant Cell Reports,2006,25(10):1067-1074.
[26] Matthysse A G,Thomas D L,White A R.Mechanism of cellulose synthesis inAgrobacteriumtumefaciens[J].Journal of Bacteriology,1995,177(4):1076-1081.
[27] Guo D,Chen F,Inoue K,et al.Downregulation of caffeic acid 3-O-methyltransferase and caffeoyl CoA 3-O-methyltransferase in transgenic alfalfa.impacts on lignin structure and implications for the biosynthesis of G and S lignin[J].The Plant Cell,2001,13(1):73-88.
[28] Lacombe E,Hawkins S,Van Doorsselaere J,et al.Cinnamoyl CoA reductase,the first committed enzyme of the lignin branch biosynthetic pathway:cloning,expression and phylogenetic relationships[J].The Plant Journal :for Cell and Molecular Biology,1997,11(3):429-441.
[29] 樊飞飞,李杰勤,詹秋文,等.植物肉桂酰辅酶A还原酶基因克隆研究进展[J].中国生物工程杂志,2015,35(12):96-102.
