UV-B辐射对元阳梯田稻田土壤活性有机碳含量与温室气体排放的影响
2018-03-14李虹茹湛方栋祖艳群何永美郭先华
王 灿,李虹茹,湛方栋,李 想,李 元,祖艳群,何永美,郭先华
(云南农业大学资源与环境学院,昆明 650201)
臭氧层损耗引发的地表紫外辐射B(UV-B)增强和温室气体排放增加是被广泛关注的全球环境问题之一。稻田是大气温室气体的主要排放源之一,CH4排放量约占全球CH4排放总量的5.3%~19%,我国是水稻种植大国,稻田是中国最主要的CH4排放源之一[1-2]。我国稻田N2O的年排放量约为169 Gg N,在农业N2O排放中占比很高,CO2作为农业温室气体排放的主要成分之一,稻田系统的CO2排放也不容忽视[3-4]。地表UV-B辐射的增强会对植株、生物群落乃至生态系统产生显著影响,对农田温室气体排放和农田系统的碳循环也会产生较大影响。有研究表明,UV-B辐射对稻田温室气体的排放存在显著的影响,UV-B辐射增强会通过改变植株生理代谢过程,影响植株的根系生长和根系分泌物的分泌情况,进而改变根际土壤微生物活性及组分,最终影响冬小麦、大豆、水稻等农田N2O与CH4等温室气体的排放状况,显著影响作物的CO2排放,且对稻田CH4排放通量和累积排放量的影响作用显著,显著改变CH4的日排放规律[5-8]。胡正华等[7]研究发现UV-B辐射会促进稻田土壤N2O排放,增加稻田平均N2O排放通量,却抑制CH4排放。也有研究表明UV-B辐射增强可显著提高稻田CH4和N2O排放通量和累积排放量,增加稻田CH4和N2O排放的综合增温潜势[8-9]。因此,UV-B对稻田温室气体的影响值得进一步深入研究。目前相关研究主要集中在UV-B辐射对温室气体排放规律上的影响,关于将温室气体与有机碳相结合的研究很少。
土壤活性有机碳在不同程度上反映土壤有机碳的有效性,是温室气体排放的主要碳源之一,其中土壤易氧化有机碳与CH4排放直接相关[10],溶解性有机碳与湿地系统中CO2和CH4的产生和排放的关系密切,稻田土壤中微生物碳含量与水稻CH4和CO2排放通量高度相关[11]。UV-B辐射增强对根际微生物的数量及土壤酶的活性产生显著的影响[12],而农田土壤中蔗糖酶、转化酶等有机碳相关酶活性增加有助于土壤活性有机碳、微生物量碳含量提高[13-14]。娄运生等[15]研究发现,UV-B辐射可增加大麦根区土壤微生物碳的含量。UV-B辐射也可显著促进红壤水稻土中有机碳的矿化,同时增加溶解性有机碳的含量[16]。因此,UV-B辐射增强会影响土壤活性有机碳含量,进而影响到土壤温室气体的排放,但相关研究鲜有报道。
元阳梯田是我国西南地区典型的冬水田,海拔较高,UV-B辐射较强,生态系统持续稳定,稻田终年淹水,氧化还原电位低,土壤有机碳含量丰富,持续且高通量排放 CH4[2,4,8]。关于 UV-B 辐射增强对元阳梯田稻田根际土壤微环境和CH4排放显著影响的研究已开展多年[8,17]。基于此,以元阳梯田稻田为研究对象,在水稻生长期模拟UV-B辐射增强条件,原位开展大田试验,研究UV-B辐射增强对稻田土壤碳转化相关酶活性、活性有机碳含量和温室气体排放通量的影响,分析稻田土壤碳转化酶活性-活性有机碳含量-温室气体排放通量间的关系,探讨UV-B辐射增强条件下稻田温室气体排放机理。以期为了解农田系统土壤碳转化与温室气体排放提供基础数据和科学依据。
1 材料与方法
1.1 试验地概况
试验于云南省元阳县新街镇箐口村(23°7′N,102°44′E)的梯田进行,该地属山地季风气候,多雨湿润,干湿季分明,年平均温度15℃,年均降水量1 397.6 mm,年平均蒸发量1543 mm,海拔1600 m,坡度26°,坡向 NE25°,UV-B 辐射背景值为 10 kJ·m-2·d-1,属于元阳哈尼梯田核心区[17]。梯田全年淹水,仅在每年4月份至11月份种植水稻,冬季泡田休闲,稻秸秆还田,是我国西南山地丘陵区典型的冬水田[8]。供试土壤为水耕人为土,土壤pH值5.32,有机质含量为26.8 g·kg-1,全 N 为 1.76 g·kg-1,全 P 为 0.45 g·kg-1,全 K为 16.20 g·kg-1,碱解 N 为 78.44 mg·kg-1,速效 K 为16.52 mg·kg-1,速效 P 为 15.26 mg·kg-1。
1.2 实验设计
白脚老粳在2016年3月16日播种育苗,5月9日移栽至试验小区内。实验点共布置了6个小区,每个小区面积为2.25 m×3.9 m,每个小区种植14行×16列水稻,每丛1秧苗,每个小区周边的6行和4列水稻设为保护行。在水稻生长期内不使用任何农药和化肥,整个生育期保持淹水状态。
UV-B辐射处理:选取试验小区内居中的10行水稻,在每行居中9列水稻的正上方,悬挂1支40 W的 UV-B 灯管(北京,UV308,光谱为 280~320 nm),模拟UV-B辐射增强。随水稻植株的生长不断调节灯管高度以控制辐照度(以植株上部计),用紫外辐射测定仪(北京师范大学光电仪器厂)测定297 nm波长处的辐射强度。设 0(自然光)、5.0 kJ·m-22 个处理水平,分别相当于元阳梯田0和20%的臭氧衰减(夏至日UV-B 辐射背景值为 10.0 kJ·m-2)。从水稻秧苗移栽返青至成熟收获,每天 10:00—17:00辐照 7 h(阴雨天除外)。
1.3 稻田土壤碳转化酶活性测定
分别于水稻生长的分蘖期、拔节期、孕穗期、抽穗期、成熟期采集土壤样品,使用土壤采样器S布点法采集稻田表层(0~20 cm)土壤,一个小区采集1 kg土壤,按四分法去掉多余的土壤。土壤鲜样装入低温储藏箱并迅速运回实验室,考虑到风干土会使酶活性衰减,因而直接用新鲜土样初步去除石砾杂质后过尼龙网筛进行分析[18-19]。
土壤多酚氧化酶活性的测定:取1 g土样(过0.25 mm筛)注入10 mL 1%邻苯三酚溶液,30℃培养2 h后加4 mL pH 4.5柠檬酸-磷酸缓冲液,再加35 mL乙醚,用力摇荡萃取30 min。最后,将溶解液进行比色[20]。
土壤纤维素酶活性的测定:取10 g土壤用1.5 mL甲苯处理并加5 mL醋酸盐缓冲液(pH 5.5),15 min后再加入5 mL 1%羧甲基纤维素溶液。然后37℃培养72 h后加热至100℃终止反应。过滤定容后取2.5 mL此液移入耐热试管中加50 mL蔥酮试剂,再进行比色[20]。
土壤蔗糖酶活性的测定:称5 g土样注入15 mL 8%蔗糖溶液,5 mL pH 5.5磷酸缓冲液和5滴甲苯。摇匀混合物37℃培养24 h后迅速过滤。吸取滤液1 mL,注入50 mL容量瓶中,加3 mL 3,5-二硝基水杨酸,并沸腾水浴锅加热5 min,水流下冷却3 min。最后用蒸馏水稀释,并在分光光度计上于波长508 nm处进行比色。每一土样需做无基质对照[20]。
β-葡萄糖苷酶活性:称取1 g土壤加入0.25 mL甲苯,4 mL MUB(pH 6.0),1 mL 葡葡糖苷溶液,混匀密封,在 37 ℃培养 1 h 后加入 1 mL 0.5 mol·L-1CaCl2,混匀,加入 4 mL 0.1 mol·L-1THAM(pH 12)。混匀过滤,波长400 nm处比色[20]。
1.4 稻田土壤活性有机碳含量测定
土壤溶解性有机碳(DOC)采用盛浩等[21]的研究方法,用硫酸钾溶液浸提,过0.45 μm微孔滤膜真空抽滤。滤液采用重铬酸钾-硫酸外加热容量法测定。
土壤微生物量碳(MBC)按照《土壤与环境微生物研究法》中的改进方法,采用氯仿熏蒸、0.5 mol·L-1K2SO4直接提取法提取土壤中的微生物量碳。浸提液用重铬酸钾-硫酸外加热容量法测定。需另设一组对照[22]。
土壤易氧化有机碳(LOC)采用Blair等[23]的传统方法——高锰酸钾氧化法测定。土壤样品加333 mmol·L-1的高锰酸钾溶液氧化,离心后取上清液用去离子水稀释,在565 nm的分光光度计上比色,根据高锰酸钾的消耗量,求出易氧化土壤样品的含碳量。
1.5 稻田温室气体排放测定
参照娄运生等[24]方法采用静态箱-气相色谱法收集田间气体样品。采样箱用PVC材料制成,是一个底面半径为30 cm、高度可随水稻生长情况自由调节的圆筒,用箍连接,最后盖上盖子,盖子上装有温度计和采气阀,连接处涂上凡士林以保证箱体的气密性。为减少采样过程中对周围环境的扰动,在观测点周围搭设栈桥。
气体样品分别于水稻生长的分蘖期、拔节期、孕穗期、抽穗期、成熟期进行采集。采用密封静态箱采集,每次采样时间固定在9:00—11:00之间,采样时先将箱体罩于水稻上,通过稻田淹水层液封保证静态箱气密性,盖上盖子后立即用双链球手动将箱内气体泵入到500 mL的真空铝箔气体袋中,采样时间分别为罩箱后的 0、10、20、30 min,时间间隔为 10 min。
气体样品采用Agilent 7890B气相色谱仪分析,检测器FID参数设置为:加热器210℃,H2流量40 mL·min-1,空气流量 400 mL·min-1,尾吹气流量(N2)20.871 mL·min-1,柱箱温度 50℃;色谱柱流量为2.500 mL·min-1。ECD 参数:加热器 300 ℃,尾吹流量(ArMe)2 mL·min-1,辅助加热(镍催化剂)375 ℃。CH4、CO2检测信号通过前检测器FID检测,N2O检测信号通过后检测器ECD检测。
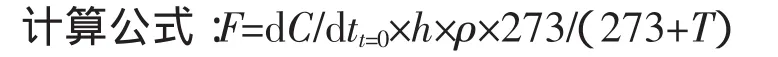
式中:F为气体排放通量;h为采样箱高度;T为箱内温度;ρ为标准状况下气体的密度;dC/dtt=0为单位时间内气体浓度线性变化率。
1.6 数据统计分析
数据使用Excel对水稻五个生长时期的数据进行统计整理,用Origin Pro9.0进行绘图,用统计软件SPSS 19.0通过单因素方差分析进行差异显著性检验与线性相关性分析。
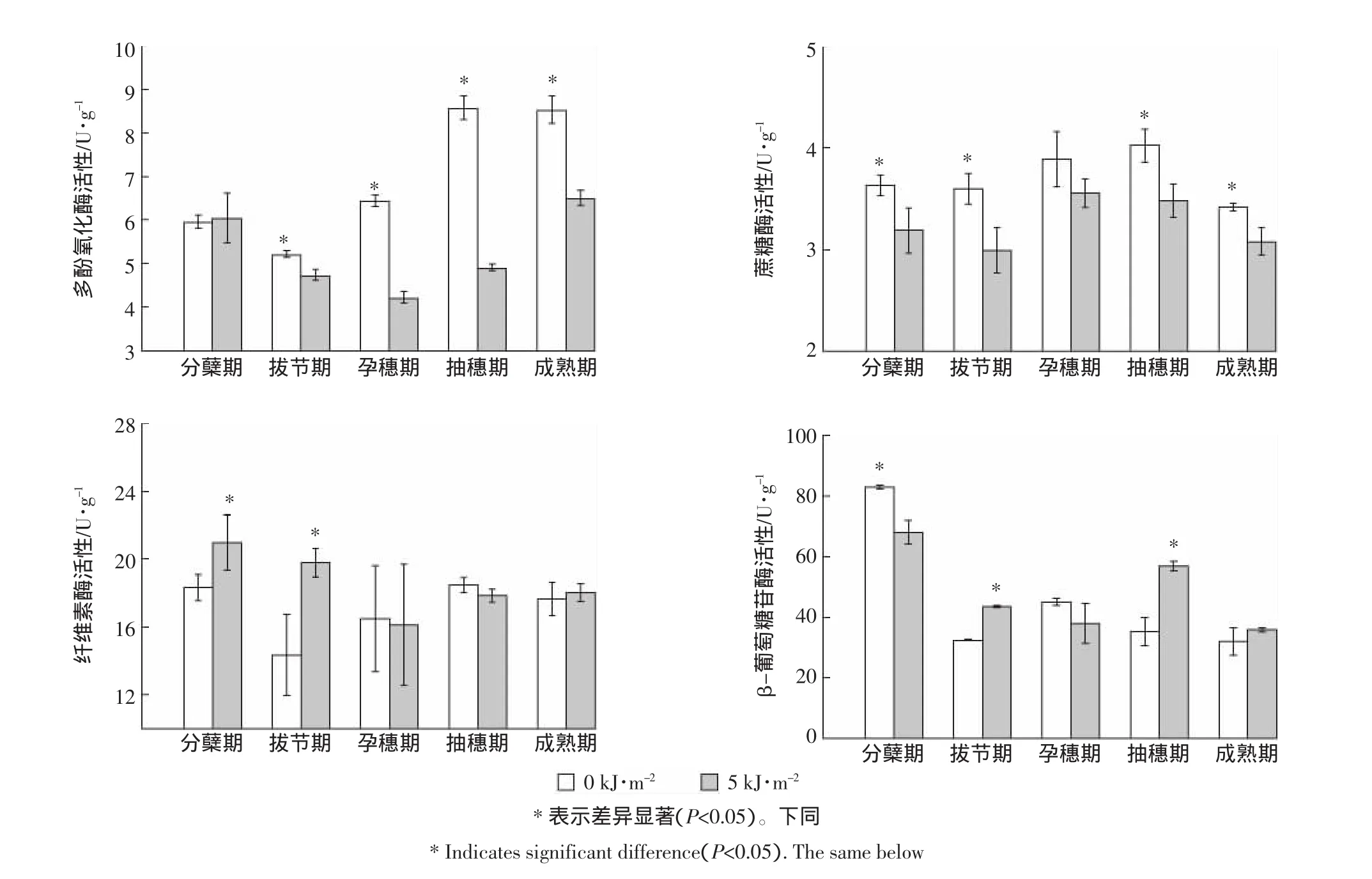
图1 UV-B辐射对土壤有机碳转化酶活性的影响Figure1 Effects of UV-B radiation on the activity of organic carbon invertase in soils
2 结果与分析
2.1 UV-B辐射增强对稻田土壤碳转化酶活性的影响
四种有机碳转化酶活性随着生育期的变化而发生变化,但不同酶之间存在差异(图1)。UV-B辐射增强处理显著降低了水稻拔节期、孕穗期、抽穗期和成熟期土壤多酚氧化酶活性(P<0.05),降幅为9%~43%。UV-B辐射增强处理显著降低水稻分蘖期、拔节期、抽穗期和成熟期土壤蔗糖酶活性(P<0.05),降低幅度为10%~17%。UV-B辐射增强处理显著升高水稻分蘖期和拔节期的土壤纤维素酶活性(P<0.05),分别增加了 2.7 U·g-1和 5.5 U·g-1,升高幅度为 14%~38%。UV-B辐射增强处理使水稻分蘖期土壤β-葡萄糖苷酶活性(P<0.05)降低18%,显著升高拔节期和抽穗期土壤β-葡萄糖苷酶活性(P<0.05)。
2.2 UV-B辐射对稻田土壤有机碳含量的影响
图2表明UV-B辐射增强处理对稻田土壤微生物量碳、易氧化有机碳和溶解性有机碳随生育期的变化有不同影响。UV-B辐射增强使土壤微生物量碳含量在水稻生长的孕穗期、抽穗期和成熟期显著降低(P<0.05),分别降低了10%、33%和36%,成熟期降幅最大。UV-B辐射增强处理显著降低孕穗期、抽穗期和成熟期土壤易氧化有机碳含量(P<0.05),降幅为9%~31.5%。综合微生物量碳与易氧化有机碳的结果发现,在水稻生育后期UV-B辐射增强处理下水稻根际土壤中两者的含量都明显降低。UV-B辐射增强处理使土壤的溶解性有机碳在水稻生长的拔节期、孕穗期和成熟期显著增加(P<0.05),分别增加了123.0、79.5 mg·kg-1和 57.8 mg·kg-1,拔节期升幅最高为 24%。
2.3 UV-B辐射对主要温室气体排放通量的影响
图3显示,UV-B辐射增强显著降低了水稻分蘖期、孕穗期、抽穗期、成熟期稻田的CH4排放通量(P<0.05),降幅为23%~42%,在抽穗期CH4排放通量最高,UV-B辐射处理后降低幅度最大。UV-B辐射增强处理显著升高了水稻分蘖期、拔节期、孕穗期、抽穗期稻田CO2的排放通量,升高幅度为41%~145%(P<0.05),UV-B辐射增强处理下在水稻生长的分蘖期CO2排放通量最高,升高幅度最大。自然光照处理下抽穗期CO2排放通量最高。UV-B辐射增强处理升高了水稻拔节期、孕穗期、抽穗期和成熟期稻田N2O的排放通量,升高幅度为11%~76%(P<0.05)。自然光照处理下分蘖期排放通量最高,UV-B辐射处理下孕穗期排放通量最高。UV-B辐射增强处理后,CO2和N2O排放通量分别平均增加 418.9 mg·m-2·h-1和 3.7 μg·m-2·h-1。
2.4 UV-B辐射对水稻植株生物量和产量的影响
分析表1,UV-B辐射增强处理降低了水稻植株的平均鲜重,但并不显著。水稻平均株高却在UV-B辐射处理后有所上升,但同样不显著。UV-B辐射增强处理显著降低了水稻的产量(P<0.05),降幅为9.3%。
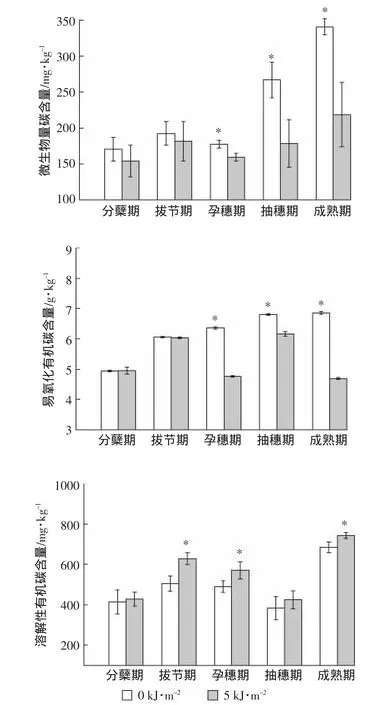
图2 UV-B辐射对稻田土壤活性有机碳含量的影响Figure2 Effects of UV-B radiation on the content of active organic carbon in the rice paddy
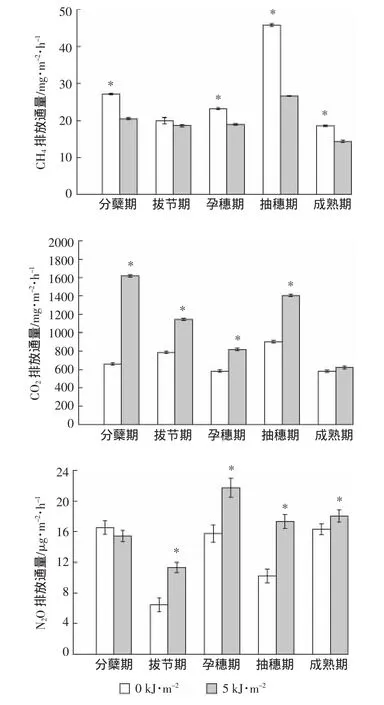
图3 UV-B辐射对稻田温室气体排放通量的影响Figure3 Effects of UV-B radiation on the greenhouse gas emissions in the rice paddy
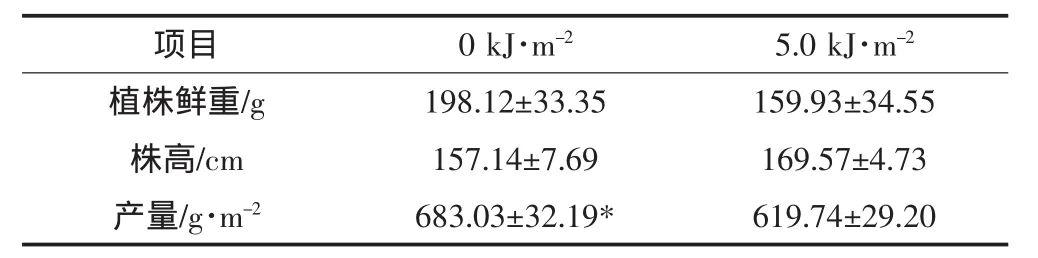
表1 UV-B辐射对水稻成熟期植株生物量和产量的影响Table1 Effects of UV-B radiation on the plant biomass and rice yield at mature stage
2.5 稻田土壤碳转化酶活性、活性有机碳含量与温室气体排放通量的相关分析
由表2可知,多酚氧化酶与微生物量碳和易氧化有机碳显著正相关(P<0.05),与溶解性有机碳显著负相关(P<0.05)。
表3中微生物量碳与CH4呈极显著正相关(P<0.01),溶解性碳与CH4显著负相关。易氧化有机碳的变化与微生物量碳的变化相近似。同时易氧化有机碳与微生物量碳显著相关(P<0.05)。
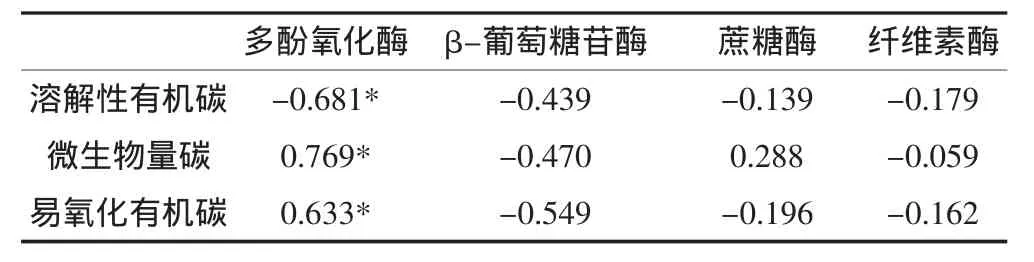
表2 稻田土壤碳转化酶活性与活性有机碳含量的相关性Table2 Correlation coefficients between carbon invertase activities and active organic carbon contents in the rice paddy
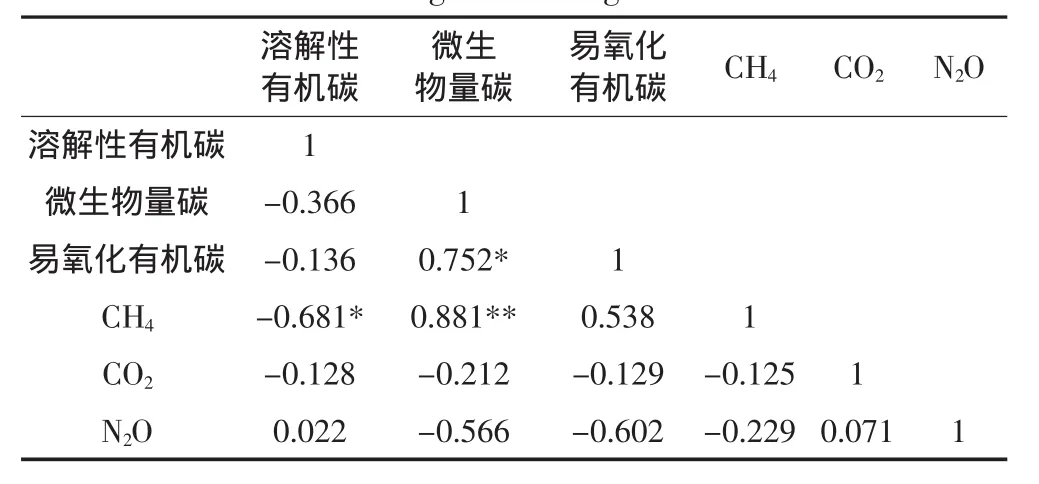
表3 土壤活性有机碳含量与温室气体排放通量的相关性Table3 Correlation coefficients between soil active organic carbon contents with greenhouse gas emissions
3 讨论
3.1 UV-B辐射对土壤活性有机碳转化的影响与机理
土壤酶是土壤生态系统的主要组成,参与土壤中大量的生化过程,活性有机碳的含量与土壤微生物数量和土壤酶活性存在紧密的关系[25-26]。在本研究中,UV-B辐射处理下土壤易氧化有机碳和微生物量碳显著降低。分析水稻生育期土壤酶活性发现,根际土壤蔗糖酶与多酚氧化酶活性在UV-B增强处理后的变化与土壤微生物量碳以及易氧化有机碳变化基本一致。土壤多酚氧化酶与微生物量碳显著正相关。这与前人研究得出的微生物生物量碳与多酚氧化酶间呈极显著正相关[27],以及土壤活性有机碳与蔗糖酶的变化趋势具有基本近似的特征等结果相一致[28]。同时实验还发现UV-B辐射处理下土壤溶解性有机碳含量增加。UV-B辐射改变有机体的生物可利用性,使微生物更容易将有机质分解成小分子释放到土壤中,土壤有机碳在辐射条件下转化为其他形式碳化合物过程中产生了大量溶解性有机碳[16]。
UV-B辐射无法直接穿透水层作用于土壤酶活性,是通过植株对UV-B辐射的响应,改变了根际土壤微环境,使得土壤有机碳相关酶活性发生变化。环境胁迫对根际微环境的影响,绝大多数是先作用于植物根系,进而由根系分泌物起作用,而不是直接对根系土壤微生物生化活动产生影响[29]。UV-B辐射增强导致水稻根系草酸和琥珀酸分泌量的增加[17],同时影响根际细菌、真菌、纤维分解菌的数量[30],对土壤微生物组成产生明显影响,进而与土壤微生物密切相关的土壤活性有机碳相关酶活性也跟着发生变化。本研究中的多酚氧化酶、蔗糖酶、纤维素酶均主要来自于微生物分泌[20]。土壤酶活性特别是多酚氧化酶、蔗糖酶等有机碳相关酶与根系分泌以及土壤微生物关系密切,结合本试验土壤酶与活性有机碳之间的相关性,可知UV-B辐射处理下活性有机碳的降低是因为UV-B辐射增强处理影响水稻根系分泌物,改变了根际微环境,从而降低根际土壤多酚氧化酶和蔗糖酶活性,削弱土壤有机质的分解以及活性有机碳的转化。进而降低土壤微生物量碳与易氧化有机碳的含量。UV-B辐射处理降低土壤有机碳转化酶的活性,特别是多酚氧化酶和蔗糖酶活性,对土壤活性有机碳转化产生很大影响。
综合本实验成熟期水稻植株株高、生物量、产量等指标,发现UV-B辐射增强处理导致土壤易氧化有机碳和微生物量碳的降低,水稻的平均有效分蘖、平均植株鲜重和水稻产量都不同程度的降低。植株生物量的降低减少植株根系分泌量,土壤活性有机碳与植株根系分泌物关系密切,一部分土壤活性有机碳直接来源于根系分泌物,因此生物量的降低也从一方面佐证了本实验的结果[31]。
3.2 UV-B辐射对温室气体排放的影响机理
稻田土壤活性有机碳与温室气体的产生关系密切,水稻根际环境的变化可显著影响稻田土壤活性有机碳转化和温室气体的产生[32-33]。土壤活性有机碳是衡量土壤碳排放能力的重要指标,特别是溶解性有机碳、微生物量碳和易氧化有机碳是土壤碳库的重要赋存形式之一,也是土壤碳排放的主要碳源,与土壤CH4和CO2的排放密切相关[34-35]。尤其是土壤易氧化有机碳与CH4排放直接相关,产甲烷菌可利用这部分有机碳产生CH4,因此易氧化有机碳可以被认为是CH4产生的主要底物[10]。同样,微生物量碳作为土壤与微生物数量高度相关的活性有机碳指标,稻田CH4排放量与微生物量碳含量显著相关[36]。本研究通过对水稻五个生育期的试验发现,水稻生育后期UV-B辐射处理下稻田CH4排放通量显著降低,与之对应的是土壤微生物量碳和易氧化有机碳的含量也产生相似变化,且微生物量碳含量与CH4排放通量呈极显著正相关。由此可知UV-B紫外辐射影响稻田土壤中有机碳的组分含量,降低稻田土壤中易氧化有机碳和微生物量碳两个与CH4排放密切相关的活性有机碳的含量[37],进而影响到CH4的产生过程,降低CH4的排放通量。
农田系统CO2的排放主要包括植物呼吸和土壤呼吸两个部分,受多种因素综合影响[38]。本实验中处理间水分温度一致。在水分温度无明显变化的情况下,土壤呼吸无明显变化[7],因而CO2排放量的增加主要得益于水稻植株呼吸作用的贡献。UV-B辐射使得一些大豆品种的幼苗光呼吸速率显著升高,会显著升高豌豆暗呼吸[39-40],高山植物麻花艽叶片的呼吸随着UV-B辐射强度增高,呼吸强度增强[41]。也有研究表明UV-B辐射对一些水稻品种的呼吸作用影响不显著[7]。这可能由于本实验种植的水稻品种为元阳梯田这一特殊的自然环境长期种植的本地水稻品种,较其他品种水稻生长的UV-B背景存在的差异,对UV-B辐射的耐性和敏感性存在地理位置的差异[42],以致UV-B辐射并未引起其呼吸机构的破坏所致,仍需电镜观察和生化分析等方面的直接证据来证明。同时UV-B增强处理下溶解性有机碳的升高也是稻田CO2排放通量增加的原因之一[43]。
本研究中UV-B辐射的增强能显著升高水稻拔节期、孕穗期、抽穗期和成熟期稻田N2O的排放通量。稻田生态系统N2O排放与土壤的硝化与反硝化作用密切相关[4]。徐鹏等[16]研究发现UV-B辐射可促进水稻土无机态氮的转化,特别是促进了NO-3-N的生成。而元阳梯田水稻的整个生长期均处于淹水状态,而土壤水分状况是影响N2O排放的因素之一,厌氧环境下NO-3-N的增加会促进稻田土壤反硝化作用,进而促进了N2O的排放[4]。这也与胡正华等[7]关于UV-B辐射提高N2O平均排放通量结果相对应。常年淹水稻田土壤的厌氧环境可能是稻田在UV-B辐射处理后N2O排放通量变化规律有别于其他作物的原因之一,但相关研究较少,仍需进一步深入的研究。
结合土壤酶与土壤活性有机碳的分析,可进一步发现UV-B辐射通过作用根际微环境改变根际土壤中活性有机碳转化的相关酶活性,特别是多酚氧化酶、蔗糖酶的活性,而土壤酶活性的变化与微生物量碳、易氧化有机碳和溶解性有机碳含量的改变,影响到温室气体的碳源,间接影响到其排放通量。
4 结论
UV-B辐射增强抑制了土壤蔗糖酶和多酚氧化酶活性,升高了水稻生育期前期土壤纤维素酶活性;UV-B辐射增强处理增加水稻生育期稻田土壤的溶解性有机碳含量,显著降低了水稻生育期后期稻田土壤微生物量碳与易氧化有机碳含量;UV-B辐射处理显著降低水稻生育期稻田CH4的排放通量,显著增加CO2和N2O的排放通量。UV-B辐射通过间接作用土壤有机碳相关酶活性,进而影响到土壤活性有机碳的转化,改变温室气体(CO2、CH4)的排放。
[1]张广斌,马 静,徐 华,等.中国稻田CH4排放量估算研究综述[J].土壤学报,2009,46(5):907-916.
ZHANG Guang-bin,MA Jing,XU Hua,et al.Literature review on estimation of methane emission from paddy fields in China[J].Acta Pedologica Sinica,2009,46(5):907-916.
[2]Yan X Y,Cai Z C,Ohara T,et al.Methane emission from rice fields in mainland China:Amount and seasonal and spatial distribution[J].Journal of Geophysical Research:Atmospheres(1984—2012),2003,108(D16):1211-1222.
[3]Zou J W,Huang Y,Lu Y Y,et al.Direct emission factor for N2O from rice-winter wheat rotation systems in Southeast China[J].Atmospheric Environment,2005,39(26):4755-4765.
[4]蔡祖聪.稻田生态系统CH4和N2O排放[M].合肥:中国科学技术大学出版社,2009.
CAI Zu-cong.Methane and nitrous emissions from rice-based ecosystems[M].Hefei:China University of Science and Technology Press,2009.
[5]Zhang F C,Jiang X D.Effects of enhanced UV-B radiation on soil respiration of barley field[J].Meteorological and Environmental Research,2010,1(6):39-41.
[6]Lou Y S,Gu X T,Zhou W L.Effect of elevated UV-B radiation on microbial biomass C and soil respiration in different barley cultivars under field conditions[J].Water,Air,&Soil Pollution,2017,3(228):1-8.
[7]胡正华,凌 慧,陈书涛,等.UV-B增强对稻田呼吸速率、CH4和N2O排放的影响[J].环境科学,2011,32(10):3018-3022.
HU Zheng-hua,LING Hui,CHEN Shu-tao,et al.Impacts of enhanced UV-B radiation on respiration rate,CH4and N2O emission fluxes from rice paddy[J].Environmental Science,2011,32(10):3018-3022.
[8]徐渭渭,何永美,湛方栋,等.UV-B辐射增强对元阳哈尼梯田稻田CH4排放规律的影响[J].生态学报,2015,35(5):1329-1336.
XU Wei-wei,HE Yong-mei,ZHAN Fang-dong,et al.Effect of enhanced UV-B radiation on CH4emission from paddy field in Yuanyang Hani Terraces[J].Acta Ecologica Sinica,2015,35(5):1329-1336.
[9]肇思迪,娄运生,张伟玮,等.UV-B增强下施硅对稻田CH4和NO2排放及其增温潜势的影响[J].生态学报,2017,37(14):4715-4724.
ZHAO Si-di,LOU Yun-sheng,ZHANG Wei-wei,et al.Effect of silicate supply on CH4and NO2emissions and their global warming potentials in a Chinese paddy soil under enhanced UV-B radiation[J].Acta Ecologica Sinica,2017,37(14):4715-4724.
[10]吴家梅,纪雄辉,霍莲杰,等.稻田土壤还原性物质特征及与甲烷排放的关联性分析[J].农业现代化研究,2014,35(5):644-648.
WU Jia-mei,JI Xiong-hui,HUO Lian-jie,et al.The characteristic of reductive material in paddy soil and its relation to methane emission[J].Research of Agricultural Modernization,2014,35(5):644-648.
[11]秦晓波,李玉娥,石生伟,等.稻田温室气体排放与土壤微生物菌群的多元回归分析[J].生态学报,2012,32(6):1812-1819.
QIN Xiao-bo,LI Yu-e,SHI Sheng-wei,et al.Multivariate regression analysis of greenhouse gas emissions associated with activities and populations of soil microbes in a double-rice paddy soil[J].Acta Ecologica Sinica,2012,32(6):1811-1819.
[12]张令瑄,谢婷婷,王 瑾,等.大田条件下UV-B辐射增强对大豆根际土壤相关指标的影响[J].江苏农业学报,2016,32(1):118-122.
ZHANG Ling-xuan,XIE Ting-ting,WANG Jin,et al.Soybean rhizosphere soil parameters in response to enhanced UV-B radiation under field condition[J].Jiangsu Journal of Agricultural Sciences,2016,32(1):118-122.
[13]张英英,蔡立群,武 均,等.不同耕作措施下陇中黄土高原旱作农田土壤活性有机碳组分及其与酶活性间的关系[J].干旱地区农业研究,2017,35(1):1-7.
ZHANG Ying-ying,CAI Li-qun,WU Jun,et al.The relationship between soil labile organic carbon fractions and the enzyme activities under different tillage measures in the Loess Plateau of central Gansu Province[J].Agricultural Research in the Arid Areas,2017,35(1):1-7.
[14]安 辉,刘鸣达,王耀晶,等.不同稻蟹生产模式对土壤活性有机碳和酶活性的影响[J].生态学报,2012,32(15):4753-4761.
AN Hui,LIU Ming-da,WANG Yao-jing,et al.Effects of different rice-crab production modes on soil labile organic carbon and enzyme activities[J].Acta Ecologica Sinica,2012,32(15):4753-4761.
[15]娄运生,程焕友,王恩眷,等.UV-B辐射增强下施氮对大麦土壤微生物量碳、氮的影响[J].中国农学通报,2010,26(13):219-224.
LOU Yun-sheng,CHENG Huan-you,WANG En-juan,et al.Effects of enhanced ultraviolet-B radiation and nitrogen levels on microbial biomass carbon and nitrogen of barley[J].China Agricultural Science Bulletin,2010,26(13):219-224.
[16]徐 鹏,王秋敏,蒋梦蝶,等.UV-B辐射促进红壤水稻土中碳氮转化[J].农业环境科学学报,2017,36(4):793-798.
XU Peng,WANG Qiu-min,JIANG Meng-die,et al.UV-B radiation facilitates the transformation of carbon and nitrogen in red paddy soils[J].Journal of Agro-Environment Science,2017,36(4):793-798.
[17]He Y M,Zhan F D,Li Y,et al.Effect of enhanced UV-B radiation on methane emission in a paddy field and rice root exudation of lowmolecular-weight organic acids[J].Photochemical&Photobiological Sciences,2016,15(6):735-743.
[18]赵炳梓,陈 吉,张佳宝,等.风干土保存时间和湿土培育时间对黄淮海平原潮土酶活性的影响[J].土壤,2011,43(3):418-425.
ZHAO Bing-zi,CHEN Ji,ZHANG Jia-bao,et al.Effect of storage time of air-drying soil and incubation period following rewetting on soil enzyme activities in North China Plain[J].Soil,2011,43(3):418-425.
[19]耿玉清,王冬梅.土壤水解酶活性测定方法的研究进展[J].中国生态农业学报,2012,20(4):387-394.
GENG Yu-qing,WANG Dong-mei.Research advances on the measurement methods for soil hydrolytic enzymes activities[J].Chinese Journal of Eco-Agriculture,2012,20(4):387-394.
[20]关松荫.土壤酶及其研究法[M].北京:农业出版社,1986.
GUAN Song-yin.Institute of soil fertilizer[M].Beijing:Chinese A-cademy of Agricultural Sciences,1986.
[21]盛 浩,宋迪思,王翠红,等.土壤溶解性有机碳四种测定方法的对比和转换[J].土壤,2015,47(6):1049-1053.
SHENG Hao,SONG Di-si,WANG Cui-hong,et al.Comparison and transform of soil dissolved organic carbon measured by four methods[J].Soil,2015,47(6):1049-1053.
[22]李振高,骆永明,滕 应.土壤与环境微生物研究法[M].北京:科学出版社,2008.
LI Zhen-gao,LUO Yong-ming,TENG Ying.Soil and environmental microbiological research method[M].Beijing:Science Press,2008.
[23]Blair G J,Lefroy R D B,Lisle L.Soil carbon fractions based on their degree of oxidation,and the development of a carbon management index for agricultural systems[J].Crop and Pasture Science,1995,46(7):1459-1466.
[24]娄运生,周文鳞.UV-B辐射增强对抗除草剂转基因水稻CH4排放的影响[J].生态学报,2012,32(15):4731-4736.
LUO Yun-sheng,ZHOU Wen-lin.Effect of advanced ultraviolet-B(UV-B)radiation on CH4emission in herbicide resistant transgenic rice from a paddy soil[J].Acta Ecologica Sinica,2012,32(15):4731-4736.
[25]Song Y Y,Song C C,Yang G S,et al.Changes in labile organic carbon fractions and soil enzyme activities after marshland reclamation and restoration in the Sanjiang Plain in Northeast China[J].Environmental management,2012,50(3):418-426.
[26]Liu C Q,Lu J J,Li H P.Landward changes of soil enzyme activities in a tidal flat wetland of the Yangtze River Estuary and correlations with physico-chemical factors[J].Acta Ecologica Sinica,2007,27(9):3663-3669.
[27]蒲 琴,胡玉福,何剑锋,等.植被恢复模式对川西北沙化草地土壤微生物量及酶活性研究[J].水土保持学报,2016,30(4):323-328.
PU Qin,HU Yu-fu,HE Jian-feng,et al.Effect of vegetation restoration pattern on the soil microbial biomass and enzyme activity in desertification grassland of Northwest Sichuan[J].Journal of Soil and Water Conservation,2016,30(4):323-328.
[28]梅万忠,宋长春,杨桂生,等.三江平原湿地土壤活性有机碳组分特征及其与土壤酶活性的关系[J].环境科学学报,2009,29(2):406-412.
MEI Wan-zhong,SONG Chang-chun,YANG Gui-sheng,et al.The active soil organic carbon fraction and its relationship with soil enzyme activity in different types of marshes in the Sanjiang Plain[J].Acta Scientiae Circumstantiae,2009,29(2):406-412.
[29]Nelson D R,Mele P M.Subtle changes in rhizosphere microbial community structure in response to increased boron and sodium chloride concentrations[J].Soil Biology and Biochemistry,2007,39(1):340-351.
[30]何永美,湛方栋,吴 炯,等.UV-B辐射对元阳梯田水稻根系LMWOAs分泌量和根际微生物数量的影响[J].农业环境科学学报,2016,35(4):613-619.
HE Yong-mei,ZHAN Fang-dong,WU Jiong,et al.Effects of UV-B radiation on rice roots-exudated LMWOAs and rhizospheric microorganism quantities in a paddy field of Yuanyang Terraces,Yunnan Province[J].Journal of Agro-Environment Science,2016,35(4):613-619.
[31]柳 敏,宇万太,姜子绍,等.土壤活性有机碳[J].生态学杂志,2006,25(11):1412-1417.
LIU Min,YU Wan-tai,JIANG Zi-shao,et al.A research review on soil active organic carbon[J].Chinese Journal of Ecology,2006,25(11):1412-1417.
[32]刘玉学,王耀锋,吕豪豪,等.生物质炭化还田对稻田温室气体排放及土壤理化性质的影响[J].应用生态学报,2013,24(8):2166-2172.
LIU Yu-xue,WANG Yao-feng,LÜ Hao-hao,et al.Effects of biochar application on greenhouse gas emission from paddy soil and its physical and chemical properties.[J].Chinese Journal of Applied Ecology,2013,24(8):2166-2172.
[33]付琳琳,蔺海红,李恋卿,等.生物质炭对稻田土壤有机碳组分的持效影响[J].土壤通报,2013,44(6):1379-1384.
WEI Lin-lin,LIN Hai-hong,LI Lian-qing,et al.Persistent effects of biochar application on organic carbon fractions of paddy soil[J].Chinese Journal of Soil Science,2013,44(6):1379-1384.
[34]汤 宏,沈健林,刘杰云,等.稻秸的不同组分对水稻土甲烷和二氧化碳排放的影响[J].生态环境学报,2016,25(7):1125-1133.
TANG Hong,SHEN Jian-lin,LIU Jie-yun,et al.Effects of rice straw fraction on methane and carbon dioxide emission from rice paddy soil[J].Ecology and Environmental Sciences,2016,25(7):1125-1133.
[35]肖 烨,黄志刚,武海涛,等.三江平原不同湿地类型土壤活性有机碳组分及含量差异[J].生态学报,2015,35(23):7625-7633.
XIAO Ye,HUANG Zhi-gang,WU Hai-tao,et al.Compositions and contents of active organic carbon in different wetland soils in Sanjiang Plain,Northeast China[J].Acta Ecologica Sinica,2015,35(23):7625-7633.
[36]Zhan M,Cao C G,Wang J P,et al.Dynamics of methane emission,active soil organic carbon and their relationships in wetland integrated rice-duck systems in Southern China[J].Nutrient Cycling in Agroecosystems,2011,89(1):1-13.
[37]付薇薇,尹力初,张 蕾,等.有机物料碳和土壤有机碳对水稻土甲烷排放的影响[J].中国土壤与肥料,2016(2):14-20.
FU Wei-wei,YIN Li-chu,ZHANG Lei,et al.Effects of exogenous organic carbon and soil organic carbon on the CH4emission in paddy soils with different fertilities[J].Soil and Fertilizer Sciences in China,2016(2):14-20.
[38]胡立峰,王宝芝,李洪文.土壤呼吸、农田CO2排放及NEE的比较研究[J].生态环境学报,2009,18(2):578-581.
HU Li-feng,WANG Bao-zhi,LI Hong-wen.The comparative study of the soil respiration,CO2emission and NEE from the farmland in the North of China[J].Ecology and Environmental Sciences,2009,18(2):578-581.
[39]戴 浩,周 青.Ce(Ⅲ)对UV-B胁迫下大豆幼苗光呼吸的影响[J].中国农业气象,2008,29(2):154-156.
DAI Hao,ZHOU Qing.Influence of cerium(Ce3+)on photorespiration of soybean seedlingunder supplementary UV-B radiation stress[J].Chinese Journal of Agrometeorology,2008,29(2):154-156.
[40]Brandle J R,Cappell W S,Sisson W B,et al.Net photosynthesis,electron transport capacity,and ultrastructure of Pisum sativum L.exposed to ultraviolet-B radiation[J].Plant Physiology,1977,60(1):165-169.
[41]岳向国,韩 发,师生波,等.不同强度的UV-B辐射对高山植物麻花艽光合作用及暗呼吸的影响[J].西北植物学报,2005,25(2):231-235.
YUE Xiang-guo,HAN Fa,SHI Sheng-bo,et al.Effects of UV-B radiation of different intensity on the photosynthesis and the dark respiration of alpine plant gentiana straminea[J].Acta Botanica Boreali-Occidentalia Sinica,2005,25(2):231-235.
[42]何永美,湛方栋,高召华,等.水稻对UV-B辐射响应的敏感性差异[J].生态环境学报,2012,21(3):489-495.
HE Yong-mei,ZHAN Fang-dong,GAO Zhao-hua,et al.Differences of UV-B radiation sensitivity of rice[J].Ecology and Environmental Sciences,2012,21(3):489-495.
[43]秦 越,李彬彬,武兰芳.不同耕作措施下秸秆还田土壤CO2排放与溶解性有机碳的动态变化及其关系[J].农业环境科学学报,2014,33(7):1442-1449.
QIN Yue,LI Bin-bin,WU Lan-fang.Dynamics and interrelationship of CO2emissions and dissolved organic carbon in soils with crop residue retention under different tillage practices[J].Journal of Agro-Environment Science,2014,33(7):1442-1449.
