蛋白质杂化荧光金纳米簇的制备及在汞离子快速检测中的应用
2018-03-13王见一谢三磊孙淑娟曾于洋江海洋
彭 涛 王见一 谢三磊 姚 凯 孙淑娟 曾于洋 江海洋
(中国农业大学动物医学院, 北京 100193)
1 引 言
贵金属荧光纳米簇是一种新型荧光纳米材料,由几个到几百个原子组成,粒径约为0.2~3.0 nm,接近电子的费米波长,呈现独特的光学、电学、化学等特性,在生物分析成像、环境监测等领域有广阔的应用前景[1~3]。荧光金纳米簇(AuNCs)具有较强的光致发光、良好的光稳定性、大的斯托克斯位移和高的荧光量子产率,是目前研究最广泛的贵金属荧光纳米簇,已被用于过氧化氢[4]、金属离子[5]、茶多酚[6]等的检测。2009年,Xie等[7]以牛血清白蛋白(BSA)为配体,在温和的条件下制备出具有红色荧光特性的蛋白质杂化荧光金纳米簇(AuNCs@BSA)。目前,已有多种有机物用于AuNCs的合成,如树枝状分子或高聚物(聚酰胺、聚乙稀亚胺等)、氨基酸(脯氨酸、酪氨酸、半胱氨酸等)、转铁蛋白、酶(辣根过氧化物酶、胰蛋白酶、溶菌酶、胃蛋白酶等)及一些小分子物质(硫辛酸、二硫苏糖醇)等[8]。因为BSA原料易得,且以BSA为配体合成AuNCs的过程简单、条件温和,所以AuNCs@BSA在很多领域应用广泛[9~11]。
重金属在生态环境中不易降解,且容易聚集在生物体内,通过食物链传递进入人体内,对人类健康有潜在的致癌和致畸等毒性[12]。汞离子(Hg2+)是一种常见的重金属污染物,广泛存在于水体、土壤及食物中,Hg2+容易聚集在生物体内,对动物和人的大脑、神经系统、生殖系统以及肾脏都有较强的毒性[13,14]。我国卫生部规定饮用水中Hg2+含量不可超过1.0 μg/L[15]。目前,Hg2+的检测方法包括电化学法[16]、比色法[17]、原子吸收光谱法[18]、质谱法等[19],但是这些方法大多检测过程繁琐、周期长。因此,建立一种快速、灵敏、便捷的Hg2+检测方法具有重要的实际应用价值。
文献[20]报道,Hg2+可使AuNCs@BSA的荧光发生不可逆转的猝灭,所以AuNCs@BSA可作为一种荧光探针用于检测Hg2+。本研究以BSA作为稳定剂和还原剂,在温和的条件下, 采用一步法将氯金酸还原,合成具有红色荧光的AuNCs@BSA,并以其为荧光检测探针检测水中Hg2+。将此探针用于自来水中的Hg2+的快速灵敏检测,结果令人满意。
2 实验部分
2.1 仪器与试剂
恒温磁力搅拌器(德国Heigoph公司); WFH-203 (ZF-1)三用紫外分析仪(上海驰唐实业有限公司);SpectraMax M5多功能酶标仪(美国Molecular Devices公司)。
牛血清白蛋白(BSA, 99.9%)、三水合氯金酸(HAuCl4·3H2O)、汞标准溶液(10 mg/mL),均购自美国Sigma-Aldrich公司);胶体金(实验室制备)[21];其它试剂均为分析纯,实验用水为双蒸水(18.2 MΩ·cm,美国Millipore公司纯水仪制备)。
2.2 AuNCs@BSA的合成
所有玻璃仪器经重铬酸溶液浸泡24 h后,用双蒸水冲洗干净。根据文献[6]方法合成AuNCs@BSA。将BSA溶液(50 g/L)和HAuCl4溶液(0.01 mol/L)在37℃等体积混合(共12 mL),磁力搅拌反应2 min后,逐滴加入1 mol/L NaOH溶液调节pH值至12.0,在37℃条件下搅拌反应12 h,溶液颜色由亮黄色变为棕黄色。将制备好的AuNCs@BSA用透析袋(100 kDa,美国Sigma-Aldrich公司)在双蒸水中透析12 h后,用无菌离心管收集(约15 mL),在4℃保存,于3个月内使用。
2.3 离子检测方法
将制备好的AuNCs@BSA用双蒸水稀释100倍后,加入酶标板各孔中(50 μL/孔),然后加入50 μL样品,反应2 min后,用多功能酶标仪扫描记录各孔在360 nm激发光下的荧光发射光谱。
2.4 检测参数优化
以添加了Hg2+(1 μg/L)的空白样品为阳性对照,综合考虑阴性样品的荧光强度及阳性样品的抑制率(Inhibition rate,I, %),确定最优AuNCs@BSA的用量、检测体系的离子浓度及pH值。抑制率计算公式如下:
I(%)=(1-F/F0)×100%(1)
其中,F和F0分别为阴性和阳性样品的荧光强度。
3 结果与讨论
3.1 AuNCs@BSA的表征及性能评价
AuNCs@BSA、BSA溶液、HAuCl4溶液、胶体金溶液在365 nm的紫外灯下的照片如图1A所示,只有AuNCs@BSA溶液发出明显的红色荧光。荧光光谱表征结果(图1B)表明,AuNCs@BSA的最大激发波长和发射波长分别为360和635 nm。高分辨扫描电镜表征结果如图1C所示,AuNCs@BSA呈现规则的单分散球形,粒径为(2.00 ± 0.05) nm。根据文献[22]报道,超小粒径的金属荧光纳米簇具有类过氧化物酶的生物催化性。分别取500 μL H2O2和TMB溶液混匀后,加入100 μL纯化后的BSA@AuNCs溶液,5 min后,溶液由无色变为蓝色(图1D)。以上结果均表明成功合成了蛋白质杂化的荧光金纳米簇[23]。因为AuNCs@BSA的粒径接近电子的费米波长,它的能级谱带变得不连续,成为不连续的离散能级,电子可在各能级间发生跃迁,从而表现出荧光性质[2]。如图1E所示,在AuNCs@BSA加入Hg2+标准品,其荧光发射光谱明显降低,证明Hg2+可猝灭AuNCs@BSA的荧光。
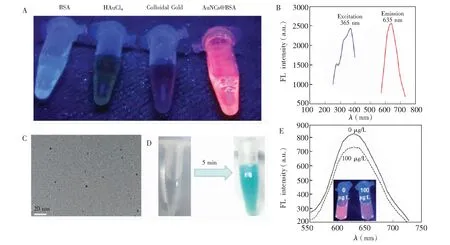
图1 AuNCs@BSA表征结果: (A) 紫外灯(360 nm)下的照片;(B) 激发和发射光谱图;(C) 透射电镜表征图;(D)过氧化物模拟酶活性;(E) Hg2+猝灭AuNCs@BSA荧光。Fig.1 Characterizations of AuNCs@BSA: (A) Image under UV light illumination, (B) fluorescent spectrum, (C) transmission electron microscopy (TEM) image , (D) mimic peroxidase activiety and (E) fluorescence quenched by Hg2+.
3.2 AuNCs@BSA荧光猝灭检测自来水中汞离子的参数优化
以上实验结果表明,Hg2+可以猝灭AuNCs@BSA的荧光。采用单一变量法对AuNCs@BSA的稀释倍数及用量、检测体系的pH值等参数进行了优化。如图2A所示,分别用双蒸水(ddH2O)、0.05 mol/L吗啉乙磺酸缓冲液(MES,pH 6.0)、0.05 mol/L磷酸缓冲液(PB,pH 6.0)、0.05 mol/L磷酸盐缓冲液(PBS,pH 6.0)、0.05 mol/L Tris-HCl(pH 6.0)、0.05 mol/L硼酸缓冲液(BB,pH 6.0)、0.05 mol/L碳酸盐缓冲液(CB,pH 9.6)共7种溶液作为AuNCs@BSA稀释液。结果表明,以ddH2O为稀释液时,阴性荧光强度和阳性抑制率均最佳。分别将AuNCs@BSA用ddH2O稀释10、20、40、60、80、100、150和200倍后进行检测,结果表明,随着AuNCs@BSA在体系中的用量增加,荧光强度增强,但是阳性抑制率变化不规律,当AuNCs@BSA稀释100倍后检测,阳性抑制率最高(图2B和2C)。 随pH值增加,阴性样品AuNCs@BSA的荧光强度没有明显变化,但当pH=5.0时阳性抑制率最高(图2D)。
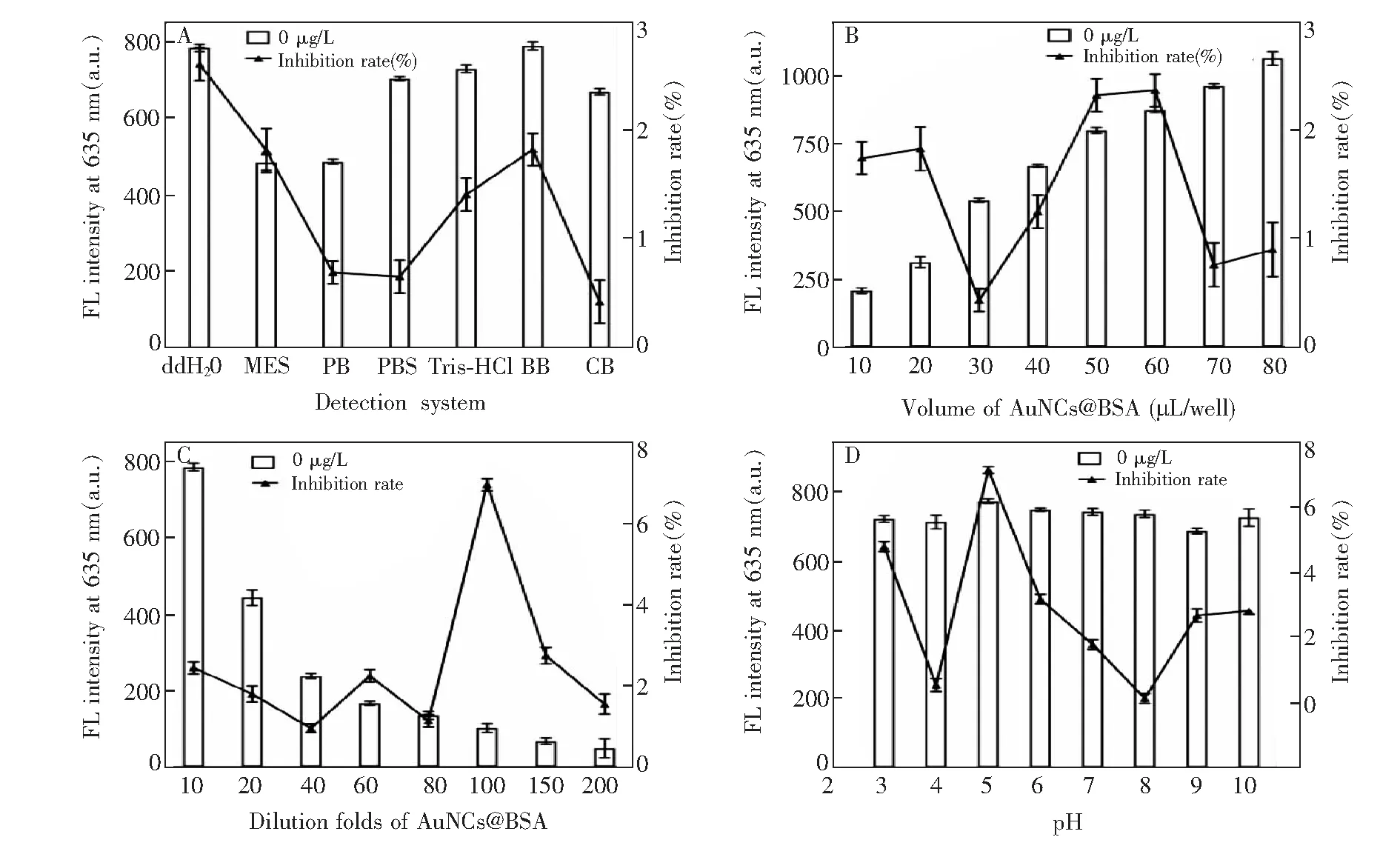
图2 缓冲体系(A)、稀释液体积(B)、稀释倍数(C)和pH值(D)对检测体系的影响Fig.2 Optimization of (A) buffer system, (B) dilution solution volume, (C) dilution folds and (D) pH value
本方法选择pH=5.0的ddH2O将AuNCs@BSA稀释100倍后检测Hg2+,灵敏度较高。
3.3 标准曲线及检测限定
由不同浓度的Hg2+标准溶液(0、 0.5、 1、 5、 10、 50、 75、 100、 200、 300、 400、 500、 600、 700、 800和900 μg/L)的荧光光谱图(图3A)可见,随着Hg2+浓度增加,体系在635 nm处的荧光强度下降;以Hg2+浓度为横坐标,相应的荧光强度为纵坐标绘制标准曲线,如图3B所示,在75~900 μg/L之间,Hg2+浓度和荧光强度有良好的线性关系y=-0.27x+ 762.02(R2=0.9959);在低浓度范围(0.5~75 μg/L),荧光强度和Hg2+的浓度对数成反比例关系,线性方程为y=-26.76lgx+ 803.1(R2=0.9951),检出限(LOD)为0.14 μg/L(3σ),低于国标规定的自来水中Hg2+的限量水平(1.0 μg/L)。如表1所示,与同类的金属纳米簇荧光法[26,27]相比,本体系检出限较低,线性范围较宽,且检测时间短。
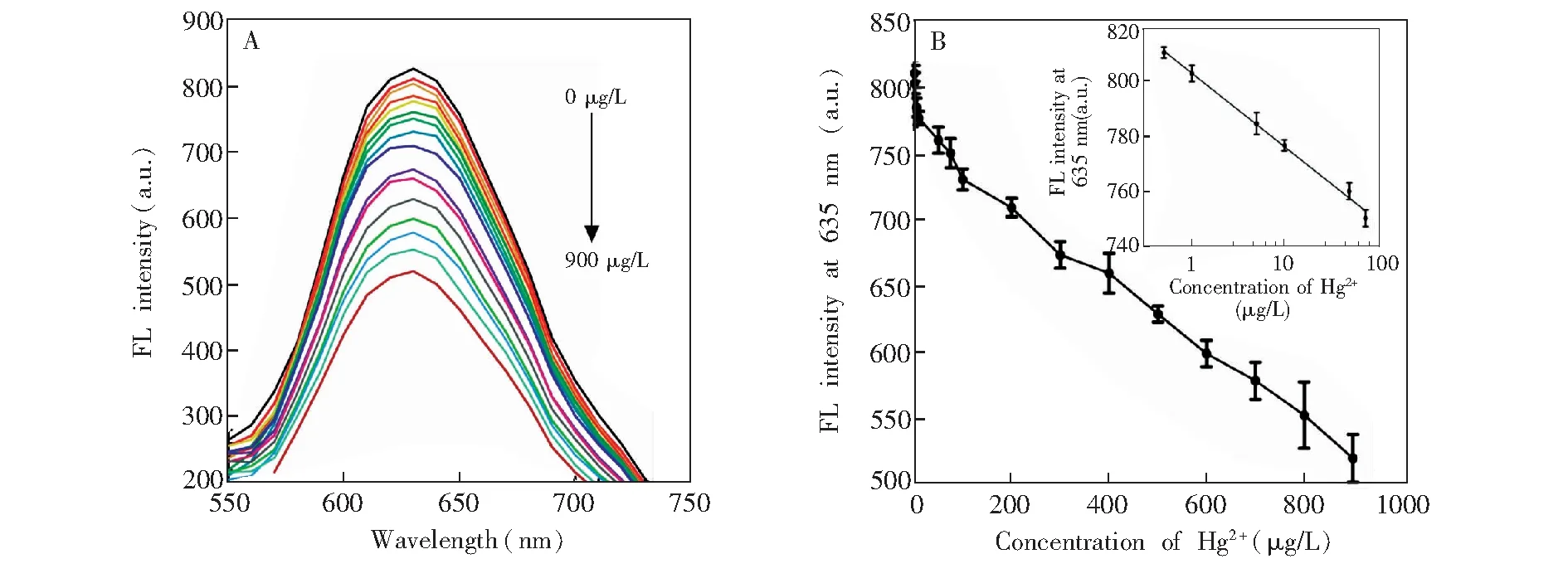
图3 不同浓度Hg2+的荧光光谱图(A)及线性关系曲线(B),插图为0.5~75 μg/L范围内的校正曲线。Fig.3 Fluorescent spectra of the detection system in the presence of different concentrations of Hg2+ (A) and calibration curve (B). Inset is calibration curve in low concentration range (0.5-75 μg/L)
表1 不同检测方法检测Hg2+的性能比较
Table 1 Comparison of different methods for Hg2+detection
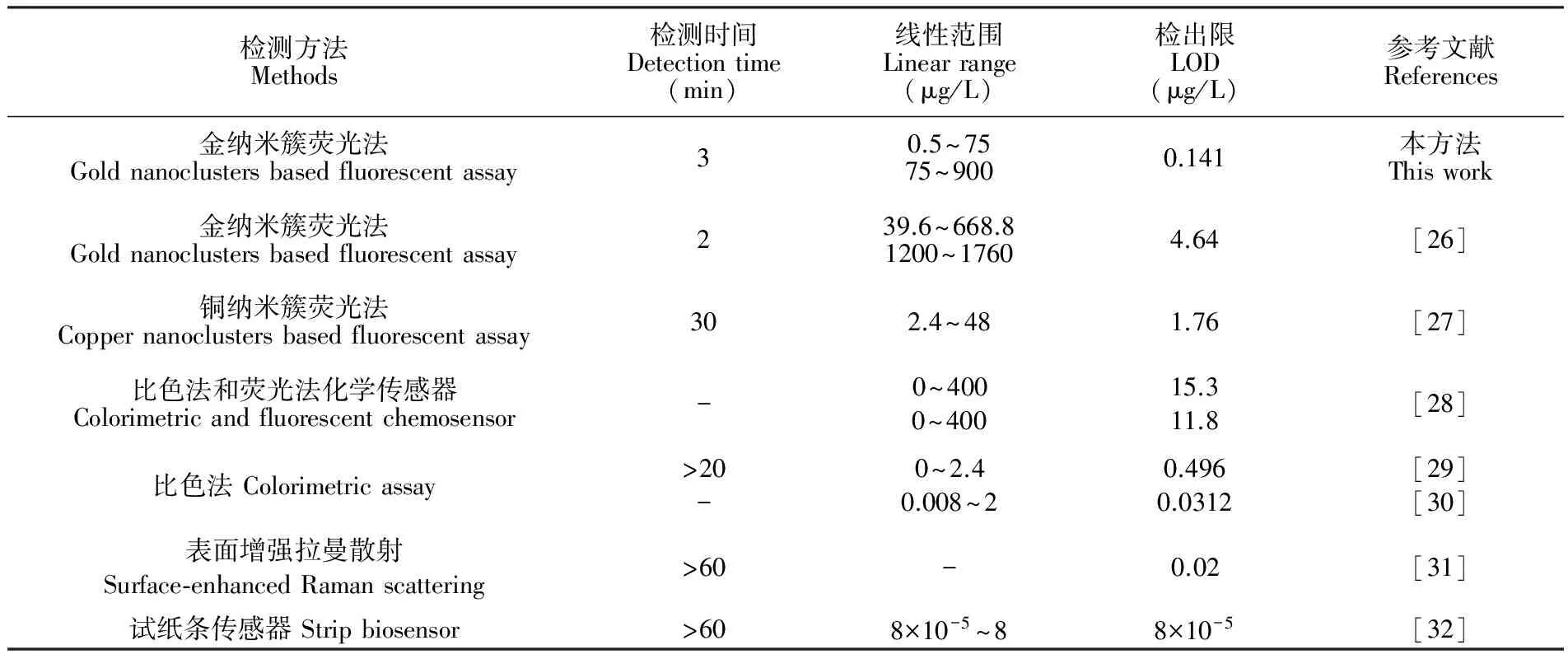
检测方法Methods检测时间Detectiontime(min)线性范围Linearrange(μg/L)检出限LOD(μg/L)参考文献References金纳米簇荧光法Goldnanoclustersbasedfluorescentassay30.5~7575~9000.141本方法Thiswork金纳米簇荧光法Goldnanoclustersbasedfluorescentassay239.6~668.81200~17604.64[26]铜纳米簇荧光法Coppernanoclustersbasedfluorescentassay302.4~481.76[27]比色法和荧光法化学传感器Colorimetricandfluorescentchemosensor-0~4000~40015.311.8[28]比色法Colorimetricassay>20-0~2.40.008~20.4960.0312[29][30]表面增强拉曼散射Surface⁃enhancedRamanscattering>60-0.02[31]试纸条传感器Stripbiosensor>608×10-5~88×10-5[32]
3.4 特异性实验
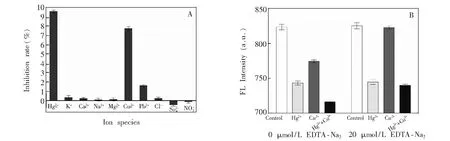
图4 特异性实验结果(A)及Cu2+干扰消除(B)Fig.4 (A) Specificity and (B) elimination of interference of Cu2+
3.5 实际样品分析
对北京海淀区不同区域的10个自来水样本,用本方法对样本中的Hg2+进行快速检测,10个样本均未检出。在空白自来水样品中分别添加0.5、 5、 10、 50和100 μg/L的Hg2+标准品,用本方法进行检测,回收率在86.8%~113.4%之间(n=3),相对标准偏差小于15%,表明本方法实用性良好。
4 结 论
本研究通过一步法合成了具有红色荧光的蛋白质杂化纳米簇,其荧光能被Hg2+有效猝灭。通过对检测条件进行优化,建立了快速、 灵敏、 便捷、 准确的自来水中的Hg2+的荧光检测方法,检出限低于国标对于自来水中Hg2+的限量值,可用于自来水中Hg2+的检测。
1 Zhang L, Wang E.NanoToday,2014, 9(1): 132-157
2 Voet A R D, Tame J R H.Curr.Opin.Biotech.,2017, 46: 14-19
3 AN Xiao-Gang, DU Jie, QI Wei-Nan, LIU Lu, LI Xiao-Yan, GAN Hai-Ling, LU Xiao-Quan.ChineseJ.Anal.Chem.,2017, 45(8): 1209-1214
安晓刚, 杜 捷, 齐伟男, 刘 璐, 李小燕, 甘海玲, 卢小泉. 分析化学,2017, 45(8): 1209-1214
4 Wen F, Dong Y, Feng L, Wang S, Zhang S, Zhang X.Anal.Chem.,2011, 83(4): 1193-1196
5 Deng H H, Zhang L N, He S B, Liu A L, Li G W, Lin X H, Xia X H, Chen W.Biosens.Bioelectron.,2015, 65: 397-403
6 Wang S, Liu P, Qin Y, Chen Z, Shen J.Sens.ActuatorsB,2016, 223: 178-185
7 Xie J, Zheng Y, Ying J Y.J.Am.Chem.Soc.,2009, 131(3): 888-889
8 XU Sheng-Hao, MAO Ya-Ning, YU Xi-Juan, LUO Xi-Liang.JournalofQingdaoUniversityofScienceandTechnology:NatutralScienceEdition,2015, 36(4): 355-362
徐升豪, 毛亚宁, 于锡娟, 罗细亮. 青岛科技大学学报:自然科学版,2015, 36(4): 355-362
9 Hu L, Han S, Parveen S, Yuan Y, Zhang L, Xu G.Biosens.Bioelectron.,2012, 32(1): 297-299
10 Qi Y X, Zhang M, Zhu A, Shi G.Analyst,2015, 140(16): 5656-5661
11 Xu P, Li R, Tu Y, Yan J.Talanta,2015, 144: 704-709
12 Zhang Y, Jiang H, Wang X.Anal.Chim.Acta,2015, 870: 1-7
13 Nolan E M,Lippard S J.Chem.Rev.,2008, 108(9): 3443-3480
14 Järup L.Brit.Med.Bull.,2003, 68(1): 167-182
15 GB5749-2006.SanitaryStandardforDrinkingWaterQuality. National standards of the People's Republic of China
生活饮用水卫生标准. 中华人民共和国国家标准. GB5749-2006
16 Xuan F, Luo X, Hsing I M.Anal.Chem.,2013, 85(9): 4586-4593
17 Zhao W, Brook M A, Li Y.ChemBioChem,2008, 9(15): 2363-2371
18 López-García I, Rivas R E, Hernández-Córdoba M.Anal.Chim.Acta,2012, 743: 69-74
19 Leopold K, Foulkes M, Worsfold P.Anal.Chim.Acta,2010, 663(2): 127-138
20 Xie J, Zheng Y, Ying J Y.Chem.Commun.,2010, 46(6): 961-963
21 Pei X Y, Wang Q, Li X M, Xie J, Xie S L, Peng T, Wang C, Sun Y Z, Jiang H Y.FoodAnal.Methods,2016, 9(7): 1919-1927
22 Tao Y, Lin Y H, Ren J S, Qu X G.Biosens.Bioelectron.,2013, 42: 41-46
23 Xu Y, Palchoudhury S. Qin Y, Macher T, Bao Y.Langmuir,2012, 28(23): 8767-8772
24 Hu D, Sheng Z, Gong P, Zhang P, Cai L.Analyst,2010, 135(6): 1411-1416
25 Chai F, Wang T, Li L, Liu H, Zhang L, Su Z, Wang C.NanoscaleRes.Lett.,2010, 5(11): 1856
26 Qiao Y, Zhang Y, Zhang C, Shi L H, Zhang G M, Shuang S M, Dong C, Ma H M.Sens.ActuatorsB,2016, 224: 458-464
27 Luo T, Zhang S, Wang Y, Wang M N, Liao M, Kou X M.Luminescence,2017, 32(6): 1092-1099
28 Nhan D T, Nhung N T A, Vien V, Trung N T, Cuong N D, Bao N C, Huong D Q, Hien N K, Quang D T.Chem.Lett.,2016, 46(1): 135-138
29 Tan L L, Chen Z B, Zhang C, Wei X C, Lou T H, Zhao Y.Small,2017, 13(14): 1603340
30 Zhang S T, Zhang D X, Zhang XH, Shang D H, Xue Z H, Shan D L, Lu X Q.Anal.Chem.,2017, 89(6): 3538-3544
31 Ding X, Kong L, Wang J, Fang F, Li D D, Liu J H.ACSAppl.Mater.Interfaces,2013, 5(15): 7072-7078
32 Chen J, Zhou S, Wen J.Anal.Chem.,2014, 86(6): 3108-3114
