新型双功能席夫碱荧光探针分别识别检测Zn2+和CN-
2018-03-13董振明王佳娜
董振明 王佳娜 张 强 王 煜
(山西大学化学化工学院, 太原 030000)
1 引 言
生物样品及环境中阴阳离子的识别与检测是目前化学领域的研究热点。在众多检测方法中,荧光传感器由于具有选择性好、灵敏度高、操作简单和可实时在线检测等优点而备受关注[1]。 Zn是人体中含量仅次于铁的过渡金属,是人体必需的微量元素之一。在基因表达、神经信号传输、金属酶的调节、DNA结合或识别等多种生物学活动中发挥着重要作用。Zn2+代谢失衡会导致缺氧缺血、癫痫及各种神经系统疾病,如老年痴呆症、帕金森病等。此外,过量的Zn2+会使土壤微生物的活性降低,对植物造成不良影响。因此,对环境及生物系统中Zn2+的检测具有十分重要的意义[2]。目前文献报道的Zn2+荧光传感器很多[3~12],但仍然存在合成复杂、选择性和灵敏度不理想等不足。Hagimori等[4]合成了可在水相体系中检测Zn2+的荧光探针,但不能消除Cd2+对检测的干扰,选择性有待提高。Lee等[8]设计的席夫碱探针合成方法较简单,但只能在纯乙腈中检测Zn2+,且灵敏度不高。因此,开发合成方法简单、选择性好、灵敏度高的Zn2+传感器,具有重要的实际应用价值。


2 实验部分
2.1 仪器与试剂
UV-2450分光光度计(日本岛津公司); LS-55荧光光度计(美国Perkin-Elmer公司),激发波长分别为328 nm (Zn2+)和335 nm (CN-); PicoMaster 1000-TCSPC 荧光分光光度计(美国PTI公司); 雷磁pHS-3C 酸度计(上海精密仪器公司); DRX-600核磁共振仪(瑞士Fällenden公司); TENSOR Ⅱ红外光谱仪(德国Bruker公司); Thermo Scientific Q Exactive 质谱仪(美国Thermo Scientific公司); LSM 880 with Airyscan 激光扫描共聚焦显微镜(德国卡尔蔡司公司)。
4'-羟基-4-氰基联苯(95%,北京百灵威科技有限公司); 2-氨甲基吡啶(97%,上海韶远化学科技有限公司); 其它试剂均为分析纯。金属离子储备液均为其相应的硝酸盐或氯化物水溶液(1.0×10-2mol/L); 阴离子储备液均为其相应的钾盐或钠盐水溶液(1.0×10-2mol/L); 探针储备液浓度为1.0×10-3mol/L。实验用水为二次蒸馏水。
2.2 探针HPBC的合成
3'-甲酰基-4'-羟基-4-氰基联苯根据文献[23]的方法合成,如Scheme 1所示,得到白色的固体产物。1H NMR (DMSO-d6)δ(ppm): 11.05 (s, 1H, OH), 10.33(s, 1H, CHO), 8.02 (s, 1H, ArH), 7.95 (d, 1H, ArH), 7.91 (d, 2H, ArH), 7.86 (d, 2H, ArH), 7.15 (d, 1H, ArH)。

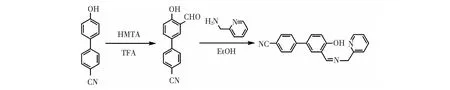
Scheme 1 HPBC的合成路线Scheme 1 Synthesis of 4'-hydroxy-3'-((2-pyridin-2-ylmethylimino) methyl)-4-biphenyl carbonitrile (HPBC)
2.3 紫外和荧光光谱实验
紫外吸收光谱实验中,HPBC浓度均为40 μmol/L; 荧光光谱实验中,HPBC浓度均为4 μmol/L。探针HPBC检测Zn2+的光谱实验均在 乙醇-H2O(2∶3,V/V, HEPES, pH=7.4)体系中进行; 检测CN-的光谱实验均在DMSO-H2O(3∶7,V/V)体系中进行。在比色管中配制5 mL一定浓度的HPBC溶液,然后向其中滴加离子溶液进行滴定实验。以硫酸奎宁(ΦF=0.54)为标准参照物,分别测定HPBC中加入Zn2+和CN-前后的荧光量子产率。
2.4 细胞实验
利用肝癌细胞BEL-7402进行体外细胞实验。在37℃,含5% CO2的环境条件下,将细胞置于10%胎牛血清的培养基中培育。向含有细胞培养液的培养基中加入3.0×10-5mol/L探针HPBC溶液,孵育30 min后,用细胞培养液清洗细胞。在激发波长405 nm、40×物镜的激光共聚焦显微镜下,观察HPBC的细胞荧光成像图。继续加入1.5×10-4mol/L Zn2+溶液,在相同条件下孵育,清洗后,观察HPBC+Zn2+的细胞荧光成像图。
2.5 CN-试纸条的制备和CN-检测
将滤纸浸泡在1.0 mmol/L HPBC的DMSO溶液中,一段时间后取出晾干,制成试纸条。随后将浸有HPBC的试纸条分别浸泡在不同浓度的CN-的溶液中,在自然光和紫外灯下观察试纸条的变化。
3 结果与讨论
3.1 探针HPBC对Zn2+的识别检测
3.1.1Zn2+对HPBC光谱的影响在EtOH-H2O(2∶3,V/V, HEPES, pH=7.4)体系中测定了Zn2+对HPBC的紫外-可见吸收光谱及荧光光谱的影响。如图1A所示,HPBC在283 和413 nm处分别有较强和较弱的两个吸收峰,并在328 nm处存在较宽的肩峰。随着Zn2+的加入,位于283和413 nm处的吸收峰逐渐降低,而在328 nm处的吸收峰显著增强,同时在277、305和404 nm处出现等吸收点。吸收峰的变化可能是由于探针分子中的酚O原子与Zn2+结合,使分子内电荷转移效应(ICT)发生变化所致。当Zn2+浓度与探针浓度相同时,328 nm处的吸收趋于稳定并达到最大,说明HPBC与Zn2+形成了1∶1的络合物。

图1 在EtOH-H2O(2∶3 V/V, HEPES, pH=7.4)体系中,(A) HPBC(40 μmol/L)的紫外吸收光谱随Zn2+ (0~1 equiv.)浓度的变化,插图为HPBC在328 nm处的吸收强度随Zn2+浓度的变化; (B) HPBC(4.0 μmol/L)的荧光光谱随Zn2+ (0~5 equiv.)浓度的变化,插图为HPBC在465 nm处的荧光强度随Zn2+浓度的变化及用365 nm的紫外灯下激发,HPBC在加入Zn2+前后的荧光改变。Fig.1 (A) Absorption spectra of HPBC (40 μmol/L) in the presence of Zn2+ (up to 1 equiv.). Inset is plot of changes in absorption intensity at 328 nm with increase of Zn2+ concentration. (B) Fluorescence titration of HPBC (4.0 μmol/L) with different concentrations of Zn2+ (0-5 equiv.) in EtOH-H2O (2∶3, V/V, HEPES, pH 7.4). Inset is changes of emission intensity at 465 nm and change in color of HPBC observed under a 365 nm UV lamp following addition of Zn2+.
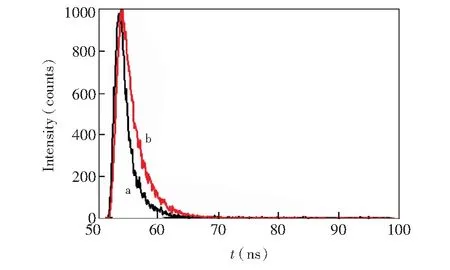
图2 297 nm的LED灯激发下,(a) HPBC(4.0 μmol/L)和(b) HPBC(4.0 μmol/L)-Zn2+(8.0 μmol/L)的荧光衰减曲线Fig.2 Fluorescence decay curves of (a) HPBC (4.0 μmol/L) and (b) HPBC(4.0 μmol/L)-Zn2+(8.0 μmol/L) obtained under a light emitting diode Lamp of 297 nm
3.1.2HPBC对Zn2+的荧光测定考察了pH值对HPBC和HPBC-Zn光谱的影响, 结果表明,HPBC-Zn的荧光对pH值有很强的依赖性。在pH 7~9范围内,荧光信号趋于稳定(见电子版文后支持信息图S1)。这为实现生物检测提供了可能性。实验选择pH=7.4的HEPES缓冲溶液调节测定体系的pH值。
考察了HPBC检测Zn2+的选择性。如图3A所示,当HPBC中加入常见金属离子K+、 Ca2+、 Na+、 Mg2+、 Al3+、 Hg2+、 Ag+、 Pb2+、 Cd2+、 Cr3+、 Fe3+、 Ni2+、 Co2+、 Cu2+、Zn2+后,只有Zn2+使探针荧光显著增强,表明HPBC可以选择性识别Zn2+。为了探究HPBC 对Zn2+的实际检测能力,考察了在其它金属离子共存的条件下,Zn2+对HPBC荧光强度的影响。如图3B所示,除Co2+、Cu2+可猝灭体系的荧光外,其它金属离子的存在均不会对HPBC-Zn2+荧光发射强度产生明显影响。进一步考察了Zn2+分别与Co2+、Cu2+共存时HPBC的紫外光谱变化(见电子版文后支持信息图S2),结果表明,这两种离子共存时,HPBC中的N、O原子会竞争性络合Co2+和Cu2+[26],而这两种离子具有顺磁性,可能与配体之间发生电子或能量转移而导致HPBC荧光猝灭。
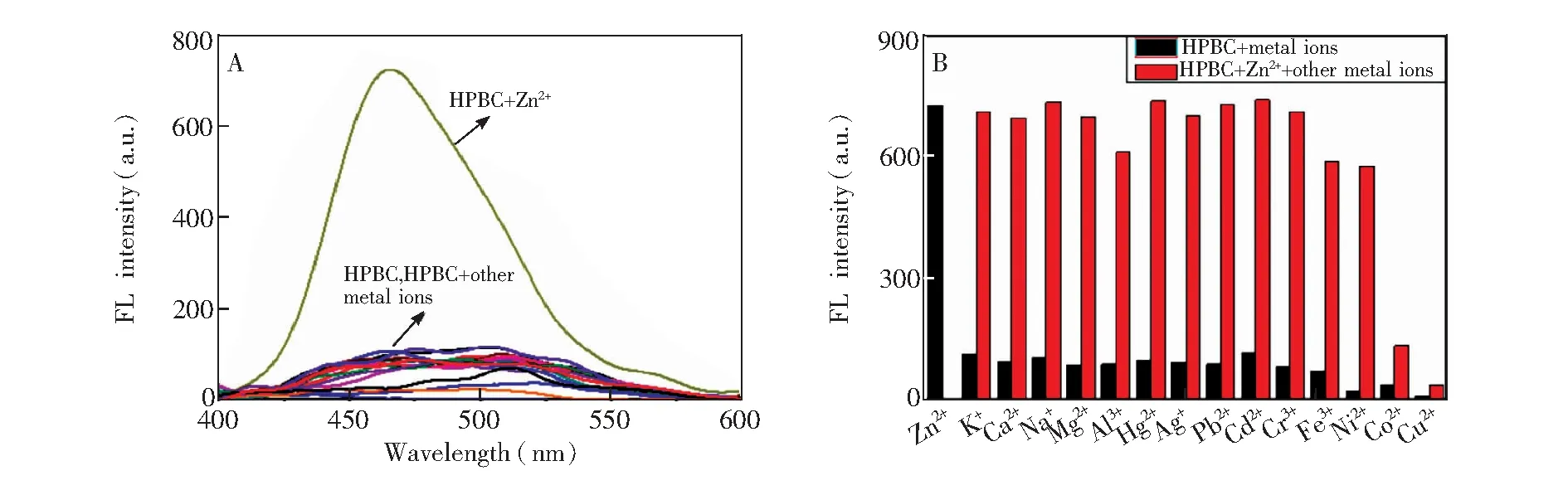
图3 (A) HPBC (4.0 μmol/L)对金属离子(8.0 μmol/L)的选择性; (B) Zn2+(8.0 μmol/L)与其它金属离子(8.0 μmol/L)共存时,HPBC (4.0 μmol/L)在468 nm处的荧光强度Fig.3 (A) Emission spectra of HPBC (4.0 μmol/L) in the presence of various metal ions (8.0 μmol/L). (B) Fluorescence intensities of HPBC (4.0 μmol/L) at 468 nm upon addition of Zn2+ (8.0 μmol/L) in the presence of interfering metal ions (8.0 μmol/L)
测定了HPBC对Zn2+的荧光滴定曲线。图1B插图表明,体系在468 nm处的荧光强度与Zn2+浓度在0.4~4.0 μmol/L范围内有良好的线性关系(R2=0.9978),检出限为36.5 nmol/L(3σ/S),低于国标GB 5749-2006《生活饮用水卫生标准》规定的饮水中Zn2+含量的限量值1.0 mg/L(约15 μmol/L)[14],比WHO规定饮用水中Zn2+限量水平(76 μmol/L)低约1000倍[27]。将HPBC与文献报道的席夫碱型Zn2+荧光探针进行比较(见电子版文后支持信息表S1),结果表明,本研究中探针HPBC的合成方法简单,可以高效识别检测水体系中的Zn2+,具有较高的灵敏度。

图4 向HPBC中交替加入Zn2+与EDTA的荧光变化。[HPBC]=4.0 μmol/L, [Zn2+]=8.0 μmol/L, [EDTA]=8.0 μmol/L。插图为紫外灯下相应荧光变化。Fig.4 Fluorescence intensity changes of HPBC upon alternate addition of Zn2+ and EDTA, [HPBC]=4.0 μmol/L, [Zn2+]=8.0 μmol/L, [EDTA]=8.0 μmol/L. Inset shows the corresponding visual fluorescent color changes
采用乙二胺四乙酸二钠盐(Na2EDTA)研究了HPBC检测Zn2+的可逆性。向HPBC中交替加入Zn2+和EDTA,HPBC表现出“ON-OFF-ON”模式的荧光变化(图4),且在4次循环后,体系荧光效率损失较小,表明HPBC对Zn2+的识别检测具有良好的可逆性。
3.1.3HPBC与Zn2+的结合模式采用荧光等摩尔连续变化法(电子版文后支持信息图S3A)测定,显示HPBC与Zn2+的络合比为1∶1。根据荧光滴定的实验结果(电子版文后支持信息图S3B),利用Benesi-Hildebrand方程计算得出HPBC与Zn2+的结合常数为2.75×104L/mol,高分辨质谱分析进一步证明了此结论。图5质谱图中峰m/z407.79179为HPBC-H++Zn2++CH3OH(计算值:m/z408.06904)。
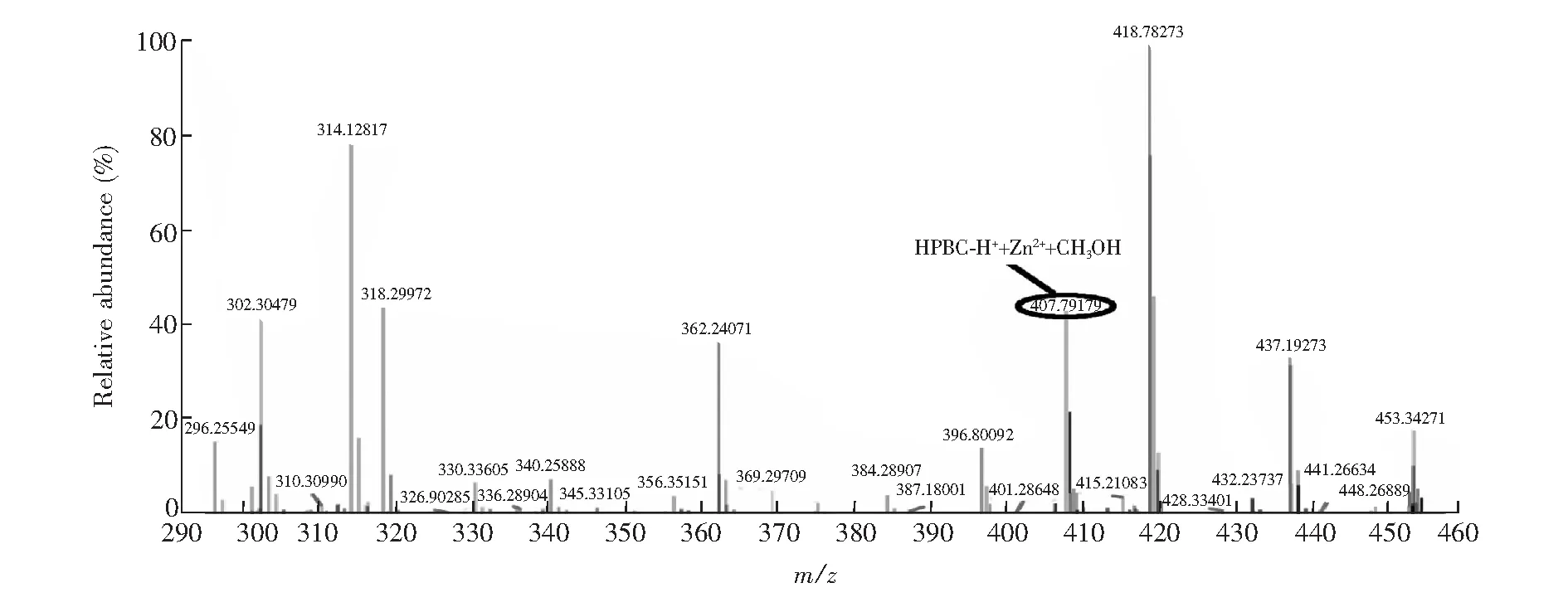
图5 HPBC-Zn2+的高分辨质谱Fig.5 Mass spectra of HPBC in the presence of Zn2+

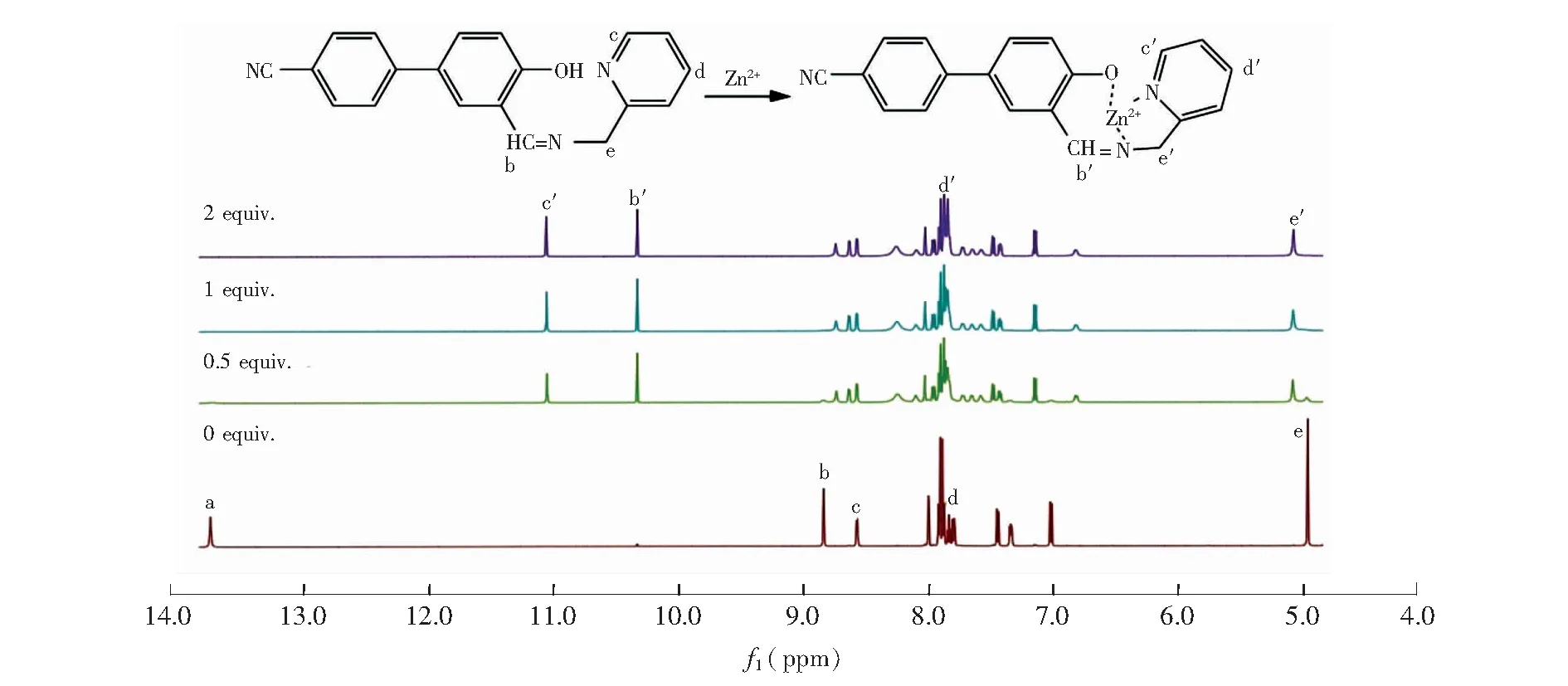
图6 探针HPBC与Zn2+核磁滴定图及其结合模式图Fig.6 Partial 1H NMR spectra of HPBC in the presence of different concentrations of Zn2+ (NO3)2·6H2O in d6-DMSO
3.1.4细胞荧光成像利用荧光共聚焦显微镜考察了HPBC与Zn2+在肝癌细胞(BEL-7402)中的成像。如图7所示,细胞与HPBC(30 μmol/L)共培养30 min后,不发射荧光。当HPBC预处理过的BEL-7402细胞与Zn2+(0.15 mmol/L)培养30 min后,细胞发射强烈的蓝色荧光,表明HPBC可以有效地检测细胞内的Zn2+。

图7 BEL-7402细胞荧光成像图:(A) 细胞与HPBC(30 μmol/L)共同孵育30 min; (B) HPBC (30 μmol/L)与细胞孵育后,再与Zn2+(0.15 mmol/L)共孵育30 min。(1)明场成像;(2)暗场成像;(3)叠加成像Fig.7 Fluorescence images of BEL-7402 cells treated with HPBC and Zn2+. (A) cell incubated with HPBC (30 μmol/L) for 30 min. (B) cell pre-incubated with HPBC (30 μmol/L) for 30 min and then treated with 0.15 mmol/L Zn2+. (1) Bright field image; (2) fluorescence image and (3) merged image
3.2 探针 HPBC对CN-的识别检测
3.2.1HPBC对CN-的传感识别考察了DMSO-H2O溶剂中阴离子对HPBC光谱的影响。发现探针对阴离子的光谱响应与DMSO-H2O中水的含量有关,最终选择了与其它阴离子相比对CN-有很好选择性的DMSO-H2O(3∶7,V/V)作为测定溶剂。
探针的紫外-可见吸收光谱在257、288、335和395 nm处有4个吸收峰(图8A)。当向探针HPBC中逐量加入CN-时,HPBC在257和288 nm处的吸收峰逐渐减弱,而在335及395 nm处的吸收峰增强,溶液颜色由无色变为淡黄色,同时在307 nm处产生一个等吸收点,表明生成了一个稳定的新物种。
如图8B所示, 激发波长为335 nm时,由于探针分子存在ESIPT效应,HPBC(ΦF=0.05)在510 nm处荧光很弱。逐渐加入CN-后,体系在510 nm的绿色荧光增强(ΦF=0.18)。荧光的增强可能是由于CN-使HPBC中的酚羟基去质子化,抑制了ESIPT效应。同样测定了体系在加入CN-前后荧光寿命的变化(电子版文后支持信息图S4)。在DMSO-H2O(3∶7,V/V)体系中,在297 nm激发波长下, 测得HPBC的平均荧光寿命为0.36 ns,当与CN-作用后,荧光寿命为2.12 ns。计算得到HPBC的kr=1.39×108s-1,knr=2.64×109s-1。而加入CN-后的kr=8.49×107s-1,knr=3.87×108s-1,表明当探针中加入CN-,kr/knr比值增大,因而荧光增强。
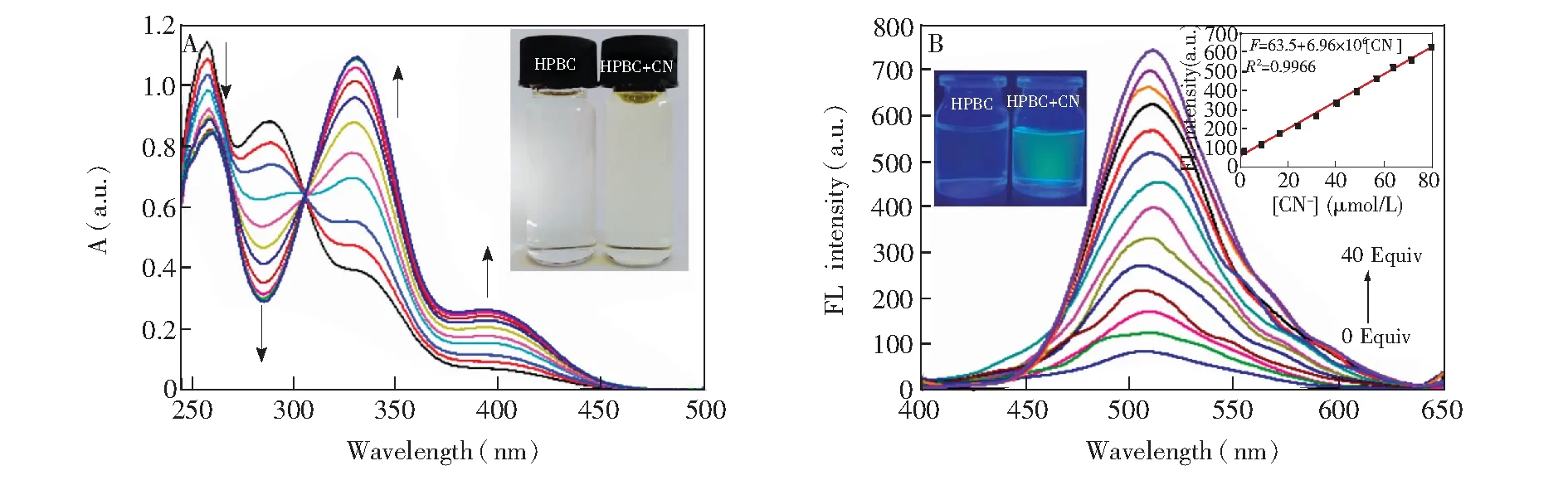
图8 DMSO-H2O (3∶7, V/V)中(A) HPBC (40 μmol/L)紫外吸收光谱随CN-浓度(0~10 equiv.)的变化; (B) HPBC(4.0 μmol/L)荧光光谱随CN- (0~40 equiv.)浓度的变化Fig.8 (A) Absorption titration of HPBC (40 μmol/L) with different concentrations of CN- (0-10 equiv.) in DMSO-H2O (3∶7, V/V). Inset shows color change of HPBC in the presence of CN-. (B) Fluorescent spectra of HPBC (4.0 μmol/L) in the presence of CN- (0-40 equiv.). Inset shows emission intensity at 510 nm upon addition of different amount of CN- and change in color of HPBC observed under a UV lamp following addition of CN-
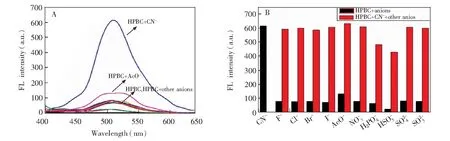
图9 (A) HPBC(4.0 μmol/L)对阴离子(80 μmol/L)的荧光选择性,(B) CN-(80 μmol/L)与其它阴离子(80 μmol/L)共存时,HPBC(4.0 μmol/L)的荧光强度Fig.9 (A) Fluorescence spectra of HPBC(4.0 μmol/L) respectively upon addition of several anions(80 μmol/L). (B) Fluorescence intensities of HPBC(4.0 μmol/L) in the presence of CN-(8.0 μmol/L) with other anions(80 μmol/L).
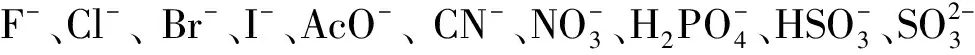


图10 探针HPBC与KCN核磁滴定图Fig.10 Partial 1H NMR spectra of HPBC in the presence of different concentrations of KCN in d6-DMSO
表1 自来水样品中CN-的检测
Table 1 Determination of CN-in tape water samples
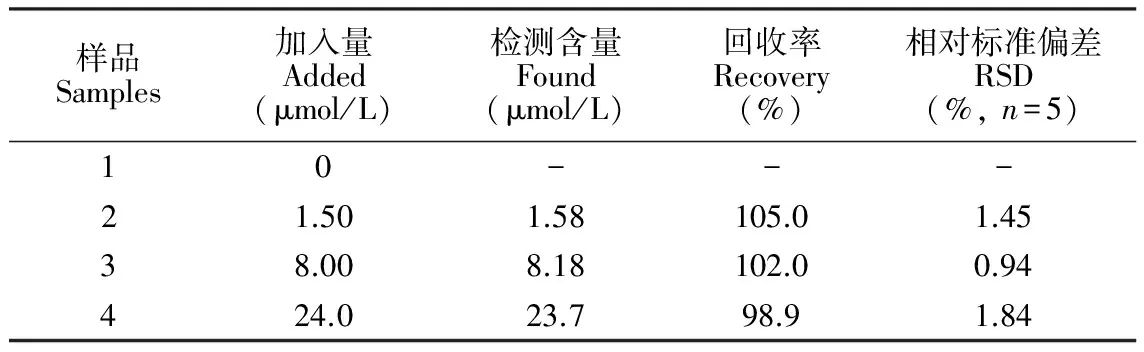
样品Samples加入量Added(μmol/L)检测含量Found(μmol/L)回收率Recovery(%)相对标准偏差RSD(%,n=5)10---21.501.58105.01.4538.008.18102.00.94424.023.798.91.84
3.2.2实际样品中CN-的分析采用HPBC对饮用水中的CN-进行了测定, 加标回收率为98.9%~105.0%(表1), 表明本方法可用于实际水样中CN-的检测。
将HPBC制作成试纸条,用于CN-的传感识别。利用HPBC的试纸条检测水样中的CN-,结果如图11所示,可以观察到较明显的颜色及荧光变化。因此,探针HPBC能够通过试纸条的方式方便快捷地检测CN-。

图11 自然光(A)和紫外灯(365 nm)(B)下试纸条对不同浓度CN-的检测结果Fig.11 HPBC-based test strips upon addition of CN- under (A) natural light and (B)365 nm UV lamp
4 结 论

1 Lee M H, Kim J S, Sessler J L.Chem.Soc.Rev.,2015, 44(13): 4185-4191
2 Chen Y C, Bai Y, Han Z, He W J, Guo Z J.Chem.Soc.Rev.,2015, 44(14): 4517-4546
3 Wang J F, Li Y B, Duah E, Paruchuri S, Zhou D M, Pang Y.J.Mater.Chem.B,2014, 2(14): 2008-2012
4 Hagimori M, Mizuyama N, Tominaga Y, Mukai T, Saji H.DyesPigments,2015, 113: 205-209
5 Liu Z, Peng C N, Wang Y, Pei M S, Zhang G Y.Org.Biomol.Chem.,2016, 14(18): 4260-4266
6 Li W, Tian X H, Huang B, Li H J, Zhao X Y, Gao S, Zheng J, Zhang X Z, Zhou H P, Tian Y P, Wu J Y.Biosens.Bioelectron.,2016, 77: 530-536
7 Mehta P K, Oh E, Park H J, Lee K.Sens.ActuatorsB,2017, 245: 996-1003
8 Lee S Y, Bok K H, Jo T G, Kim S Y, Kim C.Inorg.Chim.Acta,2017, 461: 127-135
9 Wei X D, Wang Q, Tang W Q, Zhao S L, Xie Y S.DyesPigments,2017, 140: 320-327
10 Gao Y, Liu H M, Li P, Liu Q L, Wang W, Zhao B.TetrahedronLett.,2017, 58: 2193-2198
11 Wei T B, Liang G Y, Chen X P, Qi J, Lin Q, Zhang Y M, Yao H.Tetrahedron,2017, 73: 2938-2942
12 Dong W K, Akogun S F, Zhang Y, Sun Y X, Dong X Y.Sens.ActuatorsB,2017, 238: 723-734
13 Li J J, Wei W, Qi X L, Zuo G C, Fang J K, Dong W.Sens.ActuatorsB,2016, 228: 330-334
14 GB 5749-2006, Standards for Drinking Water Quality. National Standards of the People's Republic of China
生活饮用水卫生标准. 中华人民共和国国家标准. GB 5749-2006
15 Beneto A J, Siva A.Photoch.Photobio.Sci.,2017, 16(2): 255-261
16 Wang S D, Fei X L, Guo J, Yang Q B, Li Y X, Song Y.Talanta,2016, 148: 229-236
17 Zhou X, Kim J, Liu Z X, Jo S, Pak Y L, Swamy K M K, Yoon J.DyesPigments,2016, 128: 256-262
18 Kumar R, Bhalla V, Kumar M.DaltonT.,2013, 42(24): 8808-8814
19 Park G J, Hwang I H, Song E J, Kim H, Kim C.Tetrahedron,2014, 70(17): 2822-2828
20 Wang D, Zheng J Q, Yan X, Zheng X J, Jin L P.RSCAdv.,2015, 5(79): 64756-64762
21 Qu W J, Li W T, Zhang H L, Wei T B, Lin Q, Yao H, Zhang Y M.Sens.ActuatorsB,2017, 241: 430-437
22 Qu W J, Wei T B, Lin Q, Li W T, Su J X, Liang G Y, Zhang Y M.Sens.ActuatorsB,2016, 232: 115-124
23 Alici O, Erdemir S.Sens.ActuatorsB,2015, 208: 159-163
24 Yuan C X, Li S Y, Wu Y B, Lu L P, Zhu M L.Sens.ActuatorsB,2017, 242: 1035-1042
25 Nie J, Li N, Ni Z H, Zhao Y, Zhang L F.TetrahedronLett.,2017, 58(20): 1980-1984
26 LYU Lei, SHENG Ye, ZHENG Song-Zhi, SU Ran, AN Sheng-Ji.ChineseJournalofLuminescence,2017, 38(8): 1109-1116
吕 蕾, 盛 野, 郑松志, 苏 冉, 安胜姬. 发光学报,2017, 38(8): 1109-1116
27 Mohan D, Singh K P.WaterRes.,2002, 36: 2304-2318
28 Wang L Y, Chen X G, Cao D R.RSCAdv.,2016, 6(99): 96676-96685
