牦牛Cyclin D1基因的克隆及IGF-I对其在睾丸支持细胞表达的影响
2018-03-13王亚营潘阳阳叶小琳李谷月何翃闳樊江峰余四九
王亚营,潘阳阳,叶小琳,李谷月,何翃闳,王 萌,樊江峰,崔 燕,余四九
(甘肃农业大学动物医学院,兰州 730070)
牦牛是能够适应高寒低氧环境的珍稀物种,主要分布在我国青藏高原海拔3 000 m以上的地区,具有重要的经济价值,但其自然繁殖率低,限制了牧区的发展。在牦牛上应用辅助生殖技术(Assisted reproductive technology,ART)是提高其繁殖率的重要手段,而雄性牦牛提供高质量的精子是体外繁殖成功的前提。睾丸支持细胞(Sertoli cell,SC)是唯一与生精细胞(Germ cell,GC)直接接触的体细胞,其共同构成睾丸曲细精管。睾丸支持细胞结构上紧密相连构成了血-睾屏障(Blood-testis barrier,BTB),为生殖细胞的发育提供独特的微环境[1]。睾丸支持细胞产生一系列蛋白质来调控垂体激素的释放,从而影响生殖细胞减数分裂的活性并促进精子的释放[2],对生精过程起到至关重要的调控作用。成年雄性动物睾丸的大小、生殖细胞的数量以及精子质量与SC的数量直接相关[3]。
细胞周期蛋白(Cyclins)是调控细胞周期进程的一系列蛋白质。细胞周期蛋白D1(Cyclin D1)高表达于细胞G1期,与细胞周期蛋白依赖性激酶4和6(Cyclin-dependent kinase4/6,CDK4/6)结合,形成Cyclin D1-CDK4/CDK6复合物,之后与磷酸化的视网膜母细胞瘤蛋白(Phosphorylation retinoblastoma protein,pRb)结合,使细胞由G1期进入S期,促进细胞周期进程。G1/S是细胞周期中重要的时间点,其决定细胞是否进行分裂增殖[4-5]。研究表明,Cyclin D1促进睾丸间质细胞的增殖并抑制其凋亡[6]。将小鼠胚胎干细胞中CyclinD1基因的部分外显子用非编码序列替换,得到缺乏Cyclin D1蛋白的突变鼠,其在发育过程中表现出生殖障碍等多种症状[7]。胰岛素样生长因子-I(Insulin-like growth factor-I,IGF-I)是一种促生长因子,对生殖器官的功能起到重要的调控作用。IGF-I通过调控Bax和Bcl-2等凋亡相关基因,降低了卵丘细胞[8]、卵母细胞[9]和睾丸间质细胞[10]等的凋亡率,同时还提高精子在低温环境中的运动能力及冷冻复苏的活性[9,11]。IGF-I显著提高牦牛冻精活性和体外授精胚胎的囊胚产量,并且降低了囊胚中细胞凋亡比率[12-13]。缺乏胰岛素受体(Insulin Receptor,InsR)和胰岛素样生长因子受体(Insulin-like growth factor Receptor,IGFR)的小鼠,睾丸支持细胞增殖率降低,从而导致精子产量降低,成年后睾丸的尺寸比正常鼠小75%[14]。IGF-I在维持与生殖相关细胞的正常生理功能方面发挥着重要作用,然而IGF-I是否调控睾丸支持细胞中周期相关蛋白的表达尚不清楚,牦牛CyclinD1基因的克隆及生物信息学分析在国内外也尚未见报道。
本研究以牦牛睾丸支持细胞为研究对象,克隆牦牛CyclinD1基因的CDS序列,并对其进行生物信息学分析;同时研究IGF-I对Cyclin D1在睾丸支持细胞中表达的影响。研究结果将为调控睾丸支持细胞的发育提供试验依据,为探索精子发生机制和提高精子质量奠定一定的理论基础。
1 材料与方法
1.1 主要仪器与试剂
细胞培养箱(Thermo,美国)、PCR 仪(Rio-Rad,美国)、荧光定量PCR仪(Applied Biosystems,美国)、倒置荧光显微镜(Olympus,日本);DMEM/F-12、胎牛血清(Fetal Bovine serum,FBS)(Gibco);胰蛋白酶、胶原蛋白酶、透明质酸酶、IGF-I(Sigma);总RNA提取试剂盒(Omega);反转录试剂盒、GoTaq Green Master Mix(Promega);胶回收试剂盒(GenStar);SYBR Premix Ex TaqTMⅡ、pMD 18-T Vector(TaKaRa);Fasl多克隆兔抗、CyclinD1多克隆兔抗以及羊抗兔多克隆抗体(博奥森)。
1.2 样品采集及细胞培养与鉴定
2016年10月在青海省西宁市乐家湾屠宰场,采取健康5~8月龄(此阶段为牛睾丸支持细胞的增殖分化期)牦牛的睾丸样品。获得样品后,将其放入生理盐水(含双抗)中,再置于冰盒密封,4 h内送到实验室,并对其进行处理。牦牛睾丸支持细胞的体外分离培养与鉴定参考M.D.Anway等[15]和H.Zhang等[16]的操作方法,采用两次酶消化法获得睾丸支持细胞,20 mmol·L-1Tris-Hcl低渗处理和饥饿培养以纯化细胞,再用含10% FBS的培养液培养细胞,细胞生长至80%以上融合时,用0.25%的胰酶消化细胞,调整细胞密度为5×104·mL-1,爬片培养48 h,采用Fasl免疫细胞化学方法鉴定细胞。
1.3 引物设计
根据GenBank中牛(Bostaurus)的CyclinD1和β-actin序列,利用Primer Premier 5.0 软件设计牦牛的CDS序列扩增引物Cyclin D1-C、荧光定量检测引物Cyclin D1-Y和β-actin内参引物。引物序列送上海华大基因科技公司合成。引物序列详见表1。
表1 目的基因和内参基因引物序列
Table 1 Primer sequences of target and reference genes
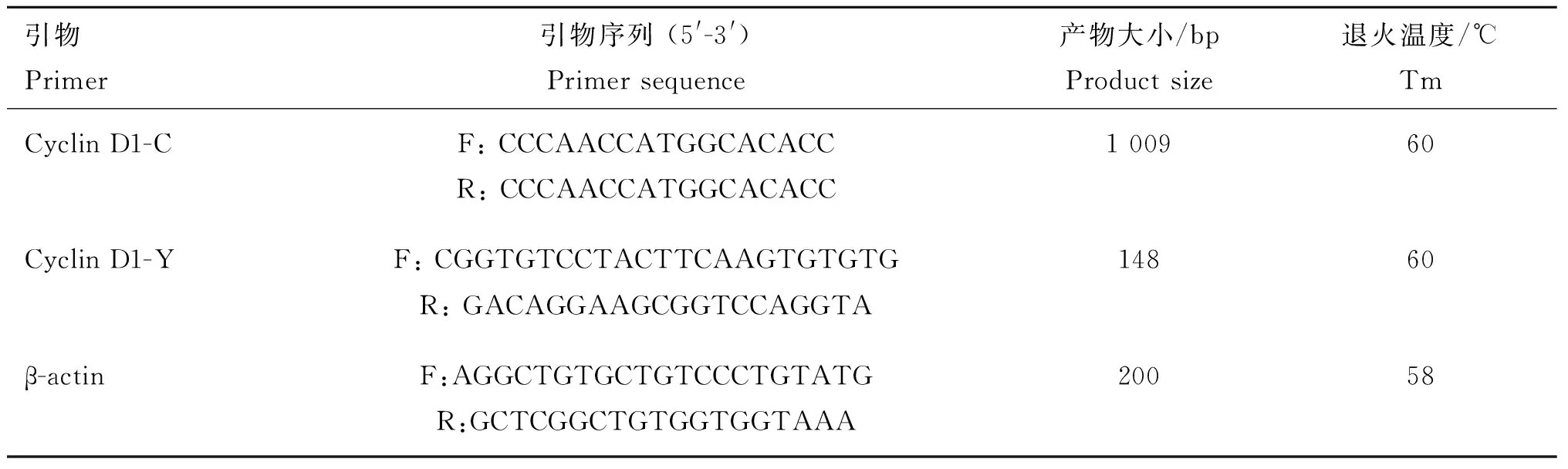
引物Primer引物序列(5'-3')Primersequence产物大小/bpProductsize退火温度/℃TmCyclinD1-CF:CCCAACCATGGCACACCR:CCCAACCATGGCACACC100960CyclinD1-YF:CGGTGTCCTACTTCAAGTGTGTGR:GACAGGAAGCGGTCCAGGTA14860β-actinF:AGGCTGTGCTGTCCCTGTATGR:GCTCGGCTGTGGTGGTAAA20058
1.4 牦牛CyclinD1基因的克隆及生物信息学分析
当原代SC生长至80%以上融合时,提取细胞总的RNA,再反转录成cDNA,置于冰箱-20 ℃,保存备用。以cDNA为模板, Cyclin D1-C为引物进行PCR扩增。反应体系:cDNA 2 μL,上下游引物各0.5 μL,GoTaq Green Master Mix 10 μL,ddH2O 7 μL。反应条件:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸1 min,35个循环;72 ℃ 5 min。PCR产物用1.5%琼脂糖凝胶进行电泳,对目的条带进行胶回收,将纯化后的DNA与pMD 18-T Vector 载体连接,转染到JM109感受态细胞,培养获得的菌液,送至上海生工生物工程公司进行测序。测序完成之后,将结果进行拼接,并对其进行生物信息学分析。利用NCBI在线软件Open reading frame finder(ORF Finder)对基因进行开放阅读框(Open reading frame,ORF)分析;利用MEGA7.0软件,采用邻接法(Neighbor-Joining)绘制系统进化树;利用 DNAMAN对核苷酸和氨基酸的同源性进行分析。
1.5 细胞免疫荧光法对蛋白质表达进行定位
选取纯化后的牦牛SC,将细胞密度调整为5×104·mL-1进行细胞爬片。培养48 h后,用4%多聚甲醛固定细胞,置于冰箱,4 ℃过夜;0.5%Tritonx-100透化1 h;1%BSA溶液室温封闭2 h;CyclinD1抗体稀释液(1∶100)孵育细胞,冰箱4 ℃过夜;二抗稀释液(1∶100)孵育细胞,室温2 h;5 ng·mL-1的DAPI染细胞核3 min;置于倒置荧光显微镜下拍照。每个步骤之间用PBS将玻片洗净,且二抗孵育后应避光操作。
1.6 qRT-PCR检测CyclinD1基因表达
选取纯化后的牦牛SC,以1×105·mL-1的细胞密度接种于6孔板中,每孔接种2 mL细胞悬液,培养24 h(使细胞全部处于静止期)后,加入IGF-I,使其终浓度分别为0、25、50、100、150 ng·mL-1,每个浓度3个重复,24 h后提取细胞总RNA。IGF-I作用时间根据牦牛睾丸支持细胞分裂周期选取[16]。反转录后,将cDNA浓度调至200 ng·μL-1,通过qRT-PCR检测CyclinD1 mRNA的表达。反应体系:cDNA 1 μL,上下游引物各0.5 μL,SYBR Premix Ex TaqTMⅡ 10 μL,Rox Reference DyeⅡ 0.4 μL,ddH2O 7.6 μL,共20 μL。反应条件:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火34 s,共40个循环。
1.7 Western blotting检测CyclinD1蛋白表达
细胞培养及因子作用等与1.6中相同,提取细胞总蛋白。获得的蛋白质样品与蛋白上样缓冲液(4×)按3∶1混合,置于100 ℃温箱中,煮10 min,使蛋白质充分变性;变性后的蛋白质在聚丙烯酰胺凝胶上进行电泳分离;在300 mA恒定电流条件下,将凝胶上的目的蛋白转到PVDF膜上;用5%脱脂奶粉溶液,将膜封闭2 h;Cyclin D1抗体4 ℃孵育过夜;二抗常温孵育2 h;加电化学发光显色液(Electrochemi- luminescence, ECL)避光显色,X光片曝光,扫描蛋白条带。
1.8 数据分析
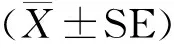
2 结 果
2.1 牦牛睾丸支持细胞培养与鉴定
纯化培养获得原代牦牛SC(图1 A)和三代SC(图1 B),均生长良好。Fasl免疫细胞化学法显示,Fasl蛋白在该细胞表达呈阳性(图1 C),阴性对照不表达(图1 D),由此可确定试验所用为纯度较高的牦牛睾丸支持细胞。
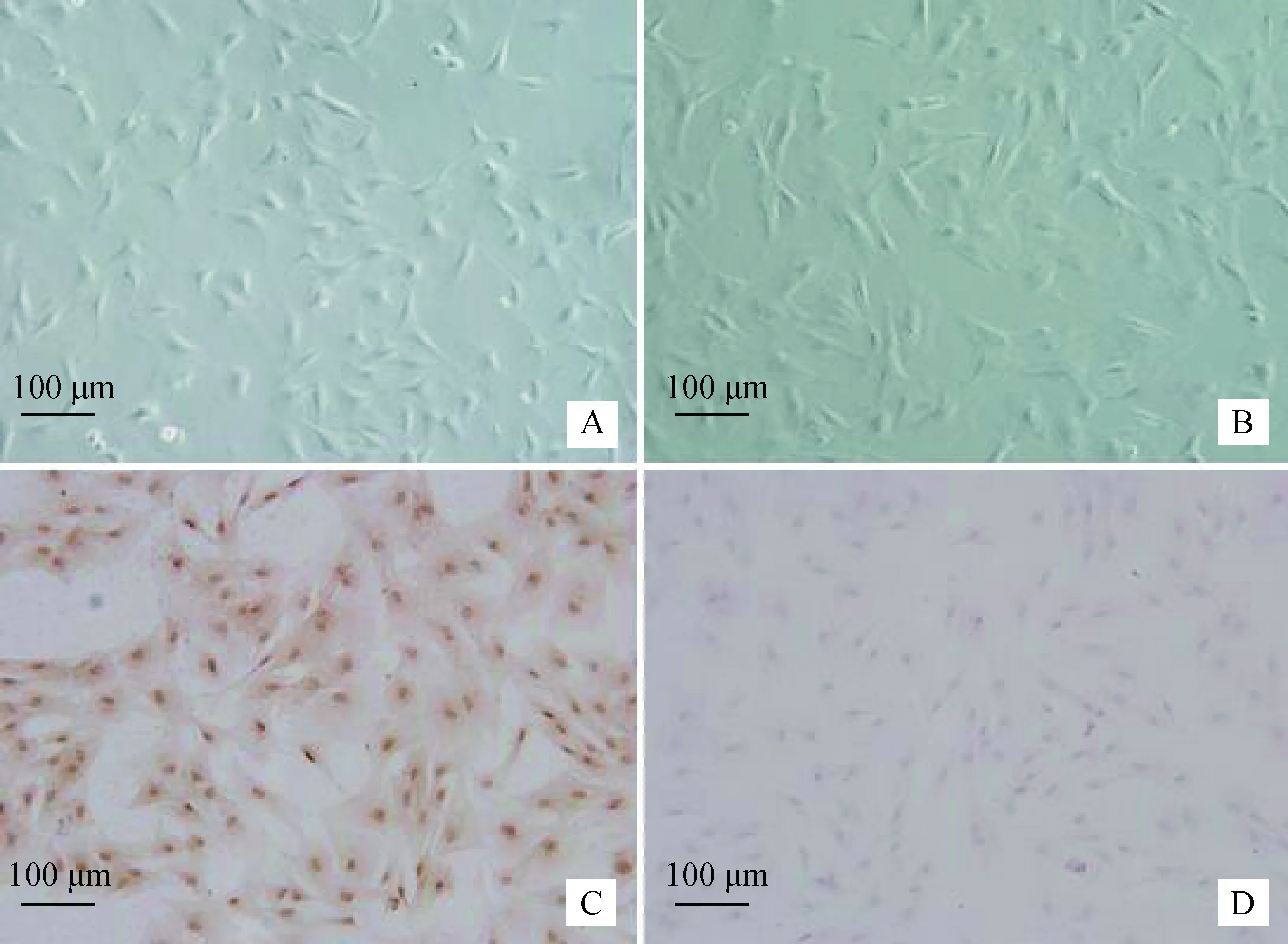
A. 原代SC; B. 三代SC;C. Fasl阳性表达;D.阴性对照A. The first generation of SC;B. The third generation of SC;C. Positive staining for Fasl;D. Negative control图1 牦牛睾丸支持细胞的培养和鉴定(标尺:100 μm)Fig.1 The cultivation and identification of the yak Sertoli cells (Scale bar: 100 μm)
2.2 CyclinD1基因的克隆及生物信息学分析
Cyclin D1-C进行RT-PCR扩增后,琼脂糖凝胶电泳显示,预期位置有明显荧光条带(图 2)。利用NCBI在线软件BLAST对拼接后的序列进行比对,Cyclin D1-C扩增产物序列与牛的CyclinD1(NM_001046273.2)序列为99%相似。将牦牛CyclinD1序列提交至GenBank,登录号为KY 420723。
ORF分析表明,该基因编码区长888 bp,起始密码子在8 bp处,终止密码子在895 bp处,编码295个氨基酸。系统进化树结果显示(图3),牦牛CyclinD1基因与瘤牛、黄牛和水牛的亲缘关系最近,与山羊和绵羊次之,与人和猫的亲缘关系最远。同源性分析结果表明(表2):牦牛Cyclin D1核苷酸序列同源性与黄牛和瘤牛的最高,为99.9%;与人的最低,为92.2%。牦牛Cyclin D1氨基酸序列同源性与黄牛、瘤牛和水牛的同源性均为100%,与人的同源性为93.5%。
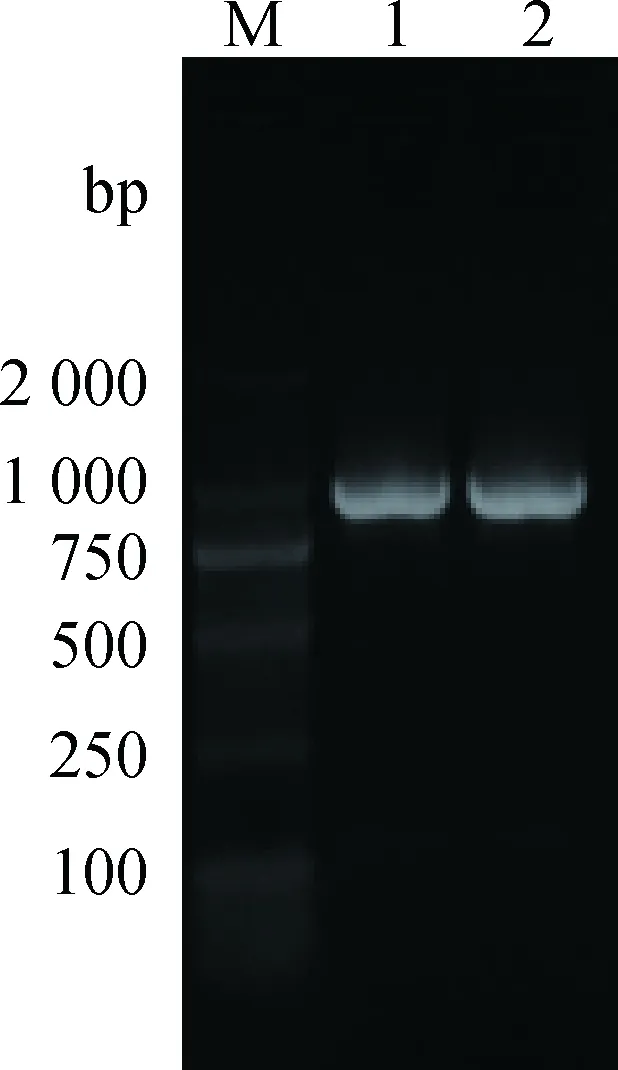
M. DL2000 DNA分子质量标准;1~2. Cyclin D1 基因扩增产物M. DL2000 DNA marker; 1-2. Cyclin D1 RT-PCR products图2 牦牛Cyclin D1基因的RT-PCR产物电泳结果Fig.2 Agarose gels electrophoresis results of Cyclin D1 RT-PCR products
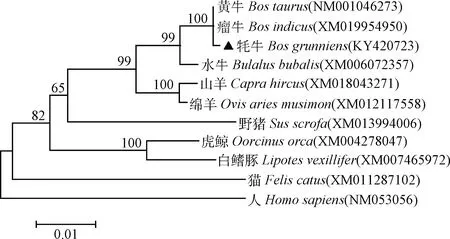
图3 Cyclin D1 基因系统进化树Fig.3 Phylogenetic tree of Cyclin D1
2.3 Cyclin D1蛋白在SC中的分布与定位
细胞免疫荧光显示(图4),Cyclin D1蛋白在SC胞核上高表达,部分细胞核中呈强表达,在SC胞质上呈极微弱表达。
表2 牦牛和不同物种间CyclinD1基因序列和氨基酸序列同源性比较
Table 2 Homologous comparisons of nucleotide and amino acids sequences of yakCyclinD1 gene with that of other species %

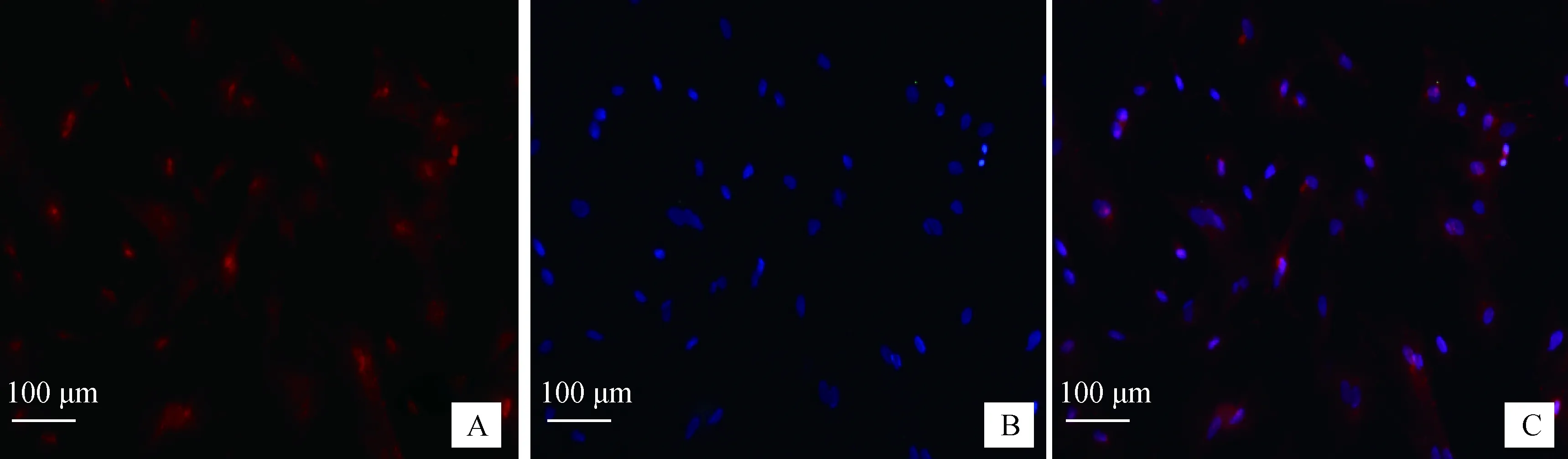
A. Cyclin D1;B. DAPI;C.合成A. Cyclin D1;B. DAPI;C. Merge图4 牦牛SC Cyclin D1蛋白表达免疫荧光技术检测(标尺:100 μm)Fig.4 The detection of Cyclin D1 protein on yak SC by immunofluorescence method (Scale bar: 100 μm)
2.4 IGF-I对牦牛SC 中Cyclin D1 mRNA的调节
IGF-I作用于体外培养的SC,对获得的样品进行qRT-PCR分析,结果显示(图5):IGF-I浓度为25和150 ng·mL-1时,CyclinD1 mRNA表达量与对照组差异不显著(P>0.05),前者表现促进,后者表现抑制;IGF-I浓度为50和100 ng·mL-1时,CyclinD1 mRNA表达量显著高于其他各组(P<0.05),其中50 ng·mL-1组的表达量最高,为对照组的1.65倍。
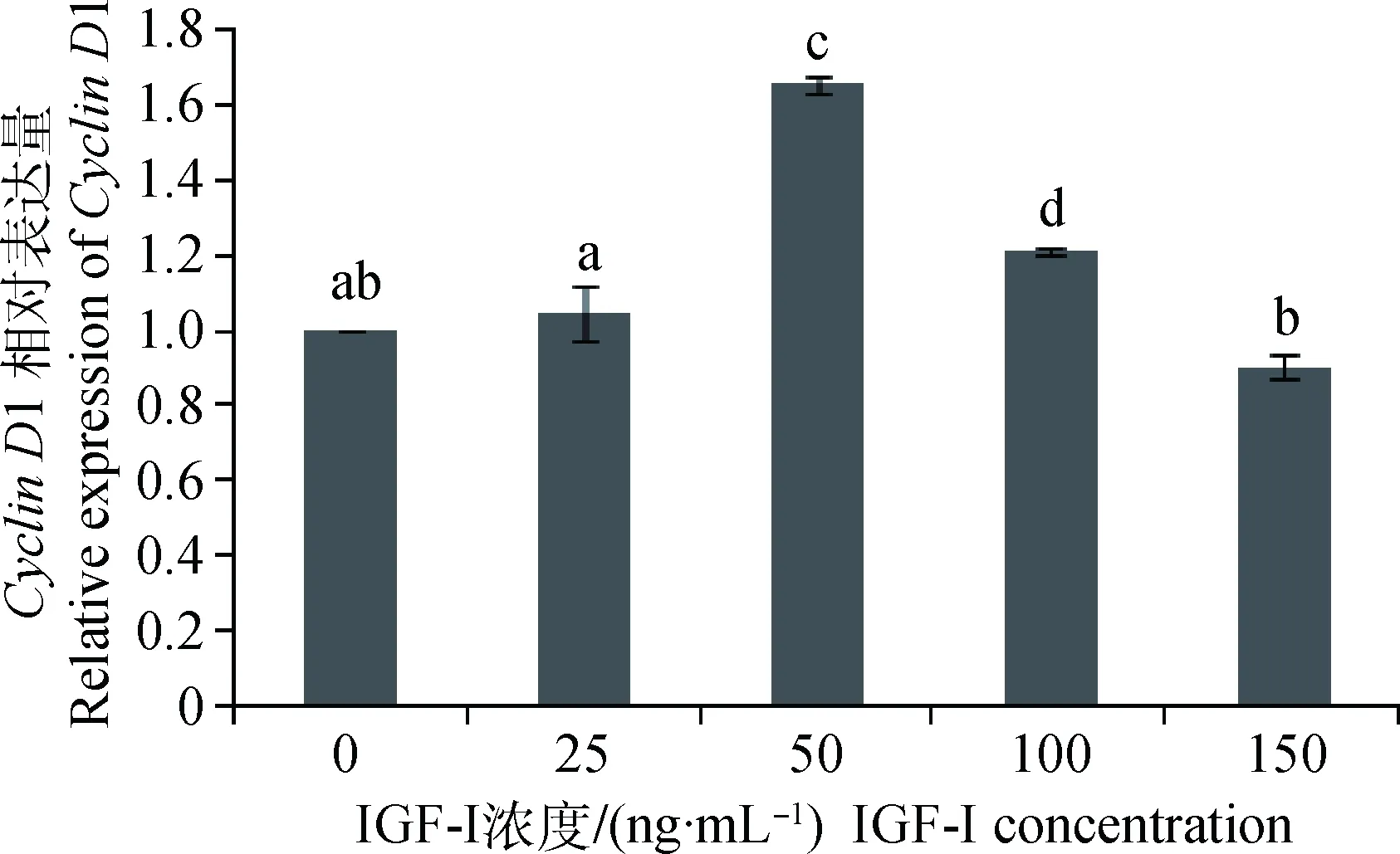
不同字母表示差异显著(P<0.05);相同字母表示差异不显著(P>0.05)。下同Different letters mean significant difference (P<0.05); same letter means no significant difference (P>0.05). The same as below图5 不同浓度IGF-I对Cyclin D1 mRNA表达的影响Fig.5 Effect of different concentration of IGF-I on Cyclin D1 mRNA expression
2.5 IGF-I对牦牛SC 中Cyclin D1 蛋白的调节
不同浓度IGF-I加入体外培养的SC,作用24 h,对获得的蛋白样品进行Western blotting,结果显示(图6和7):与对照组相比, IGF-I作用组的Cyclin D1蛋白的表达量均有提高,IGF-I浓度为100 ng·mL-1组蛋白表达量与对照组差异不显著(P>0.05),IGF-I浓度为25、50和150 ng·mL-1组蛋白表达量显著高于对照组(P<0.05),其中,50 ng·mL-1组的蛋白表达量最高,为对照组的1.20倍。
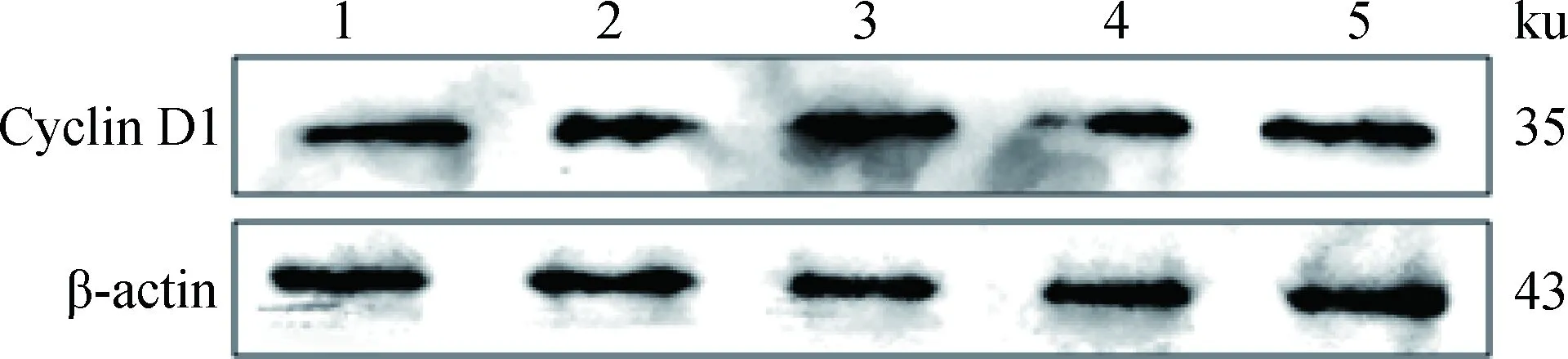
1~5. 0、25、50、100、150 ng·mL-1 IGF-I1-5.0, 25, 50, 100, 150 ng·mL-1 IGF-I图6 Cyclin D1和β-actin蛋白检测Fig.6 The detection of Cyclin D1 and β-actin protein
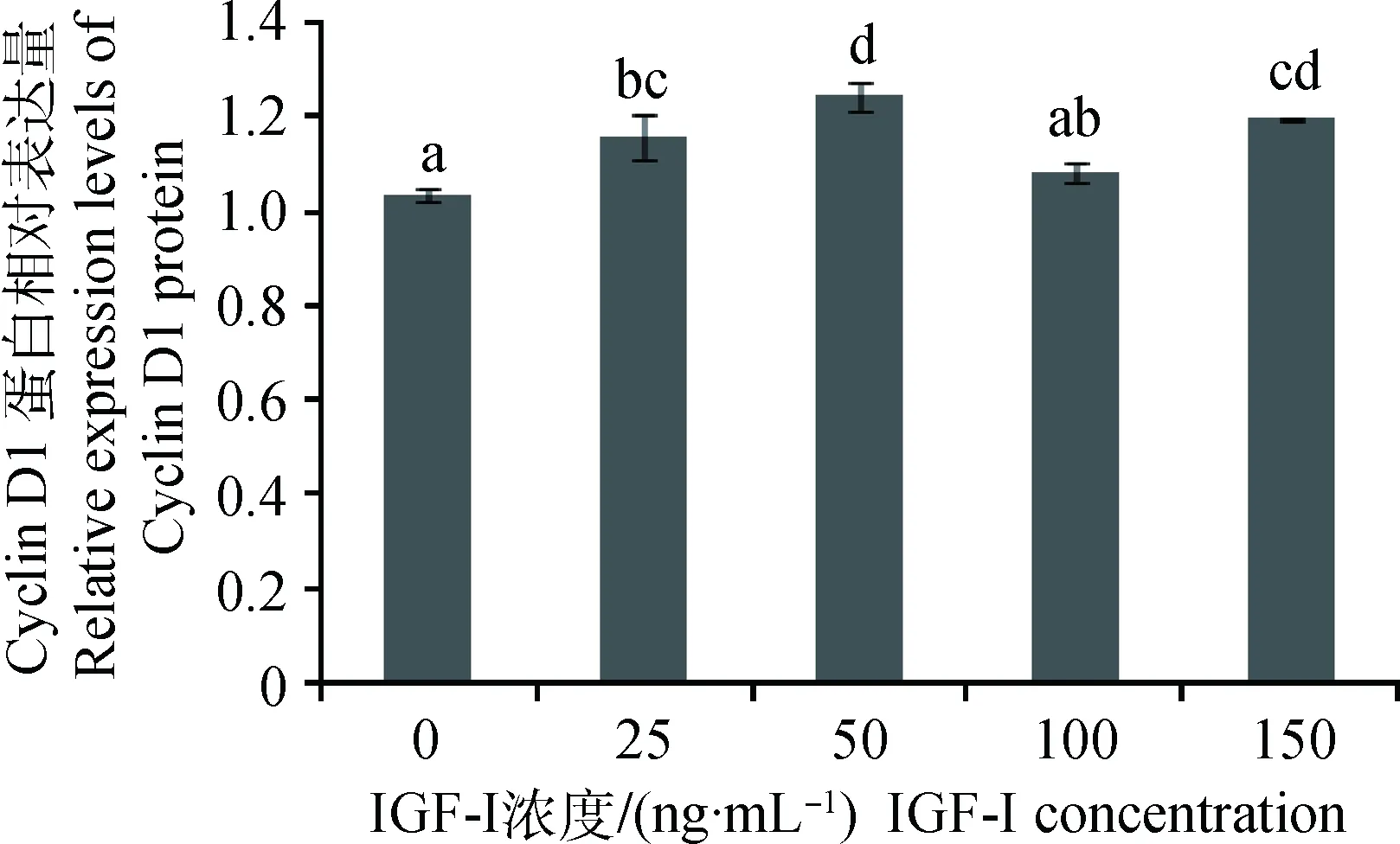
图7 不同浓度IGF-I对Cyclin D1蛋白表达的影响Fig.7 Effect of different concentration of IGF-I on Cyclin D1 protein expression
3 讨 论
本研究成功克隆出牦牛CyclinD1基因的CDS序列(GenBank登录号:KY 420723)。生物信息学分析显示,牛属动物CyclinD1核酸序列同源性达到99%以上,氨基酸序列完全一致,与其他物种相比均有较高同源性,表明CyclinD1基因在进化过程中具有保守性。 Cyclin D1蛋白在细胞中呈周期性表达,于G1期表达量最高。异步生长的人成纤维细胞免疫荧光结果显示, Cyclin D1蛋白在绝大多数细胞中呈阳性表达,且定位于细胞核[17]。本研究中,用于免疫荧光检测的SC未做同步生长处理,其结果显示,绝大多数细胞核中高表达Cyclin D1蛋白,这与前人的研究结果一致,但胞核中Cyclin D1的荧光强度并不同,可能由于细胞处于周期进程中的不同阶段。
A. Dance等[18]通过细胞计数证明,IGF-I促进体外培养的牛SC数目增殖。本研究则从分子水平进行探究,分析不同浓度的IGF-I对牦牛睾丸支持细胞中Cyclin D1基因和蛋白表达的影响,结果显示:添加IGF-I后,Cyclin D1基因和蛋白的表达量总体上升,且具有剂量依赖性,表明IGF-I可以通过调控Cyclin D1的表达,促进SC周期进程,引起细胞增殖;但高浓度的IGF-I可能激活了抑制Cyclin D1表达的途径,在本研究中,IGF-I 为150 ng·mL-1时,试验组CyclinD1 mRNA表达量低于对照组(P>0.05),可能与PI3K介导的胰岛素家族的负调控机制有关[19]。P.Ye等[20]研究发现,100 ng·mL-1的IGF-I作用于大鼠少突胶质细胞24 h,CyclinD1 mRNA表达量为对照组的7倍;Y. Jiang等[21]发现,100 ng·mL-1的IGF-I作用于鼠系膜细胞,Cyclin D1蛋白表达量为对照组的1.6倍。在本研究中,IGF-I 为100 ng·mL-1时,Cyclin D1 mRNA和蛋白的表达量分别为对照组的1.21和1.05倍。IGF-I作用于细胞时,首先与细胞表面的受体相结合,激活下游分子。研究显示,不同组织器官中IGF-I及其受体的含量[22-23]与活性[24]均不同。因此,以上差异可能与试验对象在机体内的位置及功能有关,提示生长因子对生殖器官的调控可能存在特异性。本研究中Cyclin D1基因和蛋白表达呈现一定差异性,可能是由于Cyclin D1蛋白表达过程受到多条信号通路的调控。目前研究表明,Cyclin D1至少存在两条转录后调控通路,即mTOR和/或PI3-p70S6通路和PI3 -eIF4E通路,它们可与Ras偶联,对Cyclin D1进行蛋白翻译水平的调控[25]。Ras是生长因子作用靶标,将刺激细胞生长的信号传递给下游分子,促进细胞周期进展[26]。同时,IGF-I还可以激活PI3K/Akt和MEK/ERK激酶途径,调控Cyclin D1的表达[27]。因此,Cyclin D1在SC上的表达可能受到多方面的调控。
雄性动物成年后, SC在体内不再进行增殖分化,雄性动物的生精质量在其成年之前就已决定[3]。SC的成熟障碍是多数雄性生殖障碍的根本原因,且SC的成熟障碍可能在出生之前就已经存在[28-29]。总结本研究及前人成果发现,IGF-I上调牦牛SC中Cyclin D1蛋白的表达,同时还可抑制多种生殖相关细胞的凋亡。因此,IGF-I可能通过促进牦牛SC周期进程,抑制其凋亡,从而促进SC的增殖和成熟,使其数量和质量维持正常。这对提高牦牛的生精能力及精子质量具有重要意义。
4 结 论
本研究成功克隆牦牛CyclinD1基因(GenBank登录号:KY 420723),生物信息学分析显示,其在进化过程中高度保守,Cyclin D1蛋白主要在SC胞核表达。IGF-I上调SC中Cyclin D1基因和蛋白的表达,具有剂量依赖性,最佳作用浓度为50 ng·mL-1。IGF-I可以通过影响SC中Cyclin D1的表达调控睾丸发育,从而影响雄性胚胎的生殖发育和成年动物的精子质量。
[1] WONG C H, CHENG C Y. The blood-testis barrier: its biology, regulation, and physiological role in spermatogenesis[J].CurrTopDevBiol, 2005, 71: 263-296.
[2] JOHNSON L, THOMPSON D L Jr, VARNER D D. Role of Sertoli cell number and function on regulation of spermatogenesis[J].AnimReprodSci, 2008, 105(1-2): 23-51.
[3] ORTH J M, GUNSALUS G L, LAMPERTI A A. Evidence from Sertoli cell-depleted rats indicates that spermatid number in adults depends on numbers of Sertoli cells produced during perinatal development[J].Endocrinology, 1988, 122(3): 787-794.
[4] BRADEN W A, MCCLENDON A K, KNUDSEN E S. Cyclin-dependent kinase 4/6 activity is a critical determinant of pre-replication complex assembly[J].Oncogene, 2008, 27(56): 7083-7093.
[5] HINDS P W, DOWDY S F, EATON E N, et al. Function of a humanCyclingene as an oncogene[J].ProcNatlAcadSciUSA, 1994, 91(2): 709-713.
[6] WANG H, YUAN Q Q, SUN M, et al. BMP6 regulates proliferation and apoptosis of human Sertoli cellsviaSmad2/3 and cyclin D1 pathway and DACH1 and TFAP2A activation[J].SciRep, 2017, 7: 45298.
[7] SICINSKI P, DONAHER J L, PARKER S B, et al. Cyclin D1 provides a link between development and oncogenesis in the retina and breast[J].Cell, 1995, 82(4): 621-630.
[8] 潘阳阳, 崔 燕, 樊江峰, 等. 胰岛素样生长因子-1(IGF-1)对牦牛卵丘细胞热休克蛋白70(HSP70)表达的影响及其与细胞凋亡的关联性分析[J]. 农业生物技术学报, 2015, 23(9): 1208-1216. PAN Y Y, CUI Y, FAN J F, et al. The effect of insulin-like growth factor (IGF-1) on heat shock protein 70 (HSP70) expression of yak (Bosgrunniens) cumulus cells and its relation with apoptosis[J].JournalofAgriculturalBiotechnology, 2015, 23(9): 1208-1216. (in Chinese)
[9] PAN Y Y, CUI Y, BALOCH A R, et al. Insulinlike growth factor I improves yak (Bosgrunniens) spermatozoa motility and the oocyte cleavage rate by modulating the expression of Bax and Bcl-2[J].Theriogenology, 2015, 84(5): 756-762.
[10] YOON M J, ROSER J F. Insulin-like growth factor-I (IGF-I) protects cultured equine Leydig cells from undergoing apoptosis[J].AnimReprodSci, 2010, 122(3-4): 353-358.
[11] SHIN S M, KIM S, HONG J G, et al. IGF-I improves mitochondrial membrane potential during hypothermic storage of canine spermatozoa[J].JVetMedSci, 2014, 76(7): 1065-1067.
[12] SIRISATHIEN S, BRACKETT B G. TUNEL analyses of bovine blastocysts after culture with EGF and IGF-I[J].MolReprodDev, 2003, 65(1): 51-56.
[13] CHEN P, PAN Y, CUI Y, et al. Insulin-like growth factor I enhances the developmental competence of yak embryos by modulating aquaporin 3[J].ReprodDomestAnim, 2017, 52(5): 825-835.
[14] PITETTI J L, CALVEL P, ZIMMERMANN C, et al. An essential role for insulin and IGF1 receptors in regulating sertoli cell proliferation, testis size, and FSH action in mice[J].MolEndocrinol, 2013, 27(5): 814-827.
[15] ANWAY M D, FOLMER J, WRIGHT W W, et al. Isolation of sertoli cells from adult rat testes: an approach toexvivostudies of Sertoli cell function[J].BiolReprod, 2003, 68(3): 996-1002.
[16] ZHANG H, LIU B, QIU Y, et al. Pure cultures and characterization of yak Sertoli cells[J].TissueCell, 2013, 45(6): 414-420.
[17] BALDIN V, LUKAS J, MARCOTE M J, et al. Cyclin D1 is a nuclear protein required for cell cycle progression in G1[J].GeneDev, 1993, 7(5): 812-821.
[18] DANCE A, KASTELIC J, THUNDATHIL J. A combination of insulin-like growth factor I (IGF-I) and FSH promotes proliferation of prepubertal bovine Sertoli cells isolated and culturedinvitro[J].ReprodFertilDev, 2016, 29(8): 1635-1641.
[19] TANIGUCHI C M, EMANUELLI B, KAHN C R. Critical nodes in signalling pathways: insights into insulin action[J].NatRevMolCellBiol, 2006, 7(2): 85-96.
[20] YE P, HU Q C, LIU H D, et al. β-catenin mediates insulin-like growth factor-I actions to promote cyclin D1 mRNA expression, cell proliferation and survival in oligodendroglial cultures[J].Glia, 2010, 58(9): 1031-1041.
[21] JIANG Y, CHENG D W, LEVI E, et al. IGF-1 increases laminin, cyclin D1, and p21Cip1expression in glomerular mesangial cells: an investigation of the intracellular signaling pathway and cell-cycle progression[J].JCellBiochem, 2006, 98(1): 208-220.
[22] WERTHER G A, ABATE M, HOGG A, et al. Localization of insulin-like growth factor-I mRNA in rat brain byinsituhybridization-relationship to IGF-I receptors[J].MolEndocrinol, 1990, 4(5): 773-778.
[23] WEISS O, ANNER H, NEPHESH I, et al. Insulin-like growth factor-I (IGF-I) and IGF-I receptor gene expression in the kidney of the chronically hypoinsulinemic rat and hyperinsulinemic rat[J].Metabolism, 1995, 44(8): 982-986.
[24] PFAFFL M W, GEORGIEVA T M, GEORGIEV I P, et al. Real-time RT-PCR quantification of insulin-like growth factor (IGF)-1, IGF-1 receptor, IGF-2, IGF-2 receptor, insulin receptor, growth hormone receptor, IGF-binding proteins 1, 2 and 3 in the bovine species[J].DomestAnimEndocrinol, 2002, 22(2): 91-102.
[25] GUO Y, STACEY D W, HITOMI M. Post-transcriptional regulation of cyclin D1 expression during G2 phase[J].Oncogene, 2002, 21(49): 7545-7556.
[26] FU M F, WANG C G, LI Z P, et al. Minireview: Cyclin D1: normal and abnormal functions[J].Endocrinology, 2004, 145(12): 5439-5447.
[27] YAN Y, LI X Y, KOVER K, et al. CREB participates in the IGF-I-stimulation cyclin D1 transcription[J].DevNeurobiol, 2013, 73(8): 559-570.
[28] SHARPE R M, MCKINNELL C, KIVLIN C, et al. Proliferation and functional maturation of Sertoli cells, and their relevance to disorders of testis function in adulthood[J].Reproduction, 2003, 125(6): 769-784.
[29] 梁洺源,朱化彬,陈晓丽,等,支持细胞调控精原干细胞增殖、分化和凋亡的研究进展[J].畜牧兽医学报, 2016, 47(2): 225-231. LIANG M Y,ZHU H B,CHEN X L,et al. The study progress of the proliferation, differentiation and apoptosis of spermatogonial stem cells under the regulation of Sertoli cells[J].ActaVeterinariaetZootechnicaSinica, 2016, 47(2): 225-231.(in Chinese)
