鸡支原体对氟喹诺酮类药物的耐药判定标准研究现状
2018-03-13王淑歌谷宇锋黄玲利黄安雄刘振利郝海红袁宗辉
王淑歌,谷宇锋,黄玲利,黄安雄,王 旭,刘振利,郝海红,袁宗辉
(国家兽药残留基准实验室(华中农业大学),农业部兽药残留检测重点实验室(华中农业大学),国家兽药安全评价实验室(华中农业大学),农业部畜禽产品质量安全风险评估实验室(武汉),武汉 430070)
鸡支原体又叫鸡霉形体,其对鸡和火鸡具有高致病性[1]。禽类常见致病的支原体可归为三类[2]:鸡毒支原体、滑液支原体和火鸡支原体。鸡毒支原体对家禽养殖业影响最大,主要引起以鼻窦炎、气管炎和气囊炎为主的慢性呼吸道疾病[3-4]。尽管致死率低,但是会导致饲料转化率降低和肉鸡胴体品质的下降,更大程度上增加与其他疾病共感染的概率[5-6]。随着现代生物学技术的发展,鸡支原体的检测方法在基因和蛋白质水平上也取得明显的进展。主要有酶联免疫吸附试验、分离鉴定法和分子生物学技术,如PCR检测,新兴技术如环介导等温检测法等[7-10]。疫苗免疫接种对抑制鸡毒支原体感染也有很好的效果,如国外疫苗公司先后开发出来的F株、ts-11、S6和6/85株,目前无直接证据证明这些疫苗的致病性,其保护力和安全性也在不断提高,这在鸡支原体疾病的防制中具有很好的前景[11-13]。
氟喹诺酮类药物广泛应用于兽医临床上鸡支原体的治疗[14]。该类药物具有抗菌谱广、活性强等特点,属于广谱杀菌药[15]。它抑制细菌DNA合成的DNA促旋酶和拓扑异构酶Ⅳ,从而阻断DNA复制和转录,导致细胞死亡[16]。另外它还可以通过诱导DNA和SOS修复,使DNA回旋酶抑制,同时使DNA错误复制,从而引起基因突变、细菌死亡[17]。而对于鸡支原体对氟喹诺酮的耐药性研究,国内外很少有报道[18]。目前已知的鸡支原体耐氟喹诺酮类药物的机制主要是通过GyrA和ParC氨基酸残基的改变而使药物的作用靶位发生改变。在这些药物的药物选择压力下,呈现出普遍的对氟喹诺酮类药物的耐药性[19-20]。
由于氟喹诺酮类药物普遍应用于鸡支原体病的治疗以及不合理的临床用药,已经出现了部分鸡支原体对氟喹诺酮类药物的耐药现象,而耐药需要监测并且具有紧迫性。目前国际上已有比较多的耐药判定标准,大都是在CLSI和EUCAST的基础上改进的。我国并没有制定出适合我国国情的鸡支原体对氟喹诺酮类药物的耐药判定标准,亟需制定耐药判定标准来指导临床用药和减少耐药性的产生。耐药判定标准的制定,有助于我国兽医工作者在临床过程中有规可依,有法可循。根据我国鸡支原体的特征和地域区别,能够更为合理地制定出符合当地实际情况的标准。本文以耐药判定标准为中心,综述了鸡支原体对氟喹诺酮类药物耐药判定标准制定的研究现状,为鸡支原体对氟喹诺酮类药物耐药判定标准的制定提供合理的研究方向和参考。
1 药物耐药判定标准(折点)的定义和建立流程
1.1 折点的定义
判定标准又称解释标准或折点,折点在现代微生物学实验中占着重要的比重,其用来定义菌株对抗菌药物的敏感性和耐药性[21]。CLSI将折点分为敏感性折点、中介和耐药性折点[22]。其制定方法主要包括稀释法和纸片法[23]。稀释法分为琼脂稀释法和肉汤稀释法,肉汤稀释又可分为大量稀释法和微量稀释法两种,其中后者是现在比较常用的方法[24]。CLSI和EUCAST作为折点制定比较权威的组织,对折点的制定方法也有不同之处,但是在制定流程方面也有很多相似之处,也需要确定野生型临界值(COWT)、药效学临界值(COPD)及临床临界值(COCL)。COWT是野生型菌株MIC值范围的上限,EUCAST则将其定义为流行病学临界值(ECOFFs),一般来说,ECOFFs更为常用,其不考虑临床效力,单纯考察细菌对药物的敏感性情况,主要目的是用于耐药性表型的流行病学监测[25]。药效学临界值也叫 PK/PD临界值,是选择动物模型后用生理药物浓度(如血液、尿液或牛奶)下的药动学数据和微生物药物敏感性参数制定的MIC值[22]。PK/PD 将药物在动物体内的代谢过程与体外药效学数据联系起来,主要PK/PD 参数:T>MIC、Cmax/MIC、AUC/MIC。临床临界值(COCL)更倾向于区分感染病原菌预后良好或者治疗失败。一般是通过临床有效性试验获得的,临床有效性试验数据内容很多,包括抗菌药物作用的靶动物等,在确定该临界值时,判断依据一般是病原菌的MIC(最小抑制浓度)分布、动物自然发病后使用药物的PK/PD参数、临床疗效,临床80%以上应答率等[26-27]。
1.2 折点的建立流程
CLSI是一个制定标准方法的国际性组织,它具有教育性质的综合性、非营利性的特点,其制定的许多临床检验标准及操作被视为金标准,许多国家都以此作为参考[28]。敏感性折点(S)是以野生型临界值(COWT)、临床临界值(COCL)以及PK/PD临界值(COPD)为基础的,确定最终折点应遵循一定原则。从CLSI的M37-A3文件中,我们可以了解到最终的敏感性折点建立的流程和树状图。MIC分布和野生菌株的临界值,体外耐药标志,包括表型和基因型,来自于动物模型和人体研究的PK/PD数据以及来源于恰当的临床研究和病原菌MIC的临床和细菌学预后数据等是设定正确折点所必需的参考值。
科学地把握折点的定义,明确耐药性折点对于兽医临床的重要性。折点的制定方法有多种,不同的折点制定组织其制定的方法和程序也不尽相同,但都是根据耐药监测的数据制定出来的,具有一定的地域性。所以不同的折点制定组织制定的折点其可能只具备一定的参考意义,并不能照搬过来作为我国的耐药判定标准。对于我国的折点,需要根据我国存在的鸡支原体的野生型MIC临界值、药动学和药效学数据以及临床数据,综合考虑制定出符合我国现状的耐药判定标准。
2 鸡支原体对喹诺酮类药物野生型临界值的研究
鸡支原体对氟喹诺酮类的野生型临界值的制定是参照CLSI的M37-A3文件,临床分离规定数量的菌株,并应用CLSI认可和推荐的方法进行MIC值的测定。绘制细菌MIC分布柱状图,观察野生型菌株和非野生型菌株的分界点,若野生型菌株MIC呈对数正态分布,则取拐点处为临界值;通常涵盖一个完整正态分布90%以上菌株的最低MIC处为临界值。关于鸡支原体对氟喹诺酮类的研究主要包括:MIC分布、耐药率和耐药分子机制方面的研究,且相关文献报道不多。
2.1 支原体对氟喹诺酮类药物的MIC分布
CLSI和EUCAST都没有针对鸡支原体制定出喹诺酮类药物的相应野生型折点值,支原体对氟喹诺酮类药物不同分离地的MIC分布在不同国家和地区差异较大。郭伟娜[29]选用微量稀释法测定了20株鸡支原体对六种抗生素的MIC,结果表明临床分离株对抗菌药物的敏感性有一定的地域性,从同一地区的分离的菌株对药物的敏感程度也比较相似,这或许与抗生素使用的频率有关。一些研究者对支原体耐喹诺酮类药物的MIC分布进行了相关研究(表1),证实了支原体对喹诺酮类药物的耐药现象越来越严重。A. Barberio等[30]对奶牛中分离的支原体进行了敏感性的研究,研究发现牛源支原体对恩诺沙星的MIC90值为2 μg·mL-1。W. J. M. Landman等[31]对家禽分离的滑液支原体的抗生素敏感性进行了研究,测得其对恩诺沙星和双氟沙星的耐药折点值分别为2和4 μg·mL-1。P. Thongkamkoon等[32]对2006—2011年分离的猪肺炎支原体的耐药折点进行了研究,测得其耐药折点值为2 μg·mL-1,对恩诺沙星的MIC50和MIC90的值分别为1.56和6.25 μg·mL-1。K. M. Sulyok等[33]对匈牙利牛源支原体进行了药敏分析,测得喹诺酮类药物达氟沙星、恩诺沙星和马波沙星的MIC90值分别为0.312、0.312和0.625 μg·mL-1。D. Grózner等[34]对鹅体内分离的支原体进行了药敏分析,测得该支原体对诺氟沙星和双氟沙星的MIC50值为10 μg·mL-1。J. S. Jensen等[35]测定出鸡支原体对环丙沙星和莫西沙星的最小抑菌浓度MIC分别为16和4 μg·mL-1。A. Heuvelink等[36]通过肉汤微量稀释评估牛源支原体MIC,测得牛源支原体对恩诺沙星的MIC50和MIC90值都为0.25 mg·mL-1。L. B. Duffy等[37]采用微量肉汤稀释法测定了鸡支原体对左氧氟沙星的MIC值,MIC50和MIC90的值分别为0.5和2.0 μg·mL-1。R. Krausse等[38]报道,鸡支原体对氧氟沙星和环丙沙星的敏感性表现出一致性,MIC50和MIC90的值都为1和2 μg·mL-1。药敏试验的结果表明,支原体对氟喹诺酮类药物的耐药呈普遍现象。
2.2 鸡支原体对氟喹诺酮类药物的耐药率
国内外对鸡支原体耐氟喹诺酮类药物的报道很少,只有国内少数研究报道了鸡支原体对氟喹诺酮的耐药率。林居纯等[45]对33株鸡支原体临床分离株进行了耐药性调查,参考戴自英[46]的方法进行耐药菌株判断,待检菌株的MIC值≥8倍质控菌株MIC值的定义为耐药菌株,否则为敏感菌株。结果表明,33株鸡支原体对诺氟沙星、环丙沙星和恩诺沙星等6种氟喹诺酮药物具有较高的耐药性,耐药率均已超过50%。向蓉等[47]对分离鉴定出来的20株鸡支原体采用微量肉汤二倍稀释法测定环丙沙星等几种不同抗菌药物的MIC,同样按照戴自英[46]的方法进行,测定出对环丙沙星耐药的菌株有16株,耐药率已达到80%。然而耐药率的研究和耐药性判断参考值有很大关系,不同的参考值,对菌株的耐药和敏感程度的判定也不一样,这提示建立一套完善的鸡支原体耐药判定标准迫在眉睫。
表1 部分支原体对氟喹诺酮类的MIC分布值
Table 1 The distribution ofMICof someMycoplasmato fluoroquinolones

药物Drug支原体MycoplasmaMIC分布/(μg·mL-1)MICdistribution参考文献Reference诺氟沙星羊支原体0.1~12.8[39]恩诺沙星羊支原体0.125~0.5[40]恩诺沙星猪支原体0.1~25[33]恩诺沙星鸡支原体0.002~0.095[41]单诺氟沙星牛支原体0.312~8[42]恩诺沙星牛支原体0.12~32[42]马波沙星牛支原体0.625~32[42]格帕沙星人支原体0.03~2[43]吉米沙星人支原体0.001~0.25[44]
2.3 支原体耐氟喹诺酮类药物的分子机制
细菌中存在喹诺酮类抗药决定区(QRDR),其改变可以导致细菌对喹诺酮类药物的敏感性发生变化[48]。喹诺酮类抗药决定区(QRDR)中的3个突变热点(DNA解旋酶A亚单位GyrA基因上的第83位点,拓扑异构酶Ⅳ的C亚单位ParC基因上的第80和84位点)与细菌耐药性的富积相关[49-50]。G. L. Murray等[51]对临床分离的人源支原体的耐药性进行了研究,研究发现莫西沙星对该支原体的治疗失败与GyrA和ParC基因的突变密切相关。R. Dumke等[52]研究非淋菌性尿道炎的细菌耐药性,发现支原体对氟喹诺酮类药物的耐药和ParC基因的81和83位氨基酸的突变直接相关。T. Sato等[53]对日本奶牛分离的支原体喹诺酮耐药决定区(QRDR)突变对氟喹诺酮类药物(恩诺沙星、奥比沙星、达氟沙星)的敏感性进行了研究,结果显示该支原体对氟喹诺酮类药物的MIC≥4 μg·mL-1,表明ParC基因的突变对耐药性的影响非常重要。J. Li等[19]对鸡毒支原体耐氟喹诺酮药物进行了研究,研究发现在1/2MIC的恩诺沙星和环丙沙星浓度下,可以诱导GyrA和ParC基因发生突变,导致鸡支原体对氟喹诺酮类药物的耐药性增强。以上研究表明支原体对氟喹诺酮类药物的耐药由GyrA和ParC基因的突变介导。魏飞龙等[18]研究了鸡支原体DNA回旋酶的GyrA、GyrB和拓扑异构酶Ⅳ的ParC和ParE基因,结果发现对喹诺酮类药物耐药的鸡支原体都在喹诺酮类耐药决定区(QRDR)的GyrA和ParC基因发生了突变。上述研究表明,DNA解旋酶的GyrA和拓扑异构酶Ⅳ的ParC突变对鸡支原体产生耐药性极其重要。
对于支原体野生型折点值的研究主要涉及三个方面,MIC分布、耐药率和耐药分子机制。从支原体的MIC分布可以看出其敏感性范围较大,并且有的上限药物浓度相当大,这就表明支原体对氟喹诺酮类药物的耐药确实较为严重,这从支原体对某些氟喹诺酮类药物的MIC50和MIC90值也能得到同样的结论。目前对于支原体耐药率的研究较少,可能和临床数据的收集困难有一定的关系,但对于支原体耐药率的统计却非常必要,故展开支原体对氟喹诺酮类药物耐药率的统计工作显得很有意义。根据文献报道可以得出结论,支原体对于氟喹诺酮类药物分子水平上的耐药主要是因为喹诺酮类抗药决定区(QRDR)的GyrA和ParC基因的突变引起的氨基酸的改变。这就为克服支原体对氟喹诺酮类药物的耐药提供了思路,是否可以应对该突变合理地修饰消除其耐药性。
3 鸡支原体对喹诺酮类药物PK/PD临界值的研究
EUCAST对几种应用于临床的喹诺酮类药物制定了PK/PD折点值(表2),但是不分种属,研究者也做了一些鸡支原体对氟喹诺酮类药物的PK/PD折点的相关研究。PK/PD模型是一个动力学过程,综合研究体内药动学过程与药效量化指标,把用于描述药动学与药效学的时间、药物浓度、药物效应的指标结合起来,从而更加全面准确地把握药物的效应随剂量和时间的变化规律。氟喹诺酮类药物属于浓度依赖性药物,其对致病菌的杀菌作用依赖于峰浓度。当前用于评估浓度依赖性药物杀菌作用PK/PD的参数主要有AUC0-24/MIC和CMax/MIC。
表2 氟喹诺酮类药物的PK/PD折点值(EUCAST)[54]
Table 2 The PK/PD cut off of fluoroquinolones

氟喹诺酮类药物FluoroquinolonesMIC折点/(mg·L-1)S≤R>PK/PD折点值基于以下剂量(与种属无关的)PK/PDfoldpointbasedonthefollowingdose(unrelatedtothespecies)环丙沙星0.51折点值适用于口服剂量为500mg×2或者对于不复杂的尿路感染的剂量为250mg×2~750mg×2,适用于静脉注射的剂量为400mg×2~400mg×3左氧氟沙星12折点值适用于口服剂量为500mg×1~500mg×2,适用于静脉注射的剂量为500mg×1~500mg×2氧氟沙星0.51折点值适用于口服剂量为200mg×2~400mg×2,适用于静脉注射的剂量为200mg×2~400mg×2莫西沙星0.51折点值适用于口服剂量和静脉注射剂量为400mg×1诺氟沙星0.51折点值适用于口服剂量为400mg×2
3.1 氟喹诺酮类药物在鸡体内的药效学(PD)研究
氟喹诺酮类药物属于浓度依赖型抗菌药,其对致病菌的杀菌作用取决于峰浓度,而与作用时间关系不大。可以通过提高Cmax来提高疗效,但药物剂量不应超过最低毒性剂量。当前用于评价浓度依赖性药物杀菌作用PK/PD的参数主要有AUC/MIC和Cmax/MIC。药物对病原体的治疗效果和宿主动物的类别有很大的关系,不同的动物对不同药物的体内过程具有差异性。
氟喹诺酮类药物广泛应用于家禽的全身性细菌感染的治疗。对氟喹诺酮类药物的最佳剂量的选择应在药代动力学(PK)和药效学(PD)的基础上,并考虑药物的特性。D. J. Dimitrova等[55]研究了恩诺沙星在火鸡体内的药效学,结果显示Cmax/MIC的范围为(12.90±0.50) h 至(161.23±5.90) h,AUC0-24/MIC的范围为(137.82±4.27) h至(2 153.44±66.60) h。有学者报道了对于三种不同品牌的口服恩诺沙星在肉鸡体内的PK-PD比较研究,结果显示Cmax/MIC的值分别为16.67、15.17、10.5 h[56]。A. M. Haritova等[57]报道,马波沙星静脉注射给药时AUC0-24/MIC值为94.32 h,口服给药时AUC0-24/MIC和Cmax/MIC的值分别为(73.69±25.54) h、(5.35±2.31) h。S. Ivanova等[58]报道静注环丙沙星在肉鸡体内的药效学,房室模型中AUC0-24的值为(11.34±1.11) μg·h·mL-1,Cmax的值为(2.841±0.280) μg·mL-1;非房室模型中AUC0-24的值为(11.97±0.62) μg·h·mL-1,Cmax的值为(2.638±0.460) μg·mL-1。张秀英等[59]报道单诺氟沙星(5 mg·kg-1)在雏鸡体内的药效学特征,静注时AUC0-24值为3.287 2 μg·h·mL-1,口服给药时AUC0-24和CMax的值分别为3.052 3 μg·h·mL-1、0.548 8 μg·mL-1。
AUC/MIC对临床治愈率有很强的预见性。当AUC/MIC<125时,细菌清除率只有26%,与之相比,AUC/MIC>125时的细菌清除率为82%。临床上,AUC/MIC<125时,治愈率为42%,而AUC/MIC>125时,临床治愈率为80%[60]。所以应根据具体药物在具体动物的AUC0-24值,结合具体药物对具体细菌的MIC值,确定其AUC/MIC的值,预测药物对细菌病的治疗效果。
3.2 氟喹诺酮类药物在动物体内的药动学(PK)研究
氟喹诺酮类药物在畜禽体内的药动学研究主要是临床上常用的氟喹诺酮类药物,几乎涉及了所有上市的药物,同时研究者也对不同的给药方式进行了比较。药动学的主要参数有分布半衰期、消除半衰期、最大血药浓度和达峰时间等。这些数据也是制定PK/PD折点值必需的。目前对于药效学和药动学的研究大都集中在感染人的支原体上,而对于动物支原体的研究比较少,鸡支原体的药效学和药动学的数据就更为缺乏。
一些研究者对氟喹诺酮药物在动物体内的药动学进行了相关研究(表3)。D.J.Dimitrova等[61]研究了达氟沙星通过静注和口服给药在野鸡、珍珠鸡和鹌鹑体内的代谢动力学。静注给药时消除半衰期分别为(6.82±1.87)、(3.31±0.13)和(3.84±0.89) h,总的体清除率分别为(0.45±0.16)、(1.23±0.07)和(1.61±0.34) L(kg·h)-1。口服时最大血药浓度分别为(0.54±0.26)、(0.51±0.12)和(0.78±0.11) μg·mL-1,达峰时间分别为(2.04±0.23)、(10.40±5.64)和(5.35±0.47) h。S. S. Devada等[62]考察了加替沙星通过静脉和口服给药在肉仔鸡体内的药代动力学,按体重10 mg·kg-1静注时药物分布的半衰期为(0.330±0.008) h,消除半衰期为(3.62±0.03) h,总的体清除率为(0.480±0.002) L(h·kg)-1。按体重口服10 mg·kg-1时表观分布容积、总的体清除率和平均滞留时间分别为(3.61±0.04) L·kg-1、(0.66±0.01) L·(h·kg)-1和(7.16±0.08) h。P. Lees[63]研究了帕多沙星通过口服给药在猫和狗体内的药动学,研究发现帕多沙星在给药3 h后达到最大血药浓度,药物消除半衰期为5~10 h,血药浓度能够达到药物总浓度的63%~71%。D. Sriranjani等[64]研究了司帕沙星在肉鸡体内的药代动力学,结果显示口服给药时其表观分布容积、总清除率和消除半衰期分别为2.41 L·kg-1、4·55 mL(min·kg)-1和5.94 h。比较单次和重复给药时环丙沙星在猫体内的药动学,单次给药时分布半衰期为(0.22±0.23) h,血浆清除半衰期为(4.53±0.74) h;重复多次口服给药时吸收半衰期为(0.23±0.22) h,血药达峰时间为(1.30±0.67) h[65]。不同的氟喹诺酮类药物在不同动物体内的药动学具有差异性,不同的给药方式对药动学有一定的影响。
EUCAST对部分喹诺酮类药物制定出了PK/PD折点值,但是却没有制定出不同种属动物的PK/PD折点值。因此其只具备一定的参考意义,并不能作为我国兽医临床的科学指导。药效学和药动学分别研究的是药物对动物机体的作用和机体对药物的处置过程,二者相辅相成。一方面是对鸡支原体耐药判定标准的急切需求,一方面是PK/PD折点值制定所需数据的缺少。这就使得对于鸡支原体PK/PD的研究很有必要,并且对于鸡支原体耐药判定标准的制定具有推动作用。
表3 氟喹诺酮类药物在动物体内的部分药动学(PK)指标
Table 3 Some pharmacokinetic (PK) indices of fluoroquinolones in animals
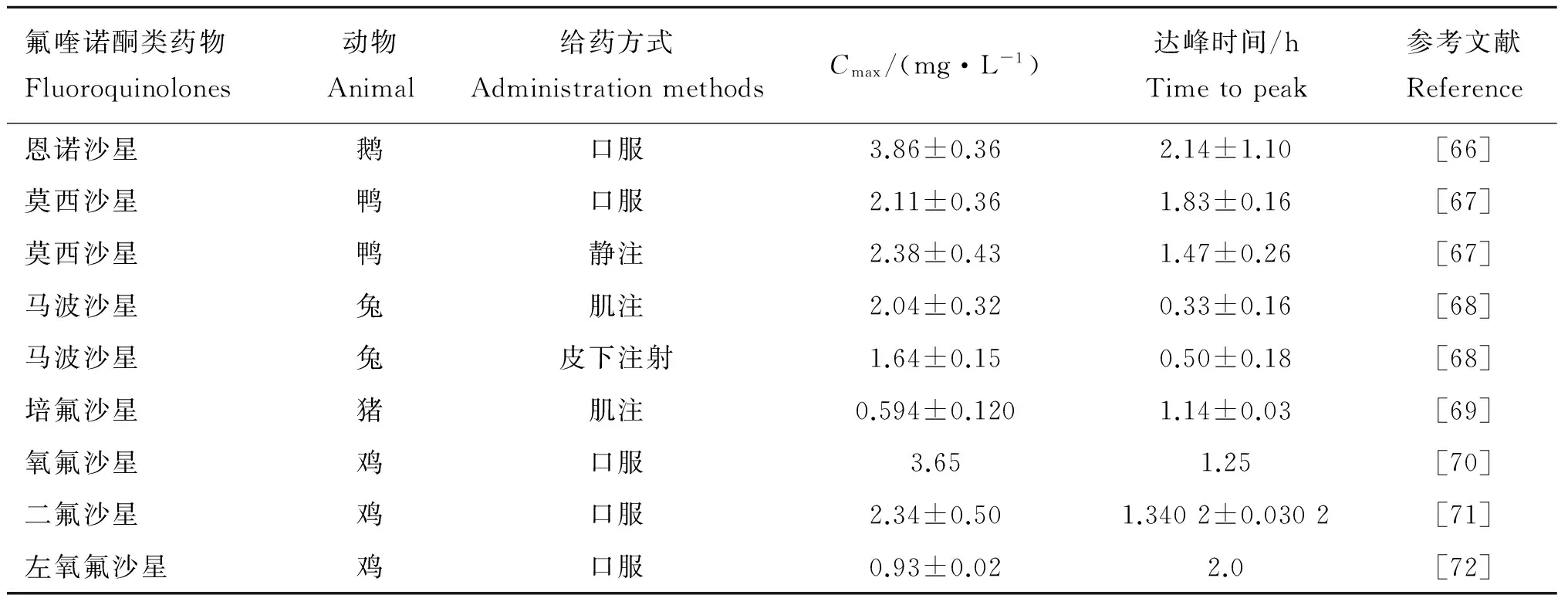
氟喹诺酮类药物Fluoroquinolones动物Animal给药方式AdministrationmethodsCmax/(mg·L-1)达峰时间/hTimetopeak参考文献Reference恩诺沙星鹅口服3.86±0.362.14±1.10[66]莫西沙星鸭口服2.11±0.361.83±0.16[67]莫西沙星鸭静注2.38±0.431.47±0.26[67]马波沙星兔肌注2.04±0.320.33±0.16[68]马波沙星兔皮下注射1.64±0.150.50±0.18[68]培氟沙星猪肌注0.594±0.1201.14±0.03[69]氧氟沙星鸡口服3.651.25[70]二氟沙星鸡口服2.34±0.501.3402±0.0302[71]左氧氟沙星鸡口服0.93±0.022.0[72]
4 氟喹诺酮类药物对鸡支原体临床临界值的研究
临床临界值是依据临床治疗数据以及结合药物对病原菌的MIC值来确定的用于病原菌临床治疗的折点值。其用于判定患病动物给药后的预后效果。这种临界值来源于感染的前瞻性临床研究和实际临床数据。但由于自然感染的病例比较分散且病原菌的分离率很低,虽然有相关的临床试验,但是缺乏对菌株的MIC检测,导致没有全面的临床研究数据来完成临床临界值的设定。文献报道,也可以根据ECOFFs 和COPD来制定临界值,但需要明确临床临界值的制定方法[73]。
用于鸡支原体临床治疗的氟喹诺酮类药物主要有诺氟沙星、环丙沙星、左氧氟沙星、恩诺沙星和达氟沙星等,研究者制定了部分氟喹诺酮类药物对鸡支原体的临床治疗处方(表4)。在大肠杆菌和鸡支原体的混合感染模型中,通过饮水给药5 d,不同抗菌药司帕沙星(25、50和100 mg·L-1)、环丙沙星(50 mg·L-1),恩诺沙星(50 mg·L-1)和泰乐菌素(500 mg·L-1)的治愈率分别为86.7%、96.7%、96.7%、96.7%、96.7%、80%,表明司帕沙星和环丙沙星、恩诺沙星的疗效相当,并显著优于泰乐菌素[74]。据报道鸡毒支原体和大肠杆菌混合感染的鸡群用达氟沙星(25、50、100 mg·L-1)、恩诺沙星(50 mg·L-1)和泰乐菌素(500 mg·L-1)混饮5 d,用药组平均体重都显著高于未治疗组,死亡率也明显降低,表明达氟沙星对鸡毒支原体引起的疾病有较好的治疗效果,可以有效地降低死亡率。用达氟沙星可溶性粉治疗多杀性巴氏杆菌和鸡支原体混合感染,分别通过饮水给予感染鸡100、50、25 mg·L-1(50 mg·L-1恩诺沙星作为对照药物),连续给药4或5 d,治愈率都较高,且病死率大为下降[75]。T. Deguchi等[76]对西他沙星治疗抗环丙沙星突变体人支原体的疗效进行了考察,显示出西他沙星有较好的疗效。H.Ding等[77]研究马波沙星对鸡支原体和大肠杆菌复合感染的鸡的疗效,以5 mg·kg-1口服给药,给药时间间隔为24 h,马波沙星可以成功治愈鸡的支原体感染。
表4 部分氟喹诺酮类药物对鸡支原体的临床治疗处方
Table 4 Some clinical prescription for the treatment ofMycoplasmawith fluoroquinolones

药物Fluoroquinolone给药途径Administrationmethods给药剂量Administrationdosage给药间隔Intervalofadministration参考文献Reference环丙沙星、恩诺沙星拌料或饮水混饮0.05%~0.1%水连续3d,间隔2周再用药1次[78]恩诺沙星混饮或肌注混饮50~75mg·L-1水;肌注2.5~5mg·kg-1每日1~2次[79]环丙沙星混饮或肌注混饮25~50mg·L-1水,肌注5mg·kg-1每日2次[79]达氟沙星混饮或肌注混饮25~50mg·L-1水,肌注1.25~2.5mg·kg-1(以体重计)每日1次[79]恩诺沙星肌注0.4mL每日2次,连用3d[80]氟哌酸混饲0.05%~0.1%连用3~5d,间隔10d再用药1次[81]恩诺沙星混饮50mL·kg-1水用药3d[81]环丙沙星或恩诺沙星混饮50mg·L-1水用药5d,间隔3~4周后重复用药[81]
国内外目前并没有相关的氟喹诺酮类药物对鸡支原体临界值的研究,临床临界值的制定需要考虑病原菌的MIC分布情况,自然发病后使用药物的PK/PD参数,临床疗效,以及临床90%以上应答率作为该临界值的判断依据,需要的参考样本较多,一般通过概率模拟法模拟数据。依据参阅相关文献,拟定临床临界值的制定方法(图1)。氟喹诺酮类药物对于鸡支原体的临床治疗应用得比较早,使用的药物种类也比较多。涉及的药物包括动物专用药以及人医临床上使用的药,同时给药方式也多种多样。从临床治疗的效果以及临床研究的数据来看,氟喹诺酮类药物对于鸡支原体病的控制也较为成功,但是临床上的给药量多少最佳(使动物不至于产生耐药性,又能更好地达到治疗的效果),要做到有章可循,所以应该合理应用该类药物减缓其耐药性,使其更好更有效地为畜牧生产保驾护航。
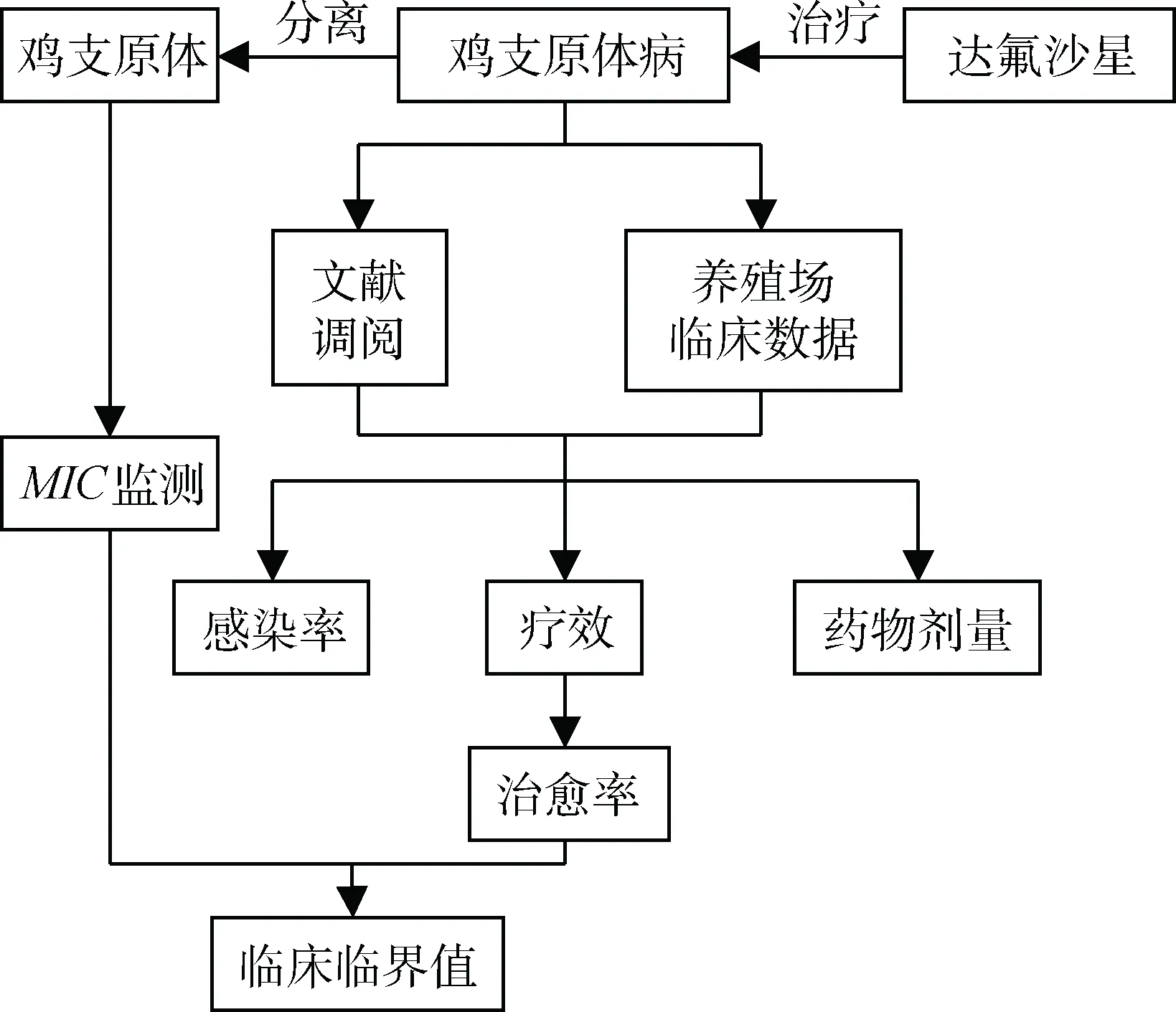
图1 达氟沙星对鸡支原体临床临界值的制定流程Fig.1 The flowing chart of clinical cutoff of danofloxacin on Mycoplasma gallisepticum
5 展 望
目前治疗鸡支原体病的首选药物是抗生素,但用药期间细菌数量减少,病症减轻,一旦停药会出现复发。这是否与鸡支原体自身的特性以及动物机体与病原的相互作用机制有关需进一步研究。氟喹诺酮类药物用于鸡支原体的治疗较为广泛,疗效也较为可观。但是临床上对于氟喹诺酮类药物的使用没有统一的规范,导致鸡支原体对喹诺酮类药物耐药现象的出现。目前对鸡支原体的药动药效学的研究比较少,进一步开展这方面的研究非常必要,以指导临床合理用药。即使经过临床试验阶段的验证,但折点的最终确立还远未完成。我国现阶段没有一套成熟的折点制定程序,主要是参照现行的CLSI标准。这就产生了一个问题,国际上现行的标准是否对我国的耐药判定具有契合的指导意义。我国的耐药判定标准现状是对于国外上市的进口抗菌药物,折点判定主要采用CLSI,对于CLSI无折点的采用EUCAST;对于国外已不用或者未上市的进口抗菌药物,只能是旧折点或者无折点;对于我国的一类新药,没有折点或者借用同类药物的折点[82]。我国并没有制定鸡支原体对氟喹诺酮类药物耐药折点,这就很有必要制定出耐药折点以期为耐药判定提供参考和依据。目前关于氟喹诺酮类药物对鸡支原体的药效学折点和临床折点的研究很少,这也是当前折点制定的一大不足。针对这些存在的问题,我国相关部门应尽快制定出相应的耐药判定标准,为我国医学卫生事业中相关耐药性标准的制定提供指导。现阶段我国畜牧生产效率不高,细菌感染性疾病频发,因此很有必要制定出适用于我国现状的耐药判定标准,合理指导用药,减缓细菌耐药现象,从而提高畜牧生产效率。
[1] WIJESURENDRA D S, KANCI A, TIVENDALE K A, et al. Development of aMycoplasmagallisepticuminfection model in turkeys[J].AvianPathol, 2015, 44(1): 35-42.
[2] LEMCKE R M. The serological differentiation ofMycoplasmastrains(pleuropneumonia-like organisms) from various sources[J].EpidemiolInfect, 1964, 62(2): 199-219.
[3] LEVISOHN S, KLEVEN S H. Avian mycoplasmosis (Mycoplasmagallisepticum)[J].RevSciTech, 2000, 19(2): 425-442.
[4] DHONDT A A, DHONDT K V, NAZERI S. Apparent effect of chronicPlasmodiuminfections on disease severity caused by experimental infections withMycoplasmagallisepticumin house finches[J].IntJParasitolParasitesWildl, 2017, 6(2): 49-53.
[5] XIAO X, SUN J, CHEN Y, et al.Exvivopharmacokinetic and pharmacodynamic analysis of valnemulin againstMycoplasmagallisepticumS6 inMycoplasmagallisepticumandEscherichiacolico-infected chickens[J].VetJ, 2015, 204(1): 54-59.
[6] XIAO X, ZHAO D H, YANG X, et al.MycoplasmagallisepticumandEscherichiacolimixed infection model in broiler chickens for studying valnemulin pharmacokinetics[J].JVetPharmacolTher, 2014, 37(1): 99-102.
[7] CHIU C H, SU L H, CHU C.Salmonellaentericaserotype choleraesuis: epidemiology, pathogenesis, clinical disease, and treatment[J].ClinMicrobiolRev, 2004, 17(2): 311-322.
[8] SHIL P K, KANCI A, BROWNING G F, et al. Development and immunogenicity of recombinant GapA+Mycoplasmagallisepticumvaccine strain ts-11 expressing infectious bronchitis virus-S1 glycoprotein and chicken interleukin-6[J].Vaccine, 2011, 29(17): 3197-3205.
[9] HUTTON S, BETTRIDGE J, CHRISTLEY R, et al. Detection of infectious bronchitis virus 793B, avian metapneumovirus,MycoplasmagallisepticumandMycoplasmasynoviaein poultry in Ethiopia[J].TropAnimHealthProd, 2016, 49(2): 317-322.
[10] FEBERWEE A, MEKKES D R, DE WIT J J, et al. Comparison of culture, PCR, and different serologic tests for detection ofMycoplasmagallisepticumandMycoplasmasynoviaeinfections[J].AvianDis, 2005, 49(2): 260-268.
[11] MUNETA Y, PANICKER I S, KANCI A, et al. Development and immunogenicity of recombinantMycoplasmagallisepticumvaccine strain ts-11 expressing chicken IFN-γ[J].Vaccine, 2008, 26(43): 5449-5454.
[13] LEIGH S A, BRANTON S L, EVANS J D, et al. Impact of fowlpox-vectoredMycoplasmagallisepticumvaccine Vectormune FP MG on layer hen egg production and egg quality parameters[J].PoultSci, 2013, 92(12): 3172-3175.
[14] ZHANG N, YE X M, WU Y Z, et al. Determination of the mutant selection window and evaluation of the killing ofMycoplasmagallisepticumby danofloxacin, doxycycline, tilmicosin, tylvalosin and valnemulin[J].PLoSOne, 2017, 12(1): e0169134.
[15] OSEI SEKYERE J, AMOAKO D G. Genomic and phenotypic characterisation of fluoroquinolone resistance mechanisms in Enterobacteriaceae in Durban, South Africa[J].PLoSOne, 2017, 12(6):e0178888.
[16] LIU X Q, LIU H X, LI Y Q, et al. Association between virulence profile and fluoroquinolone resistance inEscherichiacoliisolated from dogs and cats in China[J].JInfectDevCountr, 2017, 11(4): 306-313.
[17] TATAY-DUALDE J, PRATS-VAN DER HAM M, DE LA FE C, et al. Mutations in the quinolone resistance determining region conferring resistance to fluoroquinolones inMycoplasmaagalactiae[J].VetMicrobiol, 2017, 207: 63-68.
[18] 魏飞龙, 周云雷, 沈祥广, 等. 耐氟喹诺酮类药物鸡毒支原体DNA回旋酶及拓扑异构酶Ⅳ的突变特征[J]. 中国畜牧兽医, 2010, 37(9): 43-47. WEI F L, ZHOU Y L, SHEN X G, et al. Characterization of mutations in DNA gyrase and topoisomerase Ⅳ involved in Quinolone resistance of clinicalMycoplasmagallisepticumisolates[J].ChinaAnimalHusbandry&VeterinaryMedicine, 2010, 37(9): 43-47. (in Chinese)
[19] LI J, LU D H, LIU Z J, et al. Role of mutations in DNA gyrase and topoisomerase IV in fluoroquinolones-resistance ofMycoplasmagallisepticumobtainedinvitroandinvivo[J].JAnimVetAdv, 2012, 11(13): 2327-2332.
[20] JOHNNING A, KRISTIANSSON E, FICK J, et al. Resistance mutations ingyrAandparCare common inEscherichiacommunities of both fluoroquinolone-polluted and uncontaminated aquatic environments[J].FrontMicrobiol, 2015, 6: 1355.
[21] SAMUEL S O, ABODERIN A O, SALAMI T A T, et al. Campylobacter antimicrobial drug resistance among humans in Ilorin, Nigeria[J].NigerMedJ, 2007, 48(3): 75-77.
[22] STASS H, DALHOFF A. The integrated use of pharmacokinetic and pharmacodynamic models for the definition of breakpoints[J].Infection,2005,33(S2):29-35.
[23] 马 越, 李景云, 金少鸿. 美国临床实验室标准委员会推荐药敏试验操作方法和判断标准(2005年修订版)[J]. 中华医学杂志, 2005, 85(17): 1182-1184. MA Y, LI J Y, JIN S H. Clinical Laboratory Standards Committee recommends methods of drug susceptibility testing standards of judgment (2005 Revision)[J].NationalMedicalJournalofChina, 2005, 85(17): 1182-1184. (in Chinese)
[24] BROWN D, MACGOWAN A. Harmonization of antimicrobial susceptibility testing breakpoints in Europe: implications for reporting intermediate susceptibility[J].JAntimicrobChemother, 2010, 65(2): 183-185.
[25] TURNIDGE J, KAHLMETER G, KRONVALL G. Statistical characterisation of bacterial wild-type MIC value distributions and the determination of epidemiological cut-off values[J].ClinMicrobiolInfect, 2006, 12(5): 418-425.
[26] BÖTTNER A, DE JONG A, SCHMID P, et al. Determination of breakpoints for veterinary medically relevant antibiotics for resistance assessment of veterinary pathogens[J].BerlMünchTierarztlWochenschr, 2000, 113(9): 344-347.
[27] 童明庆. 抗菌药的PK/PD理论及其在新抗菌药的药效研究中应用[J]. 中国临床药理学杂志, 2008, 24(5): 475-480. TONG M Q. PK/PD theory of antibiotic and its application in study on Pharmacodynamics of new antibiotic[J].TheChineseJournalofClinicalPharmacology, 2008, 24(5): 475-480. (in Chinese)
[28] BYWATER R, SILLEY P, SIMJEE S. Antimicrobial breakpoints—definitions and conflicting requirements[J].VetMicrobiol, 2006, 118(1-2): 158-159.
[29] 郭伟娜. 鸡毒霉形体不同菌株的药敏实验及耐药机制的研究[D]. 武汉: 华中农业大学, 2007. GUO W N. Study on the susceptibility and resistance mechanism of different strains ofMycoplasmagallisepticumto antibiotic drugs[D]. Wuhan: Huazhong Agricultural University, 2007. (in Chinese)
[30] BARBERIO A, FLAMINIO B, DE VLIEGHER S, et al. Short communication:Invitroantimicrobial susceptibility ofMycoplasmabovisisolates identified in milk from dairy cattle in Belgium, Germany, and Italy[J].JDairySci, 2016, 99(8): 6578-6584.
[31] LANDMAN W J M, MEVIUS D J, VELDMAN K T, et al.Invitroantibiotic susceptibility of DutchMycoplasmasynoviaefield isolates originating from joint lesions and the respiratory tract of commercial poultry[J].AvianPathol, 2008, 37(4): 415-420.
[32] THONGKAMKOON P, NARONGSAK W, KOBAYASHI H, et al.Invitrosusceptibility ofMycoplasmahyopneumoniaefield isolates and occurrence of fluoroquinolone, macrolides and lincomycin resistance[J].JVetMedSci, 2013, 75(8): 1067-1070.
[33] SULYOK K M, KREIZINGER Z, FEKETE L, et al. Antibiotic susceptibility profiles ofMycoplasmabovisstrains isolated from cattle in Hungary, Central Europe[J].BMCVetRes, 2014, 10: 256.
[35] JENSEN J S, FERNANDES P, UNEMO M.Invitroactivity of the new fluoroketolide solithromycin (CEM-101) against macrolide-resistant and -susceptibleMycoplasmagenitaliumstrains[J].AntimicrobAgentsChemother, 2014, 58(6): 3151-3156.
[36] HEUVELINK A, REUGEBRINK C, MARS J. Antimicrobial susceptibility ofMycoplasmabovisisolates from veal calves and dairy cattle in the Netherlands[J].VetMicrobiol, 2016, 189: 1-7.
[37] DUFFY L B, CRABB D M, BING X, et al. Bactericidal activity of levofloxacin againstMycoplasmapneumoniae[J].JAntimicrobChemother, 2003, 52(3): 527-528.
[38] KRAUSSE R, SCHUBERT S.Invitroactivities of tetracyclines, macrolides, fluoroquinolones and clindamycin againstMycoplasmahominisandUreaplasmassp. isolated in Germany over 20 years[J].ClinMicrobiolInfect, 2010, 16(11): 1649-1655.
[39] PATERNA A, SNCHEZ A, GMEZ-A, et al. Short communication:invitroantimicrobial susceptibility ofMycoplasmaagalactiaestrains isolated from dairy goats[J].JDairySci, 2013, 96(11): 7073-7076.
[40] KIDANEMARIAM A, GOUWS J, VAN VUUREN M, et al.Invitroantimicrobial susceptibility ofMycoplasmamycoidesmycoides large colony andArcanobacteriumpyogenesisolated from clinical cases of ulcerative balanitis and vulvitis in Dorper sheep in South Africa[J].JSouthAfrVetAssoc, 2005, 76(4): 204-208.
[41] GERCHMAN I, LYSNYANSKY I, PERK S, et al.Invitrosusceptibilities to fluoroquinolones in current and archivedMycoplasmagallisepticumandMycoplasmasynoviaeisolates from meat-type turkeys[J].VetMicrobiol, 2008, 131(3-4): 266-276.
[42] LYSNYANSKY I, AYLING R D.Mycoplasmabovis: mechanisms of resistance and trends in antimicrobial susceptibility[J].FrontMicrobiol, 2016, 7: 595.
[43] BÉBÉAR C M, RENAUDIN H, SCHAEVERBEKE T, et al.In-vitroactivity of grepafloxacin, a new fluoroquinolone, against mycoplasmas[J].JAntimicrobChemother, 1999, 43(5): 711-714.
[44] WAITES K B, CRABB D M, DUFFY L B. Inhibitory and bactericidal activities of gemifloxacin and other antimicrobials againstMycoplasmapneumoniae[J].IntJAntimicrobAgents, 2003, 21(6): 574-577.
[45] 林居纯, 曾振灵, 吴聪明. 鸡毒支原体的耐药性调查[J]. 中国兽医杂志, 2008, 44(8): 40-41. LIN J C, ZENG Z L, WU C M. Investigation of drug resistance ofMycoplasmagallisepticumisolates[J].ChineseJournalofVeterinaryMedicine, 2008, 44(8): 40-41. (in Chinese)
[46] 戴自英. 临床抗菌药物学[M].北京:人民卫生出版社, 1985. DAI Z Y. Clinical antibacterial pharmacology[M]. Beijing: People′s Medical Publishing House, 1985. (in Chinese)
[47] 向 蓉, 丁焕中, 曾振灵. 鸡源大肠杆菌、支原体对几种抗菌药物的耐药性调查[J]. 养禽与禽病防治, 2006 (11): 21-22, 17. XIANG R, DING H Z, ZENG Z L. Investigation on resistance ofEscherichiacoliandMycoplasmato severalAntibioticsin chicken[J].PoultryHusbandryandDiseaseControl, 2006 (11): 21-22, 17. (in Chinese)
[48] MUSTAFA R, QI J J, BA X L, et al.Invitroquinolones susceptibility analysis of ChineseMycoplasmabovisisolates and their phylogenetic scenarios based upon QRDRs of DNA topoisomerases revealing a unique transition in ParC[J].PakVetJ, 2013, 33(3): 364-369.
[49] KHALIL D, BECKER C A, TARDY F. Alterations in the quinolone resistance determining regions and fluoroquinolone resistance in clinical isolates and laboratory-derived mutants ofMycoplasmabovis: not all genotypes may be equal[J].ApplEnvironMicrobiol, 2015, 82(4): 1060-1068.
[50] MENG D Y, SUN C J, YU J B, et al. Molecular mechanism of fluoroquinolones resistance inMycoplasmahominisclinical isolates[J].BrazJMicrobiol, 2014, 45(1): 239-242.
[51] MURRAY G L, BRADSHAW C S, BISSESSOR M, et al. Increasing macrolide and fluoroquinolone resistance inMycoplasmagenitalium[J].EmergInfectDis, 2017, 23(5): 809-812.
[52] DUMKE R, THÜRMER A, JACOBS E. Emergence ofMycoplasmagenitaliumstrains showing mutations associated with macrolide and fluoroquinolone resistance in the region Dresden, Germany[J].DiagnMicrobiolInfectDis, 2016, 86(2): 221-223.
[53] SATO T, OKUBO T, USUI M, et al. Amino acid substitutions in GyrA and ParC are associated with fluoroquinolone resistance inMycoplasmabovisisolates from Japanese dairy calves[J].JVetMedSci, 2013, 75(8): 1063-1065.
[54] 刘玉庆, 李璐璐,骆延波, 等. EUCAST欧盟药敏试验标准[M]. 北京: 中国质检出版社, 2016. LIU Y Q, LI L L, LUO Y B, et al. EUCAST EU drug susceptibility testing standards[M]. Beijing: China Quality Inspection Press, 2016. (in Chinese)
[55] DIMITROVA D J, LASHEV L D, YANEV S G, et al. Pharmacokinetics of enrofloxacin in turkeys[J].ResVetSci, 2007, 82(3): 392-397.
[56] GBERINDYER F A, WANNANG N, AKWUOBU C A. Comparative pharmacokinetics/pharmacodynamic modeling on three brands of 10% enrofloxacin oral formulations in broiler chickens[J].IntJPoultSci, 2010, 9(3): 273-277.
[57] HARITOVA A M, RUSENOVA N V, PARVANOV P R, et al. Integration of pharmacokinetic and pharmacodynamic indices of marbofloxacin in turkeys[J].AntimicrobAgentsChemother, 2006, 50(11): 3779-3785.
[58] IVANOVA S, DIMITROVA D, PETRICHEV M. Pharmacokinetics of ciprofloxacin in broiler chickens after single intravenous and intraingluvial administration[J].MacVetRev, 2017, 40(1): 67-72.
[59] 张秀英, 佟恒敏, 丛 霞, 等. 单诺沙星在雏鸡体内的药动学特征及生物利用度研究[J]. 黑龙江畜牧兽医, 2001(9): 3-4. ZHANG X Y, TONG H M, CONG X, et al. Studies on the pharmacokintics and bioavailability of Danofloxacin in chickens[J].HeilongjiangJournalofAnimalScienceandVeterinaryMedicine, 2001(9): 3-4. (in Chinese)
[60] 王 睿. 氟喹诺酮类PK/PD的研究进展[J]. 中国新药杂志, 2002, 11(11): 884-887. WANG R. The rearch progress of pharmacokinetics/pharmacodynamics in fluoroquinolones[J].ChineseJournalofNewDrugs, 2002, 11(11): 884-887. (in Chinese)
[61] DIMITROVA D J, HARITOVA A M, DINEV T D, et al. Comparative pharmacokinetics of danofloxacin in common pheasants, guinea fowls and Japanese quails after intravenous and oral administration[J].BrPoultSci, 2014, 55(1): 120-125.
[62] DEVADA S S, PATEL S D, PATEL H B, et al. Pharmacokinetics of gatifloxacin in broiler chickens following intravenous and oral administration[J].BrPoultSci, 2012, 53(2): 257-261.
[63] LEES P. Pharmacokinetics, pharmacodynamics and therapeutics of pradofloxacin in the dog and cat[J].JVetPharmacolTher, 2013, 36(3): 209-221.
[64] SRIRANJANI D, KALAISELVI L, RAMESH S, et al. Pharmacokinetics of sparfloxacin in broiler chicken[J].BrPoultSci, 2006, 47(6): 720-725.
[65] ALBARELLOS G A, KREIL V E, LANDONI M F. Pharmacokinetics of ciprofloxacin after single intravenous and repeat oral administration to cats[J].JVetPharmacolTher, 2004, 27(3): 155-162.
[66] SHI F, TANG H, XIE W, et al. Pharmacokinetic study of enrofloxacin in Tianfu geese[J].JAnimPlantSci, 2014, 24(1): 113-119.
[67] GOUDAH A, HASABELNABY S. Pharmacokinetics, plasma protein binding and bioavailability of moxifloxacin in Muscovy ducks after different routes of administration[J].ResVetSci, 2010, 88(3): 507-511.
[69] DIMITROVA D, KATSAROV V, TSONEVA D. Pharmacokinetics of pefloxacin in pigs after single intramuscular application[J].AgricSciTechnol, 2012, 4(3): 215-219.
[70] KALAISELVI L, SRIRANJANI D, RAMESH S, et al. Pharmacokinetics of ofloxacin in broiler chicken[J].JVetPharmacolTher, 2006, 29(3): 185-189.
[72] VARIA R D, PATEL J H, PATEL U D, et al. Disposition of levofloxacin following oral administration in broiler chickens[J].IsraelJVetMed, 2009, 64(4): 118-121.
[73] EL GARCH F, DE JONG A, SIMJEE S, et al. Monitoring of antimicrobial susceptibility of respiratory tract pathogens isolated from diseased cattle and pigs across Europe, 2009-2012: VetPath results[J].VetMicrobiol, 2016, 194: 11-22.
[74] 刘明春,佟恒敏,何剑斌, 等.司帕沙星对实验性感染鸡大肠杆菌-败血霉形体病的药效学研究[J].沈阳农业大学学报,2004,35(3):231-234. LIU M C, TONG H M, HE J B, et al. Pharmacodynamical studies of sparfloxacin against experimentally inducedE.coli-mycoplasma disease chickens[J].JournalofShenyangAgriculturalUniversity, 2004, 35(3): 231-234. (in Chinese)
[75] 张秀英, 郭文欣, 佟恒敏, 等. 单诺沙星对鸡败血支原体与大肠杆菌合并感染的药效学研究[J]. 中国兽药杂志, 2001, 35(1): 9-12. ZHANG X Y, GUO W X, TONG H M, et al. Pharmacodynamic studies of danofloxacin in chicks infected withMycoplasmagallisepticumandE.coil[J].ChineseJournalofVeterinaryDrug, 2001, 35(1): 9-12. (in Chinese)
[76] DEGUCHI T, KIKUCHI M, YASUDA M, et al. Sitafloxacin: Antimicrobial activity against ciprofloxacin-selected laboratory mutants ofMycoplasmagenitaliumand inhibitory activity against its DNA gyrase and topoisomerase IV[J].JInfectChemother, 2015, 21(1): 74-75.
[77] DING H, WANG L, SHEN X, et al. Plasma and tissue pharmacokinetics of marbofloxacin in experimentally infected chickens withMycoplasmagallisepticumandEscherichiacoli[J].JVetPharmacolTher, 2013, 36(5): 511-515.
[78] 李红萍, 邹 勇, 帅华平. 鸡霉形体病的诊治[J]. 福建畜牧兽医, 2009, 31(1): 35-36. LI H P, ZOU Y, SHUAI H P. Diagnosis and treatment ofMycoplasmagallisepticum[J].FujianJournalofAnimalHusbandryandVeterinaryMedicine, 2009, 31(1): 35-36. (in Chinese)
[79] 吴孔兴, 陈 峰. 鸡霉形体病的诊断与防制[J]. 当代畜禽养殖业, 2003(4): 52-54. WU K X, CHEN F. Diagnosis and control ofMycoplasmagallisepticumdisease[J].ModernAnimalHusbandry, 2003(4): 52-54. (in Chinese)
[80] 张君慧, 牛华锋, 郝春燕. 鸡的传染性滑膜囊炎的诊治[J]. 畜牧兽医杂志, 2010, 29(1): 101, 103. ZHANG J H, NIU H F, HAO C Y. Diagnosis and treatment of infectious synovitis of chickens[J].JournalofAnimalScienceandVeterinaryMedicine, 2010, 29(1): 101, 103. (in Chinese)
[81] 毛战胜. 鸡败血霉形体病因分析及综合防制[J]. 中国家禽, 2009, 31(3): 49, 51. MAO Z S. Cause analysis and integrated control ofMycoplasmagalliseplicuminfection in chicken[J].ChinaPoult, 2009, 31(3): 49, 51. (in Chinese)
[82] 李 耘, 郑 波, 吕 媛, 等. 新抗菌药物临床试验折点制定方案专家共识[J]. 中国临床药理学杂志, 2015, 31(11): 1069-1076. LI Y, ZHENG B, LV Y, et al. Chinese experts’ consensus on protocol of breakpoints setting of new antibacterial agents for clinical trial[J].TheChineseJournalofClinicalPharmacology, 2015, 31(11): 1069-1076. (in Chinese)
