茶树叶片和胚根原生质体的分离及PEG诱导融合
2018-03-13童华荣梁国鲁石艺琦袁连玉
彭 章 童华荣 梁国鲁 石艺琦 袁连玉,*
茶树叶片和胚根原生质体的分离及PEG诱导融合
彭 章1,2童华荣1梁国鲁3石艺琦1袁连玉1,*
1西南大学食品科学学院, 重庆 400715;2食品科学与工程国家级实验教学示范中心(西南大学), 重庆 400715;3西南大学园艺园林学院, 重庆 400715
植物原生质体是细胞培养和体细胞融合等细胞水平研究及植物遗传育种的重要材料。本研究用福鼎大白茶茶树的幼嫩叶片及胚根, 分析了原生质体分离过程中的材料、酶解液组成及酶解时间、纯化方法等影响因子, 建立了最佳原生质体分离体系, 为茶树体细胞杂交等细胞水平的研究提供了高效获取大量高活力原生质体的方法。结果表明, 23°C恒温黑暗或遮光培养的茶树实生苗的5周叶龄以内的幼嫩叶片是茶树原生质体分离的最佳材料, 其次是茶树种子萌发后的幼嫩胚根; 而以茶园健康生长的5周叶龄以内的幼嫩叶片为材料时, 只能获得混有大量细胞碎片的少量具有活力的原生质体。以茶树幼嫩叶片为分离材料的酶解液组成为1.5%纤维素酶+0.1%离析酶+0.5%果胶酶+0.4 mol L–1甘露醇+20 mmol L–1MES; 以茶树幼嫩胚根为分离材料的酶解液组成为1.5%纤维素酶+0.3%离析酶+0.5%果胶酶+0.4 mol L–1甘露醇+20 mmol L–1MES。分离茶树幼嫩叶和幼嫩胚根原生质体时, 宜采用低速(分别为55 r min–1和50 r min–1)恒温(23°C)摇床振荡酶解培养, 时间分别为7 h和8 h; 最适宜采用15×的转速, 离心4 min可纯化获得高产量和活力的原生质体。用40% PEG-6000诱导20 min后可使茶树原生质体融合, 融合率达10%。
茶树; 幼嫩叶; 幼嫩胚根; 原生质体分离; 原生质体融合
茶树[(L.) O. Ktze.]是山茶科山茶属的多年生的木本植物, 是重要经济作物, 生长周期长, 采用传统的有性杂交选育新品种时, 周期长、工作量大、效率低。生物技术的应用可以帮助解决这些难题。其中, 植物原生质体培养及融合技术可为茶树的品种改良及新品种培育开辟一条新的途径。获得大量高活力的原生质体是利用该技术的前提条件。
植物原生质体(protoplast)是指通过机械或酶解等特殊方法脱去细胞壁后, 留下的裸露、具有生活力、被细胞膜所包围的细胞团, 是进行原生质体培养和原生质体融合等细胞水平研究的基础[1]。利用具有活力的原生质体进行体细胞杂交, 可以打破有性杂交和远缘杂交等过程中发生的生殖障碍, 将不同品种甚至不同种属的优良性状集中于一体, 创造出常规育种所无法获得的新种质或新品种; 原生质体也是遗传转化研究的良好受体, 可以有目的地转入特定基因, 改良作物的产量、品质、抗逆性等[1-3]; 原生质体培养再生植株过程中, 往往会产生无性系变异, 同时原生质体培养还可以用来进行突变体的分离和纯化、种质的超低温保存[4]; 也可以通过理化诱变, 选出有利用价值的突变体。所以原生质体是植物遗传育种研究的重要材料。
原生质体的分离纯化研究始于20世纪60年代, Cocking等[5]用酶解法从番茄根尖中分离得到大量有活性、稳定的原生质体。目前, 已有250多种高等植物的原生质体培养获得成功[6-7]。但相对于农作物、微生物等来说, 木本植物原生质体的研究起步比较晚。柑桔是最先分离到原生质体的木本植物, 目前已建立了较为成熟的柑橘的原生质体及杂种体细胞的培养体系, 并获得了完整的植株[8]。1975年, 以色列的Vardi等[9]以Shamonti甜橙的珠心组织为材料诱导形成胚性愈伤组织, 并从中分离出原生质体; 1977年, Mattoo等[10]率先利用酶解法从苹果果肉中分离得到具有活力的原生质体; 1986年Ochatt等[11]成功获得了由野梨叶肉原生质体再生的植株。此后, 其他木本植物中, 如柿、桑树[12]、荔枝[13]、枇杷[14]、中国李[15]、枣树[16]、山杏[17]等的原生质分离、培养及融合等研究工作也取得了重要的进展。而同为木本植物的茶树, 对其原生质体的研究较少, 19世纪80年代日本中村顺行从茶树花瓣中分离出有活力的原生质体[18], 在这之后的三十多年来也很少有相关的报道, 只有部分学者报道可以利用茶树的花瓣来分离获得亚原生质体[19]。2016年专利申请中有研究者提供了利用茶树花瓣分离出具有活力的原生质体的方法[20-21]。但花瓣受季节限制, 且茶树栽培及茶园管理过程中会抑制茶树的生殖生长, 材料的获得比较难。
我们发现用茶树的幼嫩叶片及胚根分离原生质体可避免用茶树花瓣为材料的不足, 所以本研究主要针对影响以茶树幼嫩叶片和胚根为材料分离原生质体的条件, 建立高效原生体分离体系, 为茶树原生质体培养和融合等细胞水平的研究提供高效获取大量有活力原生质体的方法。
1 材料与方法
1.1 试验材料
选用福鼎大白茶种子、恒温避光培养的茶苗和自然生长的福鼎大白茶嫩叶及拟南芥幼苗, 均由西南大学茶与特色资源研究中心和试验农场提供, 纤维素酶(cellulase R-10)、离析酶(macerozyme R-10)、果胶酶(pectolase Y-23)、MES (吗啉乙磺酸)、BSA (牛血清蛋白)、甘露醇(mannitol)、葡萄糖(glucose)、KCl、NaCl、CaCl2、MgCl2、KOH等试剂购于鼎国生物技术有限公司。
1.2 试验材料的培养及取材
将新采收的福鼎大白茶树的果实去掉花色外壳得到种子, 在阴凉的地方晾干1周左右, 待用。在方形塑料盆内铺设10 cm厚的混合土壤(河沙∶泥炭土∶蛭石 = 2∶2∶1混合), 在其表面均匀撒布适量新鲜茶树种子, 再盖以1~2 cm混合土壤, 并浇适量水以保持土壤湿度; 将塑料盆放在人工气候箱中(23°C恒温, 黑暗, 湿度60%), 种植后第1周每天浇1次水, 从第2周开始每3 d浇1次水保持土壤湿润。20~25 d茶树种子破壳生胚根, 34~37 d萌芽, 然后相继长出真叶(长出3~4片真叶后可转至23°C的恒温温室内, 黑暗处理)。
取生长5~10 d的健康嫩白的幼胚根尖部分; 以及23°C恒温培养的茶树幼苗具5周以内叶龄的健康嫩叶和茶园里生长的茶树具有5周以内叶龄的健康嫩叶。
1.3 茶树各组织材料的原生质体分离及纯化
取福鼎大白茶种子萌发产生的乳白色幼胚根的尖端2 cm左右部分用剃须刀片斜切成长椭圆形薄片, 每份0.5 g幼胚根薄片放入盛装有酶解液(1.5%纤维素酶、0.3%离析酶、0.5%果胶酶、0.4 mol L–1甘露醇、20 mmol L–1KCl、20 mmol L–1MES、0.1 mol L–1CaCl2、1.0 g L–1BSA的混合酶液)的6 cm玻璃培养皿中, 盖上培养皿盖, 并将其放在转速为50 r min–1的摇床上, 于23°C恒温环境中酶解5~9 h; 取种子萌发培育的茶苗嫩叶和在茶园里采摘的嫩叶用剃须刀片切成0.5 mm左右宽的细丝, 以每份0.5 g放入盛装有酶解液(1.5%纤维素酶、0.1%离析酶、0.5%果胶酶、0.4 mol L–1甘露醇、20 mmol L–1KCl、20 mmol L–1MES、0.1 mol L–1CaCl2、1.0 g L–1BSA的混合酶液)的玻璃培养皿中并盖上皿盖,在转速为55 r min–1的摇床上, 23°C恒温酶解5~9 h。
用1 mL枪头(均需剪去枪尖使用)收集含原生质体的酶解液(用孔径100 μm滤网过滤除去未完全消化的残渣), 转入2 mL圆底离心管中, 在15×的条件下离心4 min, 吸去上清液; 加入1.5 mL W缓冲液(2 mmol L–1MES、125 mmol L–1CaCl2、5 mmol L–1KCl、154 mmol L–1NaCl、5 mmol L–1葡萄糖), 用枪轻轻吹打清洗细胞, 再在15×条件下离心4 min, 吸去上清液, 不要吸走细胞, 重复清洗1次; 将10 mL裂解液按上述方法处理后得到的浓缩细胞收集在一只离心管中, 加入0.8 mL W缓冲液, 冰上静置15 min以上, 吸去上清液, 加入等体积MMg (4 mmol L–1MES、0.4 mol L–1甘露醇、15 mmol L–1MgCl2)缓冲液后得到纯净的原生质体。
1.4 原生质体产量和活力的测定
吸取少量原生质体悬浮液于血球计数板上, 在显微镜下, 统计原生质体的产量, 重复3次。原生质体数目=最适浓度下对角线4个格子中的细胞总数×1/4×2×稀释倍数×104。
采用台盼蓝染色法测定原生质体活力, 用磷酸缓冲液PBS (8.00 g L–1NaCl, 0.20 g L–1KCl、2.89 g L–1Na2HPO4、0.20 g L–1NaH2PO4, pH 7.4)配制0.4%的台盼蓝工作液, 吸取纯化的原生质体悬浮液0.5 mL于1 mL试管中, 加入染料混匀, 避光置室温5 min, 用PBS清洗台盼蓝2次后在明视野显微镜下观察原生质体活力, 以一个视野中有活力的原生质体占该视野中原生质体总数的百分数来表示, 选取3个有代表性的视野统计。
1.5 原生质体融合
将10 mL含原生质体分离液纯化浓缩至1 mL, 吸取200 μL于培养皿中, 静置15 min, 再添加等体积PEG液(20%、30%、40%、50% PEG-6000), 在20°C室温下作用20 min, 诱导原生质体融合。用高pH高钙溶液(0.1 mol L–1CaCl2、0.1 mol L–1山梨醇、1 mol L–1Tris, pH 9.5)稀释PEG诱导融合后的原生质体, 第1次加0.125 mL, 静置5 min; 第2次加0.25 mL, 第3次加0.5 mL, 第4次加1.25 mL, 每次间隔5 min, 最后轻轻吸去上清液。取融合后的细胞液于显微镜下观察。
2 结果与分析
2.1 茶树原生质体分离材料的选择及处理方式
原生质体产量和活力的高低与分离材料的来源及其生理状态有着密切的关系, 所以本研究选取茶树的幼嫩叶、幼嫩胚根和遮光、恒温等不同处理的茶树幼苗的不同组织, 进行茶树原生质体分离体系的优化试验(图1)。结果切成细条的茶树幼嫩叶片的酶解效果是良好的, 大部分叶片可被降解, 可以获得大量游离的原生质体。
如图2所示, 以模式植物拟南芥的幼嫩叶片为对照, 3种不同材料中, 暗处理的幼嫩叶片分离出来的原生质体的产量和活力都是最高的, 可产生大量游离的、圆球形的、具有活力的原生质体, 可以达到相同条件下模式植物拟南芥的叶片产生的原生质体的产量和活力; 以茶树种子萌发产生的幼嫩胚根为材料, 也可以分离出高活力的原生质体, 但是产量低于前者; 而以在茶园正常生长的一芽三叶为材料时, 分离的原生质体的状况不佳, 产量低, 且会产生大量的碎片。

图1 茶树不同材料的选择及处理
A: 种子萌发产生的幼嫩胚根; B: 正常茶园生长的茶树的一芽三叶; C: 黑暗处理的茶树幼嫩实生苗; D: 切割后的叶片; E: 酶解液消化后的叶片。
A: young radicle produced by seed germination; B: one bud and three leaves from the tea plant grown in normal environments; C: dark treated young tea seedlings; D: slices of leaves; E: enzymatic digested leaves.

图2 不同材料分离获得的茶树原生质体
CK: 分离自拟南芥的叶片; A: 分离自黑暗处理的茶树幼嫩实生苗的幼嫩叶; B: 分离自种子萌发产生的幼嫩胚根; C: 分离自正常茶园生长的茶树的一芽三叶。
CK: protoplasts isolated from leaves of; A: protoplasts isolated from dark treated young seedlings leaves of tea plant; B: protoplasts isolated from the young radicle produced by seed germination; C: protoplasts isolated from one bud with three leaves of the tea plant grown in normal environments.
2.2 酶的种类和浓度对原生质体产量和活力的影响
裂解酶的种类、酶组合及其浓度对不同材料分离出的原生质体的产量和活力都有较大影响。如图3和表1所示, 与拟南芥叶片为对照, 以黑暗处理的茶树幼苗的幼嫩叶为材料分离原生质体的最适酶组合及用量为1.5%纤维素酶(cellulase R-10)、0.1%离析酶(macerozyme R-10)、0.5%果胶酶(pectolase Y-23); 茶树幼嫩叶片在该酶解液组合中裂解7 h后, 分离获得的原生质体产量和活力最高, 产量可达8.8×106个 g–1。如图3-C所示, 用台盼蓝染色的方法检测获得的原生质体的活力, 只有细胞碎片才被染成蓝色, 完整原生质体基本未着色, 数据统计分析结果显示, 分离获得的茶树原生质体活力可高达88%。
如表2所示, 以茶树胚根为材料分离的原生质体的最适酶组合及用量为1.5%纤维素酶(cellulase R-10)、0.3%离析酶(Macerozyme R-10)和0.5%果胶酶(Pectolase Y-23), 在该条件下酶解8 h, 胚根分离原生质体的产量和活力最高, 产量可达3.2×106个g–1; 用台盼蓝染色的方法检测到分离获得的原生质体活力可达89%。

图3 茶树嫩叶原生质体产量计数及活力检测
CK: 以拟南芥幼嫩叶片为材料分离获得的原生质体的产量(0.25 mm×0.25 mm方格); A: 以茶树幼嫩叶片为材料分离获得的原生质体的产量(视野1, 0.25 mm×0.25 mm方格); B: 以茶树幼嫩叶片为材料分离获得的原生质体的产量(视野2, 0.25 mm×0.25 mm方格); C: 用台盼蓝染色的方法检测分离获得的茶树原生质体活力。
CK: number of protoplasts isolated from the leaves of(0.25 mm × 0.25 mm squares); A: number of protoplasts isolated from the leaves of tea plants (0.25 mm × 0.25 mm squares); B: number of protoplasts isolated from the leaves of tea plants (0.25 mm × 0.25 mm squares); C: vitality of tea plant protoplasts detected by trypan blue staining.
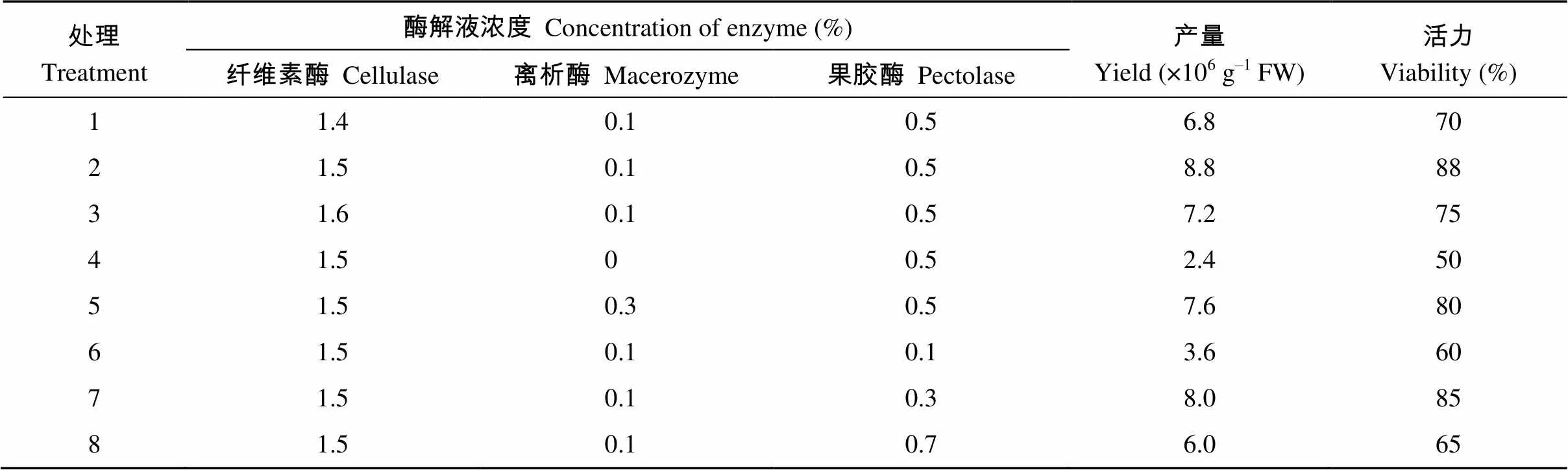
表1 不同酶解液组合对分离茶树嫩叶原生质体的影响
表中数据为恒温(23±1)°C条件下酶解7 h后的计数结果。
The results were counted after 7 h of enzymatic hydrolysis under constant temperature (23±1)°C.
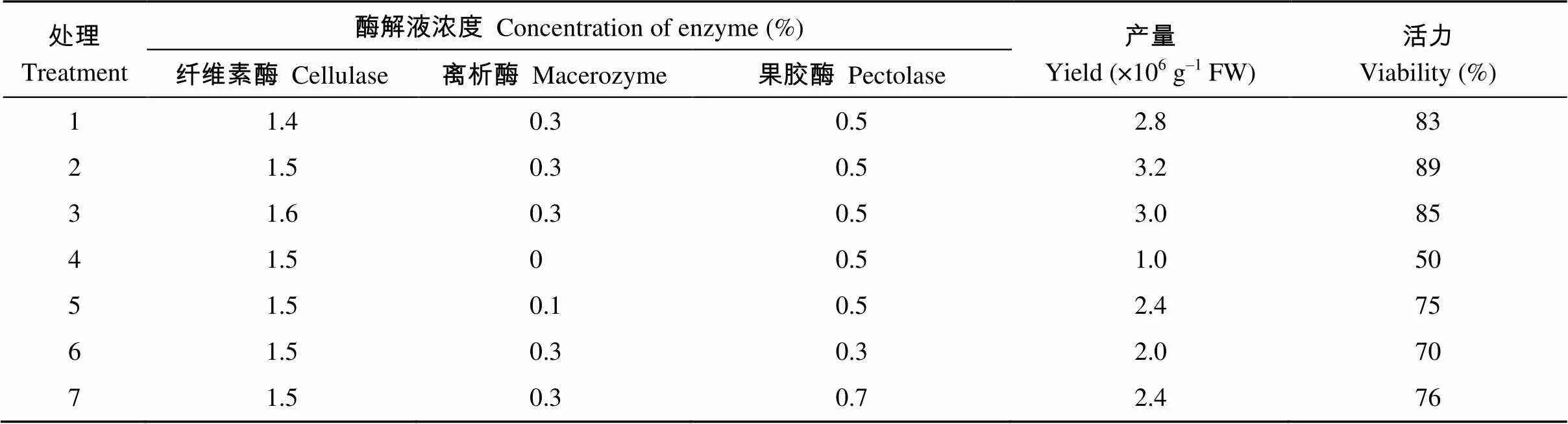
表2 不同酶解液组合对分离茶树胚根原生质体的影响
表中数据为(23±1)°C恒温条件下酶解8 h后得到的结果。
The results were obtained after 8 h of enzymatic hydrolysis under constant temperature (23±1)°C.
2.3 酶解时间对原生质体产量和活力的影响
由表3可见, 6 h之内的酶解不充分, 游离的原生质体很少; 以茶树幼嫩叶和胚根为分离材料时, 酶解7~8 h的原生质体产量和活力都达到最高; 继续延长酶解时间到9 h, 原生质体开始破裂, 在显微镜视野中发现细胞碎片明显增多, 原生质体的产量和活力大幅下降。本研究确定, 以幼嫩叶片为材料时, 酶解的最佳时间为7 h; 以胚根为材料时, 最佳的酶解时间为8 h。

表3 不同酶解时间对茶树叶片原生质体的产量和活力的影响
表中数据为(23±1)°C恒温条件下酶解不同时间段后得到的结果。
>The results were obtained in different hours of enzymolysis under constant temperature (23±1)°C.
2.4 渗透压对原生质体分离的影响
不同甘露醇浓度调节的渗透压对分离原生质体的产量和活力也有很大影响, 如表4所示, 在较低的渗透压条件下, 茶树原生质体的产量和活力均较低, 随渗透压逐渐升高, 原生质体产量和活力逐渐提高。酶解液渗透压为0.3 mol L–1浓度的甘露醇时, 分离获得的茶树原生质的状态较好, 细胞呈浑圆状态, 约有70%以上的完整的原生质体, 但产生的碎片及细胞器较多; 酶解液渗透压为0.4 mol L–1浓度的甘露醇时, 分离获得的茶树原生质的状态最好, 细胞呈浑圆状态, 约有85%以上完整的原生质体,且细胞碎片及细胞器较少; 但随渗透压进一步升高, 原生质的产量和活力会下降, 酶解液渗透压为0.5 mol L–1浓度的甘露醇时,分离获得的茶树原生质体的体积开始缩小, 有皱褶。综上所述, 茶树原生质体分离的酶解液的最佳渗透压浓度为0.4 mol L–1的甘露醇。
2.5 茶树原生质体的融合
本研究对分离纯化后的茶树原生质体的融合条件进行了优化, 采用PEG-6000 (聚乙二醇)化学诱导的方法。如图4所示, 在含高pH 9.5高钙(0.2 mol L–1CaCl2)的40% PEG-6000溶液的条件下, 利用茶树幼嫩叶片和胚根为材料分离获得的原生质体可发生接触及融合, 并且融合的比例可以达到10%。
3 讨论
作为世界茶树的起源中心之一, 我国拥有丰富的茶树种质资源, 尤其是西南地区。但到目前为止, 茶树新品种的选育以扦插等无性繁殖及传统选择育种和引种的方式居多, 主要原因是有性杂交选育茶树新品种的周期长, 耗费大量人力物力。而植物体细胞杂交是一种能有效的缩短育种周期的生物技术。体细胞杂交育种, 也称为原生质体融合育种, 是指双亲(种间、属间、甚至科间)的原生质体在特定的物理或化学因素作用下诱导融合成核质杂种或胞质杂种, 通过细胞分裂形成愈伤组织, 并分化和再生出植株[22]。体细胞杂交技术已经被应用于多种植物的育种过程。其中, 木本植物中应用该技术较为成熟的是柑橘, 邓秀新等已经成功利用该技术获得多个柑橘新品种, 解决了多个柑橘远缘杂交不亲和、雌或雄性器官败育以及珠心胚干扰等育种难题[23-25]。本文从茶树幼嫩叶片和幼嫩胚根中分离获得了大量高活力的原生质体, 且对分离获得的原生质体进行了细胞融合, 获得了较为理想的融合细胞, 可为后续的茶树体细胞杂交育种工作奠定基础。
起始材料是影响植物原生质体分离和培养的重要因素。Revilla等[26]认为, 慎重地选择原生质体分离所用的材料比分离本身更为重要。材料的化学成分、生理状态等均会影响原生质体分离的产量及质量, 利用种子直接萌发的实生幼苗来作为原生质体的分离材料具有非常多的优点, 因为幼苗的子叶、胚根、茎、嫩叶等均为分离原生质体最理想的幼嫩组织和器官, 拟南芥和扁豆的子叶均为分离优质原生质体的最佳材料[27-28]。本研究发现以种子直接萌发后生长4~5周的茶树实生幼苗是分离茶树原生质体的最优起始材料,即可以用实生苗的幼嫩叶片, 也可以利用实生苗的幼嫩胚根; 茶树的叶片中富含的茶多酚等酚类物质在原生质体的分离过程中会被氧化为褐色, 严重影响茶树原生质体的分离质量和数量, 所以前人的研究材料多选择酚类含量较少的花瓣, 但花瓣的取材受到限制, 且保存期特别短。本研究采用恒温黑暗或者遮光处理条件下的培养以降低茶树幼嫩叶片中的多酚类物质, 进而明显提高茶树幼嫩叶片原生质体的产量和质量。试验结果证明, 恒温遮光或黑暗处理1周的茶树实生苗的5周叶龄内的健康幼嫩叶片是分离茶树原生质体的最佳材料, 其次是茶树种子萌发后产生的胚根。

表4 酶解液渗透压对分离茶树原生质体的影响
表中数据为(23±1)°C恒温条件下酶解7 h后观察的结果。
The results were obtained after 7 h of enzymatic hydrolysis under constant temperature (23±1)°C.
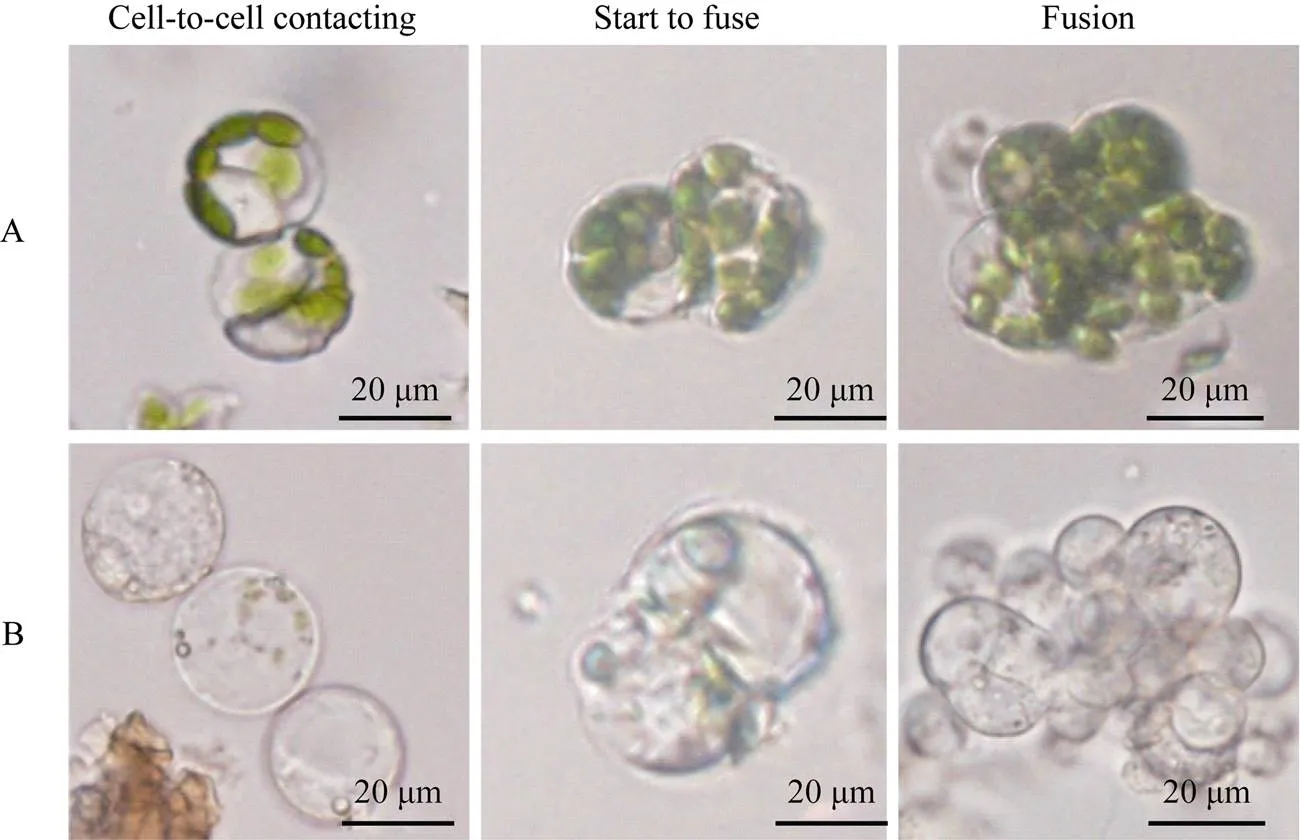
图4 茶树原生质体的融合
A: 茶树幼嫩叶片原生质体的融合过程; B: 茶树幼嫩胚根原生质体的融合过程。
A: The fusion process of protoplasts from young leaves from tea plants; B: The fusion process of protoplasts from young radicle of tea seedlings.
酶解法是目前植物原生质体分离技术中应用最为广泛且有效的方法。用含1%的纤维素酶和1%的离析酶的混合酶液可以从拟南芥幼苗中分离获得大量高活力的原生质体[29]; 含2%的纤维素酶和1%的离析酶的混合酶液可用于橡树叶片的原生质体的分离[30]; 2%的纤维素酶和0.5%的果胶酶混合可以分离杨树叶片的原生质体[31]。本研究表明, 茶树幼嫩胚根分离的最适酶组合用量是1.5%纤维素酶、0.3%离析酶和0.5%果胶酶, 幼嫩叶分离的最适酶组合及用量为1.5%纤维素酶、0.1%离析酶和0.5%果胶酶。酶解液中酶的种类组合、酶浓度、酶解时间和渗透压等均是影响植物原生质体分离过程中原生质体的产量和质量的关键因素[32-33]。在适当的渗透压下, 植物原生质体可保持完整的形态和活力, 杨树和橡树原生质体分离过程中的甘露醇浓度均为0.4 mol L–1 [30-31], 本研究发现茶树原生质体分离的最佳甘露醇浓度也为0.4 mol L–1, 此时分离获得的原生质体呈浑圆状态, 约有85%以上是完整的; 随着酶解时间的增加, 原生质体的产量和活性反而会降低, 杨树的原生质体分离过程中的酶解时间为3~6 h[31],本研究发现茶树原生质体分离的最佳酶解时间为7~8 h。
有性杂交在作物品种改良和性状遗传规律研究中发挥重要作用, 茶树的品种选育过程中较为常用的是扦插等无性繁殖方式, 有性繁殖获得的新品种并不多, 而且茶树的许多优良品种间存在生殖隔离, 很难进行有性杂交, 比如说三倍体茶树品种等; 亲缘关系较远的茶树群体间也很难进行有性杂交, 而利用原生质体融合技术可克服这些障碍并获得新的种质资源。原生质体间可以自发融合,但频率很低, 聚乙二醇(polyethyleneglycol, PEG)诱导法是目前植物中诱导原生质体融合时应用最广泛的方法, 其诱导融合频率高, 无种属特异性要求, 不需要特殊的仪器, 操作简单。不同物种的细胞进行PEG诱导融合时所需要的PEG的分子量和浓度均不同, 研究表明, 拟南芥叶肉细胞PEG-4000介导的最适浓度为20%; 转化水稻栽培品种的愈伤组织原生质体, 其最适浓度为40%的PEG- 6000[34-35]。本研究发现40%的PEG-6000可诱导茶树幼嫩叶和胚根的原生质体的融合。
目前, 茶树外植体的组织培养技术已经慢慢成熟, 分离得到原生质体并完成不同品种茶树间的原生质体融合, 可进行融合后杂种细胞的无菌培养, 最终获得完整的杂种茶树植株, 该技术可为茶树的遗传育种工作提供新的途径, 培育更多优良的茶树品种资源, 缩短茶树的育种周期。利用本研究优化的茶树原生质体分离及融合体系, 还可大规模开展茶树基因的亚细胞定位、次生代谢物的细胞反应器等其他细胞水平上的研究, 为茶树基因功能验证、遗传转化和次生代谢途径调控等其他方面的科学研究提供基础及参考。茶树细胞培养体系的建立及优化也是亟待探索和优化的方向, 极具应用价值。
[1] Nanjareddy K, Arthikala M K, Blanco L, Elizabeth S A, Miguel L. Protoplast isolation, transient transformation of leaf mesophyll protoplasts and improved-mediated leaf disc infiltration of: tools for rapid gene expression analysis., 2016, 16: 53
[2] Rehman L, Su X F, Guo H M, Qi X L, Cheng H M. Protoplast transformation as a potential platform for exploring gene function in., 2016, 16: 57
[3] Burris K P, Dlugosz E M, Collins A G, Stewart C N, Lenaghan S C. Development of a rapid, low-cost protoplast transfection system for switchgrass (L.)., 2016, 35: 693–704
[4] Larkin P J, Scowcroft W R. Somaclonal variation: a novel source of variability from cell-cultures for plant improvement., 1981, 60: 197–214
[5] Cocking E C. Method for the isolation of plant protoplasts and vacuoles., 1960, 187: 962–963
[6] 彭邵锋, 陆佳, 陈永忠, 王瑞, 陈隆升, 马力, 王湘南. 木本植物原生质体培养体系研究进展. 中国农学通报, 2013, 29(1): 1–6 Peng S F, Lu J, Chen Y Z, Wang R, Chen L S, Ma L, Wang X N. Research progress of protoplast culture in woody plants., 2013, 29(1): 1–6 (in Chinese with English abstract)
[7] 王善平, 许智宏. 木本植物的原生质体培养. 细胞生物学杂志, 1989, (1): 14–18 Wang S P, Xu Z H. Protoplast culture of woody plants., 1989, (1): 14–18 (in Chinese)
[8] Liu J H, Xu X Y, Deng X X. Protoplast isolation, culture and application to genetic improvement of woody plants., 2003, 1: 112–120
[9] Vardi A, Spiegelroy P, Galun E. Citrus cell culture: isolation of protoplasts, plating densities, effect of mutagens and regeneration of embryos., 1975, 4: 231–236
[10] Mattoo A, Lieberman M. Localization of the ethylene-synthesizing system in apple tissue., 1977, 60: 794–799
[11] Ochatt S J, Caso O H. Shoot regeneration from leaf mesophyll protoplasts of wild pear (var. Pyraster L.)., 1986, 122: 243–249
[12] 羿德磊. 桑树原生质体分离及融合的研究. 山东农业大学硕士学位论文, 山东泰安, 2012 Yi D L. Study on Protoplast Isolation and Fusion of Mulberry.MS Thesis of Shandong Agricultural University, Tai’an, China, 2012 (in Chinese with English abstract)
[13] 俞长河, 陈振光, 吕柳新. 荔枝原生质体培养再生植株. 福建农业大学学报, 1996, 25(3): 386 Yu C H, Chen Z G, Lyu L X. Regeneration of plantlets from protoplasts culture of Litchi., 1996, 25(3): 386 (in Chinese with English abstract)
[14] 林顺权, 陈振光. 枇杷原生质体培养再生植株. 福建农业大学学报, 1994, 23(1): 125 Lin S Q, Chen Z G. Plant regeneration from protoplast of Loquat., 1994, 23(1): 125 (in Chinese with English abstract)
[15] 马锋旺, 李嘉瑞. 中国李原生质体培养及植株再生. 西北农业大学学报, 1999, 27(3): 64–68 Ma F W, Li J R. Protoplast culture and plant regeneration of Chinese plum., 1999, 27(3): 64–68 (in Chinese with English abstract)
[16] 何业华, 胡芳名, 谢碧霞, 何钢, 胡中沂. 枣树原生质体培养及其植株再生. 中南林学院学报, 1999, (3): 29–31 He Y H, Hu F M, Xie B X, He G, Hu Z Y. Protoplast culture of Zizyphus jujube and plant individual regeneration.1999, (3): 29–31 (in Chinese with English abstract)
[17] 马锋旺, 李嘉瑞. 山杏原生质体培养再生植株. 园艺学报, 1998, 25: 224–229 Ma F W, Li J R. Plant regeneration from cultured protoplasts ofvar., 1998, 25: 224–229 (in Chinese with English abstract)
[18] 中村顺行, 叶乃兴. 茶树原生质体的分离. 茶叶科学简报, 1985, (1): 46–47 Nakamura A, Ye N X. Isolation of protoplasts from tea plants.1985, (1): 46–47 (in Chinese)
[19] 赖钟雄, 何碧珠, 陈振光. 茶树花粉管亚原生质体的分离. 福建农业大学学报, 1998, 27(增刊): 41–44 Lai Z X, He B Z, Chen Z G. Isolation of protoplasts from pollen tubes of tea plant., 1998, 27 (suppl): 41–44 (in Chinese)
[20] 王璐, 钱文俊, 王新超, 李娜娜, 杨亚军. 一种茶树原生质体的提取方法. CN105695391A, 2016-06-22 Wang L, Qian W J, Wang X C, Li N N, Yang Y J. A method for extracting protoplast from Tea plant. CN105695391A, 2016-06-22 (in Chinese)
[21] 杨子银, 梅鑫, 周瀛, 傅秀敏. 一种茶树花原生质体及其制备方法和应用. CN105670985A, 2016-06-15 Yang Z Y, Mei X, Zhou Y, Fu X M. The preparation method and application of flower tea protoplast. CN105670985A, 2016-06-15 (in Chinese)
[22] Davey M R, Anthony P, Power J B, Kenneth C L. Plant protoplasts: status and biotechnological perspectives., 2005, 23: 131–171
[23] Liu J H, Xu X Y, Deng X X. Intergeneric somatic hybridization and its application to crop genetic improvement., 2005, 82: 19–44
[24] Guo W W, Zhou C H, Yi H L, Deng X X. Intergeneric somatic hybrid plants betweenandand evaluation of their root rot resistance., 2000, 42: 668–672
[25] Liu J H, Hu C G, Deng X X. Regeneration of diploid intergeneric somatic hybrid plants between Microcitrus and Citrus via electrofusion.1999, 41: 1177–1182
[26] Revilla M A, Ochatt S J, Doughty S, Power J B. A general strategy for the isolation of Mesophyll protoplasts from deciduous fruit and nut tree species., 1987, 50: 133–137
[27] Dovzhenko A, Dal Bosco C, Meurer J, Koop H U. Efficient regeneration from cotyledon protoplasts in., 2003, 222: 107–111
[28] Sinha A, Wetten A C, Caligari P D S. Optimisation of protoplast production in White Lupin., 2003, 47: 21–25
[29] Yoo S D, Cho Y H, Sheen J.mesophyll protoplasts: a versatile cell system for transient gene expression analysis., 2007, 2: 1565–1572
[30] Kuzminsky E, Meschini R, Terzoli S, Pavani L, Silvestri C, Choury Z, Scarascia-Mugnozza G. Isolation of mesophyll protoplasts from Mediterranean woody plants for the study of DNA integrity under abiotic stress., 2016, 7: 1–7
[31] Tan B Y, Xu M, Chen Y, Huang M R. Transient expression for functional gene analysis usingprotoplasts., 2013, 114: 11–18
[32] Guo J, Morrell-Falvey J L, Labbe J L, Muchero W, Kalluri U C, Tuskan G A, Chen J G. Highly efficient isolation ofMesophyll protoplasts and its application in transient expression assays., 2012, 7: e44908
[33] 李妮娜, 丁林云, 张志远, 郭旺珍. 棉花叶肉原生质体分离及目标基因瞬时表达体系的建立. 作物学报, 2014, 40: 231−239 Li N N, Ding L Y, Zhang Z Y, Guo W Z. Isolation of mesophyll protoplast and establishment of gene transient expression system in Cotton., 2014, 40: 231−239 (in Chinese with English abstract)
[34] 梁大伟. 拟南芥叶肉原生质体分离及瞬时表达体系的建立. 兰州大学硕士学位论文, 甘肃兰州, 2009 Liang D W. Isolation of Mesphyll Protoplast from Arabidopsis thaliana and the Setup of Transient Expression Assay System. MS Thesis of Lanzhou University, Lanzhou, China, 2009 (in Chinese with English abstract)
[35] 李文彬, 王革娇, Stanchina E, Castiglione S, 孙勇如, Sala F. PEG介导原生质体转化获得水稻转基因植株. 植物学报, 1995, 37: 409–412 Li W B, Wang G J, Stanchina E, Castiglione S, Sun Y R, Sala F. Transgenic rice plants produced by PEG-mediated plasmid uptake into protoplasts., 1995, 37: 409–412 (in Chinese with English abstract)
Protoplast Isolation and Fusion Induced by PEG with Leaves and Roots of Tea Plant (L. O. Kuntze)
PENG Zhang1,2, TONG Hua-Rong1, LIANG Guo-Lu3, SHI Yi-Qi1, and YUAN Lian-Yu1,*
1College of Food Science, Southwest University, Chongqing 400715, China;2National Demonstration Center for Experimental Food Science and Technology Education (Southwest University), Chongqing 400715, China;3College of Food Science, Southwest University, Chongqing 400715, China
Plant protoplasts are important materials for studies on plant cell culture, somatic cell fusion, genetics and breeding. This work established a stable and efficient method for getting a large amount of vital and intact protoplasts from young leaves and young roots oftea plant. For protoplast isolation, the young leaves of tea seedlings grown in the condition of constant temperature (23°C) and dark or shading were the best materials, and the young radicle of tea plant was also the better, While the healthy young leaves of tea plants grown in tea plantation were used as materials, only a small quantity of viable protoplasts mixed with a large number of cell fragments were obtained. The optimal enzyme solution for protoplasts isolation from young leaves of tea seedlings contained 1.5% cellulase + 0.1% macerozyme + 0.5% pectolyase + 0.4 mol L–1mannitol + 20 mmol L–1MES, and that from radicle of tea seedlings contained 1.5% cellulase + 0.3% macerozyme + 0.5% pectolyase + 0.4 mol L–1mannitol + 20 mmol L–1MES. Protoplasts with high yield and viability were purified when incubated in a shaker with low speed (55 r min–1and 50 r min–1respectively) under constant temperature (23°C) for 7 h and 8 h, and then centrifuged at 15×for 4 min. PEG-6000 was used to induce the fusion of protoplasts from young leaves and radicle of tea plants. The fusion time, the concentration of fusion agent PEG-6000 were discussed. The optimal protoplast infusion conditions were induction with 40% PEG-6000 for 20 min, and the fusion rate was about 10%.
; young leaf; young root; protoplast isolation; protoplast fusion
2017-07-28;
2017-11-21;
2017-12-18.
10.3724/SP.J.1006.2018.00463
本研究由国家自然科学基金青年项目(31400583), 国家级大学生创新创业训练计划项目(201610635041)和重庆市基础与前沿研究计划一般项目(cstc2014jcyjA80011)资助。
This study was supported by the National Natural Science Foundation of China (31400583), National Training Program of Innovation and Entrepreneurship for Undergraduates (201610635041), and the Basic and Frontier Research Program of Chongqing (cstc2014jcyjA80011).
Corresponding author袁连玉, E-mail: yuanlianyu88@163.com
E-mail: 969979310@qq.com
http://kns.cnki.net/kcms/detail/11.1809.S.20171218.0919.004.html
