新疆棉花根际细菌TaqMan探针实时荧光定量PCR的建立及时空动态分析
2018-03-13李雪艳杨红梅霍向东欧提库尔李玉国史应武
张 涛,李雪艳,杨红梅,楚 敏,高 雁,曾 军,霍向东,张 涛,林 青,欧提库尔,李玉国,娄 恺,史应武
(1.新疆大学生命科学与技术学院,乌鲁木齐 830052;2.新疆农业科学院微生物应用研究所,乌鲁木齐 830091)
0 引 言
【研究意义】棉花黄萎病是一种土传病害,是新疆棉花生产上最主要的病害之一,严重阻碍着新疆棉花产业的发展[1]。棉花黄萎病菌在土壤中生长繁殖,产生大量微菌核,改变棉花根际微生态环境。因此,分析棉花根际微生物动态对于研究棉花根际微生物与黄萎病的发生具有重要意义。【前人研究动态】顾美英等[2-3]研究发现,新疆棉花黄萎病发病株根际土壤微生物总量均大于健康株根际微生物总量。李洪连等[4-6]研究表明,棉花对黄萎病的抗性除了与根际微生物数量有密切关系外,与根际微生物种类、种数和优势种也有关。张燕[7]研究表明,病株棉花的根际土壤中细菌群落结构是动态的并随着棉花的生长而发生规律性的变化。前人研究已经证实,棉花黄萎病的发生与根际微生物有密切关系。【本研究切入点】棉花根际微生物通过改变棉花根际微生态影响棉花黄萎病的发生,而细菌在根际微生物群落中数量和种类最多[8]。因此,定量检测棉花根际细菌是研究棉花根际微生物与宿主黄萎病发生相关性的基础。目前,棉花根际微生物定量检测方法主要有选择性培养基法、活体检测法、免疫检测法和分子生物学法。近年来,实时荧光定量PCR技术以其快速、灵敏、准确、特异性强和重复性好等优点,已成为棉花根际微生物检测的重要工具[9-13]。然而应用Taqman探针实时荧光定量PCR技术定量棉花根际微生物数量的报道比较少见。【拟解决的关键问题】研究应用TaqMan探针实时荧光定量PCR技术对新疆棉花病株不同生育期根际细菌数量进行检测以及时空动态分析,为研究棉花根际细菌对黄萎病的调控效应提供理论依据。
1 材料与方法
1.1 材 料
1.1.1 供试土样
选择新疆北疆地区的石河子、乌苏和精河,南疆地区的库尔勒、图木舒克和阿拉尔,东疆地区的哈密等7个植棉区为采样点。分别于棉花的苗期、蕾期、花铃期和吐絮期等4个时期采集病株根际10~15 cm的土壤。土样在室内经自然晾干后,用直径2 mm的筛网过筛,混匀,装入密封袋中,4℃保存备用。
1.1.2 主要试剂和仪器
Ezup柱式土壤基因组DNA抽提试剂盒、SanPrep柱式DNA胶回收试剂盒、SanPrep柱式质粒DNA小量抽提试剂盒、Eppendorf Centeifuge 5417R型离心机、DW-40L188型医用低温保存箱、T Personal型PCR仪、DYCP-31E型电泳仪、WD-9413B型凝胶成像分析仪、Epoch型超微量微孔板分光光度计、Roche LightCycler®480Ⅱ型实时荧光定量PCR仪。
1.2 方 法
1.2.1 土壤根际微生物基因组总DNA的提取
利用Ezup柱式土壤基因组DNA抽提试剂盒的操作方法提取棉花根际土壤基因组总DNA。提取出的DNA样品保存于-20 ℃冰箱中备用。
1.2.2 样品PCR扩增
以土壤基因组总DNA为模板,选择根际细菌16S rDNA基因特异引物27F:5'-AGAGTTTGATCCTGGCTCAG-3'和 1492R:5'-GGTTACCTTGTTACGACTT-3'对不同取样时期的根际土壤基因组DNA进行PCR扩增。PCR反应液组成为:PremixTaq12.5 μL,DNA模板1 μL,27F(10 μM) 0.5 μL,1492R(10 μM) 0.5 μL,ddH2O 10.5 μL:PCR反应条件为:95℃预变性5 min,95℃变性45 s,50℃退火45 s,72℃延伸1 min,共30个循环,最后72℃延伸7 min。PCR产物经0.7%的琼脂糖凝胶电泳检测。
1.2.3 重组质粒的制备与鉴定
将上述PCR扩增产物混合后经SanPrep柱式DNA胶回收试剂盒纯化后,克隆至pGEM-T easy载体,转化至大肠杆菌DH5α感受态细胞中,在氨苄青霉素平板上通过蓝白斑试验筛选阳性转化菌。取部分阳性菌液送生工生物工程(上海)股份有限公司进行测序,测序结果在GenBank上进行Blast同源性比对分析。序列正确的阳性克隆子利用SanPrep柱式质粒DNA小量抽提试剂盒提取质粒DNA,用超微量分光光度计测定质粒OD值并计算质粒的浓度。
1.2.4 RT- qPCR反应体系的建立及优化
将制备好的质粒标准品10倍梯度稀释,得到6个稀释度的标准模板,作为标准品。应用土壤根际细菌通用性引物331F:TCCTACGGGAGGCAGCAGT和797R:GGACTACCAGGGTATCTAATCCTGTT扩增菌株16S rDNA,探针Probe:5'- CGTATTACCGCGGCTGCTGGCAC -3'。探针和引物由上海闪晶分子生物科技有限公司合成。反应体系的建立及优化采用史应武[14]的方法:通过Roche LightCycler®480Ⅱ型实时荧光定量PCR仪进行荧光定量PCR扩增探针浓度的优化,其探针浓度优化后的体系为:模板(标准DNA/阴性对照) 5 μL/0 μL,上下游引物各0.8 μL,FS Essential DNA Probes Master 10.0 μL,Probe 0.4 μL,加ddH2O水补足20 μL。反应条件为:95 ℃欲变性10 min:95℃ 25 s,50℃ 120 s,72℃ 90 s,共45个循环。退火延伸时检测荧光信号。根据反应的Ct值、最高荧光值对引物反应浓度、最佳退火温度及扩增效率进行优化,以扩增Ct值在15~35,扩增效率接近100%为最佳反应。
1.2.5 标准曲线的建立
根据已经建立及优化的反应体系,对获得的重组质粒标准品梯度稀释样品进行荧光定量检测,同时设置不加模板的阴性对照,每个反应体系重复3次,由Roche LightCycler®480Ⅱ型实时荧光定量PCR仪自动生成标准曲线。
1.2.6 样品的RT- qPCR检测
采用建立的实时荧光定量PCR体系对新疆棉花各生育期、各采样地点根际土壤DNA样品进行检测。检测完毕后,根据建立的标准曲线计算根际细菌的含量(copies/g FRW)。
1.3 数据处理
采用Origin 2017软件对数据进行处理与分析。
2 结果与分析
2.1 标准曲线的绘制
经计算,质粒标准品的拷贝数为2.31×107copies/g (FRW),将标准品作10倍梯度稀释,获得2.31×102~2.31×107copies/g (FRW) 6个稀释梯度的标准品。将6个不同稀释度的标准品进行实时荧光定量PCR检测,反应结束后由Roche LightCycler®480Ⅱ系统软件自动生成反应曲线和标准曲线。图1,图2
扩增反应的误差为0.008 49,扩增效率为1.852,相关性系数为0.996,说明该反应体系和条件比较理想。标准曲线的斜率为-3.736,截距为43.50,由此得出根际细菌的DNA起始浓度对数值与Ct值之间的线性方程为y=-3.736x+43.50。
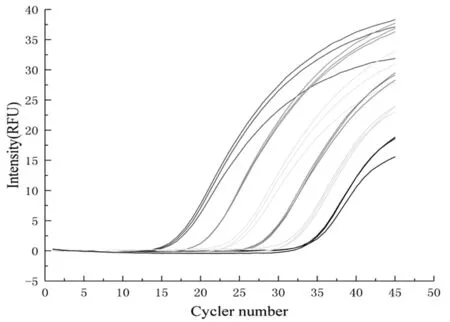
图1 10倍梯度稀释阳性质粒的荧光定量PCR扩增曲线
Fig.1 RT-q PCR amplifacation curve of serial 10-fold dilutions of positive recombinant plasmids

Note: Error: 0.00849; Efficiency: 1.852; Slope: -3.736; YIntercept: 43.50; Link: 2,027
图2 棉花根际细菌TaqMan实时荧光定量标准曲线
Fig.2 RT-q PCR standard curve of serial 10-fold dilutions of positive recombinant plasmids
2.2 新疆棉花不同生育时期根际细菌数量
库尔勒、阿拉尔和哈密根际细菌数量变化趋势在苗期至花期之间相似,根际细菌数量都是先增加后减少,花期至絮期之间根际细菌数量变化趋势不同,从花期开始,库尔勒根际细菌数量则是平缓增加,阿拉尔根际细菌数量则是不断减少,絮期为1.6×105copies/g (FRW),哈密根际细菌数量则是急剧增加,絮期达到最大值1.7×107copies/g (FRW);石河子、乌苏和图木舒克根际细菌数量变化趋势基本相同,从苗期开始缓慢减少,花期之后快速增加;精河根际细菌数量最低,苗期为8.5×104copies/g (FRW),从苗期开始缓慢增加,蕾期至花期之间变化不大,花期之后快速增加,絮期达到6.7×106copies/g (FRW)。图3
2.3 新疆棉花不同采样地点根际细菌数量
哈密根际细菌数量最高,吐絮期达到1.7×107copies/g (FRW),其次为库尔勒,蕾期为8.8×106copies/g (FRW),再次为阿拉尔,蕾期为6.8×106copies/g (FRW);根际细菌数量最低的是精河,苗期仅为8.5×104copies/g (FRW)。总体来看,新疆棉花根际细菌数量的空间变化是东疆大于南疆大于北疆。图4

注:SHZ、WS、JH、KEL、TMS、ALE、HM分别表示石河子、乌苏、库尔勒、图木舒克、阿拉尔和哈密棉花病株根际细菌
Note: SHZ, WS, JH, KEL, ALE, TMS, HM show rhizosphere bacteria in cotton affected Verticillium Wilt in Shihezi, Wusu , Jinghe, Korla, Alar, Tumushuker and Hami respectively
图3 不同生育时期棉花黄萎病病株根际细菌数量变化
Fig.3 Variation of number of rhizosphere bacteria in cotton infected by verticillium wilt at different growth stages
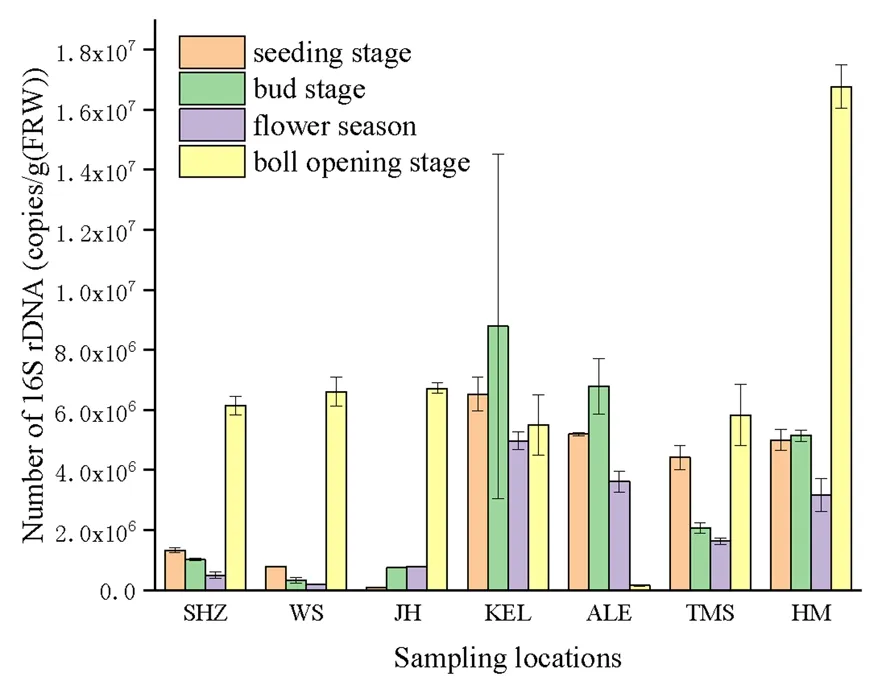
注:SHZ、WS、JH、KEL、ALE、TMS、HM分别表示采样地点石河子、乌苏、精河、库尔勒、阿拉尔、图木舒克和哈密
Note: SHZ, WS, JH, KEL, ALE, TMS, HM show sampling locations in Shihezi, Wusu , Jinghe, Korla, Alar, Tumushuker and Hami respectively
图4 不同采样地点棉花黄萎病病株根际细菌数量变化
Fig.4 Variation of number of rhizosphere bacteria in cotton infected by verticillium wilt at different sampling sites
3 讨 论
棉花根际微生物是棉花微生态系统中重要组成部分,而根际微生物区系主要以细菌为主,细菌以生长快、抗逆性强和次生代谢产物多而著称,是生物防治棉花黄萎病的主要菌群[15]。因此,寻找一种快速、准确、灵敏的根际细菌检测方法是研究根际微生物与棉花黄萎病发生关系的前提。
实验室中传统检测根际细菌含量的方法是平板菌落计数法,该方法存在的问题是,可分离培养的根际细菌只占环境微生物的0.1%~10%[16],这很难反映出根际细菌的真实数量;此外,平板菌落计数法操作比较繁琐,劳动强度比较大,培养时间较长,不能满足大量样品快速检测需求。而实时荧光定量PCR技术可以对土壤根际细菌个体进行绝对定量,极大地提高了检测的准确性;同时,该技术操作简便,可以大量扩增,能够在很短的时间内对棉花根际细菌进行大量检测。与传统方法相比,实时荧光定量PCR技术具有快速、准确的优点。通过TaqMan探针实时荧光定量PCR技术建立了一种快速、准确、灵敏的根际细菌检测方法。研究结果表明:棉花黄萎病株根际细菌数量随着棉花生育时期的不同而不同,根际细菌数量最高的是哈密,吐絮期达到1.7×107copies/g (FRW),根际细菌数量最低的是精河,苗期仅为8.5×104copies/g (FRW)。
董莲华等[17]对转基因和非转基因棉花对根际细菌数量的研究表明,根际细菌从蕾期开始下降,花期降到最低,铃期和絮期有所回升。研究与董莲华的结果相似。李家恕等[18]分析了棉花根际细菌总数,结果表明,棉花出苗以后细菌总数逐渐上升,至开花期达到最高,以后又慢慢减少。孙建波等[19]对香蕉不同生育时期根际土壤细菌群落变化的研究表明,香蕉根际微生物数量随着香蕉生育阶段的不同而不同。沈法富等[20]对转Bt基因抗虫棉和非转基因棉根际微生物区系的研究表明,苗期根际细菌的数量少,蕾期开始上升,到花铃期根际细菌的数量达到高峰,吐絮期下降。这可能是由于棉花品种、采样地点以及细菌数量计数方法上的差异而造成了结果上的差异。
4 结 论
该文通过TaqMan探针实时荧光定量PCR技术建立了一种快速、准确、灵敏的根际细菌检测方法,为快速检测根际微生物数量提供了一种方法。运用此方法发现,新疆棉花根际细菌数量在时间和空间上变化不尽相同,从整个生育时期来看,棉花根际细菌数量呈现出不规律的变化趋势;从不同采样地点来看,棉花根际细菌数量变化趋势是东疆、南疆、北疆依次减少,其中,棉花根际细菌数量最多的是东疆地区的哈密,吐絮期达到1.7×107copies/g(FRW),最少的是北疆地区的精河,苗期仅为8.5×104copies/g(FRW)。该文仅对棉花根际细菌数量进行了定量检测,而对于根际其他微生物的数量并没有进行研究,这是下一步研究工作的方向。
)
[1] 李国英,张新全,宋玉萍,等.北疆棉区棉花黄萎病发生趋势、抗性研究[J].新疆农业科学,2015,52(1):185-190.
LI Guo-ying, ZHANG Xing-quan, SONG Yu-ping, et al. (2015). Cotton verticillium wilt occurrence tendency,varieties resistance and deserving attention problems in the north of Xinjiang [J].XinjiangAgriculturalSciences, 52(1): 185-190. (in Chinese)
[2] 顾美英,徐万里,茆军,等.新疆绿洲农田不同连作年限棉花根际土壤微生物群落多样性[J].生态学报,2012,32(10):3 031-3 040.
GU Mei-ying, XU Wan-li, MAO Jun, et al. (2012). Microbial community diversity of rhizosphere soil in continuous cotton cropping system in Xinjiang [J].ActaEcologicaSinica, 32(10): 3,031-3,040. (in Chinese)
[3] 顾美英,徐万里,茆军,等.新疆棉花黄萎病发病株根际土壤微生物生态特征[J].西北农业学报,2009,18(2):276-279.
GU Mei-ying, XU Wan-li, MAO Jun, et al. (2009). Rhizosphere Soil Microbial Ecological Characteristics of Infected Cotton Plants by Verticillium wilt in Xinjiang [J].ActaAgriculturaeBoreali-occidentalisSinica. 18(2): 276-279. (in Chinese)
[4] 李洪连,袁虹霞,黄俊丽,等.不同有机改良剂对棉花黄萎病的防病作用及其机制[J].植物保护学报,2002,(4):313-319.
LI Hong-lian, YUAN Hong-xia, HUANG Jun-li, et al. (2002). Effects of organic amendments on cotton Verticillium wilt and their mechanisms to control disease [J].ActaPhytophylacicaSinice, (4): 313-319. (in Chinese)
[5] 李洪连,王守正,张明智.棉花抗、感枯萎病品种根际微生物数量研究[J].河南农业大学学报,1990,(1):49-56.
LI Hong-lian, WANG Shou-zheng, ZHANG Ming-zhi. (1990). Quantitative study on rhizosphere microorganisms of resistance and susceptible to cotton [J].ActaAgricultureUniversityHenanensis, (1):49-56. (in Chinese)
[6] 李洪连,袁红霞,王烨,等.根际微生物多样性与棉花品种对黄萎病抗性关系研究-Ⅰ.根际微生物数量与棉花品种对黄萎病抗性的关系[J].植物病理学报, 1998, 28(4): 341-345.
LI Hong-lian, YUAN Hong-xia, WANG Ye, et al. (1998). Study on the relationship between diversity of microbes in rhizosphere and resistance of cotton cultivars to verticillum dahliae-Ⅰ.the population of microbes in cotton rhizosphere and cultivars resistant to v. dahliae [J].ActaPhytopathologicaSinica, 28(4): 341- 345. (in Chinese)
[7] 张燕.棉花不同生育期根际细菌群落组成分析[D].山东农业大学,2009.
ZHANG Yan. (2009).Analysisofbacteriacommunityduringdifferentgrowthanddevelopmentstagesofcottonrhizospheresoil[D]. Master Thesis. Shandong Agricultural University, Tai'an. (in Chinese)
[8] 兰海燕,王长海,宋荣.棉花内生细菌及其研究进展[J].棉花学报,2000,(2):105-108.
LAN Hai-yan, WANG Chang-hai, SONG Rong. (2000) . Advances on Endophytic Bacteria in Cotton [J].ActaGossypiiSinica, (2): 105-108. (in Chinese)
[9] 刘雅慈,何泽,张胜,等.油气田土壤甲烷氧化菌实时荧光定量PCR检测技术的建立与应用[J].微生物学通报,2014,41(6):1 071-1 081.
LIU Ya-ci, HE Ze, ZHANG Sheng, et al. (2014). Development and application of a fluorescent quantitative real-time PCR technique for detection of methane-oxidizing bacteria in oil and gas field soil [J].MicrobiologyChina, 41(6):1,071-1,081. (in Chinese)
[10] 李琼,孔宝华,范静华,等.应用TaqMan探针实时荧光定量PCR技术早期检测稻瘟病[J].植物病理学报,2011,41(2):118-123.
LI Qiong, KONG Bao-hua, FAN Jing-hua, et al. (2011). Early detection of rice blast by TaqMan real-time flourescence quantitative polym erase chain reaction [J].ActaPhytopathologicaSinica, 41(2): 118-123. (in Chinese)
[11] 徐小刚,刘雅婷.实时荧光定量PCR在植物病害中的应用[J].中国农学通报,2009,25(7):52-56.
XU Xiao-gang, LIU Ya-ting. (2009). Application of Real-time Fluorescence Quantitative PCR in Plant Disease [J].ChineseAgriculturalScienceBulletin, 25(7): 52-56. (in Chinese)
[12] 袁亚男,刘文忠.实时荧光定量PCR技术的类型、特点与应用[J].中国畜牧兽医,2008,(3):27-30.
YUAN Ya-nan, LIU Wen-zhong. (2008). The Types, Characteristics and Applications of Real-Time Fluoescent Quantitative PCR Techniques [J].ChinaAnimalHusbandryandVeterinaryMedicine, (3): 27-30. (in Chinese)
[13] 沈元劼,齐谢敏,刘标,等.棉花黄萎病菌实时荧光定量PCR检测方法的建立及应用[J].生态学杂志,2015,34(7):2 058-2 063.
SHEN Yuan-jie, QI Xie-min, LIU Biao, et al. (2015). Development and application of a real-time PCR assay for the detection and quantification of Verticillium dahliae [J].ChineseJournalofEcology, 34(7): 2,058-2,063. (in Chinese)
[14] 史应武,楚敏,杨红梅,等.新疆棉花黄萎病株内生真菌荧光定量检测及时空动态分析[J].微生物学通报,2017,44(10):1-11.
SHI Ying-wu, CHU Ming, YANG Hong-mei, et al. (2017). Quantitative detection and spatiotemporal dynamic analysis of endophytic fungi in cotton infected by Verticillium Wilt using real-time PCR [J].MicrobiologyChina, 44(10): 1-11. (in Chinese)
[15] 梁宏,黄静,赵佳,等.生物防治棉花黄萎病的研究进展[J].生物技术通报,2015,31(5):1-6.
LIANG Hong, HUANG Jing, ZHAO Jia, et al. (2015). Studies on Biocontrol of Cotton Verticillium Wilt [J].BiotechnologyBulletin, 31(5): 1-6. (in Chinese)
[16] 顾卿,许艳丽,魏巍,等.土壤细菌群落密度实时荧光定量PCR检测体系的建立[J].土壤与作物,2012,1(2):117-120.
GUO Qing, XU Yan-li, WEI Wei, et al. (2012). The Establishment of the Real-Time PCR System for Detecting Soil Bacteria Abundance [J].SoilandCrop, 1(2): 117-120. (in Chinese)
[17] 董莲华,孟盈,王晶.转Bt+CpTI基因棉花对根际土壤细菌及氨氧化细菌数量的影响[J].微生物学报,2014,54(3):309-318.
DONG Lian -hua, MENG Ying, WANG Jing. (2014). Effects of transgenic Bt+Cp TI cotton on rhizosphere bacteria and ammonia oxidizing bacteria population [J].ActaMicrobiologicaSinica,54(3): 309-318. (in Chinese)
[18] 李家恕,王祖农.棉花根际微生物的初步观察[J].山东大学学报(自然科学版),1961,(1):58-65.
LI Jia-shu, WANG Zu-nong. (1961). Preliminary Observation on Rhizosphere Microorganisms in Cotton[J].JournalofShandongUniversity(NaturalScience) , (1): 58-65. (in Chinese)
[19] 孙建波,邹良平,李文彬,等.香蕉不同生育期根际土壤细菌群落变化研究[J].热带作物学报,2016,37(6):1 168-1 171.
SUN Jian-bo, ZHOU Liang-ping, LI Wen-bin, et al. (2016). The Variation of Bacterial Community in the Banana Rhizosphere Soil at Different Growth Stages [J].ChineseJournalofTropicalCrops, 37(6): 1,168-1,171. (in Chinese)
[20] 沈法富,韩秀兰,范术丽.转Bt基因抗虫棉根际微生物区系和细菌生理群多样性的变化[J].生态学报,2004,(3):432-437.
SHEN Fa-fu, HAN Xiu-lan, FAN Shu-li. (2004). Changes in microbial flora and bacterial physiological group diversity in rhizosphere soil of transgenic Bt cotton [J].ActaEcologicaSinica, (3): 432-437. (in Chinese)
