p-STAT3在奥沙利铂致急性神经病理性疼痛中的作用*
2018-03-13李双凤王亚平欧阳碧山
李双凤 王亚平 欧阳碧山 赵 鑫
(1 中南大学湘雅二医院麻醉教研室,长沙 410011;2 海南省人民医院麻醉教研室,海口 570311;3 中南大学湘雅三医院神经内科教研室,长沙 410013)
奥沙利铂作为第三代铂类化疗药物,广泛地用于治疗晚期转移性结直肠癌病人[1,2]。约85%至95%的病人在奥沙利铂治疗期间迅速发展为无运动功能障碍的神经病理性疼痛,高峰发生在用药后24~48 h[3~6],持续一周左右。这一神经病变的发展往往限制了化疗方案的进行而导致治疗终止[7]。近年来相关的研究日益增加,然而,确切的病理生理机制却尚不清楚。三环类抗抑郁药、抗惊厥药、阿片类药物和非甾体镇痛消炎药是目前用于治疗化疗引起的神经病理性疼痛的药物。然而,这些药物的有效性和安全性是有限的[8]。因此,发展新的安全有效的可替代药物及发现其可能机制,具有非常重要的临床意义。
Janus激酶 (Janus kinase, JAK) /转导和转录激活因子3 (signal transducers and activators of transcription 3, STAT3) 信号转导通路作为细胞内经典的信号转导通路,参与胶质细胞的活化及神经病理性疼痛的形成[9,10]。近来研究发现STAT家族中的STAT3在调节免疫及应激中起重要作用。因此,本实验通过探讨p-STAT3在奥沙利铂致急性神经病理性疼痛中的影响,希望了解奥沙利铂致急性神经病理性疼痛的分子机制,进而为新的治疗方法提供理论支持。
方 法
1.实验动物
成年健康雄性Sprague-Dawley大鼠(由湖南天勤生物技术有限公司提供,批号:43006700008149),清洁级,体重180~220 g,8周龄,4~6只/笼饲养,12 h明暗交替,保持室温和湿度在适当范围,自由进食水和食物。至少7天时间让大鼠适应环境和实验者,然后开始实验。
2.实验模型建立
本研究采用奥沙利铂诱发急性神经病理性疼痛为模型。十六只大鼠随机接受单次腹腔注射奥沙利铂(6 mg/kg,n = 8)或 5%葡萄糖溶液 (6 mg/kg,n = 8)[11,12]。所有行为学测试均在奥沙利铂或葡萄糖给药后0、1、2、3、4、5天进行。经研究发现大鼠在给药后的第2天机械性刺激及冷刺激引起的痛觉异常具有显著性变化。因此,我们选取单次腹腔注射奥沙利铂后的第2天来研究实验的第二部分。
3.药物处理
奥沙利铂(江苏恒瑞医药提供)溶于5%葡萄糖溶液的浓度为2 mg/ml,腹腔注射(i.p.) 6 mg/kg。对照组腹腔注射相同体积的5%葡萄糖溶液。AG490(JAK/STAT信号通路抑制剂,美国Sigma公司提供)溶于3.5%的二甲基亚砜(DMSO),腹腔注射10 mg/kg,对照组腹腔注射相同体积的3.5% DMSO。所有的动物在实验结束后,戊巴比妥钠过量处理。
4.动物分组
(1)建立模型分组:①对照组:5%葡萄糖(6 mg/kg,i.p.); ②奥沙利铂组:奥沙利铂(6 mg/kg,i.p.)。
(2)AG490对其模型的影响,该部分实验分成三组:①对照组:5%葡萄糖(6 mg/kg,i.p.) + 与AG490相同体积的3.5% DMSO (i.p.);②奥沙利铂组:奥沙利铂(6 mg/kg,i.p.) + 与AG490相同体积的3.5% DMSO (i.p.);③ AG490组:奥沙利铂(6 mg/kg,i.p.) + AG490 (10 mg/kg,i.p.)。
5.行为学测试
所有行为学测试均在上午10:00~12:00之间进行。给药人员不参与行为学测试。每次测试前大鼠有30 min适应测试环境和测试,分别在奥沙利铂给药后第0、1、2、3、4,5天,以及在奥沙利铂给药后第2天再注射AG490后第4 h进行测试。冷热痛觉异常采用大鼠甩尾潜伏期(tail withdrawal latency, TWL)测定,将大鼠尾巴分别浸入4℃冷水或42℃热水中,记录尾巴在冷水中的持续时间。设定20 s为终止时间,以避免组织损伤。每次测试间隔5 min,连续观察5次,记录平均值。机械触痛异常采用电子von Frey疼痛测量仪(美国IITC Life Science)测量机械性缩足反射阈值(paw withdrawal threshold, PWT)。将大鼠分别放置于金属筛网上的有机玻璃箱里,安静15 min后,以硬性von Frey纤维垂直地刺向其双侧后肢足底中部皮肤,缓慢增加刺激压力,大鼠出现抬足、舔足、躲避等反应时,读取读数器上显示的最大值(g)。设定切断压力为80 g,避免损伤大鼠足底组织。每只老鼠双足分别重复测量5次,间隔5 min,记录平均值。
6. Western blot测定p-STAT3
大鼠进行行为学测试后,立刻戊巴比妥钠麻醉(100 mg/kg,i.p.),立即取出脊髓腰膨大置于液氮中快速冻结。组织投入RIPA单去污剂蛋白裂解液于匀浆器中进行匀浆。在4℃离心,收集上清液。然后,蛋白质样品装上SDS-聚丙烯酰胺分离凝胶,再将蛋白质电泳转移到PVDF膜上。用封闭液(含3%脱脂牛奶的TBST溶液)室温封闭PVDF膜l h,在4℃加入兔抗p-STAT3(Tyr705,1:500稀释,Cell Signaling Technology)。然后,膜与辣根过氧化物酶标记的抗兔二抗孵育(1:3 000,Cell Signaling Technology)1.5 h,在室温下,浸泡ECL工作液1 min化学显影并拍照。
7.免疫荧光检测p-STAT3
动物深度麻醉后,冷生理盐水经心灌注到流出清夜后,冷4%多聚甲醛灌注固定,采集脊髓腰膨大,保存在10%蔗糖4℃过夜脱水。脊髓组织切成5 μm切片,在含3%驴血清和0.3%Triton X-100的1 × 磷酸盐缓冲盐水(PBS)预孵育1 h(25℃)。第一部分加入DAPI(4,6-二脒基-2-苯基吲哚,1 mg/ml,北京索莱宝科技有限公司)直接进行染色。第二部分使用的的一抗为兔抗p-STAT3(Tyr705;1:50稀释;Cell Signaling Technology),在同一缓冲液中4℃孵育24 h;红色荧光二抗孵育:用抗体稀释液配制红色荧光二抗Alexa 594标记的羊抗兔IgG (1:200,Molecular Probes),室温避光孵育2 h。染色切片用Olympus荧光显微镜观察(日本奥林巴斯)和图像是由CCD摄像机现场拍摄。
8.统计学处理
结 果
1.奥沙利铂对大鼠疼痛行为学及脊髓p-STAT3表达的影响
在奥沙利铂处理前,两组疼痛行为学指标在统计学上无显著性差异。与对照组相比,奥沙利铂组均在给药后第一天迅速出现痛觉异常,明显缩短了大鼠的机械缩足反射阈值(PWT)和冷刺甩尾撤退潜伏期(TWL) (P < 0.05),在给药后第二天达到高峰 (P < 0.01),持续到第五天(P < 0.05,见图 1 A,B);奥沙利铂组大鼠的热刺激甩尾潜伏期(TWL)未见明显改变(P > 0.05;见图1 C)。同时,奥沙利铂组p-STAT3蛋白水平在第一天显著升高 (P < 0.05),在第二天达到高峰(P < 0.01),持续到第五天(P < 0.05,见图2)。此外,免疫荧光显示奥沙利铂组p-STAT3表达比对照组显著增加(P < 0.01,见图5)。因此,我们选择单剂量奥沙利铂(6 mg/kg,i.p.)处理后的第二天作为奥沙利铂诱发急性神经痛来做后面的第二部分实验。由于实验组没有出现热刺激引起的疼痛异常,我们没有在第二部分实验来做热刺激甩尾潜伏期试验。
2. AG490对奥沙利铂引起的急性神经病理性疼痛的影响
与奥沙利铂组比较,腹腔注射AG490后可明显提高大鼠的机械缩足反射阈值(PWT)和冷刺激甩尾潜伏期 (TWL)(P < 0.05,见图 3);Western Blot分析和免疫荧光显示AG490显著地抑制p-STAT3蛋白水平的表达(P < 0.01,见图4、5)。
讨 论

图1 奥沙利铂诱发大鼠疼痛行为学变化的影响(n = 8,±SD)A: 机械刺激;B: 冷刺激;C: 热刺激。*P < 0.05,**P < 0.01,与对照组相比PWT: 缩足反射阈值;TWL: 甩尾潜伏期Fig.1 The influence of oxaliplatin on cold, heat and mechanical allodynia in rats (n = 8,±SD)*P < 0.05, **P < 0.01, compared with control group.PWT: paw withdrawal threshold; TWL: tail withdrawal latency.
本研究发现在奥沙利铂诱发引起的急性神经病理性疼痛模型中,p-STAT3在大鼠脊髓腰膨大中过量表达,并通过腹腔注射JAK/STAT信号通路抑制剂AG490能够明显减轻大鼠冷刺激和机械性刺激引起的异常痛觉。这些结果表明,p-STAT3参与了奥沙利铂诱导引发的急性神经病理性疼痛。
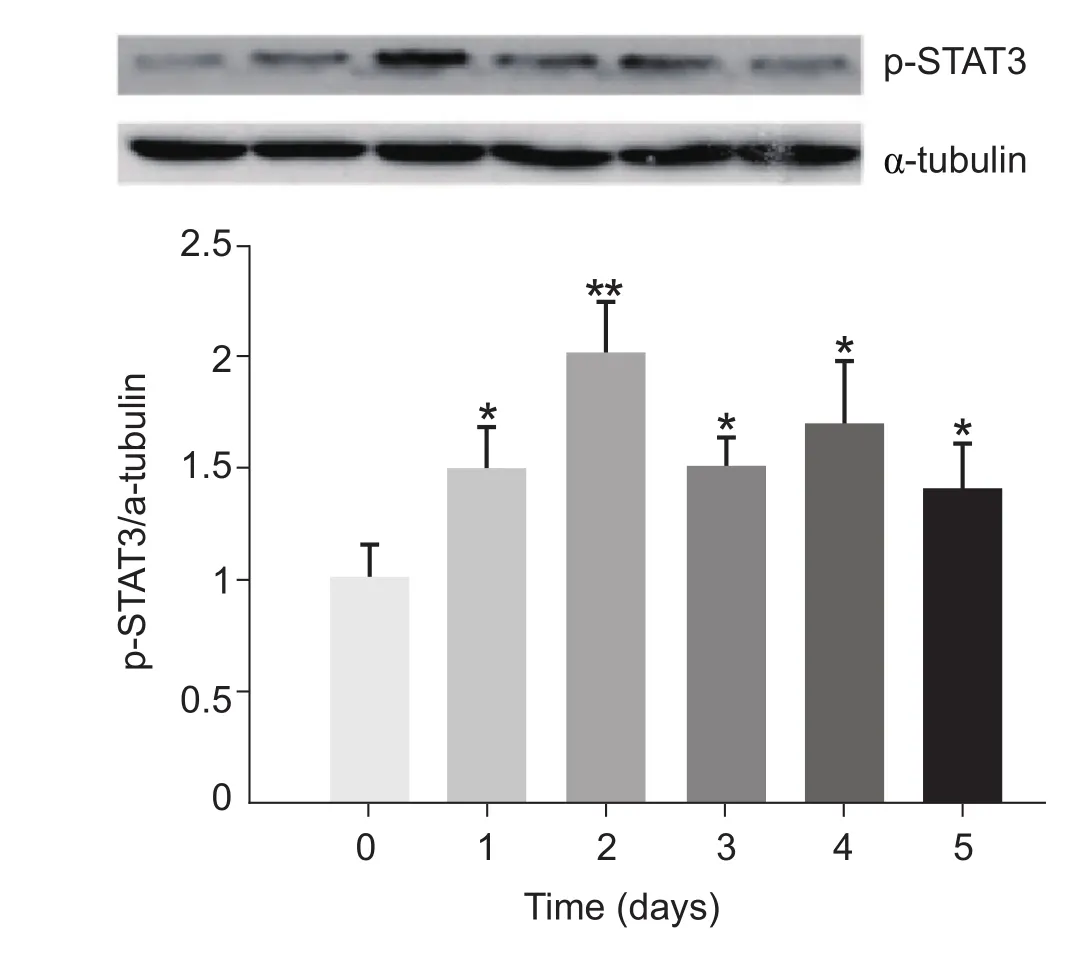
图2 奥沙利铂对大鼠脊髓p-STAT3表达的影响(n = 3,±SD)*P < 0.05,**P < 0.01,与 day 0 相比Fig.2 The expression of p-STAT3 protein in the spinal cord of oxaliplatin-treated rats (n = 3,±SD).*P < 0.05, **P < 0.01, compared with on day 0.

图3 AG490对奥沙利铂诱发大鼠疼痛行为学的影响(n = 8,±SD)A: 机械刺激;B: 冷刺激*P < 0.05,与对照组相比;#P < 0.05,与奥沙利铂组相比,PWT: 缩足反射阈值;TWL: 甩尾潜伏期Fig.3 The effects of AG490 on oxaliplatin-induced cold and mechanical allodynia in rats (n = 8,±SD)*P < 0.05, compard control group; #P < 0.05, compared with oxaliplatin group. PWT: paw withdrawal threshold; TWL: tail withdrawal latency.

图4 AG490对大鼠脊髓p-STAT3 expression结果的影响(n = 3,±SD)**P < 0.01,与对照组相比;##P < 0.01,与奥沙利铂组相比Fig.4 The effect of AG490 on expression of p-STAT3 in the spinal cord of rats (n = 3,±SD)**P < 0.01, compared with control group; ##P < 0.01,compared with oxaliplatin group.
临床上无论是采用奥沙利铂的单剂量或累积剂量都可能会引发神经病理性疼痛,奥沙利铂诱发的神经病理性疼痛成为癌症治疗成功的主要障碍。在抗肿瘤临床试验中,使用奥沙利铂的剂量为每两周85 mg/m2或每三周130 mg/m2,并可耐受的最大剂量为200 mg/m2,这相当于大约6 mg/kg的剂量[13,14]。因此,在本实验中采用单剂量奥沙利铂(6 mg/kg)腹腔注射,给药途径及剂量大小是根据大量研究结果决定的[11,13~17]。这些研究都发现单剂量奥沙利铂处理能够显著引发大鼠对冷刺激和机械性刺激的异常痛觉,但都没有出现热刺激促发的异常疼痛;在本项建立模型过程中,同样发现奥沙利铂组大鼠没有出现热刺激引起的异常疼痛,所以我们没有在第二部分实验做热刺激鼠尾撤退潜伏期试验。
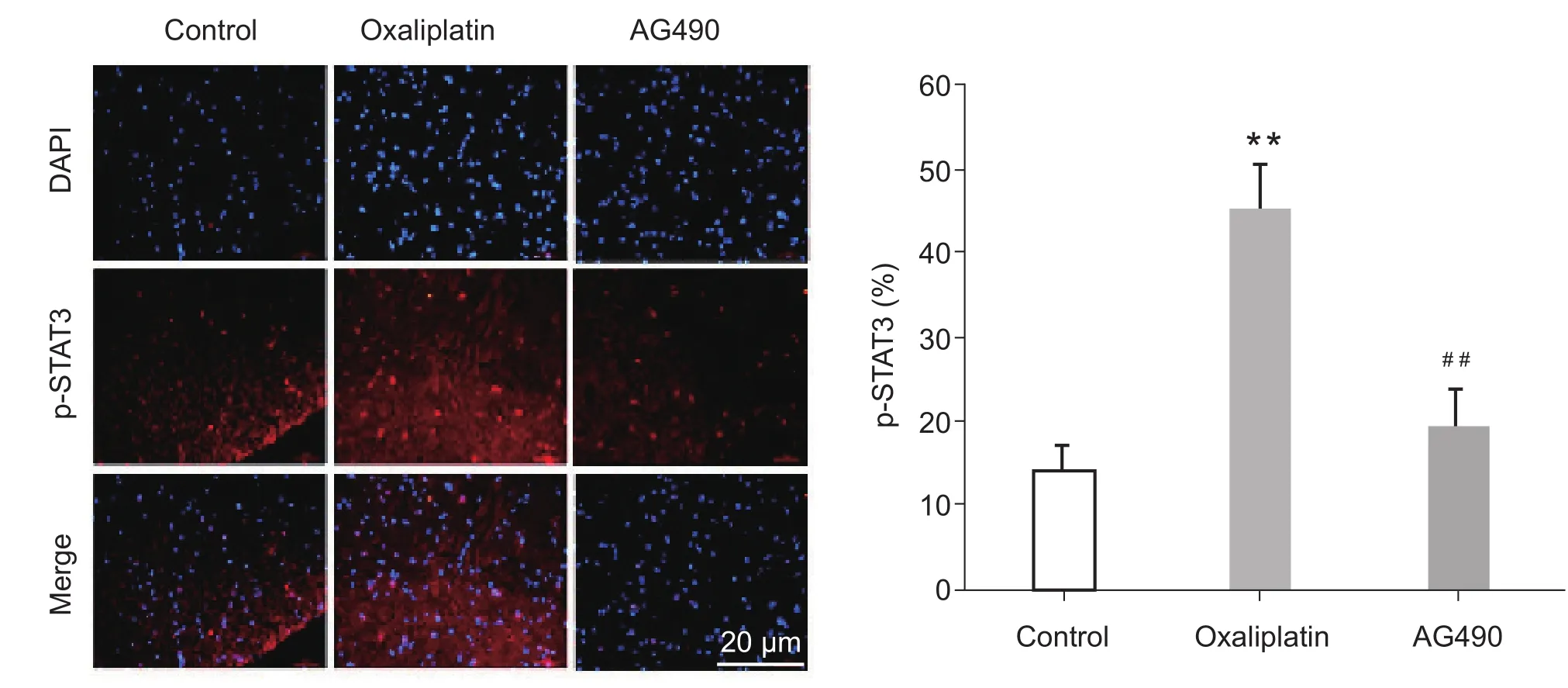
图5 AG490对大鼠脊髓p-STAT3 免疫荧光结果的影响 (n = 3,±SD, bar = 20 µm)**P < 0.01,与对照组相比;##P < 0.01,与奥沙利铂组相比DAPI:4,6-二脒基-2-苯基吲哚Fig.5 The effect of AG490 on immuno fl uorescence of p-stat3 in the spinal cord of rats (n = 3,±SD, bar = 20 µm)**P < 0.01, compared with control group; ##P < 0.01, compared with oxaliplatin group.DAPI: 4,6-diamidino-2-phenylindole.
一些研究发现损伤外周神经可激活JAK2/STAT3信号通路,从而引起STAT3过度磷酸化,导致神经病理性疼痛[10,18~22]。一项大鼠脊髓神经损伤的研究发现通过抑制JAK/STAT3信号通路可减少脊髓背角星形胶质细胞的增殖和促进触觉恢复引发的异常疼痛[9,23]。此外,脊髓IL-33/ST2通过激活JAK2/STAT3信号通路加剧神经病理性疼痛[24,25]。根据这些研究,STAT3信号分子在外周和脊髓神经损伤中都被激活,而其抑制剂可减轻神经病理性疼痛。同样,本实验采用单剂量腹腔注射奥沙利铂诱导引发的急性神经病理性疼痛为模型,发现奥沙利铂可引起STAT3的过度磷酸化;同时,伴随着大鼠机械性刺激和冷刺激引发的异常疼痛。
有研究发现STAT3抑制剂WP1066可减轻CCI大鼠引起的异常疼痛[14];同样,本实验采用JAK/STAT信号通路抑制剂AG490处理大鼠可减轻奥沙利铂诱导引发的异常疼痛。因此,这些发现都提示JAK/STAT通路抑制剂可能为治疗神经病理性疼痛的有效治疗提供新靶点,为临床治疗提供有效方法和理论支持。
[1]Screnci D, Mckeage MJ, Galettis P, et al. Relationships between hydrophobicity, reactivity, accumulation and peripheral nerve toxicity of a series of platinum drugs.Br J Cancer, 2000, 82:966 ~ 972.
[2]Baker DE. Oxaliplatin: a new drug for the treatment of metastatic carcinoma of the colon or rectum. Rev Gastroenterol Disord, 2003, 3:31 ~ 38.
[3]Mathe G, Kidani Y, Triana K, et al. Aphase I trial of trans-1-diaminocyclohexane oxalatoplatinum (l-OHP).Biomed. Pharmacother, 1986, 40:372 ~ 376.
[4]Extra JM, Espi M, Calvo F, et al. Phase I study of oxaliplatin in patients with advanced cancer. Cancer Chemother. Pharmacol, 1990, 25:299 ~ 303.
[5]Ibrahim A, Hirschfeld S, Cohen MH, et al. FDA drug approval summaries: oxaliplatin. Oncologist, 2004, 9:8.
[6]Cersosimo RJ. Oxaliplatin-associated neuropathy: a review. Ann. Pharmacother, 2005, 39:128 ~ 135.
[7]Saif MW, Reardon J. Management of oxaliplatin-induced peripheral neuropathy. Ther Clin Risk Manag,2005, 1:249 ~ 258.
[8]Lynch JJ 3rd, Wade CL, Zhong CM, et al. Attenuation of mechanical allodynia by clinically utilized drugs in a rat chemotherapyinduced neuropathic pain model. Pain,2004, 110:56 ~ 63.
[9]Tsuda M, Kohro Y, Yano T, et al. JAK-STAT3 pathway regulates spinal astrocyte proliferation and neuropathic pain maintenance in rats. Brain, 2011, 134 (Pt 4):1127 ~1139.
[10]Dominguez E, Rivat C, Pommier B, et al. JAK/STAT3 pathway is activated in spinal cord microglia after peripheral nerve injury and contributes to neuropathic pain development in rat. J Eurochem, 2008, 107:50 ~ 60.
[11]Ling B, Coudore-Civiale MA, Balayssac D, et al.Behavioral and immunohistological assessment of painful neuropathy induced by a single oxaliplatin injection in the rat. Toxicology, 2007, 234:176 ~ 184.
[12]Lim BS, Moon HJ, Li DX et al. Effect of bee venom acupuncture on oxaliplatin-induced cold allodynia in rats. Evid. Based Complement Alternat Med, 2013,2013:369324.
[13]Raymond E, Chaney SG, Taamma A, et al. Oxaliplatin:a review of preclinical and clinical studies. Ann Oncol,1998, 9:1053 ~ 1071.
[14]Carrato A, Gallego J, Diaz-Rubio E. Oxaliplatin: results in colorectal carcinoma. Crit Rev Oncol Hematol, 2002,44:29 ~ 44.
[15]Holmes J, Stanko J, Varchenko M, et al. Comparative neurotoxicity of oxaliplatin, cisplatin, and ormaplatin in a Wistar rat model. Toxicol. Sci, 1998, 46:342 ~ 351.
[16]Jamieson SM, Liu J, Connor B, et al. Oxaliplatin causes selective atrophy of a subpopulation of dorsal root ganglion neurons without inducing cell loss. Cancer Chemother. Pharmacol, 2005, 56:391 ~ 399.
[17]Li D, Lee Y, Kim W, et al. Analgesic effects of bee venom derived phospholipase A2 in a mouse model of oxaliplatin-induced neuropathic pain. Toxins, 2015,7:2422 ~ 2434.
[18]Popiolek-Barczyk K, Kolosowska N, Piotrowska A, et al.Parthenolide relieves pain and promotes M2 microglia/macrophage polarization in rat model of neuropathy.Neural Plast, 2015, 2015:1 ~ 15.
[19]Dominguez E, Mauborgne A, Mallet J, et al.SOCS3-mediated blockade of JAK/STAT3 signaling pathway reveals its major contribution to spinal cord neuroinflammation and mechanical allodynia after peripheral nerve injury. J Neurosci, 2010, 30:5754 ~5766.
[20]Wang N, Liang H, Zen K. Molecular mechanisms that in fl uence the macrophage m1-m2 polarization balance.Front Immunol, 2014, 5:1 ~ 9.
[21]Yamauchi K, Osuka K, Takayasu M, et al. Activation of JAK/STAT signalling in neurons following spinal cord injury in mice. J Neurochem, 2006, 96:1060 ~ 1070.
[22]王健, 杨帆, 李俊峰,等. 鞘内给予氯胺酮通过抑制星形胶质细胞内STAT3的磷酸化改善大鼠神经病理性痛的研究. 神经解剖学杂志, 2015, 31:679 ~ 685.
[23]薛照静, 申乐, 王之遥,等. JAK2/STAT3通路参与大鼠坐骨神经结扎神经病理性疼痛模型. 基础医学与临床 , 2014 , 34:62 ~ 67.
[24]Liu S, Mi WL, Li Q, et al. Spinal IL-33/ST2 Signaling Contributes to Neuropathic Pain via Neuronal CaMKII-CREB and Astroglial JAK2-STAT3 Cascades in Mice. Anesthesiology, 2015, 123:1154 ~ 1169.
[25]袁超, 曹红. 胶质细胞MCP-1-JAK/STAT作用于神经元NMDAR参与神经病理性疼痛的研究进展. 中国疼痛医学杂志, 2014, 20(7):584 ~ 587.
