嗜酸氧化硫硫杆菌DS1的分离鉴定及单质硫氧化特性
2018-03-12李静泉许继飞
李静泉, 姜 燕, 许继飞, 赵 吉
(内蒙古大学环境与资源学院/内蒙古自治区环境污染控制与废物资源化重点实验室,内蒙古呼和浩特 010021)
煤炭燃烧过程中释放的二氧化硫是造成大气污染的主要原因之一,对生态环境和人体健康危害严重。煤炭微生物脱硫因其效率高、成本低、二次污染小等特点[1-2]越来越受到研究者的关注。嗜酸氧化硫硫杆菌为化能自养型细菌,广泛存在于酸性矿山废水和矿区土壤等环境中,是脱硫微生物的主要代表之一,不仅能应用于硫的氧化脱除,还能应用于污泥淋滤去除重金属、生物处理降低盐碱地pH值、尾矿冶金等领域[3-6]。高效脱硫菌株是微生物脱硫应用于环保领域的关键。因此,分离和筛选高效脱硫菌株是一项基础且非常重要的研究工作。
胡瑜等从高硫煤矸石山酸性废水中分离得到的嗜酸氧化硫硫杆菌CMTT-32对单质硫的氧化率在第11天时达到 65.6%,日产硫酸的量最高达3 g/L[7]。杨期勇等分离筛选得到1株嗜酸氧化硫硫杆菌JJU-1,其培养基的pH值在第6天时约下降至1.0,在第9天时约下降至0.7,且研究发现硫粉投加量对菌株JJU-1的氧化产酸量有影响[8]。吕早生等从矿山土样中分离得到1株嗜酸氧化硫硫杆菌HY-01,在培养180 h后其培养基的pH值约下降至1.0,对应的D600 nm略大于1.0,但菌株HY-01不能利用Na2S2O3[9]。嗜酸氧化硫硫杆菌QH-1在1周内可将培养基的pH值降到1.0以下,生长稳定期时培养基的pH值为0.6,同时试验发现菌株 QH-1 对Zn2+、Cu2+有一定的耐受性,而对Mo2+的耐受性较差[10]。嗜酸氧化硫硫杆菌TS6在培养基初始pH值为2~6的条件下能够在3~4 d内将pH值约降至1.0,而当初始pH值为8时则难使pH值明显下降,且菌株TS6对Cr3+、Cu2+、Zn2+、Ni2+具有耐受性[11]。
本试验从高硫煤矿储煤区的土壤中分离筛选出1株高效脱硫菌,并研究该菌株的单质硫氧化曲线,及培养基中单质硫初始量和金属离子对单质硫氧化过程的影响。
1 材料与方法
1.1 试验材料
1.1.1 土壤样品采集 土壤样品,采自内蒙古自治区乌海市乌达煤矿储煤区。
1.1.2 培养基 Waksman培养基:0.200 g(NH4)2SO4,3.000 g K2HPO4·3H2O,0.500 g MgSO4·7H2O,0.126 g CaCl2·2H2O,10.000 g S0,1 000 mL蒸馏水,按试验需要用HCl溶液调节培养基的pH值。S0先经紫外照射灭菌再与高压蒸汽灭菌的培养基的其余部分进行混合。用于菌株的液体培养。
Starky-Na2S2O3-琼脂培养基:2.000 g(NH4)2SO4,0.500 g MgSO4·7H2O,0.250 g CaCl2·2H2O,3.000 g KH2PO4,0.001 g FeSO4·7H2O,10.000 g 400 g/L Na2S2O3,20.000 g琼脂,1 000 mL蒸馏水。浓度为400 g/L的Na2S2O3母液先经过滤除菌再与高压蒸汽灭菌的培养基其余部分在50~60 ℃进行混合。用于菌株的平板固体培养。
1.2 试验方法
1.2.1 菌株富集培养与分离 取5 g土壤样品加入盛有 100 mL Waksman培养基(pH值为2.0)的250 mL锥形瓶中,在30 ℃、160 r/min条件下培养7 d,在培养过程中如有化能自养菌的生长则培养基将变为浑浊的乳白色。取5 mL培养液加入1瓶新的盛有100 mL Waksman培养基的250 mL锥形瓶中,在30 ℃、160 r/min条件下培养7 d,连续富集培养6代。将最后1次的富集液进行梯度稀释,分别取10-3、10-4、10-5稀释液各100 μL加到Starky-Na2S2O3-琼脂培养基上,涂布均匀,倒置于30 ℃恒温培养箱中培养。挑取形态不同的菌落于装有20 mL Waksman培养基的50 mL锥形瓶中,在 30 ℃、160 r/min条件下培养,验证单质硫氧化功能。同时通过固体平板划线法进行验证,直到分离得到纯的具有脱硫功能的菌株。
1.2.2 菌株鉴定 在Starky-Na2S2O3-琼脂培养基上观察菌落形态,对菌株进行革兰氏染色,在显微镜下对菌株个体进行观察。菌株16S rRNA基因PCR扩增所用引物为27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1 492R:5′-GGTTACCTTG TTACGACTT-3′。16S rRNA基因PCR扩增程序为94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 90 s,29次循环;72 ℃ 10 min。基因测序结果通过Blast、MEGA 4.1进行分析和构建系统进化树。
1.2.3 嗜酸氧化硫硫杆菌的单质硫氧化特性研究
1.2.3.1 种子液的准备 将菌液按3%(体积比)的接种量接入盛有初始pH值为2.0的Waksman培养基的锥形瓶中,在30 ℃、160 r/min条件下培养8 d,静置沉淀3 min以去除培养液中的单质硫,吸取上层菌液作为种子液。
1.2.3.2 嗜酸氧化硫硫杆菌的单质硫氧化曲线 Waksman培养基的初始pH值调节为2.3,按3%(体积比)的接种量向盛有20 mL Waksman培养基的50 mL锥形瓶中接种种子液,种子液的D600 nm为0.22。在30 ℃、160 r/min摇床中培养,每2 d测定1次培养液的SO42-浓度、pH值、D600 nm。每组试验设3个重复。
在混凝土灌注之前,要保证混凝土隔水栓与初灌料斗以及相关工作人员到位。安排专业工作人员检测并评估坍落指数,以保证能够与施工标准要求相适应。
1.2.3.3 单质硫不同初始量对嗜酸氧化硫硫杆菌单质硫氧化效率的影响 将Waksman培养基中单质硫的初始量分别设为0.1%、2%、3%(质量体积比),培养基的初始pH值调为2.0。按3%(体积比)的接种量向盛有20 mL Waksman培养基的50 mL锥形瓶中接种种子液,种子液的D600 nm为0.22。在30 ℃、160 r/min摇床中培养,每2 d测定1次培养液的SO42-浓度、pH值。每组试验设3个重复。
1.2.3.4 不同金属离子对嗜酸氧化硫硫杆菌单质硫氧化效率的影响 选用的金属离子分别为Fe3+、Ca2+、Zn2+、Co2+、Ni2+、Cu2+、Mn2+、Mg2+、K+,向初始pH值为2.0的Waksman培养基中加入各金属离子,使培养基中该金属离子的浓度均增加1 mmol/L,同时设置在Waksman培养基中不添加金属离子作为对照。
接种量均为3%(体积比),种子液的D600 nm为0.27,培养条件为 30 ℃、160 r/min摇床培养。培养第7天时取样测定SO42-浓度、pH值。每组试验设3个重复。
1.2.3.5 单质硫氧化率的计算 根据各取样点的样品与培养基中初始SO42-浓度之差和培养基中初始加入单质硫的量来计算单质硫氧化率。
式中:r为单质硫氧化率;C2为各取样点样品中SO42-浓度的平均值,mg/L;C1为培养基中初始SO42-浓度的平均值,mg/L;m为20 mL培养基中单质硫的初始量,mg。
1.2.4 取样方法和检测仪器
在取样测定SO42-浓度、pH值时,将菌液在5 000 r/min条件下离心10 min,取上清液,随后抽滤,使溶液澄清,用pH计测定pH值,用离子色谱仪测定SO42-浓度。
1.2.4.2 检测仪器 离子色谱仪(881 Compact IC pro-Anion),购自瑞士万通中国有限公司;紫外可见分光光度计(TU-1810),购自北京普析通用仪器有限责任公司;pH计(ST2100),购自奥豪斯仪器(常州)有限公司。
2 结果与分析
2.1 脱硫菌株的分离、鉴定
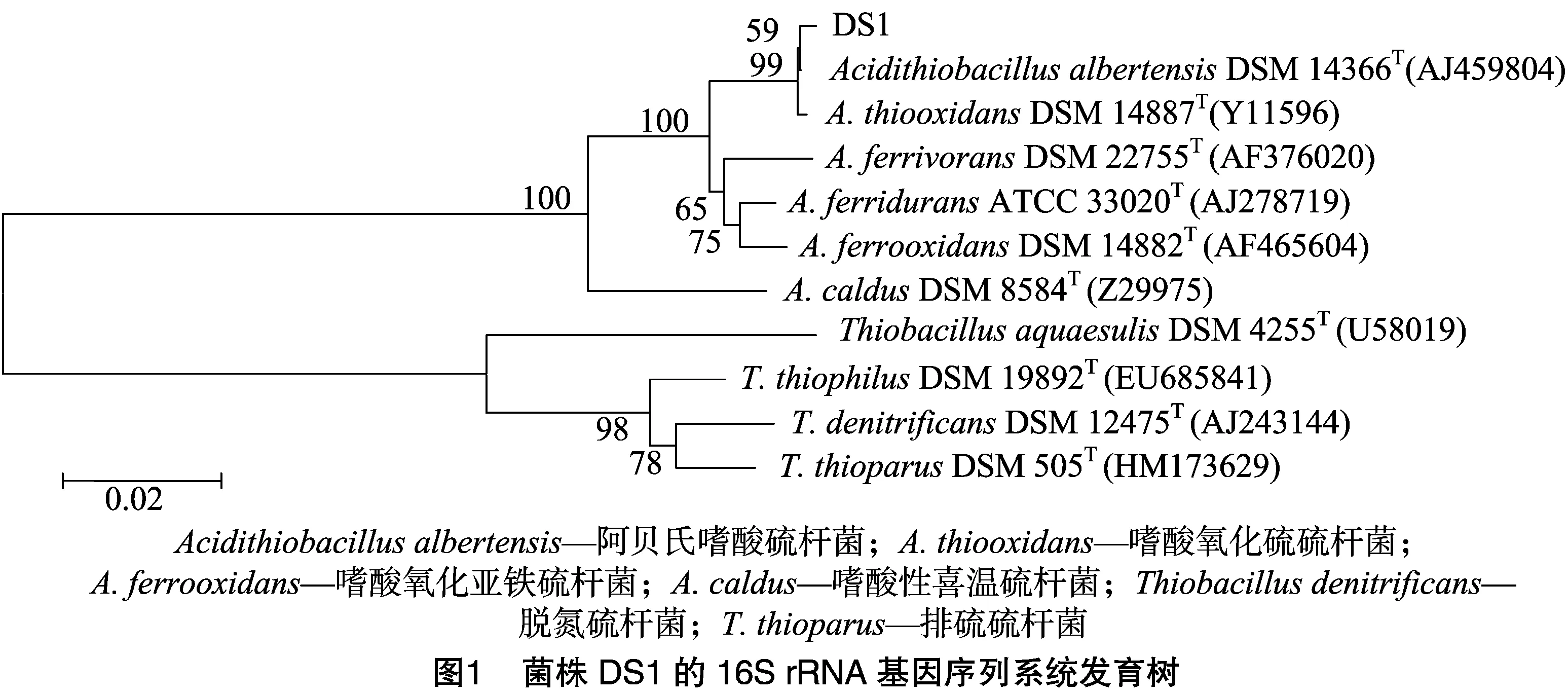
从土壤样品中分离筛选出1株高效脱硫菌株,革兰氏染色呈阴性,杆状菌,菌落透明,在Starky-Na2S2O3-琼脂培养基上形成云雾状氧化圈,能够在初始pH值为2.0的Waksman培养基中生长且最终pH值低于1.0。由图1可知,菌株DS1的16S rRNA基因序列与模式菌株AcidithiobacillusthiooxidansDSM 14887、A.albertensisDSM 14366的16S rRNA基因序列相似性最高,均为99%。因此,将菌株DS1命名为嗜酸氧化硫硫杆菌DS1(A.thiooxidansDS1)[12]。嗜酸氧化硫硫杆菌DS1的16S rRNA基因序列GenBank登录号为KX618878。
2.2 嗜酸氧化硫硫杆菌DS1的单质硫氧化曲线
由图2可知,在单质硫初始量为1%的Waksman培养基中接种嗜酸氧化硫硫杆菌DS1后,在0、2、4、6、8、10、12、14 d时,培养基中SO42-的平均浓度分别为448.4、3 656.9、13 326.7、14 820.8、15 327.1、20 237.8、21 926.4、22 125.1 mg/L,培养基的pH值平均值分别为 2.22、1.58、1.06、0.84、0.83、0.72、0.71、0.64,培养基的D600 nm平均值分别为0.008、0.022、0.135、0.136、0.189、0.194、0.147、0.120。而未接菌的培养基中SO42-浓度和pH值基本保持不变。嗜酸氧化硫硫杆菌DS1在2、4、6、8、10、12、14 d时的单质硫氧化率分别为10.70%、42.93%、47.91%、49.60%、65.96%、71.59%、72.26%。嗜酸氧化硫硫杆菌DS1在12 d时单质硫氧化率达到 71.59%,SO42-浓度为21 926.4 mg/L;之后增长缓慢,14 d时单质硫氧化率为72.26%,SO42-浓度为 22 125.1 mg/L。培养基的pH值由0 d时的2.22在14 d时降到 0.64。在硫氧化过程中,嗜酸氧化硫硫杆菌DS1的生长量在8、10 d时较高,其D600 nm分别为0.189、0.194。可见嗜酸氧化硫硫杆菌DS1的单个个体对单质硫具有高效的氧化能力。

2.3 单质硫不同初始量对嗜酸氧化硫硫杆菌DS1氧化单质硫效率的影响
由图3-a可知,在单质硫初始量为0.1%的Waksman培养基中接种嗜酸氧化硫硫杆菌DS1后,在0、2、4、6、8、10、12、14 d时,培养基中SO42-浓度的平均值分别为998.1、1 089.5、1 300.0、1 558.9、2 235.9、2 769.7、3 483.0、3 739.9 mg/L,培养基的pH值平均值分别为1.67、1.57、1.49、1.27、1.25、1.15、1.00、0.96。嗜酸氧化硫硫杆菌DS1在2、4、6、8、10、12、14 d时的单质硫氧化率分别为3.05%、10.06%、18.69%、41.26%、59.05%、82.83%、91.39%。
由图3-b可知,在单质硫初始量为2%的Waksman培养基中接种嗜酸氧化硫硫杆菌DS1后,在0、2、4、6、8、10、12、14 d 时,培养基中SO42-浓度的平均值分别为576.5、3 804.1、13 051.8、15 584.5、32 475.5、43 855.4、46 046.7、46 016.4 mg/L,培养基的pH值平均值分别为 1.71、1.02、0.57、0.54、0.30、0.21、0.15、0.15。嗜酸氧化硫硫杆菌DS1在2、4、6、8、10、12、14 d时的单质硫氧化率分别为5.38%、20.79%、25.01%、53.17%、72.13%、75.78%、75.73%。
由图3-c可知,在单质硫初始量为3%的Waksman培养基中接种嗜酸氧化硫硫杆菌DS1后,在0、2、4、6、8、10、12、14 d 时,培养基中SO42-浓度的平均值分别为762.4、3 148.1、11 701.3、25 446.7、30 593.1、41 523.6、49 677.2、52 815.4 mg/L,培养基的pH值平均值分别为 1.68、1.00、0.55、0.39、0.31、0.16、0.09、0.06。嗜酸氧化硫硫杆菌DS1在2、4、6、8、10、12、14 d时的单质硫氧化率分别为2.65%、12.15%、27.43%、33.15%、45.29%、54.35%、57.84%。
综合来看,14 d时嗜酸氧化硫硫杆菌DS1在单质硫初始量为0.1%条件下的单质硫氧化率为91.39%,在单质硫初始量为2%条件下的单质硫氧化率为75.73%,在单质硫初始量为3%条件下的单质硫氧化率为57.84%,嗜酸氧化硫硫杆菌DS1对单质硫的氧化率随着单质硫初始量的增加而降低。可见,嗜酸氧化硫硫杆菌DS1对低含量单质硫(单质硫初始量为0.1%)具有较高的单质硫氧化率,而对高含量单质硫(单质硫初始量为3%)也有不错的氧化效果,14 d时单质硫氧化率接近60%。同时,培养液的pH值在单质硫初始量为2%的条件下在14 d时下降至0.15,在单质硫初始量为3%的条件下在14 d时下降至0.06,说明嗜酸氧化硫硫杆菌DS1具有较强的产酸能力。
2.4 添加不同金属离子对嗜酸氧化硫硫杆菌DS1氧化单质硫效率的影响
由图4可知,分别向Waksman培养基中添加不同种类金属离子,培养7 d时测得添加Fe3+、Co2+、Cu2+、Ni2+、Zn2+、K+、Mg2+、Ca2+、Mn2+培养基中SO42-浓度的平均值分别为 18 272.7、2 150.8、18 470.7、17 406.8、17 307.8、15 817.9、15 061.0、15 273.2、15 602.9 mg/L,而未在培养基中添加金属离子的对照组试验中SO42-浓度为13 987.3 mg/L。由图5可知,添加Fe3+、Co2+、Cu2+、Ni2+、Zn2+、K+、Mg2+、Ca2+、Mn2+培养基中pH值平均值分别为0.42、1.17、0.39、0.42、0.43、0.44、0.44、0.46、0.44,而未向培养基中添加金属离子的对照组试验中培养基的pH值平均值为0.47。试验结果显示,除Co2+对嗜酸氧化硫硫杆菌DS1氧化单质硫具有明显的抑制作用外,Fe3+、Cu2+、Ni2+、Zn2+、K+、Mg2+、Ca2+、Mn2+均对嗜酸氧化硫硫杆菌DS1氧化单质硫有促进作用,其中,Cu2+、Fe3+的促进作用较强,Ni2+、Zn2+的促进作用次之,K+、Mg2+、Ca2+、Mn2+的促进作用相对较弱。可见嗜酸氧化硫硫杆菌DS1对金属离子具有较强的耐受能力。



3 讨论与结论
嗜酸氧化硫硫杆菌DS1具有高效的脱硫能力,单质硫初始量为0.1%,在14 d时其单质硫氧化率可达91.39%,对低含量单质硫氧化彻底;单质硫初始量为1%、2%,在14 d时其单质硫氧化率均高于70%,可见嗜酸氧化硫硫杆菌DS1能够在单质硫含量较广的范围内保持高效的氧化能力,并且在 14 d 时培养基中SO42-浓度分别高于22 000、46 000 mg/L;单质硫初始量为3%时其单质硫氧化率约为60%,培养基中SO42-浓度最终约为53 000 mg/L。培养液pH值的降低体现了脱硫微生物的产酸能力,同时也体现了菌株的脱硫能力。嗜酸氧化硫硫杆菌DS1具有较强的产酸能力,在单质硫初始量为2%、3%的条件下其培养液pH值在14 d时分别下降至0.15、0.06。在已报道的脱硫微生物中,嗜酸氧化硫硫杆菌CMTT-32在11 d时对单质硫的氧化率达65.6%,pH值降到0.8左右,20 d时培养液中SO42-浓度达到22 760 mg/L[7];嗜酸氧化硫硫杆菌JJU-1随着培养基中单质硫初始量的增加,其培养液的pH值下降速度变快,产酸效果较好,与菌株DS1的情况一致,但培养8 d后其培养液的pH值降到0.7左右[8];嗜酸氧化硫硫杆菌Tt-1在单质硫氧化过程中培养8 d后其培养液的pH值降到1.0左右[13];嗜酸氧化亚铁硫杆菌T1在氧化单质硫为硫酸根过程中,培养144 h后其培养基的pH值由初始的 2.42 最终降为1.66[14];与之相比,嗜酸氧化硫硫杆菌DS1具有更强的单质硫氧化和产酸能力。此外,嗜酸氧化硫硫杆菌DS1对金属离子的耐受性试验结果表明,其对Fe3+、Cu2+、Ni2+、Zn2+、K+、Mg2+、Ca2+、Mn2+等多种金属离子具有耐受能力,在生物冶金、污泥淋滤去除重金属等方面具有广阔的应用前景。
嗜酸氧化硫硫杆菌氧化单质硫生成硫酸根的过程为先由单质硫氧化生成亚硫酸根,再由亚硫酸根进一步氧化生成硫酸根,同嗜酸氧化亚铁硫杆菌氧化单质硫的过程相同[15]。而亚硫酸根离子作为单质硫氧化的中间代谢产物能够强烈抑制离子氧化酶的活性,不同的脱硫菌对亚硫酸根的敏感程度不同从而会影响其脱硫效率[16]。而且嗜酸氧化硫硫杆菌的不同菌株的基因组之间可能存在特异性以适应其生存的环境[17]。因此,对于具有强产酸能力的嗜酸氧化硫硫杆菌DS1,其基因组信息值得被挖掘。另外,虽然菌株DS1的产酸能力较强,但在Waksman培养基中的生长量偏低,须改善其生长条件提高其生长量。嗜酸氧化硫硫杆菌和嗜酸氧化亚铁硫杆菌均在生物脱硫、生物冶金、生物浸磷、污泥淋滤去除重金属等方面具有应用价值[18-22],因此,嗜酸氧化硫硫杆菌DS1与嗜酸氧化亚铁硫杆菌的混合使用具有研究价值。
[1]张东晨. 煤炭微生物脱硫技术的研究与发展[J]. 洁净煤技术,2005,11(2):50-54,65.
[2]杨 娟,谢翼飞,李旭东,等. 一株耐盐硫氧化细菌的分离鉴定及脱硫机理[J]. 应用与环境生物学报,2015,21(5):819-823.
[3]Rojas-Avelizapa N G,Gómez-Ramírez M,Hernández-Gama R,et al. Isolation and selection of sulfur-oxidizing bacteria for the treatment of sulfur-containing hazardous wastes[J]. Chemical & Biochemical Engineering Quarterly,2013,27(1):109-117.
[4]Li Q,Wang C,Li B,et al. Isolation ofThiobacillusspp. and its application in the removal of heavy metals from activated sludge[J]. African Journal of Biotechnology,2012,11(97):16336-16341.
[5]张 静,王 清,李晓茹,等. 利用硫氧化细菌改良盐碱土[J]. 吉林大学学报(地球科学版),2009,39(1):147-151.
[6]姚 维,杨爱江,郭贵香,等. 硫氧化细菌的分离及其对钼镍尾矿的脱硫作用实验研究[J]. 贵州大学学报(自然科学版),2014,31(5):115-118.
[7]胡 瑜,毕银丽,赵 斌. 硫杆菌的分离鉴定及其对煤矿废弃物的氧化脱硫特性[J]. 应用与环境生物学报,2007,13(1):116-120.
[8]杨期勇,邱秀文,程鹏飞,等. 嗜酸性氧化硫硫杆菌的分离鉴定及其产酸特性[J]. 生态环境学报,2015,24(8):1366-1374.
[9]吕早生,关海燕,李凌凌,等. 一株高浸磷嗜酸氧化硫硫杆菌的分离与鉴定[J]. 应用与环境生物学报,2011,17(3):326-329.
[10]王 锐,邱丽娜,关景洋,等. 一株嗜酸硫氧化细菌的分离鉴定及生长特性[J]. 环境科学学报,2010,30(3):485-489.
[11]黄峰源,王世梅,周立祥. 氧化硫硫杆菌TS6的生长条件及其对重金属耐受性研究[J]. 环境科学学报,2006,26(8):1290-1294.
[12]Kelly D P,Wood A P. Reclassification of some species ofThiobacillusto the newly designated generaAcidithiobacillusgen. nov.,Halothiobacillusgen.nov.andThermithiobacillusgen. nov [J]. International Journal of Systematic and Evolutionary Microbiology,2000,50(Pt 2):511-516.
[13]谭良良,张 军,陈 俊,等. 一株氧化硫硫杆菌的分离鉴定及其沥滤污泥研究[J]. 中国给水排水,2014,30(7):21-26.
[14]王雅琴,张翠茹,赵素合,等. 氧化亚铁硫杆菌的筛选、生长特性及其橡胶再生研究[J]. 环境工程学报,2010,4(3):683-688.
[15]Suzuki I,Chan C W,Takeuchi T L. Oxidation of elemental sulfur to sulfite byThiobacillusthiooxidanscells[J]. Applied and Environmental Microbiology,1992,58(11):3767-3769.
[16]Sugio T,Wakabayashi M,Kanao T,et al. Isolation and characterization ofAcidithiobacillusferrooxidansstrain D3-2 active in copper bioleaching from a copper mine in Chile[J]. Bioscience Biotechnology and Biochemistry,2008,72(4):998-1004.
[17]Travisany D,Cortés M P,Latorre M,et al. A new genome ofAcidithiobacillusthiooxidansprovides insights into adaptation to a bioleaching environment[J]. Research in Microbiology,2014,165(9):743-752.
[18]巩冠群,陶秀祥,张 兴,等. 氧化亚铁硫杆菌优化培养及脱硫的研究[J]. 中国矿业大学学报,2006,35(4):510-514.
[19]Mohseni S,Marzban A,Sepehr S A,et al. Investigation of some heavy metals toxicity for indigenousAcidithiobacillusferrooxidansisolated from Sarcheshmeh copper mine[J]. Jundishapur Journal of Microbiology,2011,4(3):159-166.
[20]龚文琪,陈 伟,张晓峥,等. 氧化亚铁硫杆菌的分离培养及其浸磷效果[J]. 过程工程学报,2007,7(3):584-588.
[21]唐朝军,董发勤,代群威,等. 嗜酸氧化硫硫杆菌对中低品位磷矿的浸磷效率研究[J]. 矿物学报,2011,31(2):280-283.
[22]任婉侠,李培军,何 娜,等. 土壤中嗜酸性氧化亚铁硫杆菌的分离鉴定及其性能研究[J]. 农业环境科学学报,2008,27(2):602-607.
