连续2代铜胁迫处理对海州香薷种子形态大小、萌发及幼苗生长的影响
2018-03-12梁慧娟李钧敏
梁慧娟, 闫 明, 李钧敏
(1.山西师范大学生命科学学院,山西临汾 041004; 2.浙江省植物进化生态学与保护重点实验室,浙江台州 318000; 3.台州学院生态研究所,浙江台州 318000)
目前,由于人类活动(如采矿等)所带来的土壤重金属污染已经成为全球环境污染治理的难题与焦点[1]。重金属铜(Cu)既是植物光合作用、电子呼吸传递、蛋白质代谢、抗氧化反应等代谢过程所必需的元素,同时过量的铜又对植物生长和发育具有强烈抑制作用[2]。因此,寻找铜耐受或超积累植物已成为铜污染区域的植被恢复或修复的主要途径之一[3]。
海州香薷(Elsholtziasplendens)为唇形科香薷属的一年生草本植物,别称“铜草”和“铜草花”,广泛分布于我国的长江中下游地区。近年来的研究证实,海州香薷对铜具有较高的耐性和较强的累积能力,其根部铜含量高,在铜矿区生长异常旺盛,是矿区的优势种之一,为铜矿的指示植物,是一种有潜力的修复植物[4-6]。当前较多研究集中在海州香薷对铜富集能力、光合作用、根系分泌物、铜结合蛋白质等一些生理生化机制上,对其后代适合度影响的研究较少,尤其是有关海州香薷的适应性进化几乎没有研究涉及。
种子作为植物的后代,其形态是植物在长期进化过程中对环境适应的结果[7],它与种子数量、扩散对策及幼苗竞争能力有密切关系,进而影响植物适合度的大小[8]。种子萌发是植物最早接受重金属胁迫的阶段,也是评价植物重金属耐性的重要指标。在植物生长过程中,早期的幼苗大小是植物生存适合度的最主要指标[9],反映了子代幼苗建群的能力[10]。有学者等采用溶液培养的方法,发现海州香薷种子的发芽率随着铜浓度的升高而先升后降,铜处理可以显著抑制海州香薷胚根与胚轴的生长。目前尚未见通过多代培养试验来分析铜胁迫对海州香薷后代适合度影响的相关报道。
本研究以经过连续2代重金属铜胁迫的海州香薷种群和对照(同步培养2代,未经过铜胁迫处理的海州香薷种群)种子为供试材料,分析铜胁迫对海州香薷后代种子大小、种子萌发率及幼苗生长的影响,以更深入地认识该植物响应铜胁迫的生长与发育规律。
1 材料与方法
1.1 试验材料
于2013年在湖北省红安县华河镇的几个自然村周围,在无Cu污染的背景下,随机采集相应的海州香薷种子。于2014年5月上旬对种子进行杀菌处理(0.5%次氯酸钠)后放入48孔穴盘中萌发,待植物幼苗长至6叶苗龄时,取相似大小的幼苗进行移栽,采用筐栽方法进行重金属驯化。培养基质由泥炭土、河沙、蛭石按 6 ∶3 ∶1的比例混合而成,基质均于121 ℃灭菌2 h。Cu处理为添加CuSO4(分析纯)溶液(0.16 mol/L)至终浓度达1 000 mg/kg的土壤;对照(CK)添加等体积的无菌水,作为不添加Cu处理。处理后将土壤放在大棚中平衡1周后移栽海州香薷,每筐栽种80株。每个处理6次重复。于同年12月底收获种子,备用。2015年5月开始参照2014年的方法对已收获的海州香薷种子进行第2次重金属驯化,于同年12月底收获二代试验种子,备用。
1.2 种子大小及形态分析
随机抽取2个处理二代海州香薷种子各1 000粒,用精确度为万分之一的天平称其千粒质量,每筐种子重复3次。再随机选取10粒种子,均匀撒在Epson扫描仪的玻璃板上,扫描获得图像后,用SmartGrain软件直接分析种子的形态指标,获得种子表面积、周长、长度、宽度和长宽比。
1.3 种子萌发试验
随机抽取2个处理的二代海州香薷种子,用0.3%次氯酸钠表面消毒20 min,用蒸馏水冲洗干净后,置于恒温光照培养箱中萌发(25 ℃、16 h光照+20 ℃、8 h黑暗),用不同Cu2+浓度(0、5、20、100、250、500、1 000、2 000 μmol/L)溶液(主要成分为CuSO4·5H2O)处理9d。每个培养皿放置25粒种子,共3个重复。将处理后的种子以5×5的方阵形式整齐摆放在铺有双层滤纸的90 mm培养皿中,并添加等量的不同浓度的铜溶液,使滤纸完全湿润,置于恒温光照培养箱中萌发,于每天的固定时间统计种子发芽数,当胚根长度大于2 mm时计为萌发,并用移液枪统一补充适量铜溶液。在第3天统计发芽势,在第8天统计发芽率。
1.4 幼苗生长指标测定
在第9天,用电子游标卡尺和电子天平测量幼苗的胚轴长度、胚根长度、胚轴鲜质量和胚根鲜质量,并分别按以下公式计算发芽率、发芽势、发芽指数和活力指数等指标[11]:
发芽率(Gr)=(∑Gt/N)×100%;
发芽势(Ge)=3 d内发芽种子数/N;
发芽指数(Gi)=(∑Gt/Dt);
活力指数(Vi)=Gi×S。
式中:Gt为在t天的发芽数,粒;Dt为相应的发芽时间,d;N为种子总数,粒;S为幼苗长度,mm。
1.5 数据分析
采用Excel 2010、SPSS 17.0对数据进行统计分析,采用独立样本t检验比较种群间各项指标平均数间差异的显著性(α=0.05),采用Origin 8.5软件辅助作图。
2 结果与分析
2.1 铜胁迫对海州香薷种子形态及大小的影响
由表1可以看出,与对照相比,铜胁迫处理2代后海州香薷种子表面积、周长、长度和宽度均显著低于对照种群,但种子长宽比与种子千粒质量没有明显变化。
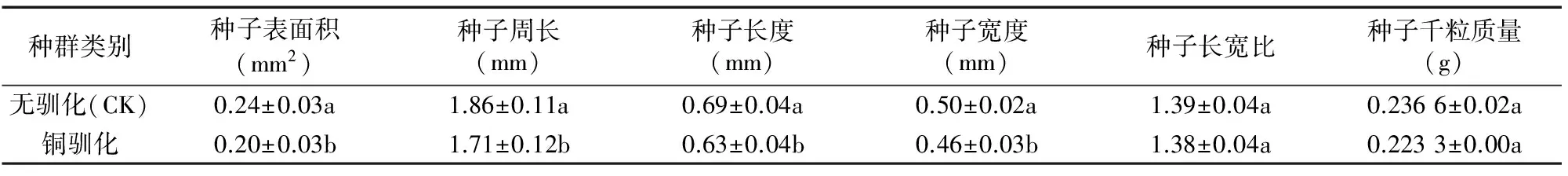
表1 铜驯化种群与无驯化种群海州香薷种子形态指标及千粒质量
注:表中数据格式为“平均值±SD”。同列数据后标有不同小写字母者表示处理间存在显著性差异(P<0.05)。
2.2 铜处理对不同种群海州香薷种子萌发的影响
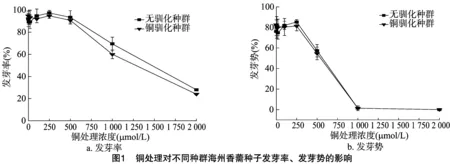
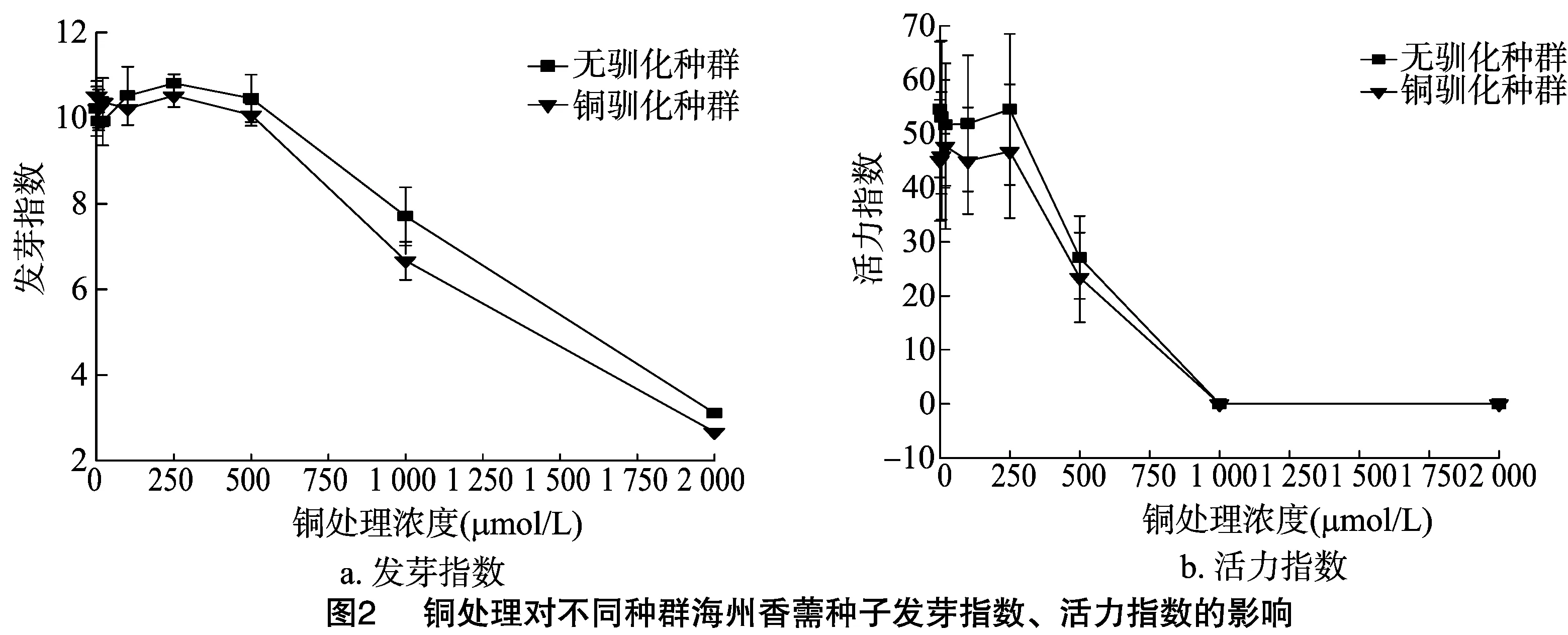
由图1、图2可见,随着铜浓度增加,2个种群的海州香薷种子发芽率、发芽势、发芽指数、活力指数大致呈先升高后降低的趋势,表明高浓度的铜处理可以显著抑制海州香薷种子的萌发。不管是在哪个铜浓度下,2个海州香薷种群的种子发芽率、发芽指数和第3天的发芽势均不存在显著差异,但铜胁迫处理种群的种子活力指数始终明显低于对照种群。
2.3 铜处理对不同种群海州香薷幼苗生长的影响
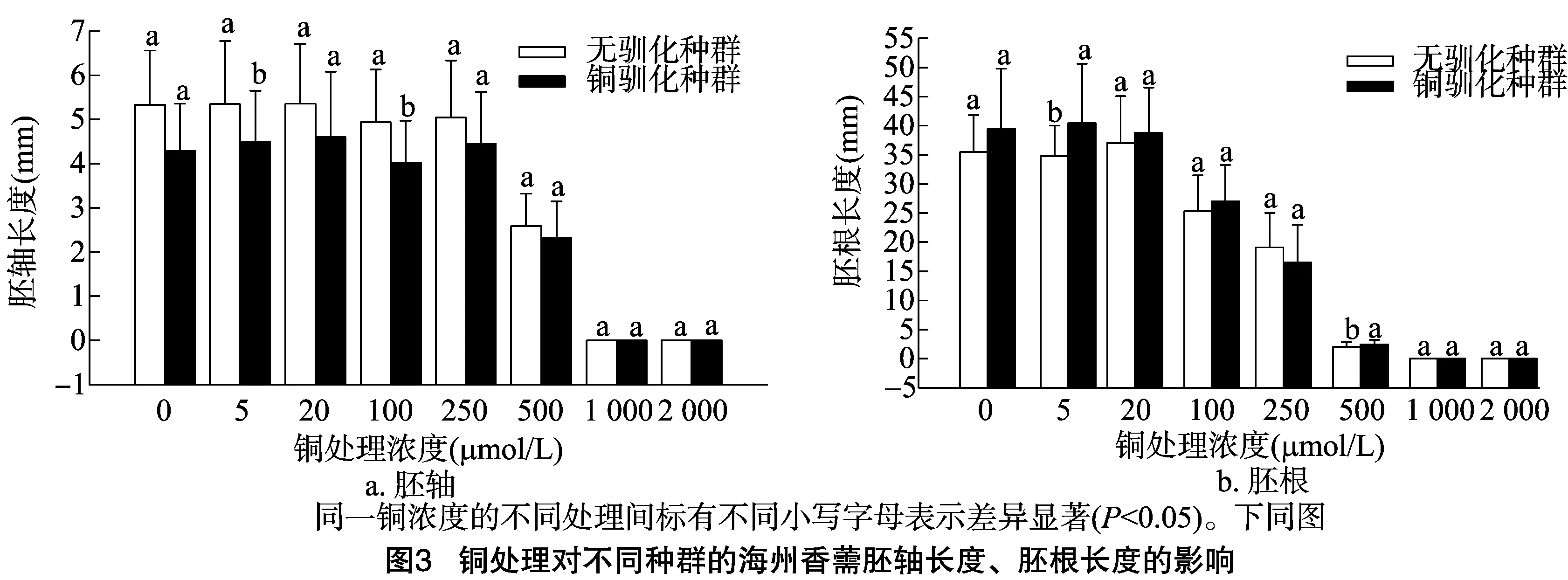
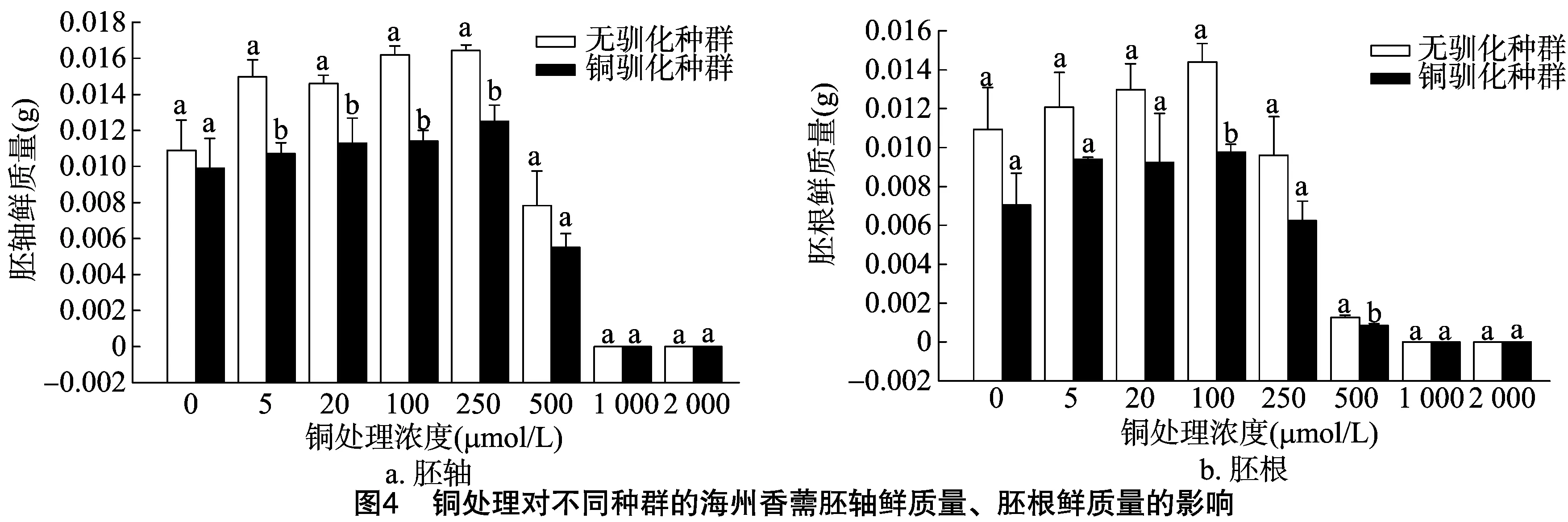
由图3、图4可以看出,随着铜浓度的增加,海州香薷幼苗胚根和胚轴长度、鲜质量先逐渐升高再逐渐降低,表明高浓度的铜处理可以显著抑制海州香薷的幼苗生长。当铜浓度为5、100 μmol/L时, 铜胁迫处理种群的胚轴长度显著低于对照种群;但胚根长度在铜浓度为5、500 μmol/L时显著高于对照种群。在铜浓度为5、20、100、250 μmol/L时,铜胁迫处理种群的胚轴鲜质量要显著低于对照种群,而在铜浓度为100、500 μmol/L时的胚根鲜质量也显著低于对照种群。
3 讨论
种子萌发是健全的种子在充足的水分、适宜的温度和足够的氧气等适宜条件下,能够发芽并长成正常植株的能力。发芽率和发芽势能较好地反映种子萌发的速度、整齐性,发芽指数、活力指数是种子萌发的综合指标,能更全面地反映种子萌发期耐受重金属的能力[11]。植物幼苗生长快慢可以反映植物生长形态的特征,也可以反映植物后期的生长状况[12]。重金属对种子萌发的影响存在低浓度下的刺激效应和高浓度下的抑制作用[13]。本研究发现,不管是铜胁迫处理过的海州香薷种群的种子还是对照种群的种子,其发芽率、发芽势、发芽指数、活力指数、胚根和胚轴长度及鲜质量在响应不同浓度铜处理时均存在“低促高抑”的现象。过量的铜会对植物产生毒害,可降低植株的存活率、降低生物量、延迟开花和果实成熟时间以及籽粒的发育等[3]。鱼小军等发现,随着铜浓度的增大,显著抑制了7种豆科牧草种子的发芽及幼苗生长[14]。王丹等也证实,高含量铜对小白菜种子萌发、幼苗生长产生显著抑制作用[15]。本研究发现,1 000 mg/kg铜胁迫处理2代的海州香薷种群的种子表面积、周长、长度和宽度均显著低于对照种群;不管是在哪个铜浓度下,铜胁迫处理种群的种子活力指数始终明显低于对照种群;在铜浓度为5、100 μmol/L 时,铜胁迫处理种群后代的胚轴长度显著低于对照种群;在铜浓度为5、20、100、250 μmol/L时,铜胁迫处理种群后代的胚轴鲜质量要显著低于对照种群;在铜浓度为100、500 μmol/L时,铜胁迫处理种群后代的胚根鲜质量显著低于对照种群。这些结果表明,1 000 mg/kg重金属铜连续处理2代可显著抑制海州香薷种子的发育、种子萌发及幼苗生长。李月灵研究也发现,铜处理可以推迟海州香薷的始花期、开花高峰期、终花期,缩短花期持续时间,使植物花序宽、花序生物量、种子总数量、总质量显著下降[3],从而降低了海州香薷后代的适合度。
重金属会对生物产生的一定的影响,而生活在重金属环境中的生物也会对重金属产生一定的适应性[16]。驯化在动物与微生物研究中应用较多。近年来的研究发现,植物会在长期进化中演变出耐受重金属的多种响应机制[17]。重金属处理可以显著降低种子千粒质量[3]。本研究发现,铜胁迫连续处理2代的海州香薷种群的千粒质量与对照种群相似,表明铜胁迫处理2代后,海州香薷种子的成分组成可能发生了适应性改变,虽然表面积变小,但质量变化不大。本研究还发现,在铜浓度为5、500 μmol/L时,铜胁迫处理2年的海州香薷种群幼苗的胚根长度显著高于对照种群,表明铜胁迫处理2代后,海州香薷幼苗会提高胚根长度以增强幼苗对外界养分的捕获能力,从而减缓铜胁迫对后代生长的抑制作用[3]。后续研究将继续增加培养代数,以进一步确认海州香薷对铜胁迫的快速适应性进化发生的可能性及机制。
[1]Li J M,Jin Z X,Gu Q P. Effect of plant species on the function and structure of the bacterial community in the rhizosphere of lead-zinc mine tailings in Zhejiang,China[J]. Canadian Journal of Microbiology,2011,57(7):569-577.
[2]Kamali M,Pour M S,Moud A A M. Copper effects on growth parameters of hollyhock (AlthaearoseaL.)[J]. Journal of Ornamental and Horticultural Plants,2012,2(2):95-101.
[3]李月灵. 接种丛枝菌根真菌对海州香薷耐受铜胁迫的影响及机制[D]. 上海:上海师范大学,2014:59-73.
[4]柯文山,席红安,杨 毅,等. 大冶铜绿山矿区海州香薷(Elsholtziahaichowensis)植物地球化学特征分析[J]. 生态学报,2001,21(6):907-912.
[5]柯文山,熊治廷,金则新,等. 海州香薷(ElsholtziahaichouensisSun)不同生态型Cu吸收和酸性磷酸酶活性差异[J]. 生态学报,2007,27(8):3172-3181.
[6]Ke W S,Xiong Z T,Chen S J,et al. Differences of Cu accumulation and Cu-induced ATPase activity in roots of two populations ofElsholtziahachowensisSun[J]. Environmental Toxicity,2008,23(2):193-199.
[7]周 旋,何正飚,康宏樟,等. 温带-亚热带栓皮栎种子形态的变异及其与环境因子的关系[J]. 植物生态学报,2013,37(6):481-491.
[8]王桔红,杜国祯,崔现亮,等. 青藏高原东缘61种常见木本植物种子萌发特性及其与生活史的关联[J]. 植物生态学报,2009,33(1):171-179.
[9]武高林,杜国祯. 植物种子大小与幼苗生长策略研究进展[J]. 应用生态学报,2008,19(1):191-197.
[10]张丽坤,王 朔,冯玉龙. 紫茎泽兰种子形态特征和萌发特性与其入侵性的关系[J]. 生态学报,2014,34(13):3584-3591.
[11]陈俊任,柳 丹,吴家森,等. 重金属胁迫对毛竹种子萌发及其富集效应的影响[J]. 生态学报,2014,34(22):6501-6509.
[12]张凡凡,于 磊,鲁为华,等. 不同驯化年限野生线叶野豌豆种子特性及幼苗耐寒性[J]. 草业科学,2013,30(11):1771-1777.
[13]陈 伟,张苗苗,宋阳阳,等. 重金属胁迫对4种草坪草种子萌发的影响[J]. 草地学报,2013,21(3):556-563.
[14]鱼小军,张建文,潘涛涛,等. 铜、镉、铅对7种豆科牧草种子萌发和幼苗生长的影响[J]. 草地学报,2015,23(4):793-803.
[15]王 丹,魏 威,王松山,等. 铜、铬单一及复合污染对小白菜种子萌发及根长的生态毒性[J]. 西北农林科技大学学报(自然科学版),2010,38(12):63-68,74.
[16]徐 池. 重金属Cu对蚯蚓的驯化研究[D]. 南京:南京农业大学,2012:38-46.
[17]李 洋,于丽杰,金晓霞. 植物重金属胁迫耐受机制[J]. 中国生物工程杂志,2015,35(9):94-104.
