薰衣草精油与总黄酮的超声波辅助综合提取
2018-03-12邵江娟张佳辉章文明
吴 昊, 邵江娟, 张佳辉, 章文明, 姜 岷
(1.南京工业大学/国家级江苏先进生物与化学制造协同创新中心,江苏南京 211816; 2.南京中医药大学,江苏南京 210023)
薰衣草(Lavandulaspp.)为唇形科(Labiatae)一年生或多年生植物,同时具备香料植物与药用植物2种属性。薰衣草所含香气成分是天然香精与香料的主要构成部分,从中提取出的薰衣草精油具有促进血液循环、提升机体活力和免疫力、缓解焦虑及神经性偏头痛、松弛消化道痉挛、消除肠胃胀气等众多益处[1],被称为“精油之母”,已广泛应用于日化产品、保健品、食物加工及医药等领域[2]。薰衣草自20世纪60年代开始被引进到我国新疆地区,目前,新疆地区薰衣草的种植面积占全国种植面积的95%左右[3],薰衣草精油的年产量大于100 t。黄酮类化合物是天然产物中的主要有效成分,具有抗炎、抗氧化、抗肿瘤、保护心血管等多种生物活性[4],研究表明,薰衣草黄酮具有较强的抗氧化和清除自由基的作用[5-6]。目前,国内对薰衣草原料的利用率极低,主要提取其中的挥发性精油,出油率仅为干花质量的1.5%左右[7],提取后的薰衣草残渣往往被作为废弃物,既严重浪费了资源,又大大增加了薰衣草产品的生产成本。虽然提取薰衣草黄酮已有报道[5-6,8-9],但均直接以薰衣草花为原料进行单一提取,经济性不高。因此,亟需对薰衣草开展深加工研究,进一步提高其附加值。
从植物中提取有效成分的主要手段是基于组分在固液两相之间质量传递的固液浸提,但无论是溶剂进入物料内部,还是物料内可溶性成分转移进入溶剂,均受物料的细胞组织结构的显著影响[10],形成严重的传质阻力,因此造成固液浸提效率低下。超声波具有机械效应、空化效应及热效应,而且还可以产生乳化、击碎、扩散、化学效应等一系列次级效应[11],这些效应增大了介质分子的运动速度,同时也提高了介质的穿透能力,从而促进有效成分的溶解及扩散,缩短提取时间,有利于提高有效成分的提取率。本试验首先将薰衣草干花浸于水中,采用超声波-水蒸气蒸馏法提取出挥发性的薰衣草精油,分离出精油提取后的残渣,以乙醇溶液为提取溶剂,采用超声波辅助浸提薰衣草总黄酮,通过探讨薰衣草精油与总黄酮综合提取的可行性,为薰衣草的深加工提供技术支持。
1 材料与方法
1.1 试验材料
1.1.1 试验材料 薰衣草干花(产地为新疆霍城县农四师65团,2015年收割,自然晾干),预先将干花粉碎,过80目备用。所用试剂为分析纯或色谱纯,试验用水为超纯水。
1.1.2 试验装置与仪器 电热植物蒸馏浸提装置(自制,含冷凝收集器),超声波萃取仪(KQ-600V,超声频率40 Hz,功率600 W,购自江苏省昆山市超声仪器有限公司),真空干燥箱(DZF-6050,购自上海博迅医疗生物仪器股份有限公司),电子分析天平[BS124S,购自赛多利斯科学仪器(北京)有限公司], 旋转蒸发器(RE52A,购自上海亚荣生化仪器厂), 紫外分光光度计[UV2800,购自优尼柯(上海)仪器有限公司],气相色谱仪(GC2800,购自上海伍丰科学仪器有限公司),FID(flame ionization detector,简称FID)检测器(购自上海伍丰科学仪器有限公司),PEG毛细管色谱柱(DB-WAX,30 m×0.25 mm×0.25 μm,购自美国安捷伦科技有限公司)。
1.2 试验方法
1.2.1 薰衣草精油的提取 采用单因素试验,分别考察料液比、超声温度、超声时间、蒸馏时间、浸泡时间及无机盐对精油提取率的影响。称取100 g薰衣草干花粉末,加入2 000 mL蒸馏浸提装置中,加入相应的去离子水浸泡2 h,随后进行超声处理,之后进行水汽蒸馏提取,从料液开始沸腾时计时,通过蛇形冷凝管将馏出的气体冷却液化,待蒸馏结束后,将馏出液静置1 h后分层。收集上层油相,用无水硫酸钠脱水干燥后得到薰衣草精油,称质量后计算精油提取率,公式如下:

(1)
1.2.2 薰衣草总黄酮的提取 将精油提取后的固液混合物立即过滤分离,并用去离子水洗涤残渣3次,获得的薰衣草残渣在80 ℃下干燥至恒质量。配制乙醇溶液,从薰衣草残渣中提取薰衣草总黄酮,经预试验确定以乙醇体积分数、料液比、超声时间、超声温度为考察因素,进行因素水平正交设计(表1),以总黄酮提取率为评价指标,确定薰衣草残渣中总黄酮的最佳提取工艺条件。每次向试验装置中加入10 g薰衣草残渣(按照其含水量折算出的绝对干质量),在一定温度下用乙醇溶液预先浸泡1 h,然后在同样的温度下进行超声辅助提取。

表1 正交试验的因素水平
提取结束后立即过滤,并用相同的乙醇溶液洗涤残渣,合并滤液将体积回复到加入时的体积,即为总黄酮提取液,用旋转蒸发仪在60 ℃下挥干溶剂,经真空干燥后获得浸膏粉,检测其中的总黄酮含量,并计算出总黄酮提取率,公式如下:

(2)
1.3 检测方法
1.3.1 薰衣草精油主要特征组分含量的检测 薰衣草精油主要有效成分为芳樟醇、乙酸芳樟酯、乙酸薰衣草酯、樟脑[12]。根据GB 1886.38—2015《食品安全国家标准 食品添加剂 薰衣草油》指定的检测条件与步骤[13],采用气相色谱面积归一化法,检测以上4种特征组分的含量。
1.3.2 薰衣草总黄酮的检测 利用NaNO2-Al(NO3)3-NaOH显色法检测总黄酮,以芸香苷标准液作为对照品。移取0、1、2、3、4、5 mL 0.200 mg/mL芸香苷标准液(用体积分数为60%的乙醇溶液溶解并定容)分别置于6支25 mL比色管中,按文献[14]的方法进行检测,以未添加芸香苷标准液的空白样作对照,检测510 nm波长处的吸光度。以吸光度(D)为横坐标,相应的芸香苷质量(M)为纵坐标绘制标准曲线,其回归方程为M=1.813 66D-0.003 89,r2=0.995 9,线性范围为0~1.00 mg,用于表征总黄酮质量。将50 mg待测浸膏样品用60%乙醇溶液溶解并定容至50 mL,取1 mL溶解液加入 25 mL 比色管中进行检测,根据回归方程计算出对应的总黄酮质量,进而换算出样品中的总黄酮含量。
2 结果与分析
2.1 超声波辅助水蒸气蒸馏提取薰衣草精油
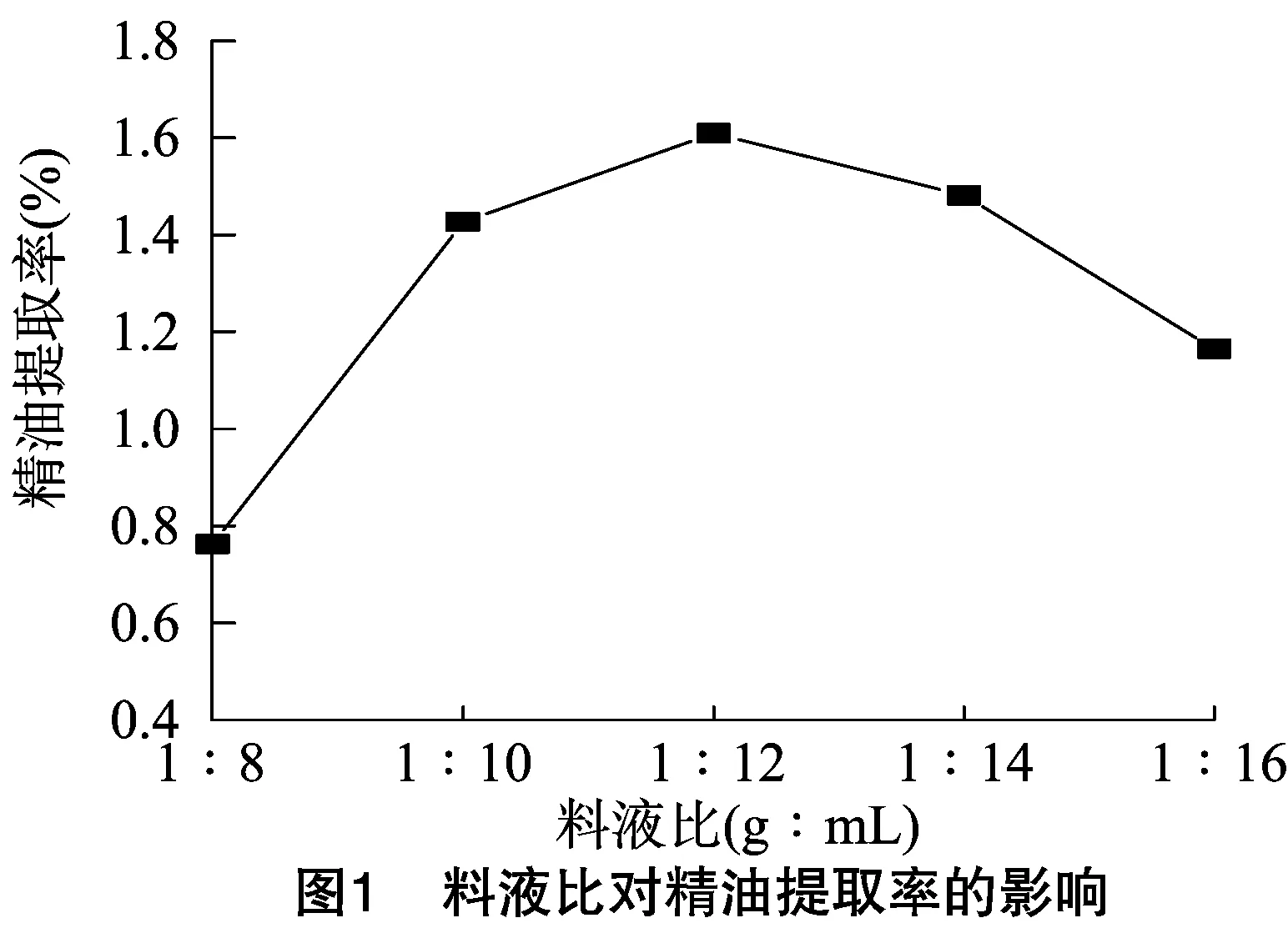
2.1.1 料液比对精油提取率的影响 在不超声处理的情况下,在1 ∶8~1 ∶16(g ∶mL)范围内考察料液比对薰衣草精油提取率的影响,蒸馏时间为2 h。料液比直接影响精油提取率,若物料含量过高,精油在水中的扩散过程会受到较大的传质阻力;若液体比例过高,精油在水中的溶解量会随之增大,也会影响提取率。由图1可知,随着液体含量的增高,精油提取率呈现增大趋势,当料液比为1 g ∶12 mL时,精油提取率达到最大值,为1.61%,之后则明显呈下降趋势。因此,精油提取的最适料液比为1 g ∶12 mL。
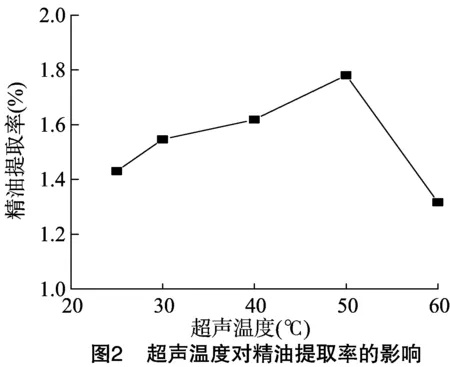
2.1.2 超声温度对精油提取率的影响 料液比为 1 g ∶12 mL,超声时间为30 min,在25~60 ℃范围内考察超声温度对精油提取率的影响,蒸馏时间为2 h。由图2可知,随着超声温度的上升,精油提取率呈现递增的趋势,当超声温度达到50 ℃时,精油提取率达到最高值,为1.781%,但当超声温度继续升高时,精油提取率明显下降。由于超声温度直接影响超声的空化作用,超声温度升高对空化作用有利,有利于提高精油提取率,但是超声温度过高时,气泡中蒸气压增大,气泡闭合时促进了缓冲作用,使空化作用减弱[15],反而不利于提取。因此,超声温度的最适温度为50 ℃。
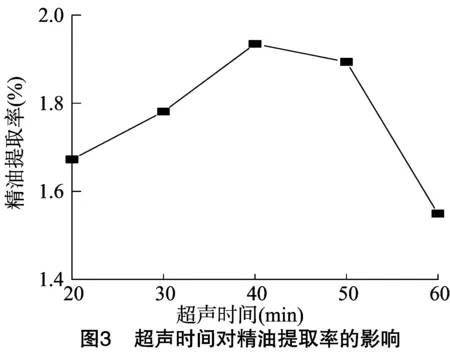
2.1.3 超声时间对精油提取率的影响 在超声温度优化的基础上,考察超声时间(20~60 min)对精油提取率的影响,蒸馏时间为2 h。超声利用机械效应、热效应及空化效应,可以在一定程度上加快分子间的扩散、溶解,但超声时间过短起不到明显的作用,而超声时间过长则可能会破坏薰衣草精油中的挥发性成分,反而使提取率降低。由图3可知,超声时间对薰衣草精油的提取率有较大影响。当超声时间为40 min时,薰衣草精油的提取率达到最大值,为1.935%。因此,选择精油提取的超声时间为40 min。
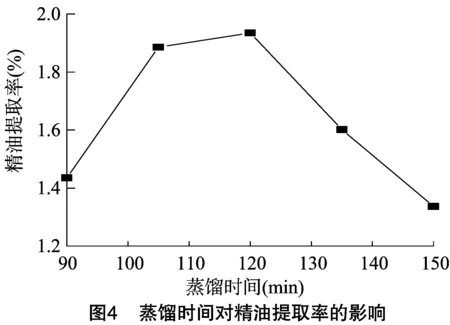
2.1.4 蒸馏时间对精油提取率的影响 在此前超声处理参数优化的基础上,考察蒸馏时间对精油提取率的影响。由图4可知,随着蒸馏时间的不断延长,精油提取率先呈明显的递增趋势,当蒸馏时间达到120 min时,提取率为1.94%,继续增加蒸馏时间,精油提取率呈递减趋势。这是由于液体处于沸腾状态时,操作时间过长会引起精油中一些热敏性化合物的分解及精油在水中的溶解度增加[16]。因此,选择最适的蒸馏时间为120 min,即2 h。
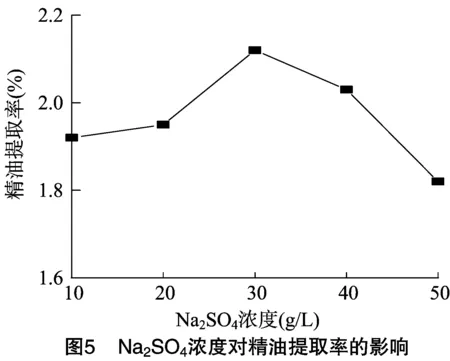
2.1.5 无机盐对精油提取率的影响 添加无机盐会影响精油的提取率,溶解在混合液中的无机盐可以通过其在液相发生缔合作用来改变汽液平衡,盐效应能使体系的蒸汽压下降[17],由于无机盐在水中与精油中的溶解度存在较大的差异,精油对水的相对挥发度增高。因此,在同等温度下,加入某些无机盐有可能会明显提高出油率,本试验考察4种常见无机盐(均配制成30 g/L无机盐溶液)对精油提取率的影响。文献[18]报道,提取薰衣草精油过程中,加入MgSO4的盐效应最明显。由表2可知,只有Na2SO4、KCl可以提高精油提取率,其中加入Na2SO4时精油的提取率达到2.09%,比未添加时提高8.85%。因此,选择添加Na2SO4最为适宜。在此基础上考察Na2SO4的浓度对精油提取率的影响。由图5可知,当Na2SO4的浓度大于30 g/L时,精油的提取率明显降低。因此,添加Na2SO4的最适浓度为30 g/L。

表2 盐效应对精油提取率的影响
最终确定超声辅助水蒸气提取薰衣草精油的工艺:以 30 g/L Na2SO4水溶液为提取剂,料液比为1 g ∶12 mL,在 50 ℃ 下浸泡2 h,在该温度下超声处理40 min,随后蒸馏2 h(以沸腾后计时)。在此条件下重复试验3次,薰衣草精油的提取率为2.05%~2.16%,均大于2.00%,与直接水蒸气蒸馏相比,提取率约增加25%。
2.2 不同提取方式对薰衣草精油主要成分含量的影响
对不同提取方式获得的薰衣草精油中的主要成分含量进行检测。由表3可知,采用以上提取方式获得的薰衣草精油中4种主要成分的含量均符合GB 1886.38—2015的规定[13]。值得注意的是,采用超声辅助处理后,其中乙酸芳樟酯的含量明显降低,而芳樟醇的含量有所增加,推测在较高温度下,超声波处理可能会使部分乙酸芳樟酯发生水解,由此可见须要严格控制超声处理的时间与温度。
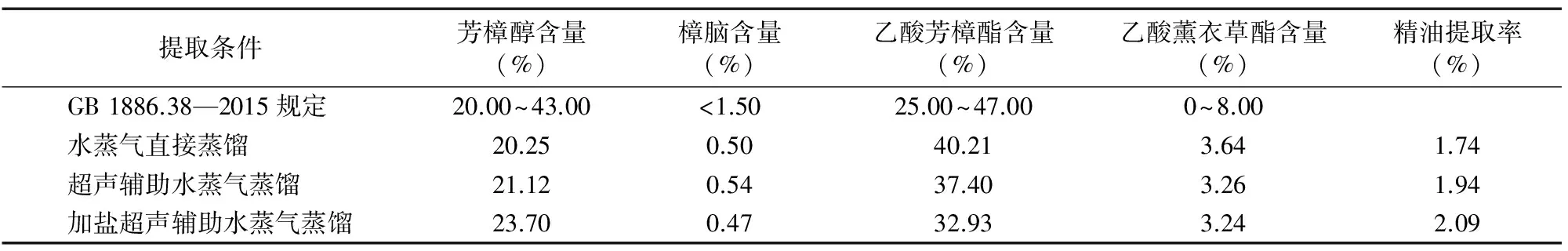
表3 不同提取方式下的薰衣草精油主要成分比较
2.3 超声波辅助浸提薰衣草残渣中的总黄酮
总黄酮提取的正交试验结果如表4所示,由极差分析结果可知,各因素对薰衣草残渣中总黄酮提取率的影响表现为料液比>超声时间>超声温度>乙醇体积分数。优化的工艺组合为A1B3C2D1,即乙醇溶液的体积分数为50%、料液比为 1 g ∶25 mL、超声温度60 ℃、超声时间30 min。在此条件下进行3次重复验证试验,残渣超声辅助浸提的平均浸膏得率为 18.1%,浸膏中的平均总黄酮含量为48.2%,残渣中的总黄酮平均提取率为8.73%,浸膏粉呈黄绿色。为了进一步提高总黄酮的提取率,以优化后的条件对同一残渣连续提取4次,由表5可知,对残渣提取2次即可提取出绝大部分黄酮,继续增加提取次数,浸膏中总黄酮的含量明显降低,说明杂质大量溶出。从后期纯化考虑,提取2次即可,最终薰衣草残渣的总黄酮提取率为11.81%,浸膏中总黄酮的含量为 44.94%,有利于后期纯化处理。
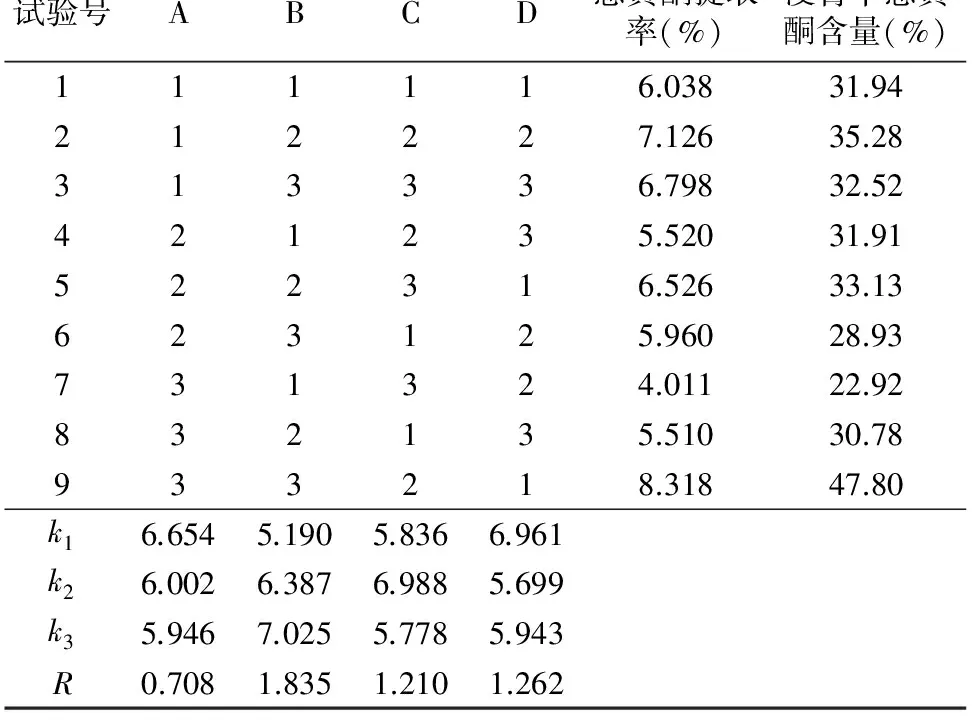
表4 总黄酮提取正交试验结果
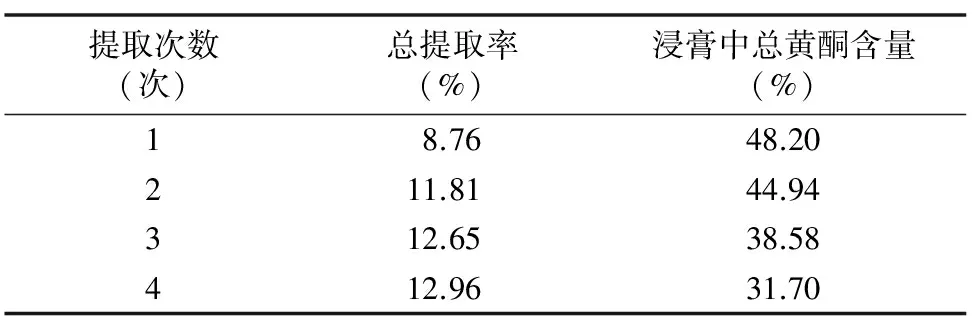
表5 提取次数对总黄酮提取率的影响
3 讨论与结论
本研究采用超声波辅助的手段对薰衣草中的挥发油和黄酮类化合物这2类活性成分进行综合提取。结果显示,超声波辅助水蒸气蒸馏法可明显提高薰衣草精油的提取率,优化后的提取工艺为以30 g/L Na2SO4水溶液为提取剂,料液比为1 g ∶12 mL,50 ℃下浸泡2 h,随后在此温度下超声处理 40 min,蒸馏2 h。在此条件下,薰衣草精油的提取率大于 2.00%,精油中有效组分含量符合GB 1886.38—2015的规定。对提取后的薰衣草残渣采用乙醇溶液超声波辅助提取薰衣草总黄酮,经正交设计优化,提取条件为乙醇体积分数为50%,料液比为1 g ∶25 mL,60 ℃下浸泡1 h,相同温度下超声时间为30 min。经过2次提取处理,残渣的总黄酮提取率达 11.81%,浸膏中总黄酮的含量为44.94%。由此可知,薰衣草可以通过超声波辅助分步提取的方式,同时获得薰衣草精油与总黄酮,该综合提取方法提高了原料的利用率,有利于降低制备成本,可为薰衣草产品的深度开发提供依据。
[1]徐 攀,王克柱,卢 聪,等. 薰衣草对神经系统药理作用的研究进展[J]. 现代药物与临床,2015,30(10):1298-1302.
[2]Lis-Balchin M. Lavender:the genus lavandula[M]. London and New York:Taylor and Francis Inc.,2002:57-262.
[3]李 敏,王自健,路 喆,等. 不同产地薰衣草H-701精油理化性质比较[J]. 江苏农业科学,2015,43(2):303-306.
[4]李 楠,刘 元,侯滨滨. 黄酮类化合物的功能特性[J]. 食品研究与开发,2005,26(6):139-141.
[5]杨 洁,高峰林. 新疆狭叶薰衣草总黄酮抗氧化活性的研究[J]. 中国食品添加剂,2010(2):162-165.
[6]李紫薇,刘 伟,张 艺. 等薰衣草总黄酮的微波提取及其抗氧化性研究[J]. 食品工业科技,2013,34(5):255-258.
[7]胡星麟. 薰衣草精油品质评价及杂花薰衣草精油蒸馏残渣化学成分的研究[D]. 南京:南京师范大学,2014.
[8]李紫薇,贾风勤,居尔艾特提·拜克,等. 超声波辅助提取狭叶薰衣草总黄酮的研究[J]. 伊犁师范学院学报(自然科学版),2012(3):53-56.
[9]赵 军,谭 为,徐 芳,等. 大孔树脂纯化薰衣草总黄酮的工艺[J]. 食品研究与开发,2012,33(12):42-45.
[10]张志健. 超声辅助浸提机理与影响因素分析[J]. 食品工业科技,2010,31(4):399-401,398.
[11]张素萍. 超声频率对中药有效成分提取的影响[J]. 广州化工,2014,43(2):13-14,24.
[12]胡喜兰,赵 宏,刘玉芬,等. 用GC-MS方法分析薰衣草的化学成分[J]. 食品科学,2005,26(9):432-434.
[13]中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准 食品添加剂 薰衣草油:GB 1886.38—2015[S]. 北京:中国标准出版社,2015.
[14]李紫薇,欧阳艳,腊 萍,等. 大孔吸附树脂分离纯化薰衣草总黄酮[J]. 食品工业科技,2012,33(17):245-247,251.
[15]陈 辉,强颖怀,葛长路. 超声波空化及其应用[J]. 新技术新工艺,2005(7):63-65.
[16]张秋霞,陈计峦,江 英. 薰衣草精油的提取工艺研究[J]. 食品科技,2007,32(5):123-125.
[17]陈 迅,陆筱艾,刘向程,等. 盐析效应在水蒸气提取植物精油中作用分析[J]. 广州化工,2015,43(6):112-113,175.
[18]李双明,顾雅玲,解 晓,等. 超声强化水蒸气蒸馏法提取薰衣草精油[J]. 食品工业,2013(2):41-44.
