HPLC-TOF/MS法检测黄曲霉毒素及霉菌指纹谱图的建立
2018-03-12李志贤郭礼强孙清荣
李志贤, 郭礼强, 孙清荣, 李 楠
(1.山东科技职业学院,山东潍坊 261053; 2.潍坊出入境检验检疫局,山东潍坊 261041)
霉菌的鉴定和分类在传统上以形态和培养特征为主要依据,但霉菌的形态特征复杂,其形态研究也因没有标准、共同的表述及具有较大的人为主观性而经常受到质疑[1]。分子生物学是解决以上问题的有效途径之一,然而许多分子技术手段仍处于研究阶段,只能部分取代常规的霉菌鉴定方法,作为用于形态学鉴定的一个有力补充,此外利用分子生物学手段进行真菌的分类和鉴别在时间和金钱方面花费较多,这是其最大短板。次生代谢产物是在霉菌正常生长受抑制时才会大量产生的,由于霉菌代谢产物有一定的特异性[2],通过其代谢产物,可以对其进行一定的划分,作为形态学和分子生物学分类的补充。
霉菌的存在是产生霉菌毒素的先决条件,但有霉菌污染并不一定会带来霉菌毒素污染,二者存在紧密且必然的联系,比如黄曲霉有产霉毒素的菌株和不产霉毒素的菌株,不产毒素菌株被用来作为有益菌对产毒菌株加以抑制,但二者从分类学和分子生物学的角度比较,差异非常小,而如果从食品安全角度比较,产毒与不产毒菌株完全是两个概念。霉菌代谢产物在一定条件下也可以相互进行转化,近年来国外有研究表明,杂色曲霉毒素在合适条件下可以转化成黄曲霉毒素。目前,霉菌的检测和分类与真菌毒素的检测从生物学和化学的两个领域被严格区分开来,各自被独立进行研究,忽视了其内在的必然联系和规律。Minto等报道,黄曲霉毒素其中一条合成途径后部分为杂色曲霉素A→脱甲基杂色曲霉素→杂色曲霉素(ST)→O甲基杂色曲霉素(MST)→黄曲霉毒素B1(AFB1)[3]。本研究通过高分辨质谱检测到ST和MST毒素,而对于其前体脱甲基杂色曲霉素和杂色曲霉素A未检测到,推测这2种次级代谢物含量很少或为非胞外代谢物。过去,直接分析真菌培养基以确定是否存在霉菌毒素必然包括“目标”分析,不可避免地假定能找到那种毒素,而高分辨质谱提供了一种可能的新方法用于研究真菌产生毒素的行为,因为仪器能测定在液相色谱分离中检测到的任何组分分子、离子的精确质量数,这些组分可以通过检索数据库中相关次级代谢产物的精确质量数得以鉴定,在全扫描条件下具有灵敏度高和选择性好的特点,适用于多种代谢物的同时检测[4-6]。目前,国内外缺乏利用高分辨质谱法对霉菌代谢产物进行的研究,笔者所在课题组通过代谢产物提取培养,经高分辨质谱检测筛查,通过代谢谱库搜索,寻找其生物性标志物并建立其指纹图谱,对产毒曲霉有毒代谢物筛选和菌种类鉴定提供一种新方法。
1 材料与方法
1.1 仪器、试剂与材料
高效液相色谱-高分辨质谱联用仪:Thermo Ultimate 3000-Exactive(美国Thermo公司),配电喷雾离子源(ESI);离心机:5810R型(Eppendorf公司);氮吹仪:N-EVAP(Organomation Associates公司);霉菌培养箱:上海森信实验仪器有限公司;高温蒸汽灭菌锅:上海申安医疗器械厂;纯水机:Milli-Q(美国Millipore公司);万分之一天平(Mettler AE163);均质器(IKA T25);振荡器(IKA MS1);5 mL一次性注射器; 0.22 μm 针头过滤器。
AFB1、黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1)、黄曲霉毒素G2(AFG2)、青霉酸、曲酸均购于Biopure公司;ST、MST购于Sigma公司中性氧化铝(Alumina-N)购于上海五四化学试剂有限公司;石墨炭黑粉(GCB)、C18粉(ODS)、PSA粉和氨丙基粉(Cleanert NH2)购于Agela Technologies Inc。
甲醇、乙酸乙酯、乙腈和甲酸均为色谱纯,美国Biopure公司;PD液体培养基(霉菌培养基):马铃薯去皮切块,每 200 g 加入500 mL水,煮沸30 min。双层纱布过滤至烧瓶中,加入20 g蔗糖,加水至1 L,121 ℃高压灭菌20 min。
标准菌株:寄生曲霉(CGMCC3.124),购自中国普通微生物菌种保藏管理中心(CGMCC)。
1.2 样品处理
将冷藏菌种接种到PD液体培养基内,28 ℃培养5 d,取培养液400 μL接种到装有10 mL PD液体培养基的培养皿中,在28 ℃下培养9 d。使用移液器移取菌液3 mL到离心管中,13 000 r/min离心10 min,吸取上清液2 mL到干净玻璃管中;加入6 mL乙腈(含1%甲酸)溶液,涡混均匀后于30 ℃水浴氮气吹干,在玻璃管中加入0.2 g ODS,用1 mL乙腈-水(3 ∶7,含0.1%甲酸)涡混定容,静置1 min后取上清液经 0.22 μm 的滤膜过滤,待上机分析。同时以空白PDA培养基重复以上方法作对照。
1.3 液相色谱串联质谱条件
1.3.1 液相色谱条件 色谱柱:Eclipse Plus C18(3.0 mm×100 mm,1.8 μm);流动相A:水-甲醇-甲酸(体积比 900 ∶99 ∶1)加5 mmol乙酸铵;流动相B:甲醇-甲酸(体积比999 ∶1)。高效液相色谱(HPLC)使用反相C18柱,流动相:A 0.1%甲酸水,B甲醇。梯度洗脱程序:0.0 min→1.0 min,5% B;1.0 min→6.0 min,5% B→30% B;6.0 min→11.0 min,30% B→60% B;11.0 min→16.0 min,60% B→98% B;16.0 min→18.0 min,98% B;平衡2.0 min。进样体积10 μL,流速 0.3 mL/min。
1.3.2 质谱条件 全扫描正离子模式,气体温度为350 ℃,干燥器流量为12 L/min,雾化器压力为310.264 kPa,离子源为正离子,数据储存方式为柱状图,质量扫描范围(m/z)为100~1 100。标准品参数见表1。
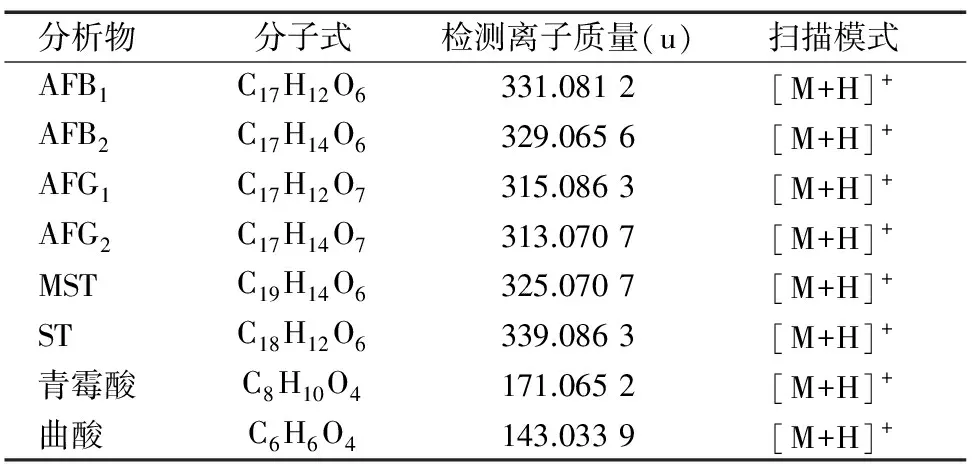
表1 8种真菌毒素标准品的参数
1.4 数据处理
数据采用XCMS开放性软件进行色谱峰识别以及峰匹配,并采用主成分分析法(pnhcipal component analysis,简称PCA)对对照组和培养提取液组进行模式识别。
2 结果与分析
2.1 提取条件的选择
用于提取溶液中目标组分的试剂一般为乙酸乙酯和异丙醇,本试验通过在空白培养基中添加目标物提取后经质谱检测的方法分别对乙酸乙酯、乙酸乙酯+异丙醇、乙酸乙酯+1%甲酸、乙酸乙酯+异丙醇+1%甲酸和乙腈+1%甲酸的提取效果进行考察,结果发现MST回收率偏低,不适用于乙酸乙酯等有机溶剂提取(表2)。通过多次试验,最终选择了乙腈+1%甲酸提取,各种代谢物的提取回收率均达到了86%以上,结果见表2。
2.2 净化条件的选择
培养基基质复杂,而常用的免疫亲和柱和多功能净化柱受真菌毒素化学性质限制,通过基质加标的方法分别比较了226(Romer)、HLB(Waters)、Agilent多功能净化柱、黄曲霉免疫亲和柱(华安麦科)对真菌毒素或代谢物的回收率。结果表明,黄曲霉免疫亲和柱只对黄曲霉类有较好的回收,HLB固相萃取柱对真菌毒素及代谢物有较高的回收率,但净化成本很高,见表3。本研究使用QuEChERS方法[7-8],同时考察了Alumina-N、GCB、ODS、PSA、NH25种净化粉对6种霉菌代谢物毒素的吸附回收率,通过标准品加净化粉经质谱检测并计算回收率,结果发现ODS净化回收率在91.3%~108.9%,净化粉回收率较好,而其他净化粉对6种毒素都有不同程度的吸附,结果见表4。通过对ODS净化粉不同添加比例组合后净化8种真菌代谢物的对比,确定了“1.2”节用量为最佳比例条件。
2.3 色谱质谱条件的优化
2.3.1 色谱条件的选择 采用1.8 μm色谱柱填料使得高效液相色谱在较高的流速下依然可以保持良好的分离效率,并节省分析时间,提高分析通量。考虑到质谱系统对流量的耐受性,采用0.3 mL/min的流速能够满足分离要求并提高分析通量,同时可不经分流将流出液直接导入质谱系统进行检测。对于培养基这种复杂的霉菌代谢物样本,等度洗脱很难达到满意的效果,而梯度洗脱是一种较为理想的选择。在试验中笔者采用空白基质同法制备的样品来考察梯度条件对于分离的影响。首先,采用线性梯度洗脱,即B液在10 min内由0%线性变为98%(10 min后为柱冲洗和柱平衡程序),虽然超高效液相色谱(UPLC)有相对于HPLC更高的分离效率,但由于培养液中化合物的种类和数量都非常多,分离效果达不到要求。将梯度洗脱时间延长为20 min,分离情况以及检测到峰的数量都有明显的提高。进一步将洗脱时间延长为30 min,分离效果又有了提高,但17 min后色谱峰较少,可以进行进一步的优化以缩短分析时间,通过梯度程序进一步优化将洗脱时间变为18 min,平衡2 min,用于霉菌代谢物的分离分析,取得了较为理想的分离效果。良好的分离可以进一步减少质谱检测的离子抑制效应。

表2 不同提取试剂的提取效率 %
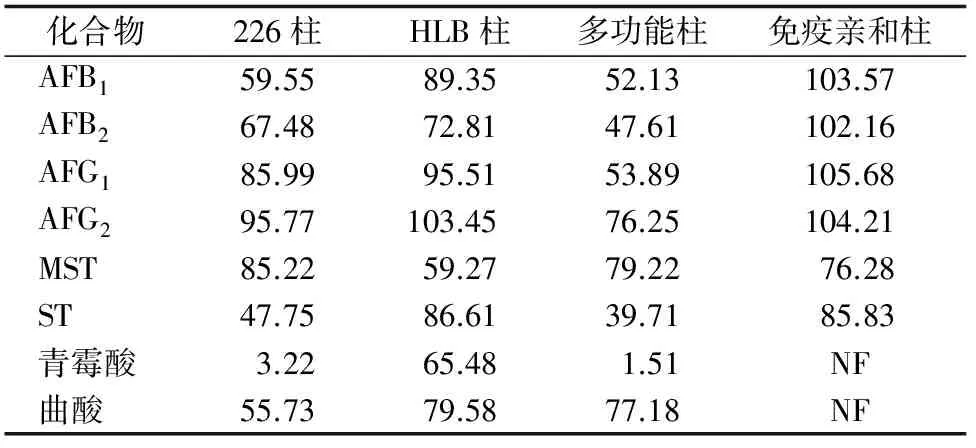
表3 不同净化柱对多种代谢物回收率的影响 %
注:“NF”表示未检测到。
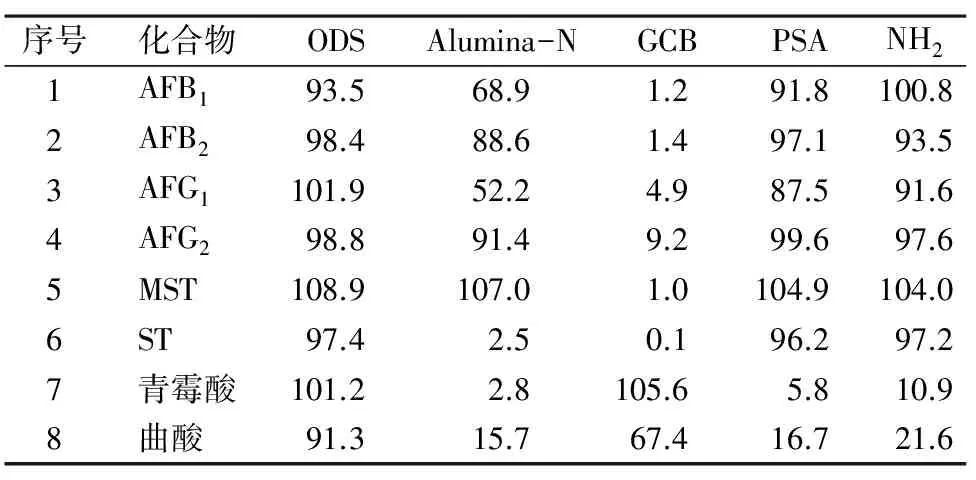
表4 经ODS、Alumina-N、GCB、PSA、NH2吸附 的8种真菌毒素回收率 %
对于培养基这种复杂体系而言,其扫描的色谱峰的数量非常多,若分析色谱保留时间的稳定性差,直接对比空白样品和培养液代谢物指纹图谱来观察代谢物的变化比较困难。采用开放性软件XCMS可以快速提取出有用的信息。模式识别的方法有赖于高质量的数据集的建立,即色谱峰的匹配。保留时间的恒定对于色谱峰的匹配是至关重要的因素。本试验考察了标准品中6个色谱峰在3次重复分析中保留时间的稳定性,结果显示色谱保留时间的稳定性较好。
任何代谢物的产生,在霉菌代谢合成中都有一个代谢途径,也可能有旁路途径或分支途径,比如在黄曲霉毒素代谢中,杂色曲霉素B可以合成黄曲霉毒素B2,也可以氧化进一步合成黄曲霉毒素B1;黄曲霉毒素G2和黄曲霉毒素B2a为同分异构体,黄曲霉醇和黄曲霉B2为同分异构体,黄曲霉毒素G1和黄曲霉毒素Q1为同分异构体等,还有其他一些未知的代谢物,结构和化学性质类似,要实现良好分离比较困难。试验发现,流动相为甲醇-水时(含0.1%甲酸),有的峰形不好,分离度达不到要求。对甲醇-水流动相进一步调整,经反复试验,确定了前面所述流动相比例以及梯度洗脱方法,应用该方法基线平稳,各成分能完全分离并得到好的响应值。高分辨质谱仪不需要对质谱条件进行特殊优化,可以采用通用质谱条件,只需调整扫描质量范围即可。化合物筛选离子提取误差小于5×10-6u。提取离子色谱图见图1、图2。
2.3.2 质谱条件的选择 对于质谱离子源,需要设置干燥气的温度、流量,雾化器的压力,以及毛细管电压等参数的数值。其中干燥气的温度、流速,雾化器的压力还与流动相的比例、流速以及待分析的物质有很大关系。本试验中对培养产毒霉菌的研究,是以产黄曲霉毒素为基础的,根据黄曲霉毒素建立霉菌代谢产物标志代谢产物及其指纹图谱,不是检测和建立其所有标志性代谢产物,由于黄曲霉毒素在正离子条件下响应值高,所以只是做了正离子全扫描,并且能得到很多的化合物信息,质荷比范围为100~1 100,减少了分析时间,所以本试验选用正离子扫描。脱溶剂气流量以及温度对代谢物的离子化效率有较大影响。以0.3 mL/min的流速泵入0.1%甲酸溶液,调整雾化气流量以及温度,观察雾化情况,结果在脱溶剂气流量为12 L/min、温度为350 ℃的情况下喷雾效果较好并且稳定。Q-Tof质谱仪采用微通道板来检测离子,增加微通道板电压可以提高信号强度,同时也会影响其使用寿命。采用恒流泵恒速泵入参比溶液,以100 V为单位从1 800 V开始逐步增加电压,观察m/z=322.048 1的峰的强度,直至增加100 V电压时峰强度的增加幅度低于30%即为最优电压。通过优化得到的微通道板电压为2 500 V。
2.4 标准品扫描分析
代谢组学的核心问题是通过一个对照组和试验组的等比性分析,比如用霉菌培养后纯化的培养液作为试验组,用空白培养基作同等处理后作为对照组,通过它们之间的等比对照分析,去解释它们之间的一些代谢物和代谢通路的差别,通过对代谢组的整体性分析,将这些代谢物产物与生物学特征、功能和疾病等相互关联在一起。为便于分析研究,首先配制各浓度均为5 μg/mL的混合标准溶液经高分辨质谱扫描检测,为保证数据的稳定性和利于数据分析处理,标准品和空白样品各扫描3次,保存模式为柱状图模式(Centroid)。用Metabolomics XCMS开放性软件处理,根据空白对照、精确分子量以及一定的统计学分析如P值<0.05等来减少杂质分子的干扰,确定标准品参数,结果见表5。表5中的数据,是标准品和空白样品经高分辨质谱扫描,经XCMS软件处理比对的结果。差异分3种情况,一种是标准品有而样品没有,即标准品经质谱扫描在特定位置出峰而空白样品因没有其化合物,则在同样时间不会出现与标准品一样精确分子量的化合物峰;二是标准品和空白样品在特定位置同时出峰;三是标准品在特定时间未出峰而空白样品有显著峰。根据标准品和空白样品的差异变化我们可以把差异的后2种情况排除,从而快速得到标准品的特征性参数。通过表5中标准品化合物理论m/z与实际测量值相比较,偏差范围不超过5×10-6u。应用XCMS软件的优点是不需要人工对每个特征峰提取,经软件处理即可得到所有的特征峰参数,在样品比对中会极大地节约时间,通过标准品和空白样品的比对,笔者可以确定方法的可行性,并可通过综合扫描情况对其进行整体分析。
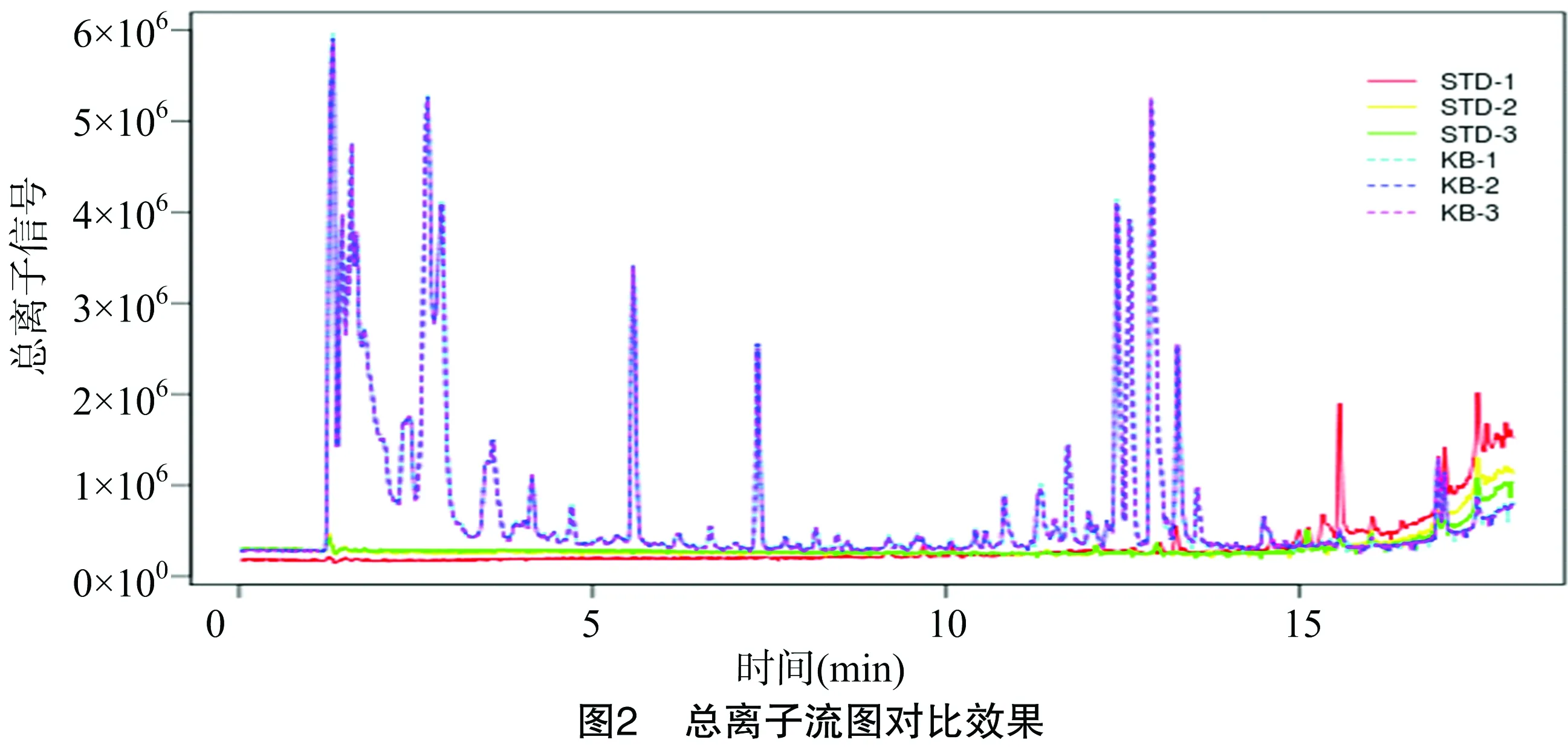
2.4.1 总离子流图比较 总离子流图对比效果见图2。
2.4.2 离子云图比较 在试验比对中,通过XCMS软件中的离子云(Cloud Plot)可以形象化一个二维数据集的分布,当在有非常多的数据集合时对比明显,使用内置的例程在图中轴线设置限制,并添加各点的数据,如图3上半部分为空白样品的Cloud Plot,横坐标为时间轴,纵坐标为质核比,绿色圆点为每个特异性离子。图3下半部分标准品的Cloud Plot,可以很简单明了地弄清楚空白样品和标准品的差异。

表5 标准品扫描比对结果

2.4.3 主成分分析 主成分分析或者主元分析,是一种掌握事物主要矛盾的统计分析方法,它可以从多元事物中解析出主要影响因素,揭示事物的本质,简化复杂的问题。计算主成分的目的是将高维数据投影到较低维空间。对于一个由多个变量描述的复杂事物,人们难以认识,如果事物的主要方面刚好体现在几个主要变量上,人们只需要将这几个变量分离出来,进行详细分析,PCA是可以用原有变量的线性组合来表示事物的主要方面的分析方法。本试验通过PCA图谱分析,确定比对结果差异明显,详见图4。

2.5 样品扫描分析
基于液相色谱串连质谱的非靶向代谢组学的研究流程一般分为3个部分:一是样品准备和数据采集;二是数据处理工具,本试验用XCMS数据处理;三是代谢物结构鉴定。代谢组学目前主要应用于早期疾病的诊断,如糖尿病诊断,以及发现疾病的代谢途径、代谢通路、了解疾病的发生发展。本试验主要通过靶向代谢和非靶向代谢结合的方法,通过预测可能的代谢产物来对霉菌产毒代谢物的研究,了解其标志性代谢物的产生及发展。按照“1.2”节样品处理方法将样品CGMCC 3.124经Metabolomics XCMS开放性软件处理,根据空白对照、精确分子量和出峰时间等筛选CGMCC 3.124代谢产物的同时确定其菌种的指纹谱图,并经过标准品确定,结果见表6。

表6 样品3.124扫描比对结果

表7 METLIN数据库检索精确分子量347.076 4化合物及结构特征
3 讨论
霉菌代谢物众多,对于非靶向代谢来说,只通过有限的标准品来判定比较困难,又由于二次代谢物产量少,代谢物基质复杂,目前没有非常有效的提取纯化方法,从而制约了通过高分辨质谱二级离子扫描来筛查化合物。本试验通过大量的基础资料收集以及文献资料检索,先确定黄曲霉毒素代谢物的产生途径及各种可能的代谢产物,有针对性地对代谢产物进一步筛选,从而通过精确分子量搜索代谢物数据库初步对化合物分子式和名称进行推测判定。比如筛查中提取到代谢物精确分子量347.076 4,通过代谢物谱库搜索到6种可能的代谢物(表7),结构式推断为C17H14O8,推测为黄曲霉毒素M2(AFGM2)、黄曲霉毒素G2a(AFG2a)或黄曲霉毒素B1二醇中的一种,由于代谢物含量很低,需要进一步优化培养条件和提高净化方法来进一步判定。
4 结论
本研究建立了一种产毒霉菌代谢物指纹谱库的快速检测方法,借助高分辨质谱设备和代谢软件以及代谢物谱库,筛查霉菌有毒性标志物并建立其指纹谱图,可为霉菌分类提供一定的补充,为筛查未知化合物提供一定的参考。
[1]缪承杜,洪 葵. 真菌分类技术的研究进展[J]. 安徽农业科学,2007,35(22):6695-6697.
[2]Carlile M J,Waikinson S. The fungi[M]. London:Academic Press,1994:482-490.
[3]Minto R E,Townsend C A. Enzymology and molecular biology of aflatoxin biosynthesis[J]. Chemical Reviews,1997,97:2537-2555.
[4]Tautenhahn R,Patti G J,Rinehart D,et al. XCMS online:a web-based platform to process untargeted metabolomic data[J]. Analytical Chemistry,2012,84(11):5035-5039.
[5]Zhu Z J,Schultz A W,Wang J H,et al. Liquid chromatography quadrupole time-of-flight mass spectrometry characterization of metabolites guided by the METLIN database[J]. Nature Protocols,2013,8(3):451-460.
[6]Patti G J,Tautenhahn R,Rinehart D,et al. A view from above;cloud plots to visualize global metabolomic data[J]. Analytical Chemistry,2013,85(2):798-804.
[7]董 静,宫小明,张 立,等. QuEChERS-高效液相色谱法检测蔬菜中的蚍虫啉,虫酰肼,阿维菌素和噻螨酮[J]. 分析试验室,2008,27(3):91-94.
[8]史 娜,侯彩云,路 勇,等. QuEChERS-高效液相色谱-质谱法检测食品中14种真菌毒素[J]. 食品科学,2014,35(16):190-196.
