外源褪黑素对干旱胁迫下紫苏幼苗生长的影响
2018-03-12孙汪亮
李 爱, 孙汪亮, 李 林, 孙 锋
(天津农学院园艺园林学院,天津 300384)
紫苏(PerillafrutescensL.Britt)为唇形科紫苏属一年生草本植物,是我国卫生部门最早批准的药食同源植物之一。紫苏的经济价值非常高,发展前景也十分广阔[1-2]。目前对紫苏的研究大多集中在营养成分提取、药理作用评定等方面,而对紫苏的生产和逆境生理方面的研究相对较少[3-5]。水分是植物生长乃至一切生命活动所必需具备的重要环境因子之一。在自然环境下,植物生长发育的过程经常会遭受干旱或涝害的胁迫[6]。特别是在苗期,干旱胁迫往往会给植物中后期的生长带来较大的负面影响[7]。干旱使细胞失水萎蔫,细胞膜受损、透性加大,植物生理代谢紊乱,呼吸作用异常,光合功能下降,干物质的积累和分配受到影响,最终导致植株产量和品质下降[8-13]。
植物生长调节剂普遍被用来调节植物生长和提高植物的抗逆能力,因此探究潜在的植物生长调节剂及其作用机制对增强作物抵抗干旱的能力具有重要意义[14]。1995年,在高等植物中首次发现褪黑素[15],作为一种抗氧化剂和植物保护剂,褪黑素在抵御氧化胁迫和环境伤害方面发挥着较大的作用[16]。在逆境条件下,植物体内的褪黑素积累量会出现增多的现象。其次,外源褪黑素也具有广谱的清除自由基作用,能减轻逆境胁迫下植物受到的过氧化损伤[17]。叶君等对小麦的研究发现,在干旱胁迫下,褪黑素能够改善小麦的光合特性,使小麦幼苗抵抗干旱和恢复的能力得到了提高[14]。盐胁迫显著抑制了海棠幼苗的正常生长,而外施褪黑素缓解了盐胁迫的抑制作用[18]。在高温胁迫下,外施褪黑素后,黄瓜的超氧自由基产生速率和H2O2含量显著降低,并且褪黑素能够有效清除黄瓜体内过多的活性氧,抑制细胞膜透性和丙二醛含量的增大,提高黄瓜植株叶片的抗氧化系统酶活性和可溶性蛋白质的含量,对黄瓜抵抗高温的能力有显著增强作用[19-21]。对野生叶用芥菜施加低浓度的外源褪黑素(0.1 mmol/L)后,促进了芥菜的根长生长,然而在施加高浓度的褪黑素(100 mmol/L)后,幼苗生长受到了抑制[22]。
本试验以紫苏为材料,利用聚乙二醇-6000(polyethylene glycol,简称PEG-6000)模拟干旱环境,探究不同浓度的外源褪黑素对干旱胁迫下紫苏幼苗生长和生理指标的影响,从而加强人们对褪黑素提高紫苏抗旱性作用机制的认识,为更好地利用外源褪黑素指导生产实践提供理论依据。
1 材料与方法
1.1 试验材料
紫苏种子由河北省安国中药材推广站提供,播种后选取长势一致的幼苗用于试验。
1.2 试验方法
1.2.1 幼苗培养及处理 选取大小均匀、籽粒饱满的紫苏种子,温水浸种10 min,蒸馏水浸种24 h,然后将种子放在铺有滤纸的培养皿中,于28 ℃恒温培养箱内催芽3 d,最后播种于混有草炭、蛭石、珍珠岩的基质中(V草炭∶V蛭石∶V珍珠岩=1 ∶1 ∶1),3 d 后胚芽破土,10 d后选取长势一致的幼苗移栽到育苗穴盘中。移栽后的紫苏幼苗分为6个处理组:CK1、CK2、M50、M100、M300、M500。每个处理24株幼苗,重复3次。待幼苗长至4叶1心时,每隔1 d给幼苗浇1次1/2 Hogland’s营养液。开始处理时,连续3 d根外施加外源褪黑素后,再用10% PEG-6000溶液连续胁迫处理3 d,各处理施加的试剂及浓度如表1所示,处理结束2 d后同时间取样,测定相关指标。部分样品保存于-80 ℃冰箱中备用。

表1 紫苏幼苗的不同处理
1.2.2 幼苗叶长、叶宽及长宽比的测定 每个处理取12株幼苗,选取第1对真叶测量叶片的长度(L)和宽度(W),重复3次。长宽比=L/W。
1.2.3 幼苗干鲜质量的测定及相对含水量 采取称质量法测定紫苏幼苗的相对含水量。将育苗穴盘中正常生长的幼苗表面的水分擦干,并将根部残留的基质土去掉,称质量,记录幼苗鲜质量(fresh weight,简称FW)。将样品放置在105 ℃条件下杀青15 min,再于80 ℃恒温条件下烘干至恒质量,称其质量,记录幼苗干质量(dry weight,简称DW),重复3次。根据公式计算相对含水量:相对含水量=(FW-DW)/FW×100%。
1.2.4 相关生理指标的测定 丙二醛(malonic dialdehyde,简称MDA)含量的测定采用硫代巴比妥酸法(thiobarbituric acid,简称TBA);超氧化物歧化酶(superoxide dismutase,简称SOD)活性采用SOD抑制氮蓝四唑(nitro-blue tetrazolium,简称NBT)光化还原法测定;过氧化物酶(peroxidase,简称POD)活性的测定采用愈创木酚显色法;可溶性蛋白含量的测定采用考马斯亮蓝G-250法。
1.3 数据处理与统计方法
采用SPSS 20.0软件在0.05水平上对所测数据作单因素方差分析,以Duncan’s新复极差法比较不同处理间的差异显著性,并采用Excel绘图。
2 结果与分析
2.1 褪黑素处理对干旱胁迫下紫苏幼苗叶片的影响
由图1-a可知,与对照组1(CK1)相比,不管是否外施褪黑素,干旱胁迫均使幼苗的叶长显著下降,其中CK2比CK1的叶长显著下降15.50%。在干旱胁迫下,外施褪黑素的浓度为100 μmol/L时,幼苗叶长达到最大值,为2.33 cm,与CK1相比,幼苗叶长显著下降9.69%,与CK2相比,叶长增长 6.88%,但差异不显著。由图1-b可知,与CK1相比,CK2叶宽下降4.97%。在干旱胁迫下当褪黑素的浓度为 100 μmol/L 时,幼苗叶宽达到最大值,为1.55 cm;与CK1相比,M100处理的幼苗叶宽下降3.73%,与CK2相比,M100处理的幼苗叶宽增长1.31%,但差异不显著。
由图1-c可知,对照组1(CK1)叶片长宽比为1.60,而CK2的长宽比为1.42,显著下降11.25%,说明干旱胁迫能使紫苏幼苗叶片长宽比显著下降。与CK2相比,通过外施褪黑素能增加幼苗叶片长宽比,且随着褪黑素浓度的增加,叶片长宽比呈现出先增加后下降的趋势,但均低于CK1。当褪黑素浓度达到300 μmol/L时,长宽比达到最大值,为1.55,与CK2相比,长宽比提高9.15%。结果表明,在用10% PEG-6 000溶液胁迫处理紫苏幼苗时,外施褪黑素能提高叶片的长宽比,起到缓解干旱胁迫的作用。

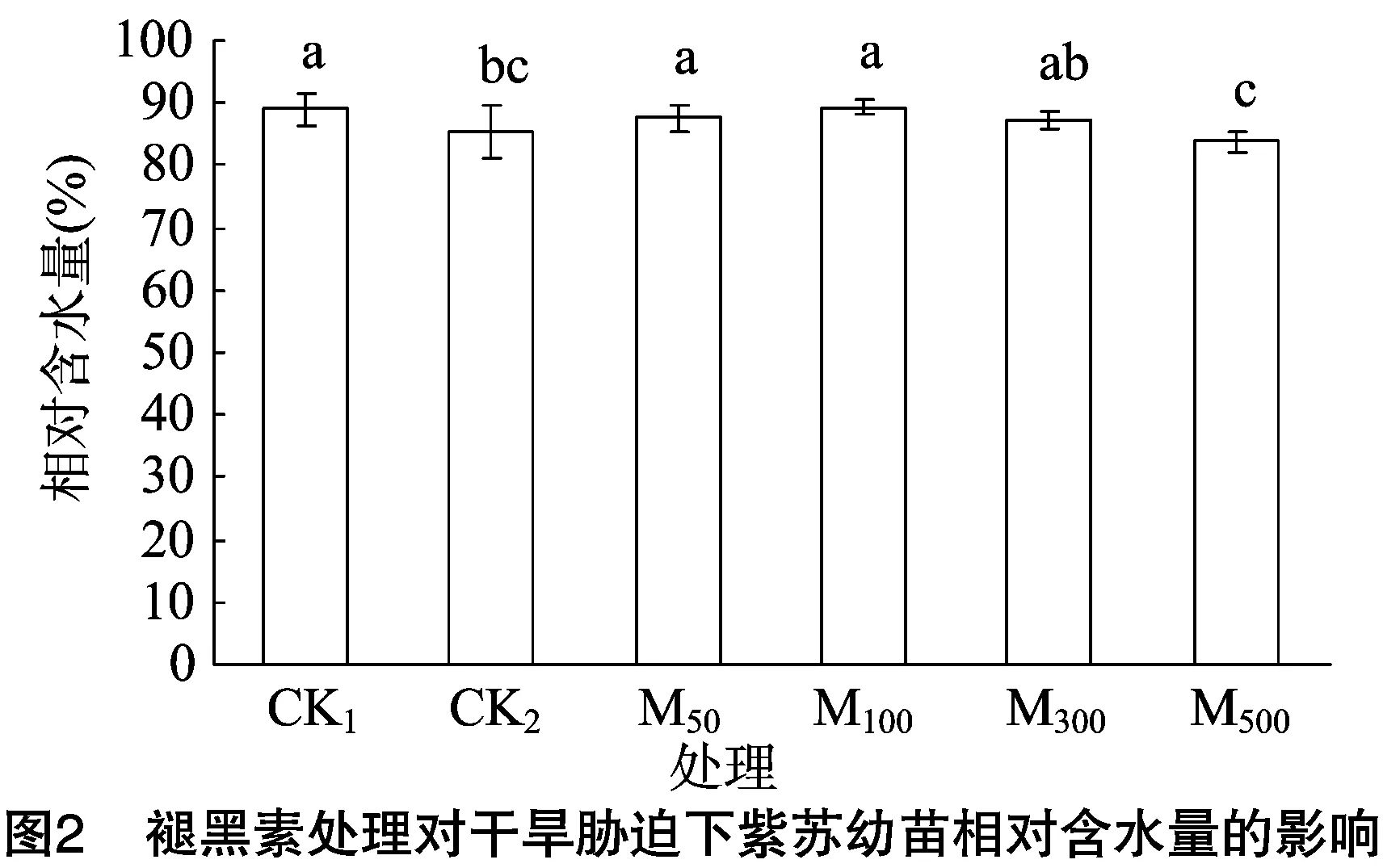
2.2 褪黑素处理对干旱胁迫下紫苏幼苗相对含水量的影响
由图2可知,对照组1(CK1)紫苏幼苗的相对含水量为89.01%,干旱胁迫处理后,CK2的相对含水量为85.35%,比CK1显著下降4.11%。干旱胁迫下外施不同浓度的褪黑素处理紫苏幼苗,随着褪黑素浓度的增加,紫苏幼苗相对含水量呈现出先增加后下降的趋势,当褪黑素浓度为100 μmol/L时,相对含水量达到最大值,为89.25%,与CK1的相对含水量相当。当褪黑素的浓度为500 μmol/L时,紫苏幼苗相对含水量为83.75%,与CK1相比,相对含水量显著下降5.91%,与CK2相比,紫苏幼苗相对含水量下降1.87%,但差异不显著。结果表明,干旱胁迫处理紫苏幼苗时,低浓度的褪黑素能够提高幼苗的抗旱能力,增加幼苗相对含水量。而当褪黑素的浓度超过一定范围时,其作用效果逐渐降低,甚至不能起到增加幼苗相对含水量的作用。
2.3 褪黑素处理对干旱胁迫下紫苏幼苗膜脂过氧化程度的影响
干旱胁迫处理可以导致植物体内的活性氧大量积聚,这样就给植物体造成了膜脂过氧化伤害,而MDA就是膜脂过氧化的产物,MDA的积累可作为膜脂过氧化程度的指标之一。由图3可知,CK2处理下MDA含量较CK1有大幅度提升,比CK1显著提高67.19%。而经过褪黑素处理后,MDA含量随着褪黑素浓度的增加而呈现下降的趋势,当褪黑素浓度为500 μmol/L时,MDA含量达到最低值,与CK1相比,MDA含量下降6.25%,与CK2相比,MDA含量显著下降 43.93%。这表明在干旱胁迫下外施褪黑素,能减轻紫苏幼苗膜脂过氧化作用,在一定程度上很好地缓解干旱胁迫下幼苗所受到的氧化损伤。
2.4 褪黑素处理对干旱胁迫下紫苏幼苗SOD、POD活性的影响
由图4-a可知,紫苏幼苗的POD活性在干旱胁迫处理下(CK2)比对照组(CK1)显著下降18.84%。在干旱胁迫下外施褪黑素,POD活性随着褪黑素浓度的增加呈现逐渐增加的趋势,且当外施褪黑素浓度为500 μmol/L时,达到最佳的处理效果,与CK2相比,POD活性显著提高26.79%。由图 4-b可知,SOD活性在干旱胁迫处理下(CK2)比CK1下降 8.74%。干旱胁迫下使用不同浓度的褪黑素处理紫苏幼苗,其SOD活性未呈现明显的变化趋势,当外施褪黑素浓度为100 μmol/L时,SOD活性达到最高值,与CK2相比提高 8.51%,但差异不显著。结果表明,外施一定浓度的褪黑素可以提高干旱胁迫下紫苏幼苗的抗氧化酶活性,缓解干旱胁迫造成的伤害。


2.5 褪黑素处理对干旱胁迫下紫苏幼苗可溶性蛋白含量的影响
植物体内的可溶性蛋白参与植物细胞的渗透调节,维持细胞渗透势以及水分平衡。由图5可知,干旱胁迫时,CK2的可溶性蛋白含量比CK1显著提高15.24%。而在干旱胁迫下使用褪黑素处理紫苏幼苗,其可溶性蛋白含量与CK2相比均表现出下降,但使用不同浓度的褪黑素处理时,各处理间差异不显著。当外施褪黑素的浓度为500 μmol/L时,可溶性蛋白含量达到最低值,比CK2显著下降8.51%,比CK1增加 5.43%。这说明在干旱胁迫下用褪黑素处理紫苏幼苗,在一定程度上可以有效降低幼苗所遭受干旱胁迫的程度。
3 结论与讨论
干旱环境对植物体生长以及生物量的形成具有较大影响,在自然条件下,植物生长发育的过程中经常会遭遇水分不足等情况。大量研究表明,植物在苗期,易遭遇干旱胁迫而使幼苗的生长势变弱,并对幼苗中后期的生长带来一些不可逆转的不利影响,最终导致作物产量下降。本试验利用10% PEG-6000溶液模拟干旱环境,栽培紫苏幼苗。与正常条件下生长的紫苏幼苗相比,干旱胁迫使幼苗叶片的长宽比、相对含水量以及过氧化酶活性显著下降,同时显著提高MDA和可溶性蛋白的含量。这充分说明10% PEG-6000溶液模拟干旱环境对紫苏幼苗的生长和生理造成了严重的抑制作用。

含水量是植物体内水分状况的一个重要度量指标,植物组织含水量可直接影响植物的生长、气孔状况、光合功能甚至植物产量。结果表明,在干旱胁迫下,外施适宜浓度褪黑素能够提高紫苏幼苗的相对含水量,说明褪黑素处理能有效改善紫苏幼苗的水分状况,减弱干旱胁迫所造成的伤害。
干旱胁迫时,植物体光合作用会受到一定程度的抑制,光合速率下降,出现光能过剩现象,从而造成植物体内活性氧的积累。活性氧的过量累积会导致膜脂过氧化伤害,而MDA就是膜脂过氧化伤害的最终产物,MDA含量的高低反映细胞膜遭受破坏的程度[23]。本试验中,紫苏幼苗在干旱胁迫下MDA含量比对照组1(CK1)显著提高67.19%,而使用褪黑素处理后紫苏幼苗体内MDA含量较CK2显著下降,且随着外施褪黑素浓度的增加,MDA含量呈现逐渐下降的趋势,使MDA含量维持在较低水平。当褪黑素浓度为500 μmol/L时,MDA含量达到最低值,比CK2显著下降43.93%。同时,使用褪黑素处理后的紫苏幼苗SOD和POD的活性也有所提高,有效地分解过量的活性氧。这与Tan等报道的在植物体内,褪黑素具有抗氧化的作用,可提高过抗氧化酶的活性这一研究结果[24]一致。结果表明,在干旱胁迫下使用褪黑素处理紫苏幼苗,提高了紫苏幼苗的抗氧化能力,在一定程度上有效缓解干旱胁迫所造成的氧化损伤,维持光合系统的稳定,进而大大改善叶片的光合性能。
植物细胞的渗透调节有利于增强植物的抗逆性,增强植物对不良环境的适应能力[25]。大多数植物遭受环境胁迫时,会在体内积累大量可溶性物质,例如可溶性蛋白。可溶性蛋白作为植物的渗透调节剂,能够调节植物细胞的渗透势,这种作用主要体现在保护植物细胞的渗透平衡[26]。本试验中,在干旱胁迫下紫苏幼苗可溶性蛋白质含量急剧上升,外施褪黑素后,可溶性蛋白质含量有所下降,这说明褪黑素处理后的紫苏幼苗具备一定的抵抗干旱胁迫的能力。
[1]周晓晶,李 可,范 航,等. 不同变种及种源紫苏种子油脂肪酸组成及含量比较[J]. 北京林业大学学报,2015,37(1):98-106.
[2]谭美莲,严明芳,汪 磊,等. 国内外紫苏研究进展概述[J]. 中国油料作物学报,2012,34(2):225-231.
[3]薛 山. 紫苏叶精油化学成分及生理活性研究进展[J]. 食品研究与开发,2012,33(3):235-238.
[4]李会珍,孙子文,李晓君,等. 紫苏种子性状与主要营养成分相关性分析[J]. 中国粮油学报,2013,28(10):55-59.
[5]张 鑫. 紫苏有效成分提取及资源分类[D]. 太原:中北大学,2010:2-9.
[6]蔡庆生. 植物生理学[M]. 北京:中国农业大学出版社,2014:299-312.
[7]吴 敏,张文辉,周建云,等. 干旱胁迫对栓皮栋幼苗细根的生长与生理生化指标的影响[J]. 生态学报,2014,34(15):4223-4233.
[8]Frazeli F,Ghorbanli M,Niknam V. Effect of drought on biomass,protein content,lipid zeroxidation and antioxidant enzymes in two sesame cultivars[J]. Biologic Plantarum,2007,51(1):98-103.
[9]王 瑾,刘桂茹,杨学举. PEG胁迫下不同抗旱小麦品种幼苗形态及主要理化特性的比较[J]. 河北农业大学学报,2005,28(5):6-10.
[10]刘 艳,蔡贵芳,陈贵林. 干旱胁迫对甘草幼苗活性氧代谢的影响[J]. 中国草地学报,2012,34(5):93-98.
[11]朱 慧,马瑞君,吴双桃,等. 干旱胁迫对五爪金龙种子萌发与幼苗生长的影响[J]. 西北植物学报,2009,29(2):344-349.
[12]章尧想,徐 军,任文佼,等. 干旱胁迫对半日花种子萌发及幼苗生理特性的影响[J]. 东北林业大学学报,2014,24(7):87-90.
[13]郭鹏辉,高丹丹,田晓静,等. 干旱胁迫对紫苏种子及幼苗生理特性的影响[J]. 中国油料作物学报,2015,37(5):683-687.
[14]叶 君,邓西平,王仕稳,等. 干旱胁迫下褪黑素对小麦幼苗生长、光合和抗氧化特性的影响[J]. 麦类作物学报,2015,35(9):1275-1283.
[15]Hattori A,Migitaka H,Iigo M,et al. Identification of melatonin in plants and its effects on plasma melatonin levels and binding to melatonin receptors in vertebrates[J]. Biochemistry and Molecular Biology International,1995,35(3):627-634.
[16]Manchester L C,Tan D X,Reiter R J,et al. High levels of melatonin in the seeds of edible plants:possible function in germ tissue protection[J]. Life Sciences,2000,67(25):3023-3029.
[17]张 娜. 褪黑素处理对渗透胁迫下黄瓜种子萌发及幼苗生长的影响及其分子机制[D]. 北京:中国农业大学,2014:3-8.
[18]Li C,Wang P,Wei Z,et al. The mitigation effects of exogenous melatonin on salinity-induced stress inMalushupehensis[J]. Journal of Pineal Research,2012,53(3):298-306.
[19]徐向东,孙 艳,孙 波,等. 高温胁迫下外源褪黑素对黄瓜幼苗活性氧代谢的影响[J]. 应用生态学报,2010,21(5):1295-1300.
[20]徐向东,孙 艳,郭晓芹,等. 高温胁迫下外源褪黑素对黄瓜幼苗光合作用及叶绿素荧光的影响[J]. 核农学报,2011,25(1):179-184.
[21]赵 娜. 外源褪黑素对高温胁迫条件下黄瓜幼苗碳氮代谢的影响[D]. 杨凌:西北农林科技大学,2012:12-31.
[22]Chen Q,Qi W B,Reiter R J,et al. Exogenously applied melatonin stimulates root growth and raises endogenous indoleacetic acid in roots of etiolated seedlings ofBrassicajuncea[J]. Journal of Plant Physiology,2009,166(3):324-328.
[23]Møller I M,Jensen P E,Hansson A. Oxidative modifications to cellular components in plants[J]. Annual Review of Plant Biology,2007,58(1):459-481.
[24]Tan D X,Hardeland R,Manchester L C,et al. Functional roles of melatonin in plants,and perspectives in nutritional and agricultural science[J]. Journal of Experimental Botany,2012,63(2):577-597.
[25]张海燕,赵可夫. 盐分和水分胁迫对盐地碱蓬幼苗渗透调节效应的研究[J]. 植物学报,1998,40(1):56-61.
[26]李德全,邹 琦,程炳嵩. 植物渗透调节研究进展[J]. 山东农业大学学报(自然科学版),1991,22(1):86-90.
