抗枇杷根腐病病菌的枇杷内生木霉P3.9菌株生物学特性
2018-03-12鲁海菊张晓永胡金碧田学军
鲁海菊, 张晓永, 江 涛, 胡金碧, 田学军
(红河学院生命科学与技术学院,云南蒙自 661199)
随着农业产业结构调整,大规模连片种植单一作物导致土壤连作障碍日渐突显,土传病害是导致土壤连作障碍的重要因素之一,而引入拮抗菌是生物防治连作障碍的措施之一[1]。木霉(Trichoderma)是防治作物土传病害的重要拮抗真菌,曾成功防治辣椒白绢病和猝倒病[2]、黄瓜枯萎病[3]、辣椒疫病[4]等多种土传病害。虽然野生型木霉菌株对植物病原菌有较强的抑制作用,但在田间其防效会大幅度下降,其主要原因是木霉在根际土壤中定殖受到各种环境因素的影响,很难成功定殖。有学者曾用紫外线诱变方法获得强根际能力的木霉菌株[5]。众多学者研究表明,在植物体内存在内生木霉,在可可[6]、茶树[7]、芦竹[8]、南方红豆杉[9]等植物中成功分离到内生木霉。其中,在芦竹和南方红豆杉中分离的木霉分别对烟草赤星病和水稻纹枯病有很好的防治效果。同时发现,从其他地方分离的木霉菌株也能在可可茎上定殖,与其形成共生关系,最终成为宿主的内生真菌[10]。说明不管是本地的内生木霉还是从外界引入的木霉,均能与宿主形成共生关系,最终成为宿主的内生真菌,对宿主有促生、抗病等作用[11]。内生木霉受到寄主植物的良好保护,并能获得足够的碳、氮源供其自身生长。因此,内生木霉比其他腐生的木霉更易于发挥生防作用。笔者从枇杷主干韧皮部中分离到1株内生木霉P3.9菌株,它对枇杷根腐病病菌(Pestalotiopsissp.)[12]、康乃馨根腐病病菌(Fusariumsp.)[12]、辣椒黄萎病病菌(Verticilliumsp.)[12]、万寿菊叶斑病病菌(Alternariasp.)[12]、石榴干腐病病菌[13]等均具有强烈的抑制作用,能成功定殖于枇杷主干及黄瓜根、茎、叶中,并具有固氮、抗化学农药、降解难溶性磷酸盐、降解纤维素等多种功能[14]。可见,内生木霉P3.9菌株具有广阔的开发应用前景。因此,对枇杷内生木霉P3.9菌株进行生物学特性研究,可为进一步开发其应用研究提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试菌株 笔者从枇杷主干韧皮部组织分离内生真菌,经枇杷根腐病菌对峙培养筛选,获得抗枇杷根腐病病菌的木霉P3.9菌株(Trichodermasp.)。
1.1.2 供试培养基 马铃薯葡萄糖琼脂培养基(potato dextrose agar,简称PDA;配方为200 g马铃薯、16 g葡萄糖、20 g 琼脂粉、1 000 mL蒸馏水)、马铃薯蔗糖琼脂培养基(potato saccharose agar,简称PSA;配方为200 g马铃薯、16 g蔗糖、20 g琼脂粉、1 000 mL 蒸馏水)、玉米琼脂培养基(maize agar,简称MA;配方为30 g 玉米、17 g琼脂粉、1 000 mL 蒸馏水)、小麦琼脂培养基(wheat agar,简称WA;配方为30 g小麦、20 g琼脂粉、1 000 mL蒸馏水)、枇杷琼脂培养基(loquat agar,简称LA;配方为200 g枇杷叶、20 g 琼脂粉、1 000 mL蒸馏水)、胡萝卜琼脂培养基(carrot agar,简称CA;配方为200 g胡萝卜、20 g琼脂粉、1 000 mL蒸馏水)、查贝氏(Czapek’s)培养基(配方为2.00 g硝酸钠、1.00 g磷酸二氢钾、0.50 g氯化钾、0.50 g七水硫酸镁、0.01 g硫酸铁、30.00 g 蔗糖、20.00 g琼脂粉、1 000 mL蒸馏水)。
1.1.3 试验试剂 碳源(葡萄糖、D-果糖、可溶性淀粉、麦芽糖、α-乳糖、蔗糖、D-甘露醇)、氮源(酵母膏、牛肉膏、蛋白胨、尿素、硫酸铵、硝酸铵、磷酸二氢铵)。上述材料均购自当地农贸市场及试剂公司,试剂均为分析纯。
1.2 试验方法
1.2.1 不同培养基对内生木霉P3.9菌株菌丝生长的影响 将内生木霉P3.9菌株接种在PDA平板培养基中,28 ℃条件下扩大培养5 d,在培养基同一半径周围用打孔器取直径为 5 mm 的菌丝块,同时接种于PDA、PSA、MA、WA、CA、LA等6种培养基平板中央,设3次重复,在28 ℃条件下恒温培养,5 d 后采用十字交叉法[15]测定其菌落直径。
1.2.2 碳、氮源对内生木霉P3.9菌株菌丝生长的影响 以查贝氏培养基为基础培养基,分别用相同质量分数的碳(葡萄糖、D-果糖、可溶性淀粉、麦芽糖、α-乳糖、蔗糖、D-甘露醇)和氮(酵母膏、牛肉膏、蛋白胨、尿素、硫酸铵、硝酸铵、磷酸二氢铵)替换蔗糖和硝酸钠,菌株接种以及菌落直径测量同“1.2.1”节中的方法。
1.2.3 温度对内生木霉P3.9菌株菌丝生长的影响 以PDA为供试培养基,接种后分别在温度为5、10、15、20、25、30、35、40 ℃条件下恒温培养,菌株接种及菌落直径测量同“1.2.1”节中的方法。
1.2.4 pH值对内生木霉P3.9菌株菌丝生长的影响 以PDA为供试培养基,分别用0.1%盐酸、0.1%氢氧化钠将pH值调至3、4、5、6、7、8、9、10,菌株接种以及菌落直径测量同“1.2.1”节中的方法。
1.2.5 光照对内生木霉P3.9菌株菌丝生长的影响 以PDA为供试培养基,接种后分别在光—暗交替(12 h—12 h)、全黑暗和全光照3种光处理下培养,菌株接种以及菌落直径测量同“1.2.1”节中的方法。
1.2.6 不同湿度对内生木霉P3.9菌株菌丝生长的影响 以PDA为供试培养基,接种后分别在50%、60%、70%、80%、90%、100%湿度条件下,28 ℃恒温条件下黑暗培养5 d,菌株接种以及菌落直径测量同“1.2.1”节中的方法。
1.2.7 不同营养液对内生木霉P3.9孢子萌发的影响 用2%葡萄糖、2%蔗糖、2%蛋白胨、2%葡萄糖+1%蛋白胨、2%蔗糖+1%蛋白胨配制1×106个/mL P3.9菌株木霉孢子液,取0.2 mL涂布于PDA平板上,28 ℃恒温条件下黑暗培养 18 h 后观察。
1.2.8 内生木霉P3.9菌株孢子的致死温度 用无菌水配制1×106个/mL木霉P3.9菌株孢子液,放入离心管中,在温度为40、45、50、52、55 ℃条件下水浴10 min,在28 ℃恒温条件下黑暗培养18 h后观察孢子的萌发情况。以上所有配制好的培养基用高压蒸汽灭菌锅于121 ℃条件下灭菌25 min。
1.2.9 数据统计 所有试验数据均采用SPSS 19.0统计软件中的Duncan’s多重比较法进行统计分析,计算处理间的差异显著性。
2 结果与分析
2.1 不同培养基对内生木霉P3.9菌株菌丝生长的影响
由表1可知,内生木霉P3.9菌株在不同培养基上均能正常生长,具有较强的营养适应性。内生木霉P3.9菌株在PDA培养基上生长的菌落直径与在其他培养基上生长的菌落直径相比差异极显著,菌落直径最大,说明PDA培养基最适合内生木霉P3.9菌株菌丝生长。
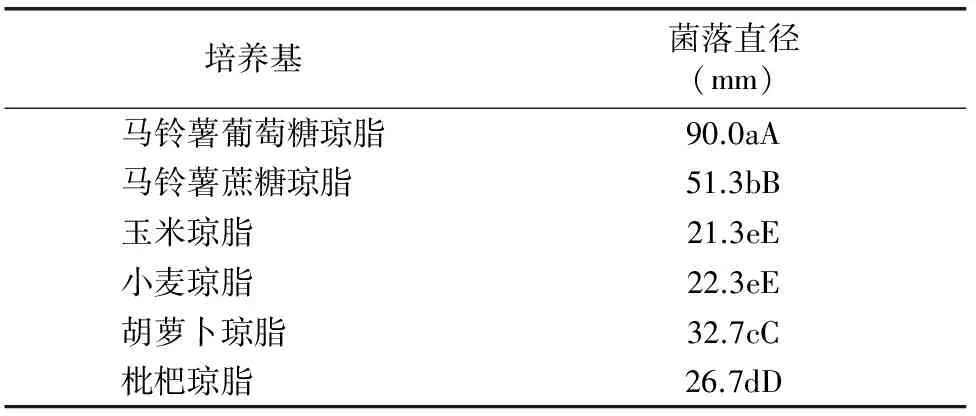
表1 不同培养基对内生木霉P3.9菌株菌丝生长的影响
注:同列数据后不同大写、小写字母分别表示在0.01、0.05水平上差异显著,下表同。
2.2 不同碳源对内生木霉P3.9菌株菌丝生长的影响
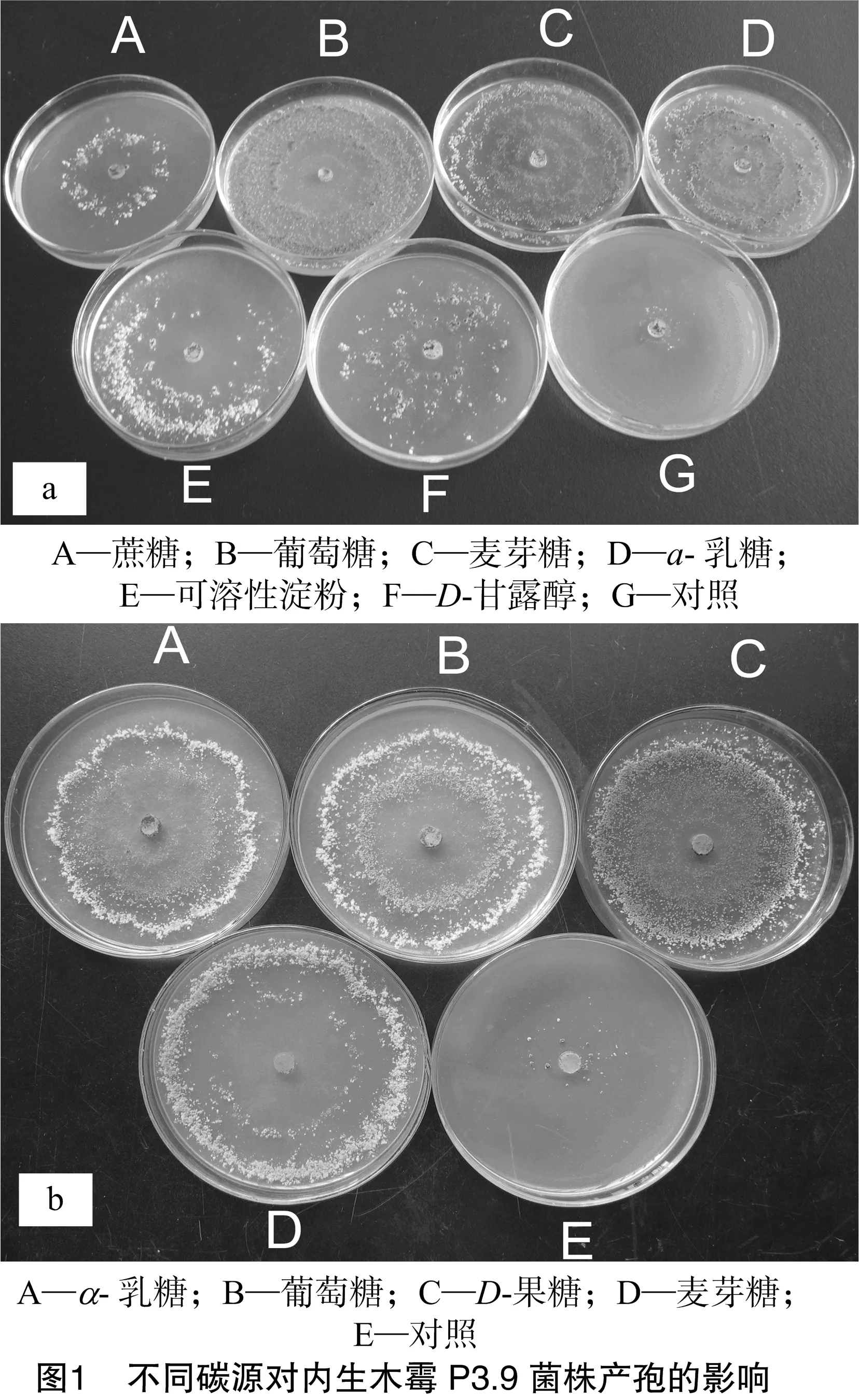
由表2可知,内生木霉P3.9菌株在不同碳源培养基上均能正常生长,具有较强的碳源适应性。相比较而言,蔗糖中的菌丝生长菌落直径与其他碳源差异极显著,菌落直径最小(除无碳源对照外),说明蔗糖不适合内生木霉P3.9菌株菌丝生长,而其他6种供试碳源均适合其菌丝生长。由图1可知,D-果糖产孢量最多,因此D-果糖最适合内生木霉P3.9菌株产孢。

表2 不同碳源对内生木霉P3.9菌株菌丝生长的影响
2.3 不同氮源对内生木霉P3.9菌株菌丝生长的影响
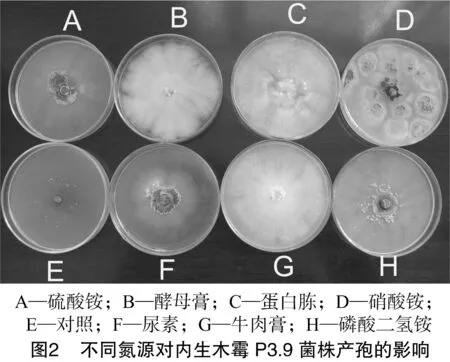
由表3可知,内生木霉P3.9菌株在不同氮源培养基上均能正常生长,具有较强的氮源适应性。在磷酸二氢铵中生长的内生木霉P3.9菌株菌落直径与其他6种供试氮源相比,差异极显著,菌落直径最大,说明磷酸二氢铵最适合内生木霉P3.9菌株菌丝生长。另外观察可知,铵态氮适合内生木霉P3.9菌株产孢(图2)。
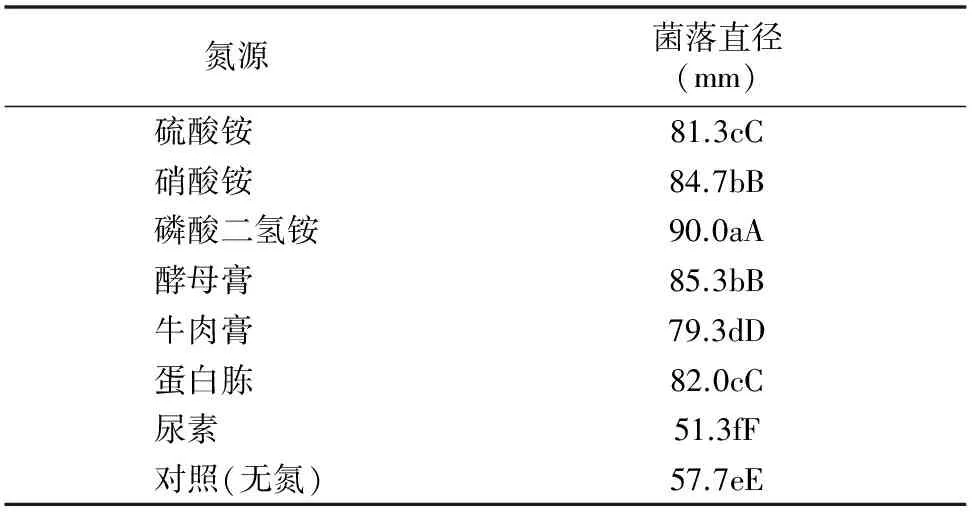
表3 不同氮源对内生木霉P3.9菌株菌丝生长的影响
2.4 不同温度对内生木霉P3.9菌株菌丝生长的影响
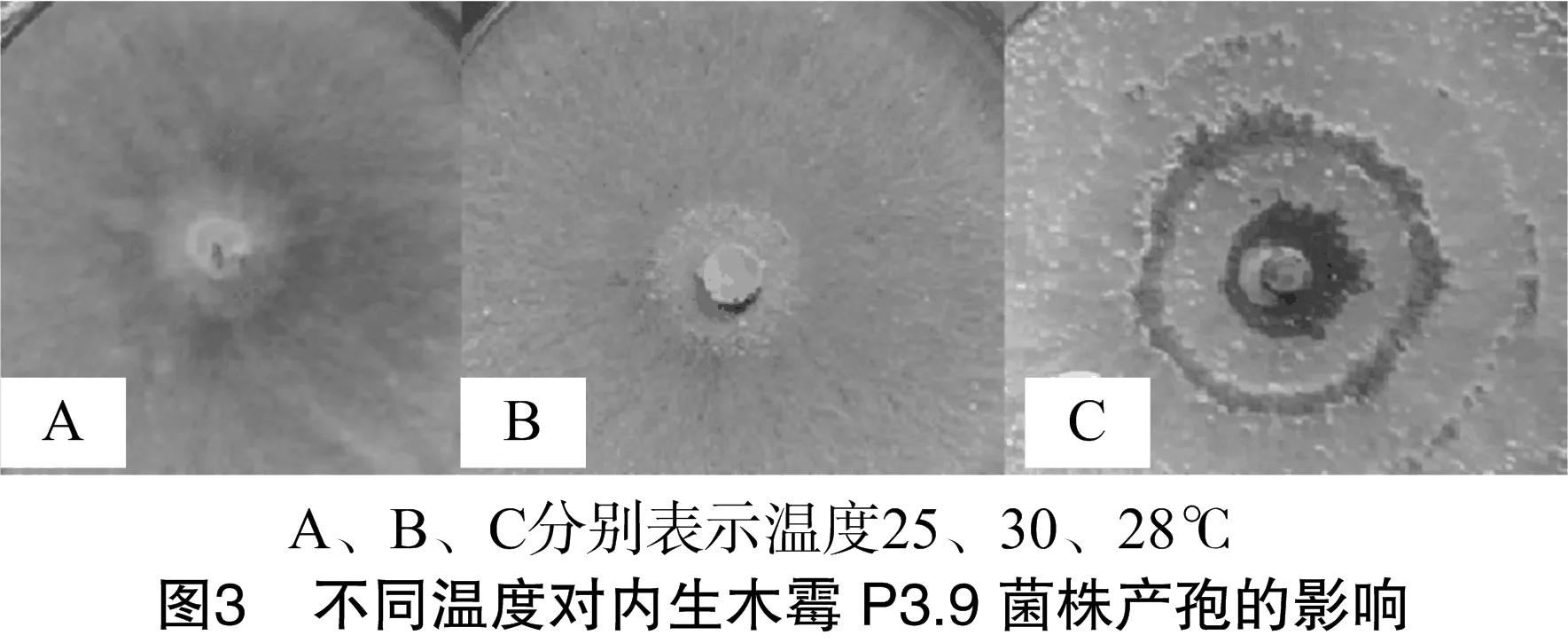
由表4可知,在温度为10~35 ℃之间,内生木霉P3.9菌株菌丝均能正常生长,在15~30 ℃之间内生木霉P3.9菌株菌落直径分别与其他温度处理差异极显著,菌落直径较大,说明在15~30 ℃范围内最适合内生木霉P3.9菌株菌丝生长。由图3可知,与温度为25、30 ℃处理相比,在28 ℃条件下内生木霉P3.9菌株产孢量较多,适合产孢。
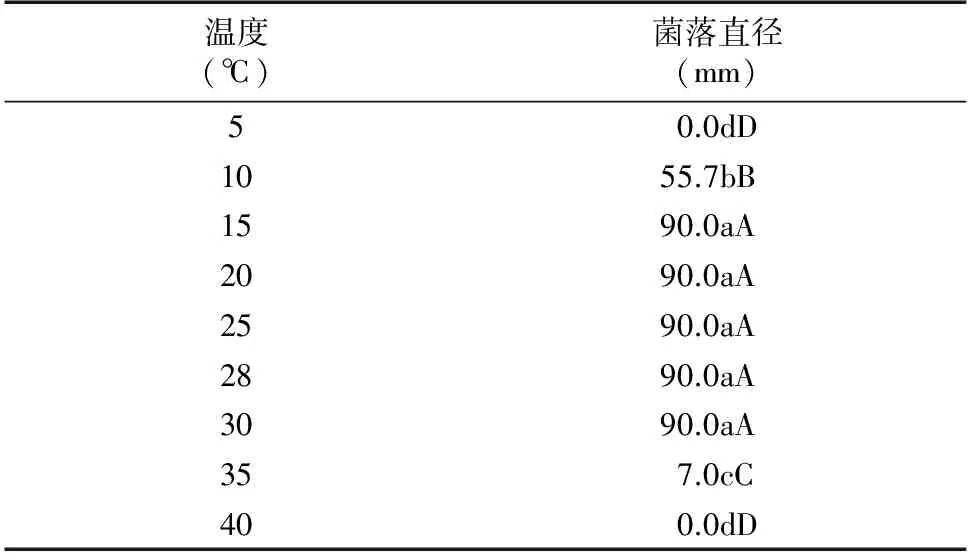
表4 不同温度对内生木霉P3.9菌株菌丝生长的影响
2.5 不同pH值对内生木霉P3.9菌株菌丝生长的影响
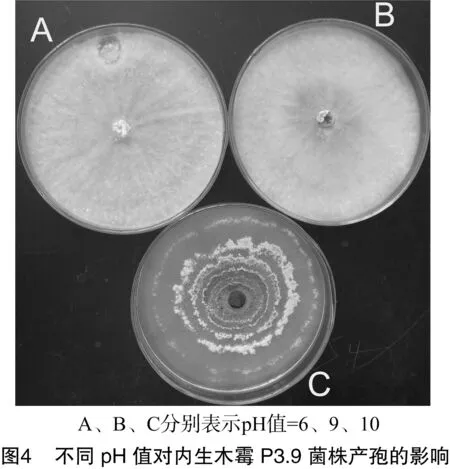
由表5可知,在pH值为3~10时,内生木霉P3.9菌株菌丝均能正常生长,菌落直径差异不显著,均达到90.0 mm,具有较强的pH值适应性。由图4可以看出,pH值为10时,内生木霉P3.9菌株菌丝直径最大,产孢量最多。
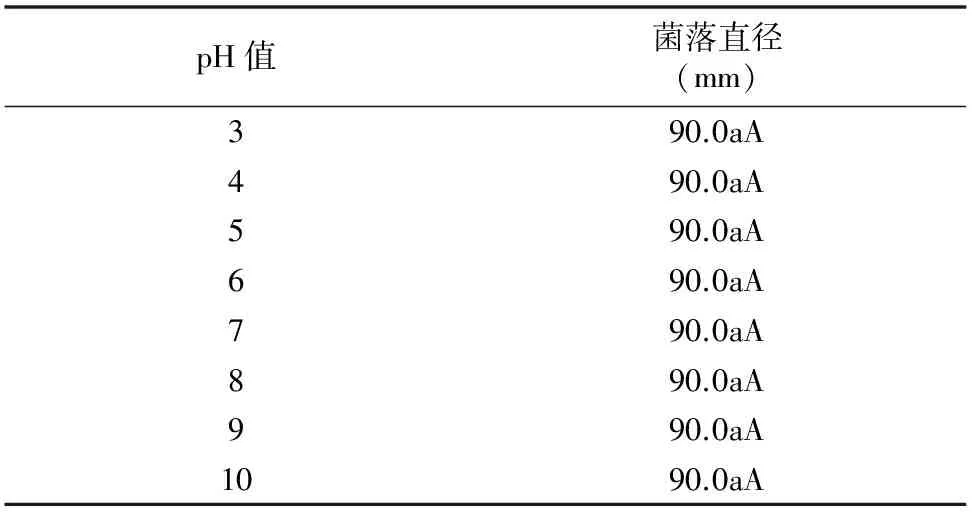
表5 不同pH值对内生木霉P3.9菌株菌丝生长的影响
2.6 光照对内生木霉P3.9菌株菌丝生长的影响
由表6可知,在光暗交替(12 h—12 h)、全黑暗和全光照3种光处理下,内生木霉P3.9菌株菌落直径差异不显著,菌落直径均达到90.0 mm,说明光照并不影响菌丝生长。其中,光暗交替最适合其产孢(图5)。

表6 光照对内生木霉P3.9菌株菌丝生长的影响

2.7 不同湿度对内生木霉P3.9菌株菌丝生长的影响
由表7可知,在不同湿度下内生木霉P3.9菌株菌落直径差异不显著,菌落直径均达到90.0 mm,说明湿度不影响内生木霉P3.9菌株菌丝生长。

表7 不同湿度对内生木霉P3.9菌株菌丝生长的影响
2.8 不同营养液对内生木霉P3.9菌株孢子萌发的影响
由表8可知,与清水对照相比,不同配比的葡萄糖、蔗糖和蛋白胨溶液对内生木霉P3.9菌株孢子萌发率影响差异极显著,说明内生木霉P3.9菌株孢子萌发受葡萄糖、蔗糖和蛋白胨溶液的影响,其中2%蛋白胨溶液极显著促进内生木霉P3.9菌株孢子萌发,2%葡萄糖和2%蔗糖溶液则极显著抑制孢子萌发。
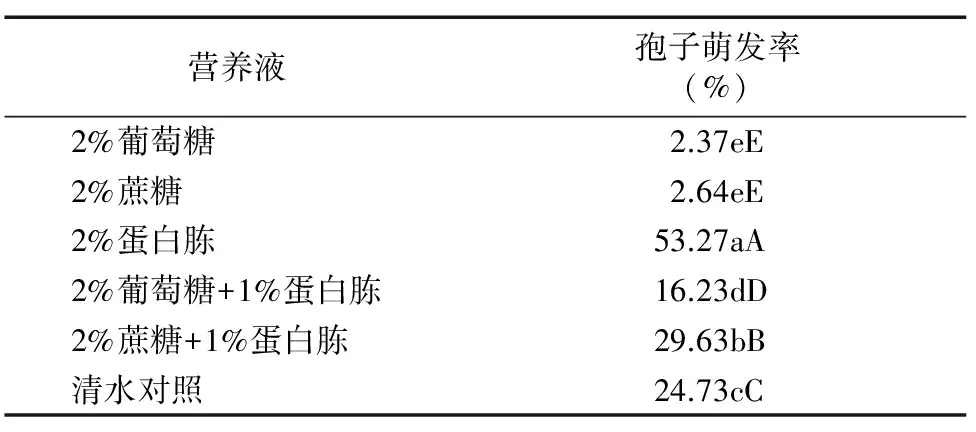
表8 不同营养液对内生木霉P3.9菌株孢子萌发的影响
2.9 内生木霉P3.9菌株孢子致死温度
由表9可知,在28 ℃恒温条件下培养18 h,不同温度水浴处理的内生木霉P3.9菌株孢子萌发率差异明显,在52、55 ℃ 2种处理中,内生木霉P3.9菌株孢子的萌发率为0,两者间无显著差异,因此选择52 ℃作为内生木霉P3.9菌株孢子的致死温度(图6)。
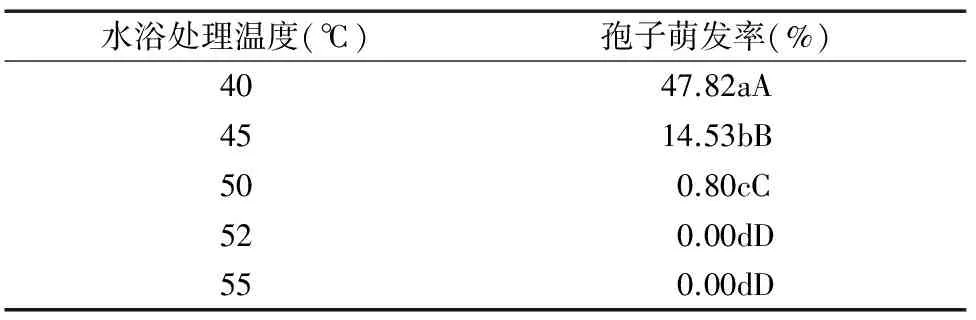
表9 内生木霉P3.9菌株孢子致死温度

3 结论与讨论
生物学测定结果表明,枇杷内生木霉P3.9菌株最适合的培养条件为PDA培养基、碳源为D-果糖、氮源为磷酸二氢铵、温度为28 ℃、pH值=10、光暗交替;2%蛋白胨溶液能极显著提高内生木霉P3.9菌株孢子萌发率,孢子致死温度为 52 ℃,铵态氮适合产孢。D-果糖、葡萄糖、麦芽糖、α-乳糖和D-甘露醇5种碳源之间对内生木霉P3.9菌株菌丝生长差异不显著,但D-果糖产孢量最多,因此D-果糖为最适合碳源;在15~30 ℃范围内,内生木霉P3.9菌株菌丝均可以获得正常生长,但28 ℃适合产孢,因此产孢最佳温度为 28 ℃;pH值在3~10范围内,内生木霉P3.9菌株菌丝均可以正常生长,但pH值=10适合产孢,因此pH值=10为最佳酸碱度;光照不影响菌丝生长,但能促进产孢,光暗交替产孢量最大,因此光暗交替最适合P3.9木霉菌株生长。
在杨树枝干上分离的T88木霉菌株最佳培养条件为PDA培养基、碳源为果糖、温度为30 ℃,光照有利于产孢[16],铵是木霉菌最易利用的氮源[17],与本研究结论基本一致。分离自菜园土中的绿色木霉HT-01菌株的最佳酸碱度为5[18],与本研究结论不一致,导致该差异的原因可能是2个菌株之间小生境不一致,枇杷属于碱性果树,在其中生长的木霉菌株长期适应碱性环境,因此偏碱性更适合其生长。这也是内生菌与寄主相互适应、协调进化[19]的又一个例证。1%葡萄糖溶液促进木霉菌Tr 970菌株孢子萌发,致死温度为55 ℃(15 min)[20],与本研究结论不一致。在15~40 ℃范围内长枝木霉TICC菌株能生长产孢,在35 ℃时菌丝生长最快[21],与本研究结论不一致。说明不同木霉菌株生长温度范围变化幅度较大,内生木霉P3.9菌株生长温度范围为15~30 ℃,在温度为10、35 ℃条件下菌丝虽能生长,但速度很慢,由此推测内生木霉P3.9菌株只适合应用在昼夜温差及季节温差不大的南方。
[1]郑军辉,叶素芬,喻景权. 蔬菜作物连作障碍产生原因及生物防治[J]. 中国蔬菜,2004(3):56-58.
[2]杨雨环,燕嗣皇,陆德清. 木霉防治辣椒白绢病和猝倒病实验研究[J]. 贵州农业科学,1996(2):31-34.
[3]高 苇,李宝聚,王万立,等. 菌糠木霉发酵物对黄瓜枯萎病的防效研究[J]. 北方园艺,2013(16):140-143.
[4]胡 琼,张海松. 木霉菌TC对辣椒疫病的防治效果[J]. 北方园艺,2012(3):147-149.
[5]鲁海菊,刘云龙. 哈茨木霉强根际定殖能力菌株的筛选[J]. 中国生物防治,2008,24(2):138-142.
[6]Samuels G J,Suarez C,Solis K,et al. et al.TrichodermatheobromicolaandT.paucisporum:two new species isolated from cacao in South America[J]. Mycological Research,2006,110(4):381-392.
[7]武汉琴,苏经迁,谢明英,等. 茶树内生木霉种的鉴定及其在植物体内的定殖[J]. 菌物学报,2009,28(3):342-348.
[8]纪丽莲. 芦竹内生真菌F0238对烟草赤星病的防治作用[J]. 江苏农业科学,2005(2):54-56.
[9]王国平,鲁书玲,郑必强,等. 内生真菌紫杉木霉ZJUF0986菌株及其活性代谢产物防治水稻纹枯病的效果[J]. 中国生物防治,2009,25(1):30-34.
[10]Bailey B A,Strem M D,Wood D.Trichodermaspecies form endophytic associations withinTheobromacacaotrichomes[J]. Mycological Research,2009,113(12):1365-1376.
[11]Nagaraju A,Sudisha J,Mahadeva S M,et al. Seed priming withTrichodemaharzianumisolates enhances plant growth and induces resistance againstPlasmoparahalstedii,an incitant of sunflower downy mildew disease[J]. Australasian Plant Pathology,2012,41(6):609-620.
[12]鲁海菊,张建春,杞敬香,等. 枇杷内生木霉P3.9抗菌谱研究[J]. 北方园艺,2014(24):103-107.
[13]鲁海菊,全舒舟,李香香,等. 枇杷内生真菌中拮抗石榴干腐病菌菌株的筛选[J]. 热带农业科学,2013,33(7):58-62.
[14]鲁海菊,沈云玫,陶宏征,等. 内生木霉P3.9菌株的多功能性及其枇杷根腐病的盆栽防效[J]. 西北农业学报,2017,26(11):1-8.
[15]方中达. 植病研究方法[M]. 3版.北京:中国农业出版社,1998:57-125.
[16]高克祥,项存悌,骆会欣,等.木霉菌株T88生物学特性的研究[J]. 东北林业大学学报,1995,23(2):33-39.
[17]李立平,段德芳. 木霉生物学特性及拮抗作用研究进展[J]. 植物医生,2006,19(4):4-6.
[18]刘连妹,屈海泳,牛 潇,等. 绿色木霉HT-01的生物学特性和抑菌特性[J]. 西北农业学报,2008,17(6):179-183.
[19]谢丽华,王国红,杨民和. 内生真菌及其对宿主植物生态适应性的影响[J]. 菌物研究,2006,4(3):98-106.
[20]王 勇,王万立,刘春艳,等. 生防木霉菌Tr9701的鉴定及其生物学特性[J]. 华北农学报,2006,21(1):100-104.
[21]王 斌,Bakar A K,刘金亮,等. 长枝木霉TICC鉴定及其生物学特性研究[J]. 中国农学通报,2011,27(5):338-345.
