滇牡丹3-酮酯酰-CoA合酶基因克隆与功能分析
2018-03-12朱金鑫孙金金原晓龙杨宇明
朱金鑫, 孙金金, 原晓龙, 王 娟, 杨宇明, 王 毅
(1.西南林业大学林学院,云南昆明 650224; 2.云南省林业科学院,云南昆明 650201; 3.国家林业局重点开放性实验室/云南珍稀濒特森林植物保护和繁育实验室/云南省森林植物培育与开发利用重点实验室,云南昆明 650201)
牡丹属芍药属牡丹组,具有很高的观赏和药用价值[1-2],牡丹籽油作为中药丹皮(牡丹根皮)生产中的副产品,其食用药用价值逐渐被人们发现,并不断加强重视。研究人员发现,牡丹籽油中含有丰富的不饱和脂肪酸,具有重要的研究价值和应用潜力[3]。滇牡丹(Paeoniadelavayi)主要分布在云南省中部至西北部、西藏自治区东南部和四川省西南部海拔 1 900~3 600 m的部分区域,是中国西南地区特有的珍稀种质资源,1992年中国植物红皮书将滇牡丹列为渐危种,1996年中国野生植物保护条例将滇牡丹定为国家二级保护植物[4-7]。滇牡丹虽然自然分布狭窄,但其栽培范围广[4],因此具有极大的引种驯化和育种空间,应用价值高。
超长链单不饱和脂肪酸(very long chain monounsaturated fatty acid,简称VLCMFA)是指主链上碳原子数≥18,有且仅有1个双键的脂肪酸[8]。VLCMFA在生物体内参与生物膜膜脂、鞘脂的合成,是角质层蜡质生物合成的前体物质[9],VLCMFA不仅在生物体内具有广泛的重要作用,而且具有独特的医疗保健、化工用途,高单不饱和脂肪酸食用油具有降血脂、保护心脑血管、促进婴幼儿大脑发育等优点[10-11],在工业上可以制备人造纤维、表面树脂、油漆干性剂等重要化工原料[12-13]。VLCMFA在生物体内主要以油酸等单不饱和脂肪酸为底物,在脂肪酰-CoA延长酶复合体的催化下合成,其中脂肪酰-CoA延长酶复合体包括4个酶:3-酮酯酰-CoA合酶(3-ketoacyl-CoA synthase,简称KCS)、3-酮酯酰-CoA还原酶(3-ketoacyl- CoA reductase,简称KCR)、3-羟酯酰-CoA脱水酶(3-hydroxyacyl-CoA dehydrase,简称HCD)、羟酯酰-CoA还原酶(enoyl-CoA reductase,简称ECR)[14-15],其中KCS催化步骤是其中的关键步骤[16],因此被认为是VLCMFA生物合成途径中的限速酶而得到广泛研究。目前KCS已经在油菜[17-18]、大豆[19-20]、油桐[21]、油茶[22]等传统油料作物中被广泛研究,2011年中华人民共和国卫生部将牡丹籽油列入新资源食品后[23],油用牡丹迅速成为研究热点。本研究从滇牡丹中克隆得到KCS基因并进行生物信息学分析,为进一步研究其调控机制及获得含高VLCMFA油用品种奠定理论基础。
1 材料与方法
1.1 试验材料与试剂
滇牡丹种子于2014年6—9月采集于云南省昆明市林业科学院树木园苗圃,样本经液氮速冻后于-80 ℃冰箱内保存待用。总RNA小量提取试剂盒购自美国Qiagen公司,pESY-T3克隆试剂盒与感受态细胞购自北京全式金生物技术有限公司,LA-Taq酶、反转录酶M-MLV购自大连宝生物工程有限公司。
1.2 试验方法
1.2.1PdKCS基因的克隆 通过转录组分析获得1个只含有部分滇牡丹KCS基因的序列片段,根据该基因片段序列设计特异性引物5′-RACE引物(本试验所用引物见表1)对 5′-基因片段进行克隆。按照总RNA小量提取试剂盒操作步骤提取总RNA,检测总RNA浓度及完整性后反转录合成cDNA第1链。按照试剂盒操作步骤扩增获得PdKCS基因5′端序列片段,利用ATGC序列拼接软件将5′-RACE获得的基因片段和转录组数据分析获得的基因片段进行拼接后获得PdKCS全长基因序列。以PdKCS基因全长序列为模板,设计含有起始密码子和终止密码子的特异性引物PdKCSF、PdKCSR,以滇牡丹种子cDNA为模板,PdKCSF和PdKCSR为引物扩增PdKCS基因cDNA开放阅读框全长序列,PCR反应体系参考PrimeScriptTMKit。扩增程序为: 94 ℃ 5 min; 94 ℃ 30 s,58 ℃ 45 s,72 ℃ 90 s,30个循环; 72 ℃ 延伸7 min。将PCR产物转入pESY-T3载体中送测序公司检测并验证。
1.2.2 生物信息学分析 应用ProtParam(http://web.expasy.org/protparam)在线工具分析蛋白质理化性质;应用ProtScale(http://web.expasy.org/protscale/)在线工具进行蛋白质亲疏水性预测分析;应用Tmpred(http://www.ch.embnet.org/soft-ware/TMPRED_form.html)在线工具分析蛋白质序列跨膜结构域;应用Cell-PLoc(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc/)进行亚细胞定位;应用NCBI(http://www.ncbi.nlm.nih.gov/)Blast和DNAMAN生物学软件进行氨基酸多序列比对分析;利用软件MEGA 5.0以邻位连接法构建氨基酸序列的系统进化树;数据使用GraphPad Prism v5.0进行分析制图。

表1 引物序列
1.2.3 荧光定量PCR检测PdKCS组织表达分析 以获得的PdKCS基因序列为模板设计特异性引物PdKCSFt和PdKCSRt;分别采集滇牡丹授粉后30、50、70、90 d的种子,采集后立即放入液氮中。用RNA小量提取试剂盒提取滇牡丹不同发育时期的种子总RNA,电泳检测后-80 ℃保存;参照反转录酶M-MLV试剂盒合成cDNA,保存于 -20 ℃;RT-PCR反应用荧光染料SYBR Green Ⅰ,GAPDH为内参基因。PCR反应体系20 μL,反应程序为:94 ℃ 4 min;95 ℃ 15 s,57 ℃ 15 s,72 ℃ 25 s,35个循环;72 ℃单点检测信号。反应结束后,60 ℃连续检测信号产生溶解曲线。用Opticon monitor 3.1软件进行数据的记录和分析。每个样品3次重复,灭菌水为空白对照。
2 结果与分析
2.1 PdKCS基因的克隆与序列分析
通过分析滇牡丹种子转录组获得的KCS基因片段,依据获得的基因片段设计5′-RACE基因扩增特异性引物,以cDNA为模板进行PCR扩增5′-RACE获得基因片段,利用ATGC序列拼接软件,最终获得全长cDNA序列1 527 bp,命名为PdKCS,序列提交GenBank(登录号KX524949)。利用NCBI ORF Finder软件对拼接数据结果进行序列分析,结果显示PdKCS基因片段包含完整的cDNA开放阅读框,编码502个氨基酸残基的蛋白质,起始密码子为ATG,终止密码子TAA,并根据获得的PdKCS基因全长设计含有起始密码子和终止密码子的特异性引物,以cDNA为模板扩增获得PdKCS基因开放阅读框,并将扩增产物连接到克隆载体中,进行永久保存。
2.2 PdKCS蛋白理化性质预测
蛋白理化性质分析结果显示,PdKCS分子式为C2 534H4 008N688O709S23,相对分子质量为56 193.2,理论等电点为9.36,脂肪酸系数为96.1,亲水性平均系数为-0.026,不稳定指数为40.61,该蛋白为碱性亲水不稳定蛋白(图1)。
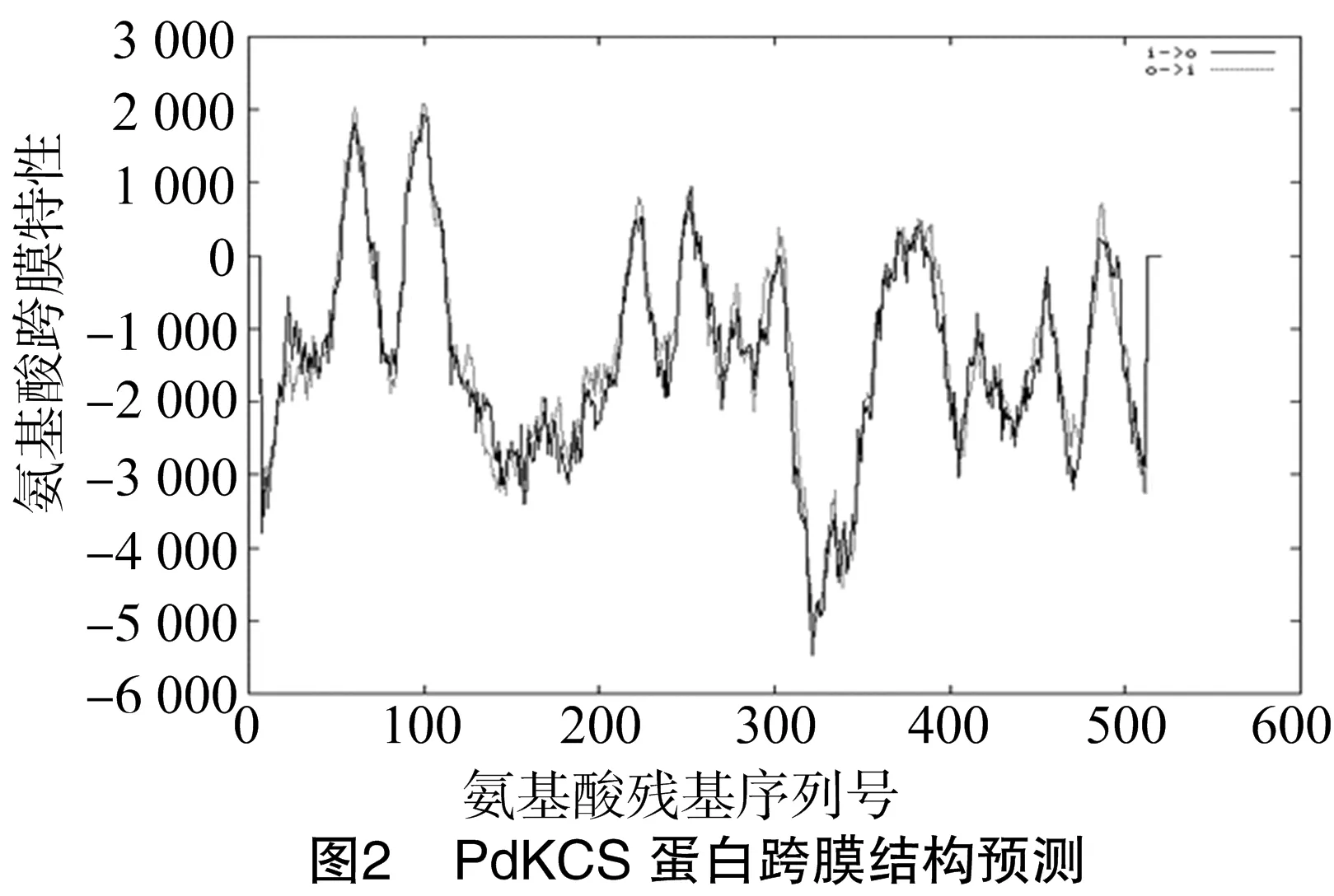
PdKCS蛋白跨膜结构预测如图2所示,亚细胞定位结果显示PdKCS定位于质体膜。
2.3 PdKCS氨基酸序列比对分析
将克隆出来的PdKCS基因编码的氨基酸蛋白序列与已报道的KCS的氨基酸序列进行多重序列比对。结果显示,该蛋白与已报道的PdKCS含有KCS家族的高度保守区“PTPSLSAM”“FGNTSSSS”“GSGFKCNSAVW”和催化区域“GMGCSA”(图3),表明该蛋白属于KCS家族蛋白。PdKCS的氨基酸序列与花生(Arachishypogaea)氨基酸序列(登录号:ACZ51240.1)相似性达65.45%,与油茶(Camelliaoleifera)氨基酸序列(登录号:ACQ41892.1)相似性达84.46%,与可可(Theobromacacao)氨基酸序列(登录号:XP_007042184.1)相似性达85.46%,与树棉(Gossypiumarboreum)氨基酸序列(登录号:ALJ55536.1)相似性达81.3%。

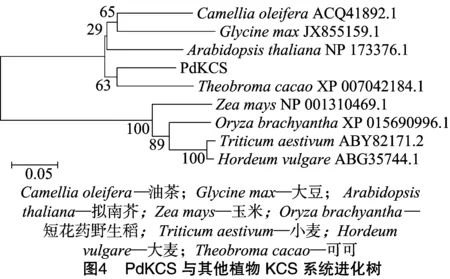
2.4 PdKCS基因系统进化树分析
利用MEGA 5.0软件构建基于PdKCS氨基酸的系统进化树(图4),结果表明,PdKCS与可可KCS(XP_007042184.1)聚为一类,亲缘关系最近,与双子叶植物聚为同一分支,与单子叶植物聚为不同分支,亲缘关系最远。由基因系统进化树可知,双子叶植物的KCS已经形成与单子叶植物亲缘关系较远的、相对独立的家族,这与目前的研究结果相吻合。
2.5 荧光定量PCR检测PdKCS
利用RT-PCR方法和PdKCS的基因特异性引物检测其在授粉后30、50、70、90 d后种子中的表达情况(图5)。使用GraphPad Prism v5.0进行数据分析, 结果显示PdKCS的表达为双峰型,在授粉后30 d时PdKCS的表达量达到第1个高峰,此后表达水平降低,在50 d后表达水平再次升高,在授粉后70 dPdKCS表达水平最高,而在种子发育后期,即授粉后70~90 d内,PdKCS表达水平降低,不饱和脂肪酸合成量降低,以积累饱和脂肪酸等物质以备萌发所需。

3 结论与讨论
KCS是植物体内催化以油酸等单不饱和脂肪酸延长碳链产生超长链单不饱和脂肪酸生物合成途径的的关键。本研究将转录组数据分析后克隆得到的滇牡丹KCS基因序列, 命名为PdKCS,GenBank登录号为KX524949,包含完整的cDNA开放阅读框,其开放阅读框全长1 527 bp,起始密码子为ATG,终止密码子为TAA,编码含502个氨基酸残基的蛋白质。生物信息学分析结果显示,PdKCS含有KCS蛋白家族的保守结构域,且与已报道的KCS具有高度一致性,表明该蛋白属于KCS家族蛋白。蛋白理化性质分析结果显示,PdKCS分子式为C2 534H4 008N688O709S23,相对分子质量为 56 193.2,理论等电点为9.36,脂肪酸系数96.1,亲水性平均系数为 -0.026,不稳定指数为40.61,该蛋白为碱性亲水不稳定蛋白,蛋白跨膜结构预测显示该蛋白为跨膜蛋白,亚细胞定位结果显示PdKCS定位于质体膜。

滇牡丹具有生态适应性强、栽培范围广等优点,因此滇牡丹具有极大的引种驯化和育种空间,牡丹籽油中含有丰富的不饱和脂肪酸,具有重要的研究价值和应用潜力,因此选育出高单不饱和脂肪酸含量的油用滇牡丹品种并推广种植,有利于促进地区林业的可持续发展。VLCMFA在生物体内主要以油酸等单不饱和脂肪酸为底物,在脂肪酰-CoA延长酶复合体的催化下合成,而脂肪酰-CoA延长酶复合体中的KCS被认为是VLCMFA生物合成途径中的限速酶,对其深入研究有助于进一步了解VLCMFA的合成过程及调控机制。因此,PdKCS基因可作为未来滇牡丹油脂高产型新品种培育的调控研究重点。本研究从滇牡丹中克隆得到KCS基因并进行生物信息学分析,为进一步研究它的调控机制及获得种子单不饱和脂肪酸含量高的油用滇牡丹品种,促进地区林业的可持续发展,创造巨大的经济价值奠定理论基础。
[1]潘开玉. 芍药科分布格局及其形成的分析[J]. 植物分类学报,1995,33(4):340-349.
[2]王莲英. 中国牡丹品种图志[M]. 北京:中国林业出版社,1997:2-7.
[3]周海梅,马锦琦,苗春雨,等. 牡丹籽油的理化指标和脂肪酸成分分析[J]. 中国油脂,2009,34(7):72-74.
[4]李 奎. 滇牡丹保护生物学与遗传多样性研究[D]. 北京:中国林业科学研究院,2013:1.
[5]龚 洵,潘跃芝,杨志云. 滇牡丹的多样性和现状评估[J]. 西北植物学报,2003,23(2):218-223.
[6]中华人民共和国野生植物保护条例[J]. 河南省人民政府公报,1996(12):14-16.
[7]于永福. 中国野生植物保护工作的里程碑——《国家重点保护野生植物名录(第一批)》出台[J]. 植物杂志,1999(5):3-11.
[8]Murphy D J,Mukherjee K D. Biosynthesis of triacylglycerols containing very long chain acyl moieties in seeds[M]// Biological Role of Plant Lipids,1989:143-146.
[9]倪 郁,郭彦军. 植物超长链脂肪酸及角质层蜡质生物合成相关酶基因研究现状[J]. 遗传,2008,30(5):561-567.
[10]Okamoto T,Chimi K,Maruyama T,et al. Nutritional studies of hardened fish oil. Ⅰ:comparisons of the effects of hardened fish oil on fatty acid profiles of tissue lipids with those of soybean oil and hardened soybean oil in rats[J]. Journal of Japan Oil Chemists Society,1988,37:177-184.
[11]王性炎,王姝清. 神经酸研究现状及应用前景[J]. 中国油脂,2010,35(3):1-5.
[12]田德雨,王士安,王立昊,等. 超长链单不饱和脂肪酸的生物合成和代谢工程[J]. 生物技术通报,2015,31(12):42-49.
[13]周万平,郎春秀,熊鲜艳,等. 油菜籽芥酸含量遗传调控研究进展[J]. 核农学报,2010,24(3):537-541.
[14]Kunst L,Clemens S. Plant long chain fatty acid biosynthetic enzyme:US,US 6815579 B1[P]. 2004(9):12-26.
[15]淮东欣. 调控超长链脂肪酸合成关键基因对植物种子中脂肪酸组成的影响[D]. 武汉:华中农业大学,2015:7-12.
[16]Qi Q,Rose P A,Abrams G D,et al. (+)-Abscisic acid metabolism,3-ketoacyl-coenzyme A synthase gene expression,and very-long-chain monounsaturated fatty acid biosynthesis in brassica napus embryos[J]. Plant Physiology,1998,117(3):979-987.
[17]Guo Y,Mietkiewska E,Francis T,et al. Increase in nervonic acid content in transformed yeast and transgenic plants by introduction of aLunariaannuaL. 3- ketoacyl-CoA synthase(KCS) gene[J]. Plant Molecular Biology,2009,69(5):565-575.
[18]王 会,刘 佳,付 丽,等. 基因工程技术在油菜油脂中的研究进展[J]. 中国农学通报,2013(24):131-137.
[19]Cahoon E B,Marillia E F,Stecca K L,et al. Production of fatty acid components of meadowfoam oil in somatic soybean embryos[J]. Plant Physiology,2000,124(1):243-51.
[20]赵 艳,翟 莹,邱增成,等. 大豆KCS基因的克隆及结构预测[J]. 分子植物育种,2013,11(1):72-76.
[21]周俊琴,谭晓风,刘美兰,等. 油桐β-酮脂酰-CoA合成酶(KCS)基因的克隆与序列分析[J]. 经济林研究,2013,31(4):52-57.
[22]李 魏. 油茶β-酮脂酰-CoA合酶基因的全长cDNA克隆[D]. 北京:中南林业科技大学,2009:1-12.
[23]中华人民共和国卫生部公告2011年第9号[J]. 中华人民共和国卫生部公报,2011(2):264.
