桃叶卫矛种子休眠机制及催芽方法初探
2018-03-12,,
, ,
(东北林业大学园林学院,黑龙江 哈尔滨 150040)
桃叶卫矛(EuonymusbungeanusMaxim),又名丝棉木、白杜、明开夜合,是卫矛科卫矛属一种暖温带树种,广泛分布于我国境内,除广东、广西两地未见野生种外,北起黑龙江,内蒙古等地,南至长江两岸各省区均有野生资源存在,同时在世界上的其他一些国家也有分布,如乌苏里地区、西伯利亚南部和朝鲜半岛等地[1]。桃叶卫矛树皮灰色,幼时光滑,老时浅纵裂,树冠圆形或卵圆形。花期5—6月,花色淡绿,聚伞花序。果期9—10月,蒴果粉红色,可长期宿存于枝上。在冬季与白雪相互掩映,具有较高的观赏价值[2]。桃叶卫矛材质坚韧细致而洁白,可作雕刻用材,工艺制品等。刘继阳等研究发现,桃叶卫矛果实总皂苷对人肝癌细胞系-SMMC、人宫颈癌细胞系-HeLa和乳腺癌细胞系-MCF 7有明显的抑制生长作用[3]。孙荣花等通过对桃叶卫矛叶片提取物对CCL4致小鼠急性肝损伤的保护作用进行研究发现,桃叶卫矛叶EtOAc和n-BuOH提取物具有良好的抗氧化效果和保肝作用,说明桃叶卫矛叶作为茶饮用的同时具有保健作用[4]。由此表明,桃叶卫矛具有极高的药用价值,有待进一步的开发利用。
种子的休眠现象在植物种子中广泛存在,了解并掌握种子的休眠机理,对于解除其休眠具有重要的指导意义[5-8]。由于桃叶卫矛在生产实践中广泛采用播种育苗的方式[9],若种子存在休眠现象,可能会导致出苗时间参差不齐,出苗率低。而现有的报道主要集中于桃叶卫矛的种子催芽、栽培技术等方面。虽然对其种子催芽的方法已有探讨,但对于其种子的休眠机理还没有过系统的研究[10-12]。Baskin C C等[13]提出了一个全面的种子休眠分类系统,其中包括 5 个分类:生理休眠(PD)、形态休眠(MD)、形态生理休眠(MPD)、物理休眠(PY)、混合型休眠(PY+PD)。根据以上5种休眠的形成机制,采用室内试验测试和统计分析方法,通过研究桃叶卫矛种子种皮特性、胚形态发育及种子内源抑制物质,来探讨桃叶卫矛种子的休眠机制。
1 材料与方法
1.1 试验材料
桃叶卫矛种子来源于黑龙江省哈尔滨市东北林业大学校园内,选取 4株生长良好的桃叶卫矛母树采集种子。于2015年10月进行采种,测定种子千粒重为15.935 g,含水量6.0%。
1.2 研究方法
1.2.1 种子生活力与发芽能力测定
生活力测定:按《林木种子检验规程》[14]规定的TTC法进行测定。
发芽能力测定:种子发芽能力用发芽率表示。种子发芽试验参照《国际种子检验规程》的方法[15]。
1.2.2 种皮透水性测定
取桃叶卫矛种子6份,每份取1 g,其中3份用解剖针撬开外种皮,另3份为对照。每份种子称质量后置25 mL试管中,加入一定量的蒸馏水,置恒温培养箱中25 ℃吸胀。每隔2 h取出种子,用滤纸吸干种子表面浮水,称质量,然后放回试管中继续吸水,直至种子吸水至恒定质量[16]。
1.2.3 种胚后熟过程中的形态发育
分别采用低温沙藏和变温沙藏的方法对种子进行处理,沙藏时间分别为7,14,21,28 d,然后进行取样,每次10粒,以沙藏前的种子为对照,并解剖观察种胚的形态和大小。具体操作为:沿种子的中轴线进行纵切,使胚和胚乳露出,在体视显微镜下观察并测量种胚及胚乳的长度,计算胚率[17]。
1.2.4 种子内源抑制物质的生物测定
称取2 g种子、胚乳和胚,分别置于锥形瓶中然后加入50 mL二氯甲烷溶液并混匀,然后密闭放入4 ℃冰箱中,每12 h震荡1次,于36 h后过滤浸提液。将滤液用旋转蒸发仪(上海亚荣生化仪器厂,RE-52)于40 ℃下蒸干,然后用蒸馏水定容至 50 mL[18]。最后,将浸提液分别稀释至25%、50%、75%。
采用三叶草种子进行内源抑制物生物活性测定。每个培养皿中置50粒三叶草种子,分别取上述各体积分数的浸提液,每个培养皿注入5 mL。以同体积的蒸馏水作为对照。每处理3次重复,在恒温光照培养箱内25 ℃进行培养,48 h后统计三叶草种子的发芽粒数(以露出子叶为发芽标准),72 h后测定苗高和根长。
1.2.5 种子催芽(休眠解除)方法
针对桃叶卫矛种子可能的休眠机制,采用赤霉素结合层积处理的方法和二因素完全随机的方法,共设计了25种不同的催芽方法来探索适宜的催芽方法。

表1 因素水平
赤霉素处理: 将桃叶卫矛种子进行消毒处理后,在室温下用不同浓度赤霉素溶液浸种催芽48 h,赤霉素浓度分别为100,200,300,400 mg/L;层积温度:1) 25 ℃层积:将经过5 g/kg KMnO4溶液消毒的种子与湿沙( 沙∶种=3∶1) 混匀后置于25 ℃恒温培养箱中层积28 d;2) 4 ℃层积:将消毒后的种子与湿沙混匀后,在4 ℃下低温层积28 d;3) 25 ℃/4 ℃层积:将消毒后的种子与湿沙混匀后,先在25 ℃下暖温层积14 d,再转移至4 ℃下低温层积14 d;4) 4 ℃/25 ℃层积: 将消毒后的种子与湿沙混匀后,先在4 ℃下低温层积14 d,再转移至25 ℃下暖温层积14 d。层积过程中每3 d适当补水,保持良好的水分和通气状态。
将上述处理后的桃叶卫矛种子进行萌发试验。具体方法参照1.2.1中发芽率测定。
1.3 数据分析
运用Excel及SPSS 20.0软件进行数据统计分析、方差分析及差异性分析。
2 结果与分析
2.1 新采收桃叶卫矛种子生活力与发芽力
种子生活力是指发芽的潜力或种胚所具有的生命力[19]。种子发芽力是指种子在适宜条件下能发芽并能长成植株的能力,是判断种子播种品质最重要的指标,用发芽势和发芽率来表示。而判断该种子是否存在休眠,则可以通过比较种子生活力和种子发芽力,若种子生活力高于发芽力,说明该种子存在休眠。试验结果表明,供试的桃叶卫矛种子生活力为93%,而其发芽势为0,发芽率为11%,种子生活力远大于其发芽率,表明桃叶卫矛种子可能存在显著休眠,还需要进一步探究。
2.2 桃叶卫矛种子透水性测定
由图1可以看出,0~4 h内破皮种子的吸水速率和吸水率急剧上升,4~24 h内破皮种子的吸水速率逐渐降低,而吸水率趋于平稳,24 h以后破皮种子的吸水率达到饱和,含水率为61.8%;而完整种子在0~12 h内吸水速率基本保持恒定,吸水率逐步升高,24 h后完整种子的吸水率达到61.1%,与破皮种子基本保持一致。
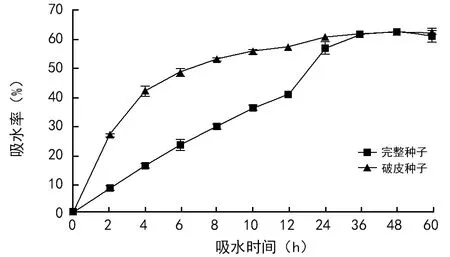
图1 桃叶卫矛种子吸水进程曲线
2.3 桃叶卫矛种子催芽过程中胚形态发育
不同层积温度及层积时间对桃叶卫矛种子胚率的影响如图2所示。由图2可知,层积前桃叶卫矛种子胚率为25.57%,当层积温度为4 ℃、4 ℃/25 ℃时,通过28 d的观察比较后可知,桃叶卫矛种子胚率与层积前基本保持一致,差异不显著;当层积温度为25 ℃时,层积14 d后的种子胚率与层积前相比降低了3.17%,差异显著,其余观察时间的胚率与层积前差异不显著;当层积温度为25 ℃/4 ℃时,层积21 d后的种子胚率比层积前下降了3.73%,差异显著,其余观察时间胚率大小与层积前相比无明显变化。
2.4 桃叶卫矛种子内源抑制物活性测定
不同部位的浸提液对三叶草种子发芽率和幼苗生长的影响如表2所示。当浸提液提取部位为胚时,不同浓度的浸提液对三叶草种子发芽率没有显著的抑制作用(p>0.05),由表2可以看出,经不同浓度浸提液处理后,三叶草幼苗的苗高与对照组差异不显著,仅浓度为50%的胚浸提液处理后三叶草幼苗根长与对照组差异性显著(p<0.05);当浸提部位为胚乳时,不同浓度的浸提液对三叶草种子发芽率的影响十分显著(p<0.05),由表2可以看出,随着胚乳浸提液浓度的提高,三叶草种子发芽率较对照组分别降低了24%、38.34%、80.34%,同时胚乳浸提液对三叶草幼苗的苗高和根长均有显著影响(p<0.05),当胚乳浸提液浓度为50%时,三叶草幼苗苗高与其他浓度下的幼苗苗高差异性不显著;当浸提部位为种子时,不同浓度的浸提液对三叶草种子发芽率的影响十分显著(p<0.05),由表2可以看出,随着种子浸提液浓度的提高,三叶草种子发芽率较对照组分别降低了31.34%、45%、55.34%,与之对应的三叶草幼苗苗高和根长较对照也出现了显著差异。

图2 不同层积温度及层积时间对桃叶卫矛种子胚率的影响

表2 不同部位的浸提液对三叶草种子发芽率和幼苗生长的影响
注:数值代表实验中每个处理3个重复的平均值±标准差,其后的小写字母代表不同体积分数浸提液与对照组的差异显著性(p<0.05)。
2.5 种子休眠解除方法
不同浓度赤霉素和层积温度对桃叶卫矛种子发芽率影响的方差分析如表3所示。由表3可知,赤霉素和层积温度对桃叶卫矛种子发芽率的影响均达到了极显著水平(p<0.01),同时二者的交互效应也达到了极显著水平。从三者贡献的离差平方和可以看出,赤霉素和层积温度均为影响桃叶卫矛种子发芽率的关键因素。由图3可知,赤霉素处理和层积处理均会促进桃叶卫矛种子发芽,当赤霉素浓度为0 mg/L时,不同的层积温度均对桃叶卫矛种子发芽率起到促进作用,且不同层积温度之间差异不显著;当赤霉素浓度达到100 mg/L或300 mg/L时, 25 ℃层积处理后的种子发芽率高于其他处理,且与对照组差异显著;当赤霉素浓度为200 mg/L时,25 ℃层积处理和4 ℃/25 ℃层积处理后种子发芽率高于其他处理;当赤霉素浓度为400 mg/L时,未采用层积处理的种子出现严重霉变,其他层积处理之间差异不显著。
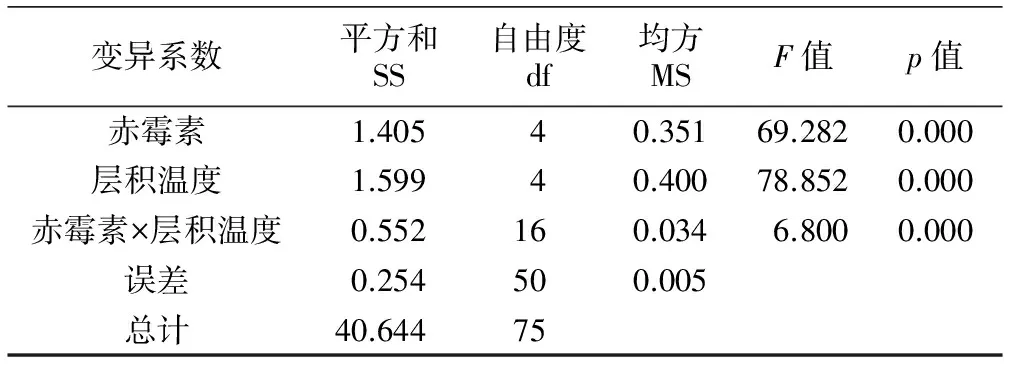
表3 不同浓度赤霉素和层积温度对桃叶卫矛种子发芽率影响的方差分析
注:双因素方差分析置信区间为95%。
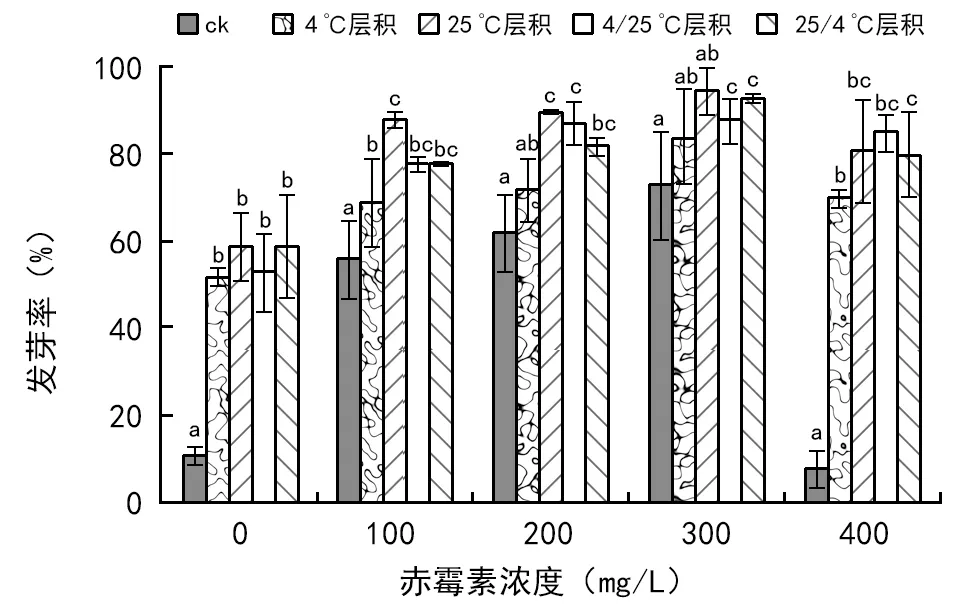
图3 不同浓度赤霉素处理和层积温度对桃叶卫矛种子发芽率的影响
3 讨 论
种子休眠是影响种子萌发率的主要因素。本试验中对新采收的桃叶卫矛种子进行TTC染色法检测后,测定其生活力为93%,而标准发芽试验测定的发芽率仅为11%,由此可见,桃叶卫矛种子存在一定程度的休眠。而引起种子休眠的原因有很多种,有的是属于形态学上的特性,有的是属于种子内部的代谢特性;有的可能由一种因素造成,也可能由多种因素共同影响。其中造成种子休眠的主要原因有:种皮障碍、胚休眠、内源抑制物的存在等[20]。因此本试验通过对桃叶卫矛种子种皮特性、胚形态发育及种子内源抑制物质的探究,进一步探讨造成其种子休眠的具体原因。
一般而言,植物种皮对种子造成的萌发障碍包括以下3点:种皮透水性差、种皮透气性差以及种皮的机械障碍[5]。赵洁等对唐古特瑞香的种子进行透水性检验后发现,唐古特瑞香种子吸水性良好[21]。对桃叶卫矛种子的初步解剖和观察结果表明,破皮种子的吸水速率虽然比完整种子的快,但是最终二者的吸水率是一致的,表明桃叶卫矛种子种皮的透水性良好,不存在机械障碍导致其不能萌发。
以往的研究表明,种胚发育的适宜条件是在潮湿和一定温度条件下,例如在湿土或湿沙中层积,经数周或数月种胚就能发育完全并获得发芽能力。因此本试验中,将桃叶卫矛种子混入湿沙中置于不同温度条件下进行层积。结果表明,不论采用何种层积方法桃叶卫矛种子胚率在层积过程中都没有出现显著的变化,由此可以推断桃叶卫矛种子种胚已经发育成熟。
种子中存在发芽抑制物抑制种子发芽,并且这种抑制物质可以存在于种子的不同部位(种被、种胚或胚乳)中。因此,准确判断抑制物质存在于种子的哪个部位可以有效地帮助种子快速催芽。本试验对桃叶卫矛种子不同部位进行浸提而获得抑制物质,研究结果表明,桃叶卫矛种子中的抑制物质主要存在于胚乳中,而胚的浸提液抑制作用不明显。
综上所述,桃叶卫矛种子种皮透水性良好,种胚发育成熟,导致其休眠的主要原因是种子中(主要是在胚乳中)存在发芽抑制物质。因此,桃叶卫矛属于生理休眠(PD)[22]。同类型的休眠植物主要有:八棱海棠(Malusrobusta)[23]和山毛榉(Fagussylvatica)[24]。而针对该类型的休眠,科研和生产上一般采用赤霉素结合层积的方法来进行休眠解除。本试验结果表明,桃叶卫矛的最适催芽方法为300 mg/L赤霉素处理48 h后,再将种子置于25 ℃环境条件下层积28 d,种子发芽率可在10 d内达到95%。
[1]宋红,丁格根其尔.桃叶卫矛种子发芽影响因素研究[J].种子,2013,32(1):87-88.
[2]卓丽环,陈龙清.园林树木学[M].北京:中国林业出版社,2004:259-260.
[3]刘继阳,于新海,刘莹,等.桃叶卫矛中营养元素的分析测定[J].微量元素与健康研究,2014,31(3):37-38.
[4]孙荣花,周元飞,邵莹,等.桃叶卫矛叶提取物的体外抗氧化活性及对CCL4致小鼠急性肝损伤的保护作用[J].辽宁中医药大学学报,2015,17(11):28-30.
[5]胡晋.种子生物学[M].北京:高等教育出版社,2006:126-127.
[6]杨荣超,张海军,王倩,等.植物激素对种子休眠和萌发调控机理的研究进展[J].草地学报,2012,20(1):1-9.
[7]李兵兵,魏小红,徐严.麻花秦艽种子休眠机理及其破除方法[J].生态学报,2013,33(15):4 631-4 638.
[8]梁喜龙,方淑梅,胡百兴,等.黄芪种子休眠机制及破除方法研究[J].江苏农业科学,2012,40(4):243-245.
[9]宋红,李万义,丁格根其尔,等.不同贮藏方法对桃叶卫矛种子萌发和营养物质的影响[J].东北林业大学学报,2015,43(6):30-33.
[10]赵瑭萍.桃叶卫矛苗木繁殖技术[J].中国林副特产,2015(3):57-58.
[11]刘继生,张鹏,金春德,等.桃叶卫矛种子的发芽特性[J].延边大学农学学报,2001,23(4):254-256.
[12]李华英,张勇哲,罗广军.桃叶卫矛假种皮浸提液对种子发芽的影响[J].延边大学农学学报,2008,30(1):58-60.
[13]Baskin C C,Baskin J M.Underdeveloped embryos in dwarf seeds and implications for assignment to dormancy class[J].Seed Science Research,2005,15:357-360.
[14]中华人民共和国国家质量技术监督局.林木种子检验规程(GB 2772-1999)[S].北京:中国标准出版社,1999.
[15]Nijenstein,H.,Nydam,J.,Don,R.and Mc Gill,C.(Eds).ISTA handbook on moisture determination (1st edition)[M].Bassersdorf Switzerland,International Seed Testing Association,2007.
[16]张华新,宋丹,刘正祥.盐胁迫下11个树种生理特性及其耐盐性研究[J].林业科学研究,2008,21(2):168-175.
[17]何俊瑜,任艳芳,任明见,等.不同小麦品种种子萌发期对镉胁迫的响应及耐镉性研究[J].江苏农业科学,2009(5):86-90.
[18]李淑英,周连第,兰彦平.几种常绿阔叶树在北方地区抗旱适应性评价[J].北京农学院学报,2005,20(4):12-16.
[19]喻方圆,周景莉,洑香香.林木种苗质量检验技术[M].北京:中国林业出版社,2008(6):60-75.
[20]郝龙飞,王庆成,张彦东.山桃稠李种子休眠机理及催芽技术[J].东北林业大学学报,2011,39(3):5-7.
[21]赵洁,晋小军,左贵平,等.赤霉素和层积处理对唐古特瑞香种子发芽的影响[J].西北农业学报,2013,22(5):136-139.
[22]Baskin,C.C.and Baskin,J.M.Seeds:ecology,biogeography,and evolution of dormancy and germination[M].San Diego,Academic Press,1990.
[23]付红祥,汤庚国.八棱海棠种子解除休眠方法的研究[J].林业科技开发,2007,21(1):31-33.
[24]Ph.Barthe,G.Garello,J.Bianco-Trinchant,et al.Oxygen availability and ABA metabolism in Fagus sylvatica seeds[J].Plant Growth Regulation,2000(30):185-191.
