β-环糊精醇体系中普萘洛尔对映异构体的手性识别研究
2018-03-10刘伟任艳芳卫艳丽董川
刘伟,任艳芳,卫艳丽,董川
(山西大学 环境科学研究所,山西 太原 030006)
环糊精(CD)是一类筒状结构的低聚糖超分子化合物,它们可以选择性包合不同碳氢化合物客体分子,包括手性对映异构体小分子[1-2]。常见的有α-CD,β-CD,γ-CD三种,它们的内腔直径分别为5.7,7.8,9.5 Å,空腔高度均为7.9 Å。环糊精具有独特的内疏水外亲水的腔体特性,不仅可以利用分子大小匹配包合客体分子,同时,还可利用疏水作用增强其与非极性客体分子的相互作用[3-4]。在分子发光分析领域,环糊精可以利用其疏水空腔为荧光分子提供有效的保护性疏水微环境,从而减少了荧光分子的激发态猝灭和非辐射跃迁过程,使得分子的荧光发射增强。因此,它常被用作发光分析的有序介质,为荧光基团提供较好的保护性微环境。
近年来,环糊精超分子化学的研究多集中于客体分子与环糊精的二元体系的研究[5-6]。陈立弟等利用β-CD的增敏作用建立了真伪五指毛桃的鉴定[7],陈金娥等建立了测定β-雌二醇的荧光增敏法[8]。随着分子识别研究的深入,第三组分在主客体分子识别中的作用越来越受到人们的重视[9-12]。醇分子不仅可以通过分子尺寸匹配进入环糊精分子的疏水内腔,同时,还可与环糊精分子形成分子间氢键,因此,小分子醇在环糊精超分子化学研究中逐渐引起了人们的兴趣[13-15]。Warner等[16]利用芘为荧光探针详细考察了一系列直链醇和支链醇对β-CD/芘包合物的影响,发现醇分子可以与β-CD/芘形成三元包合物,其结合常数与醇尺寸相关。Jodi等[17]利用吖啶的荧光特性研究了醇对β-CD/吖啶体系的影响,实验发现小分子醇能与吖啶竞争环糊精的分子内腔,同时还表现出空间填充剂的作用,其作用力大小与醇的分子大小及形状相关。Warner等[18]的研究也得出相近的结论。此外,Marek等的研究表明小分子醇与环糊精分子的协同作用能增加蒽在水溶液中的溶解性[19]。最近,Julia 和Niels计算了不同的直连醇与α-环糊精之间的包合常数,为进一步研究醇在环糊精超分子包合研究中的作用提供了直接参考[14]。
环糊精分子内腔具有内在的手性特性,利用环糊精的分子手性优势,我们实现了萘普生与色氨酸等2对对映异构体分子的手性识别[1-2]。利用室温磷光法,我们对R,S-普萘洛尔对映异构体在溴代环己烷/γ-环糊精体系中的磷光特性进行了考察,并建立了不同配比R,S-普萘洛尔对映异构体混合组分的室温磷光分析方法[20]。β-CD相对较小的疏水空腔更适合于直链小分子醇的包合[21]。将小分子醇用于环糊精三元体系的手性识别中具有一定的理论和实际意义。本文中,我们采用荧光光谱法对几种直链及支链小分子醇对R,S-普萘洛尔对映异构体/β-环糊精体系的包合过程的影响进行了详细考察,并对小分子醇对β-CD/R,S-普萘洛尔体系的手性识别影响差异进行了研究,揭示了小分子醇对β-环糊精/R,S-普萘洛尔对映异构体手性识别影响的机理及作用本质。
1 材料与方法
1.1 试剂与仪器1.1.1 试剂
β-环糊精(>98%)、异丁醇、正戊醇、正丁醇、异戊醇、环己醇、异丙醇、正丙醇购于Fluka试剂公司 (Buchs, Switzerland);R-(+)-普萘洛尔(>99%)和S-(-)-普萘洛尔(>99%)购于北京百灵威试剂有限公司,储备液均为10 mmol/L的水溶液,用时逐级稀释。磷酸氢二钠、磷酸二氢钠(分析纯)购于北京化工厂,用时配置成200 mmol/L的水溶液。所使用磷酸缓冲溶液为200 mmol/L;其余所用试剂均为分析纯。
1.1.2 仪器
缓冲溶液在pHS-3C型酸度计(上海雷磁)上进行测量;所有荧光光谱及强度的测量是均使用FLS920荧光光谱仪(英国,爱丁堡公司);实验所需二次蒸馏水用Milli-Q超纯水系统(Millipore,法国)制备,电阻18 MΩ·cm-1;HNMR谱在DRX300核磁共振仪(Fällenden,Switzerland)上获得,以氘代水为溶剂,化学位移用ppm表示。
1.2 实验步骤1.2.1 醇对普萘洛尔/β-CD体系包合常数的影响
在10 mL的比色管中加入一定量的R-或S-普萘洛尔储备液,然后加入不同体积的小分子醇,随后,加入适量的10 mmol/L的β-环糊精储备液,用二次蒸馏水定容至刻度线,摇匀,放置10 min后,转移到10 mm标准石英液比色皿中,置于Edinburgh FLS920荧光光谱仪上进行荧光光谱测量。
1.2.2 醇对普萘洛尔/β-CD体系荧光光谱的影响
分别移取适当量的R-或S-普萘洛尔储备液及小分子醇至10 mL比色管中,然后加入不同体积的10 mmol/L β-环糊精水溶液,用二次水定容至5 mL,摇匀,放置10 min后转移至10 mm标准石英比色皿中,测定其荧光光谱或记录其荧光强度。
进行荧光光谱测量时,仪器的激发、发射波长分别为293 nm和348 nm,激发、发射狭缝均为2 nm,实验温度控制在(20±1) ℃。
2 结果与讨论
2.1 R,S-普萘洛尔/β-环糊精包合物的形成
R-(+)-普萘洛尔(R-PPL)和S-(-)-普萘洛尔(S-PPL)分子中均含有一个手性碳原子,它们具有完全相同的发色团。图1是β-CD与R-PPL和S-PPL作用前后的1HNMR谱,可以看出,β-CD质子的化学位移在与R-PPL和S-PPL作用后发生了较明显的变化。图1d是R-PPL/β-CD的二维ROESY谱图,从图中显示的萘环与β-环糊精之间的相关峰表明普萘洛尔的萘环进入了β-CD的空腔,形成了普萘洛尔/β-CD包合物。

Fig.1 1H NMR spectra of β-CD (a), β-CD/R-PPL (b) and β-CD/S-PPL (c),and Partial ROESY spectra (d)R-PPL and β-CD in D2O at 20℃图1 β-CD、β-CD/R-PPL和β-CD/S-PPL的1H NMR谱及β-CD/R-PPL的二维ROESY谱
R-PPL和S-PPL在β-CD体系有较强的荧光发射,为了更好地考察它们与β-CD的相互作用,我们对R-PPL和S-PPL与β-CD的相互作用时间进行了考察,结果见图2,可以看出,体系的荧光在6 min之内趋于稳定,并在20 min内保持稳定,因此,我们选择10 min进行后续实验。
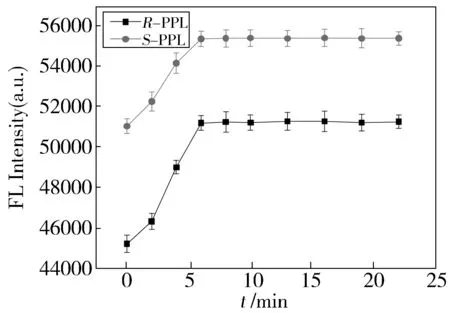
Fig.2 Effect of storing time on the fluorescence of β-CD/R-PPL and β-CD/S-PPL图2 放置时间对β-CD/R-PPL和β-CD/S-PPL体系荧光强度的影响
图3是R-PPL和S-PPL在不同浓度的β-CD存在时的荧光光谱图。可以看出,它们的荧光强度随着β-CD浓度的增加逐渐增强,但增强幅度不大。这表明普萘洛尔对映异构体均可部分进入β-CD的分子内腔并与β-CD形成二元包合物。β-CD的疏水性内腔有效屏蔽了溶剂水分子及发光分子激发态的碰撞,减少了普萘洛尔分子激发态的猝灭,从而使其荧光增强。
环糊精与普萘洛尔对映异构体分子之间的包合过程可用公式(1)描述[22]。
(1)
其中,[H]0和[G]0分别为β-CD和普萘洛尔对映异构体的初始浓度,ΔF表示普萘洛尔的荧光强度随β-CD浓度增加时的变化差值。α为β-CD和普萘洛尔二者作用过程中的二元包合物结构改变的敏感因素。K即为普萘洛尔对映异构体和β-CD的包合常数。
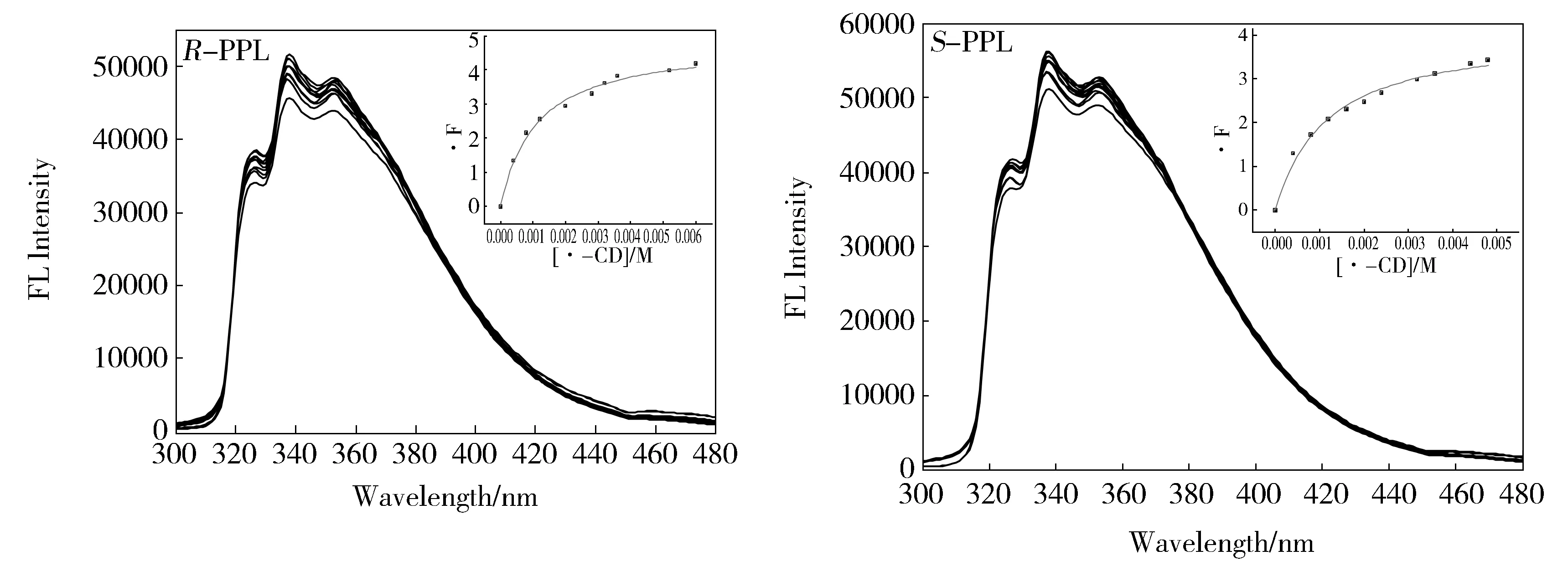
Fig.3 Fluorescence spectra of R-PPL(50 μm) and S-PPL(50 μm) in the presence of different concentrations of β-CD(from 0 to 6 mM);The insets display the plot of change in fluorescence intensity against concentration of β-CD using the non-linear fitting method图3 不同β-CD浓度下,R-PPL和S-PPL的荧光光谱图,插图分别为非线性拟合图
根据公式(1),以ΔF对环糊精浓度作图,结果见图3插图,非线性拟合结果表明R-、S-普萘洛尔与β-CD分别都生成了1∶1的二元包合物,包合常数分别为KR=924.84±41.25 L/mol-1,KS=877.94±35.36 L/mol-1,KR/KS=1.05。与γ-环糊精体系的包合常数222 和 327 L/mol相比[20],R-、S-普萘洛分子与β-CD的空腔大小更匹配。
2.2 醇对普萘洛尔/β-环糊精体系荧光光谱的影响
2.2.1 醇对R,S-普萘洛尔/β-环糊精包合物荧光猝灭的影响
考虑到小分子醇的烷基链可插入环糊精的疏水内腔,而其羟基端则可与环糊精腔口的羟基形成分子间氢键,我们选取异丁醇、正戊醇、正丁醇、异戊醇、环己醇、异丙醇、正丙醇等7种不同的小分子醇,分别研究其对普萘洛尔对映异构体/β-CD二元体系的影响。首先,我们固定R-、S-普萘洛尔和β-CD的浓度,研究比较了这7种醇对R-、S-普萘洛尔/β-CD二元包合物的荧光猝灭的影响。实验表明,这7种小分子醇都能引起R,S-普萘洛尔对映异构体/β-环糊精二元包合物荧光的猝灭,只是猝灭程度不同;同时,对其荧光光谱峰的形状和峰位置没有显著影响。根据Stem-Volmer方程求得这7种小分子醇对R,S-普萘洛尔对映异构体/β-环糊精包合物的荧光猝灭常数及手性选择因子F[KSV(R)/KSV(S)],结果见表1。手性选择因子F越偏离1表明手性选择性越强。由表1的数据可以看出异丁醇存在时普萘洛尔对映异构体的手性选择性最强。而醇的碳原子数与R,S-普萘洛尔对映异构体/β-CD体系的荧光猝灭并没有特别一致的规律可循。加入醇后,小分子醇进入β-CD的分子内腔,与普萘洛尔分子竞争内腔位置,并将R,S-普萘洛尔分子部分排挤出β-CD空腔,从而引起R,S-普萘洛尔对映异构体/β-CD体系的荧光猝灭。对于具有相同碳原子数目的醇而言,除了正丁醇与异丁醇,直链醇比支链醇对R,S-普萘洛尔对映异构体/β-CD体系的荧光猝灭程度更大,这表明了直链醇的烷基链部分比支链醇的空间位阻小,更容易进入β-CD空腔内,同时,醇分子中的羟基与β-CD分子上的羟基形成氢键作用,实验结果与Borne等的研究一致[23]。
图4为不同浓度的异丁醇对R,S-普萘洛尔/β-CD体系的Stern-Volmer荧光猝灭曲线。直线的斜率反映了异丁醇对普萘洛尔对映异构体/β-环糊精的猝灭程度,可以看出,异丁醇对R-普萘洛尔/β-环糊精的猝灭程度远大于其对S-普萘洛尔/β-环糊精的猝灭,从而使得手性选择因子F远大于1。

表1 β-环糊精存在下,不同醇对R-/S-普萘洛尔和环糊精包合物的猝灭常数

Fig.4 Stern-Volmer quenching plot of R,S-PPL/β-CD in the presence of isobutanol图4 异丁醇对R,S-普萘洛尔/β-CD环糊精体系的Stern-Volmer猝灭曲线
2.2.2 小分子醇对R,S-普萘洛尔/β-CD体系包合常数的影响

Fig.5 Fluorescence spectra of R-PPL(50 μm) and S-PPL(50 μm) in the presence of isobutanol 0.2% V/V at different concentrations of β-CD(from 0 to 6 mmol/L);The insets display the plot of fluorescence change against concentration of β-CD using the non-linear fitting method图5 异丁醇存在时,R-PPL和S-PPL在不同β-CD浓度下的荧光光谱图;插图分别为非线性拟合图
固定异丁醇浓度(V/V)为0.2%,分别考察其存在时对R,S-普萘洛尔对映异构体/β-环糊精体系随β-环糊精浓度增大的荧光光谱图,结果见图5。可以看出,随着β-环糊精浓度的增大,异丁醇/R,S-普萘洛尔/β-环糊精三元体系的荧光也不断增强。异丁醇/S-普萘洛尔/β-环糊精体系的荧光增强程度较异丁醇/S-普萘洛尔/β-环糊精体系要大,根据公式(1)计算,求得异丁醇存在时R-、S-普萘洛尔/β-环糊精包合物/异丁醇三元包合物的包合常数分别为617.32±24.69 L/mol和1 323.23±52.92 L/mol。与R,S-普萘洛尔/β-环糊精二元体系比较,可以看出异丁醇的存在引起了R-异构体与β-环糊精包合常数的减小,S-异构体与β-环糊精包合常数的增大。同时,手性识别因子也增大至2.14。这表明异丁醇的存在明显地影响了β-环糊精对普萘洛尔对映异构体分子的手性选择性。这可能与异丁醇的分子大小及结构有关,具体的分子识别机理将再探讨。
固定醇的浓度,我们分别考察了7种小分子醇对普萘洛尔对映异构体/β-环糊精体系荧光的影响,并依据公式(1),通过非线性拟合计算了R-、S-普萘洛尔/β-CD/醇的包合常数K、手性选择因子F(K(S)/K(R)及相对包合常数差异,结果见表2。
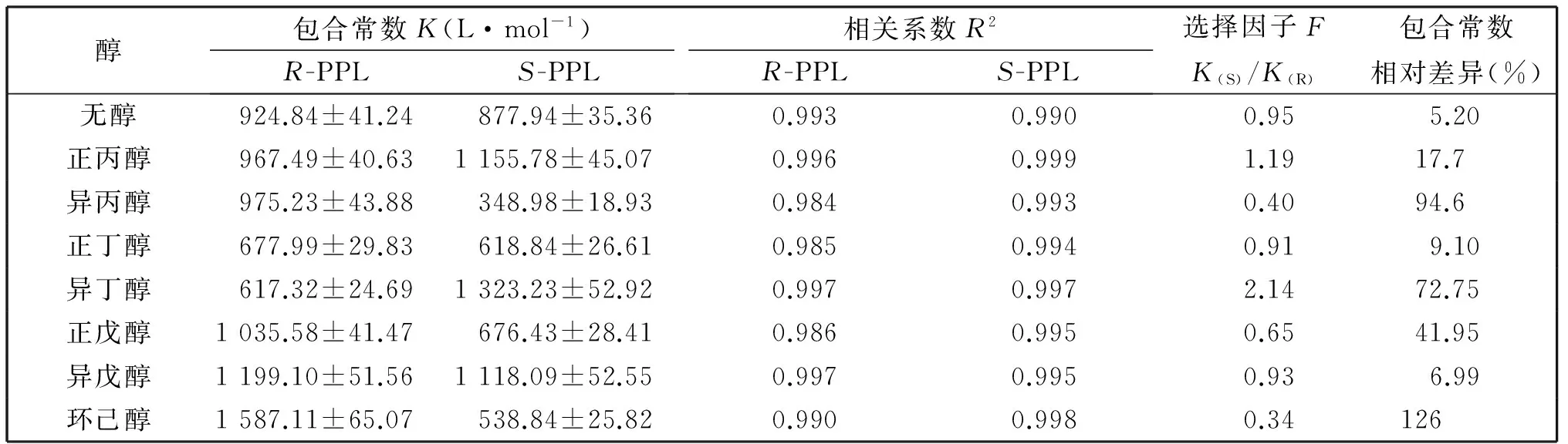
表2 0.2%不同醇(体积分数)存在下,β-环糊精和R-/S-普萘洛尔包合物的包合常数
从表2可以看出,0.2%不同醇(V/V)的存在都会对R-/S-普萘洛尔与β-CD包合物的包合常数产生影响。丙醇、丁醇、戊醇与β-CD的包合常数分别为3.72、16.6、63.1 L/mol[21],当小分子醇加入到普萘洛尔/β-CD体系中时,以空间调节或空间充填作用为主,随着醇浓度的增加,醇分子则通过与β-CD的疏水作用及分子间氢键[21]的协同作用与R-、S-普萘洛尔分子竞争β-CD内腔的包合位点,并与R-、S-普萘洛尔及β-CD形成三元包合物。形成三元包合物的作用力与醇分子的尺寸及空间结构相关,并很大程度上影响着普萘洛尔/β-CD/醇三元包合物的稳定性。普萘洛尔对映异构体的手性识别则是在形成三元包合物的过程中实现的。我们以包合常数相对差异值(包合常数差值/平均值)作为评价小分子醇对β-CD体系中普萘洛尔对映异构体的手性识别影响,计算结果见表2,可以看出,小分子醇/β-CD体系对普萘洛尔对映异构体的识别能力依次为:环己醇、异丁醇、异丙醇>正戊醇>正丙醇>正丁醇、异戊醇。异丁醇存在时,β-CD体系对普萘洛尔对映异构体的包合常数相对差异值为73%,高于在γ-环糊精/溴代环己烷体系中的22%[20]。
2.3 异丁醇存在下,β-CD对R/S-普萘洛尔的1H NMR研究
核磁共振技术(NMR)是研究手性客体分子与β-环糊精分子之间相互作用机制的重要手段。我们利用1H NMR技术考察了异丁醇存在下,普萘洛尔对映体与β-环糊精之间的相互作用。计算了β-环糊精分子中的质子化学位移及其在普萘洛尔/β-环糊精、普萘洛尔/β-环糊精/醇体系中的化学位移变化值,结果见表3。从表3可以看出β-环糊精分子中各质子的化学位移变化值在普萘洛尔/β-环糊精二元体系和普萘洛尔/β-环糊精/异丁醇三元体系中明显不同。在二元体系中,β-环糊精分子中3-、5-和6-质子的化学位移变化幅度最大,并且,5-质子的化学位移变化值远大于3-质子的化学位移变化值,同时,结合二维ROESY谱,说明普萘洛尔分子的萘环部分通过β-环糊精分子的小口端也就是5-和6-质子面进入环糊精分子内腔中,而其分子中的羟基部分则与环糊精分子外腔的羟基形成氢键作用定位在β-环糊精的腔口。异丁醇加入后,在异丁醇/普萘洛尔/β-CD三元体系中,环糊精分子中各质子的化学位移变化值也是H-5位大于H-3位,这也表明异丁醇分子也是从β-CD的小口端进入β-环糊精的分子空腔内。同时,Δδ2(H-5)>Δδ1(H-5)、 Δδ2(H-6)>Δδ1(H-6)显示:作为第三组分小分子空间调节剂,异丁醇对β-环糊精/普萘洛尔二元体系的手性分子识别影响较大,异丁醇可影响R-、S-普萘洛尔对映异构体分子与β-环糊精分子中5-、6-质子间的相互作用,使得主客体分子之间再匹配从而达到最佳的包合状态,实现对R-和S-普萘洛尔的手性识别功能。
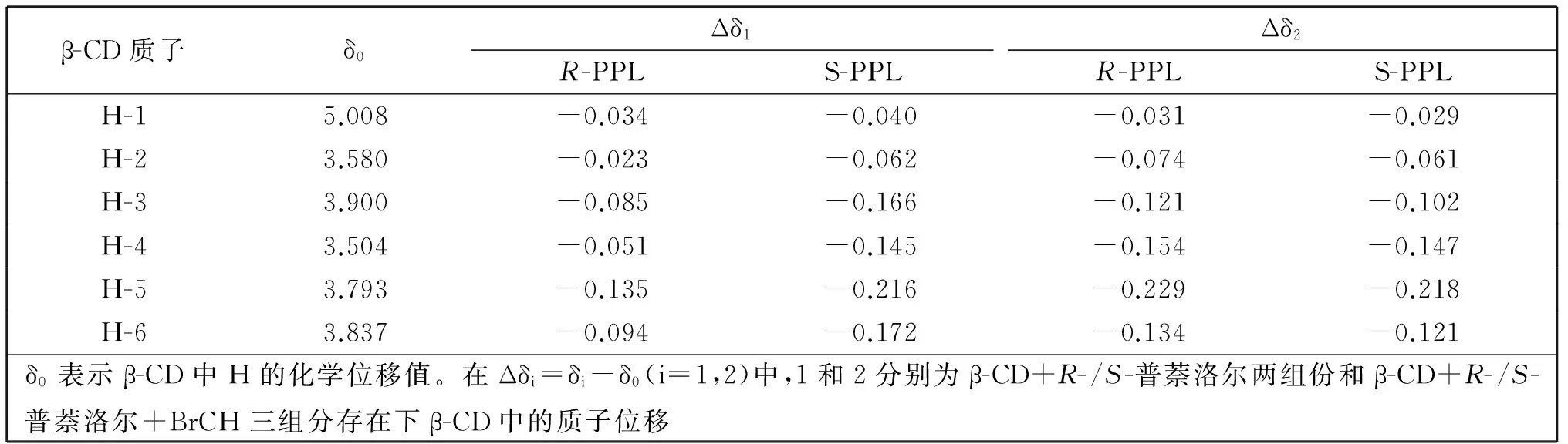
表3 β-CD各质子在二元及三元体系中β-CD中1H化学位移及其变化值
3 结论
从环糊精空腔微环境性质变化这一新的视角探讨了不同小分子醇对R,S-普萘洛尔对映异构体手性识别的影响,小分子醇通过与β-环糊精分子中的羟基之间形成分子间氢键作用导致β-环糊精空腔极性下降,同时,通过空间调节与竞争机制增大β-环糊精与普萘洛尔对映异构体之间的选择性作用,从而实现普萘洛尔对映异构体的手性识别功能,这些实验结果为实现普萘洛尔对映异构体的手性色谱分离提供了参考。
[1] Arnaud G,Condamine E,Liane H,etal.Chiral discrimination in Host-Guest Supramolecular Complexes.Understanding Enantioselectivity and Solid Solution Behaviors by Using Spectroscopic Methods and Chemical Sensors[J].JPhysChemB,2007,111(25):7017-7026.DOI:10.1021/jp0714280.
[2] Toshiyuki K,Yoshinori F,Kazuhiro M,etal.6-O-Modified β-Cyclodextrin Enabling Inclusion Complex Formation in Nonpolar Media[J].OrgLett,2009,11(22):5282-5285.DOI:10.1021/01902239e.
[3] Wei Y,Wang S,Shuang S,etal.Chiral Discrimination Between d-and l-tryptophan based on the Alteration of the Fluorescence Lifetimes by the Chiral Additives[J].Talanta,2010,81:1800-1805.DOI:10.1016/j.talanta.2010.03.044.
[4] Wei Y,Wang S,Chao J,etal.An Evidence for the Chiral Discrimination of Naproxen Enantiomers:A Combined Experimental and Theoretical Study[J].JournalofPhysicalChemistryC,2011,115:4033-4040.DOI:10.1021/jp108464r.
[5] Smith V K,Thilivhali T N,Isiah M W.Spectroscopic Study of the Interaction of Catechin with alpha-,beta-,and gamma-Cyclodextrins[J].JPhysChem,1994,98(35):8627-8631.DOI:10.1021/j100086a007.
[6] Vincenza C,Domenico M,Alessandro P,etal.Influence of the “Host-guest” Interaction on the Mobility of Genistein/β-Cyclodextrin Inclusion Complex[J].JPhysChemB,2009,113(31):11032-11038.DOI:10.1021/jp810546h.
[7] 陈立弟,文震,陈庆,等.β-环糊精增敏三维荧光法鉴别真伪五指毛桃[J].现代食品科技,2017,33(5):1-6.DOI:10.13982/j.mfst.1673-9078.2017.5.047.
[8] 陈金娥,吴玉芳,张海容.β-环糊精增敏荧光法测定β-雌二醇[J].2016,32(5):659-663.DOI:10.13526/j.issn.1006-6144.2016.05.013.
[9] Fakayode S O,Busch M A,Busch K W.Determination of Enantiomeric Composition of Samples by Multivariate Regression Modeling of Spectral Data Obtained with Cyclodextrin Guest-host Complexes —— Effect of an Achiral Surfactant and use of Mixed Cyclodextrins[J].Talanta,2006,68(5):1574-1583.DOI:10.1016/j.talanta.2005.08.018.
[10] Lenn A Y,Fortier C A,Jack I V,etal.Chiral Recognition of Propranolol with β-Cyclodextrin in the Presence of 1-and 2-Butanol[J].JournalofInclusionPhenomenaandMacrocyclicChemistry,2005,51(1-2):87-91.DOI:10.1007/S10847-004-5690-0.
[11] Fakayode S O,Busch M A,Bellert D J,etal.Determination of the Enantiomeric Composition of Phenylalanine Samples by Chemometric Analysis of the Fluorescence Spectra of Cyclodextrin Guest-host Complexes[J].Analyst,2005,130(2):233-241.DOI:10.1039/B405478D.
[12] 马良,张宇昊,江涛,等.三元超分子荧光增敏快速检测黄曲霉毒素M1[J].食品科学,2016,37(24):197-202.
[13] Varady J,Wu X,Wang S.Competitive and Reversible Binding of a Guest Molecule to Its Host in Aqueous Solution Through Molecular Dynamics Simulation:Benzyl Alcohol/β-cyclodextrin System[J].JPhysChemB,2002,106(18):4863-4872.DOI:10.1021/jp0131469.
[14] Julia G,Niels H.Calculation of Binding Affinities for Linear Alcohols to α-cyclodextrin by Twin-system Enveloping Distribution Sampling Simulations[J].FluidPhaseEquilibria,2016,422:1-17.DOI:10.1016/j.fluid.2016.02.001.
[15] Nakashima H,Yoshida N.Fluorescent Detection for Cyclic and Acyclic Alcohol Guests by Naphthalene-appended Amino-β-cyclodextrins[J].OrganicLetters,2006,8(22):4997-5000.DOI:10.1021/O10616079.
[16] Munoz de la P A,Ndou T T,Zung J B,etal.Alcohol Size as a Factor in the Ternary Complexes Formed with Pyrene and β-cyclodextrin[J].JAmChemSoc,1991,113(5):1572-1577.DOI:10.1021/ja00005a019.
[17] Schuette J M,Ndou T T,Munoz de la P A,etal.Influence of Alcohols on the Beta-cyclodextrin/acridine Complex[J].JAmChemSoc,1993,115(1):292-298.DOI:10.1021/ja00054a042.
[18] Zung J B,Munoz de la P A,Ndou T T,etal.Influence of Alcohol Addition on the Gamma-CD:Pyrene Complex[J].JPhysChem,1991,95(17):6701-6706.DOI:10.1021/j100170a059.
[19] Lubomska M,Gierycz P,Rogalski M.Enhancement of the Anthracene Aqueous Solubility by a Synergistic Effect of Alcohols and β-cyclodextrin[J].FluidPhaseEquilibria,2005,238(1):39-44.DOI:10.1016/j.fluid.2005.08.023.
[20] Wei Y,Ren Y,Li J,etal.Characterization of Room Temperature Phosphorescence of Propranolol and the Chiral Discrimination Between R-and S-isomers[J].Analyst,2011,136:299-303.DOI:10.1039/c0an00633e.
[21] Sanyo H.Inclusion Compounds in the System of β-cyclodextrin-alcohol-pyrene in Aqueous Solution[J].JPhysChem,1989,93:2074-2078.DOI:10.1021/j1003420.072.
[22] Inoue Y,Yamanoto K,Wada T,etal.Inclusion Complexation of (Cyclo) Alkanes and (Cyclo) Alkanols with 6-O-modified Cyclodextrins[J].JChemSoc,PerkinTrans2,1998,2:1807-1816.DOI:10.1039/A801858H.
[23] Barone G,Castronuovo G,Vecchio P D,etal.Thermodynamics of Formation of Inclusion Compounds in Water.α-Cyclodextrin-Alcohol Adducts at 298.15 K[J].JChemSoc,FaradayTrans1,1986,82:2089-2101.DOI:10.1039/F19868202089.
