烟草黑胫病拮抗真菌的筛选及活性评价
2018-03-09姜乾坤向必坤赵秀云
彭 阁,姜乾坤,谭 军,向必坤*,王 瑞,郭 利,赵秀云
随着烟草种植面积扩大、气候变化和种植模式改变,威胁烟草安全生产的病虫害日益严重[1],其中烟草黑胫病是具有毁灭性的土传真菌病害,给烟草种植业带来巨大损失。目前防治该病害的主要方式为化学防治,是快速遏制病情蔓延的有效手段。然而化学农药不科学的投入和施用使得田间环境污染、生态平衡破坏以及病原菌对化学药剂产生抗药性的风险非常高[2]。因此,绿色可持续的烟草黑胫病防治新技术研究与应用对于烟草安全生产非常必要。
植物病害的生物防治,利用有益微生物调节农田微生态环境,达到防治病害的目的,是一种无污染、无残留、环境友好的防治手段,已成为烟草病害生物防治的热点。木霉作为一种有益真菌分布广泛,在土壤中易分离且适合人工培养。研究发现木霉作为拮抗菌对植物病原真菌具有良好的防治效果[3]。木霉通过营养和空间竞争、寄生、抗生、促进植物生长、诱导抗性等机制对植物病原菌产生拮抗作用[4],具有广泛适用性和绿色无污染等特点,已成功用于农业生产且国外已开发成相关商品制剂[5]。黑曲霉是一种重要的工业微生物,已广泛被应用于发酵生产柠檬酸、果胶酶、蛋白酶[6],也被用于生物转化[7]、废物利用[8],具有安全性和稳定性。但将其用于植物病原真菌防治,很少有相关报道。
本研究从烟草根际土壤中筛选分离得到对烟草黑胫病菌有很好抑制效果的木霉、烟曲霉和黑曲霉菌株,对其进行形态学和分子生物学鉴定、纤维素酶和蛋白酶检测、产孢能力比较以及田间防治效果分析,以期为烟草黑胫病生防制剂开发利用提供菌种资源和理论基础。
1 材料与方法
1.1 试验材料
供试菌种为黑胫1号菌种,由湖北省烟草研究院李锡宏研究员提供。土样采集于襄阳市南漳县薛坪镇栗林坪村云烟 87健康烟田烟草根际土壤、云烟87烟草黑胫病发病严重田中健康烟草根际土壤。拮抗真菌的分离和培养为 PDA培养基,蛋白酶分泌测定为酪蛋白培养基[9],纤维素酶分泌测定为纤维素刚果红培养基[10],葡萄糖标准溶液、磷酸钠缓冲液(0.2 mol/L,pH 6.0)、CMC缓冲液、DNS显色剂均参考农用微生物菌剂国家标准[11]。
1.2 生防菌分离与筛选
将土样混匀后,准确称取10 g土壤样品,按照Niemann[12]的方法稀释。分别取10-3,10-4,10-5稀释液0.1 mL于PDA培养基平板上,涂布均匀,28 ℃培养 5~7 d;挑取菌落形态差异明显的菌落进行划线分离纯化培养,4 ℃冰箱保存。
将分离的真菌培养物和烟草黑胫病菌分别在PDA培养基上28 ℃培养5~7 d,采用对峙培养法[13]进行筛选。28 ℃培养7 d后观察抑制作用,计算抑菌率。抑菌率(%)=[(对照直径-处理直径)/对照直径]×100%。
1.3 菌种鉴定
将纯化培养后的拮抗真菌在 PDA平板上倒置培养5~7 d后,采用尚博菲[14]使用的小琼脂块培养法用番红染色观察菌丝和孢子形态特征。真菌基因组DNA提取参考文献[13]。18S rDNA扩增所用引物和反应条件参考文献[15]。将18S rDNA扩增产物纯化回收后测序,测序结果在GeneBank数据库进行BLAST比对,选取同源性较高的18S rDNA基因序列作为参比对象,运用 MEGA4.0采用Neighbour-joining法构建系统发育树。结合形态特征与18S rDNA序列分析对菌株进行鉴定。
1.4 生防菌特性测定
1.4.1 分泌纤维素酶能力测定 将纯化后的真菌,用无菌牙签挑取点接在刚果红纤维素培养基上,在28 ℃倒置培养3~5 d。培养结束后,向平板中加入1 mg/mL刚果红染液(以覆盖整个平板为宜),10~15 min后,倒去刚果红染液,加入1 mol/L NaCl溶液,15 min后倒掉NaCl溶液,反复操作3~4次观察是否有水解圈出现。
1.4.2 分泌蛋白酶能力测定 将纯化后的真菌,用无菌牙签挑取点接在酪蛋白培养基上,28 ℃倒置培养3~5 d观察是否有水解圈出现。
1.4.3 真菌固态发酵产孢子 按照 1∶1称取蛭石与玉米粉共10 g,装于9 cm平皿内121 ℃灭菌20 min,65 ℃烘箱干燥2 d。在PDA平板上培养5~7 d的真菌用无菌水洗涤刮下孢子,用血球计数板在显微镜下计数算出洗涤液中孢子浓度,调节孢子浓度为 1.2×107个/mL用于接种,接种量为 10%。营养液为(NH4)2SO40.5%,MgSO40.5%,酵母粉0.6%,含水量为 32.8%。接种完毕后,混匀放置 28 ℃培养。分别在第8、10、12 d取样于显微镜下测定孢子浓度。每种菌3次重复。
1.4.4 固态发酵产物羧甲基纤维素酶(CMC)活性测定 (1)标准曲线绘制,参考农用微生物菌剂标准[11]。(2)酶活性的测定与定义,称取固态发酵产物10 g,参考农用微生物菌剂标准[11]处理后取上清液测定,每种菌各做3个平行。测定步骤见表1。
纤维素酶活性的计算:根据标准曲线将测得的OD值换算成葡萄糖微克数,按下列公式计算酶活力。
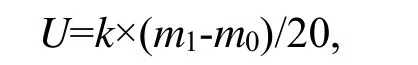
式中:U—样品的酶活,μg/g;
k—样品稀释倍数;m1—样品葡萄糖含量,μg;
m0—对照中葡萄糖含量,μg;
20—酶与底物反应时间,min。
酶活性定义为:1 mL原样酶液,1 min产生1 μg葡萄糖定义为1个酶活力单位。
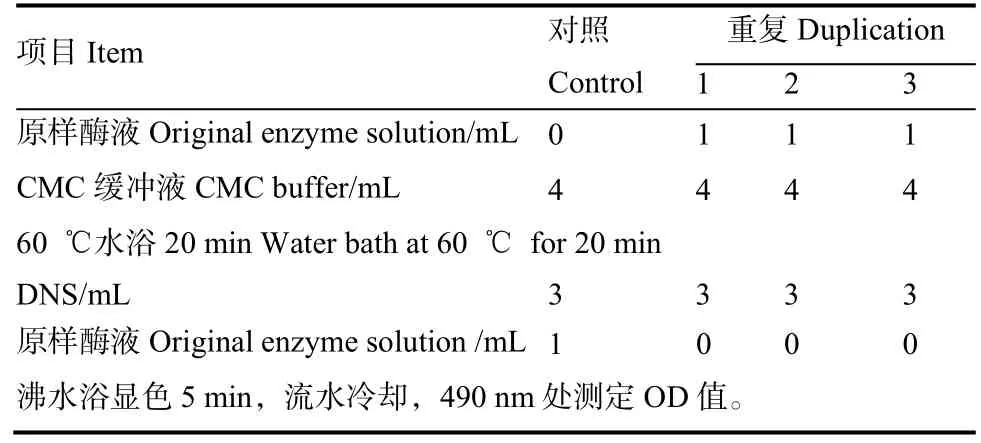
表 1 纤维素酶活性测定Table 1 Determination of cellulase activity
1.5 田间试验
田间试验在襄阳市南漳县薛坪镇栗林坪村进行。
试验药剂:将拮抗真菌经固体发酵10 d后自然干燥用于田间试验。
处理与药剂用量:试验设置4个处理,分别为木霉 ZP2-1、烟曲霉 GZ3、黑曲霉 ZP2-4、霜霉威盐酸盐。施用方法:拮抗真菌固体发酵菌粉各200 g,霜霉威盐酸盐(有效含量66.5%)80 mL分别加至50 L水中,混匀后每棵烟草灌根200 mL。共施用2次,移栽后15 d、30 d各施用1次。每个处理分为两行,每行为64棵烟草。
调查、记录和测定方法:1)调查时间和次数:共调查2次,施药当天调查1次(病情基数),施药后隔10 d调查1次。2)调查方法:以株为单位,调查发病分级标准按国家烟草病害调查分级标准GB/T23222—2008进行[16]。3)药效计算方法:病情指数=[Σ(各级病株数×该病级值)/(调查总株数×最高级值)]×100,发病率=发病烟株数/调查烟株总数×100%,防治效果=[(施药前病情指数-施药后病情指数)/施药前病情指数]×100%。
2 结 果
2.1 拮抗真菌分离
从健康烟田烟草根际土壤中共分离纯化获得真菌 13株,通过平板对峙筛选得出对烟草黑胫病菌有抑制作用的真菌有3株,编号为ZP2-1、ZP2-3、ZP2-4。从发病严重烟田健康烟株根际土壤中共分离纯化获得真菌7株,其中通过平板对峙初筛得出对烟草黑胫病菌有抑制作用的真菌有2株,编号为GZ3、GZ7。图 1显示两种土壤中对烟草黑胫病菌有拮抗作用的真菌,各真菌对烟草黑胫病菌抑菌率如图 2,其中抑菌率最大的是 ZP2-4,抑菌率为83.33%。
2.2 形态学鉴定
如图3所示,5株真菌在PDA平板上均可旺盛生长。ZP2-1的菌落生长迅速,气生菌丝少,向外辐射生长,孢子浅绿色;菌丝无间隔,分生孢子梗主分枝短,次级分枝直角分布,产孢细胞长瓶形。ZP2-3气生菌丝丰富,呈散射性生长,后期从中部开始产深绿色孢子;菌丝无间隔,分生孢子梗主分枝长,次级分枝少,单生或间生,近孢子梗顶部不规则伸出,瓶梗基部缢缩,中间膨大,顶部变细。ZP2-4气生菌丝少,菌落黑色,产黑色孢子;分生孢子呈球形,顶囊球形,分生孢子梗粗。GZ3菌落生长快,质地呈绒状,中部有厚实孢子层,边缘为白色气生菌丝;分生孢子梗光滑,顶囊烧瓶状,仅上半部产生孢子,分生孢子球形。GZ7气生菌丝分散生长,菌落棉絮状,幼期为无色或浅绿色,后期见深绿色孢子产生;分生孢子梗分枝长且丰富,与木霉属相似,瓶梗烧瓶形。
2.3 18S rDNA序列分析及分子生物学鉴定
提取5株拮抗真菌基因组DNA并以此为模板扩增各真菌18S rDNA,可得出各自大小约为700 bp的条带。经测序后,将各自序列在NCBI上用Blast分析,选取同源性较高的真菌18S rRNA基因序列作为参比对象,构建系统发育树如图4。发现ZP2-1与Trichoderma reesei(AF510497.1)相似性为82%(图 4a),ZP2-3与Trichoderma koningiopsis(JQ278018.1)相似性为 99%(图 4b),ZP2-4与Aspergillus niger(HQ600982.1)的同源关系最近(图4a),GZ3 与Aspergillus fumigatus(KX015959.1)的相似性为 100%(图 4c),GZ7与Hypocre rufa(JX21089.1)的相似性为97%(图4d)。结合形态学特征(图 3)与分子生物学鉴定,ZP2-1为里氏木霉(Trichoderma reesei),ZP2-3为拟康宁木霉(Trichoderma koningiopsis),ZP2-4为黑曲霉(Aspergillus niger),GZ3为烟曲霉(Aspergillus fumigatus),GZ7为红棕肉座菌(Hypocre rufa)。
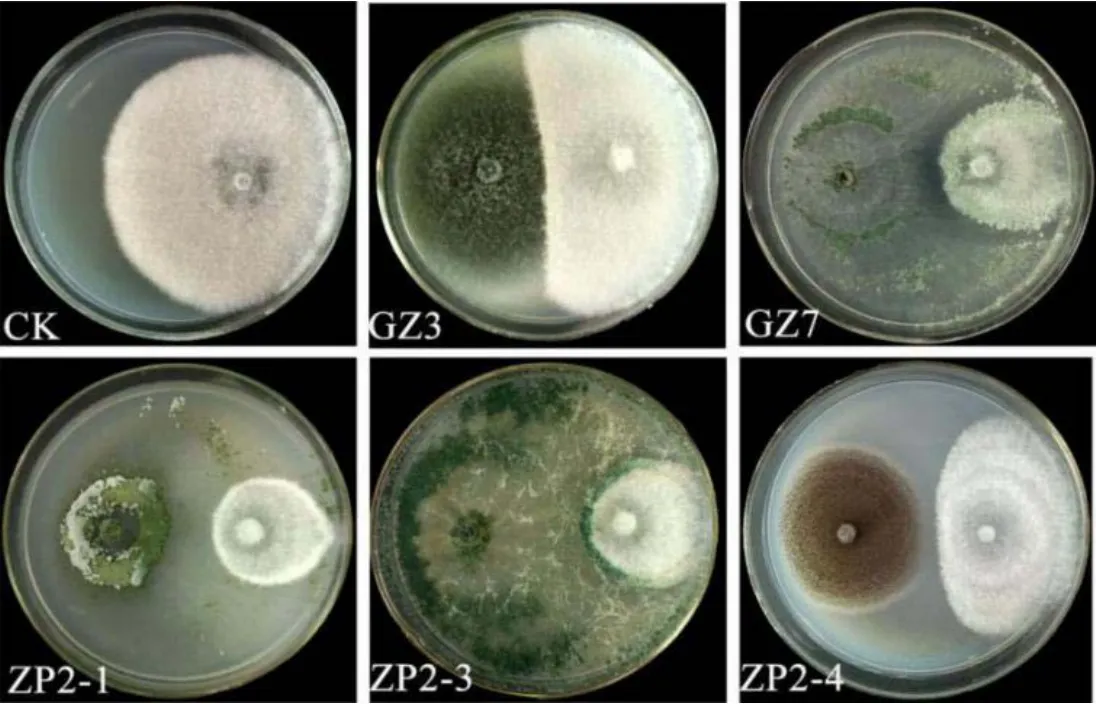
图1 拮抗真菌与烟草黑胫病菌对峙试验Fig. 1 Results of plate confronting test between antagonistic fungi and Phytophthora nicotianae
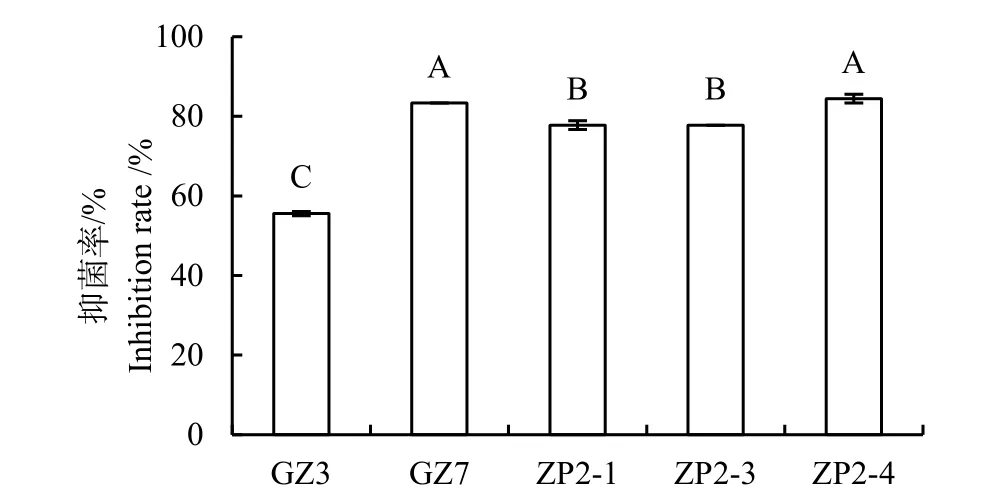
图2 拮抗真菌对烟草黑胫病菌的抑菌率Fig. 2 Inhibitory effects of antagonistic fungi against Phytophthora nicotianae
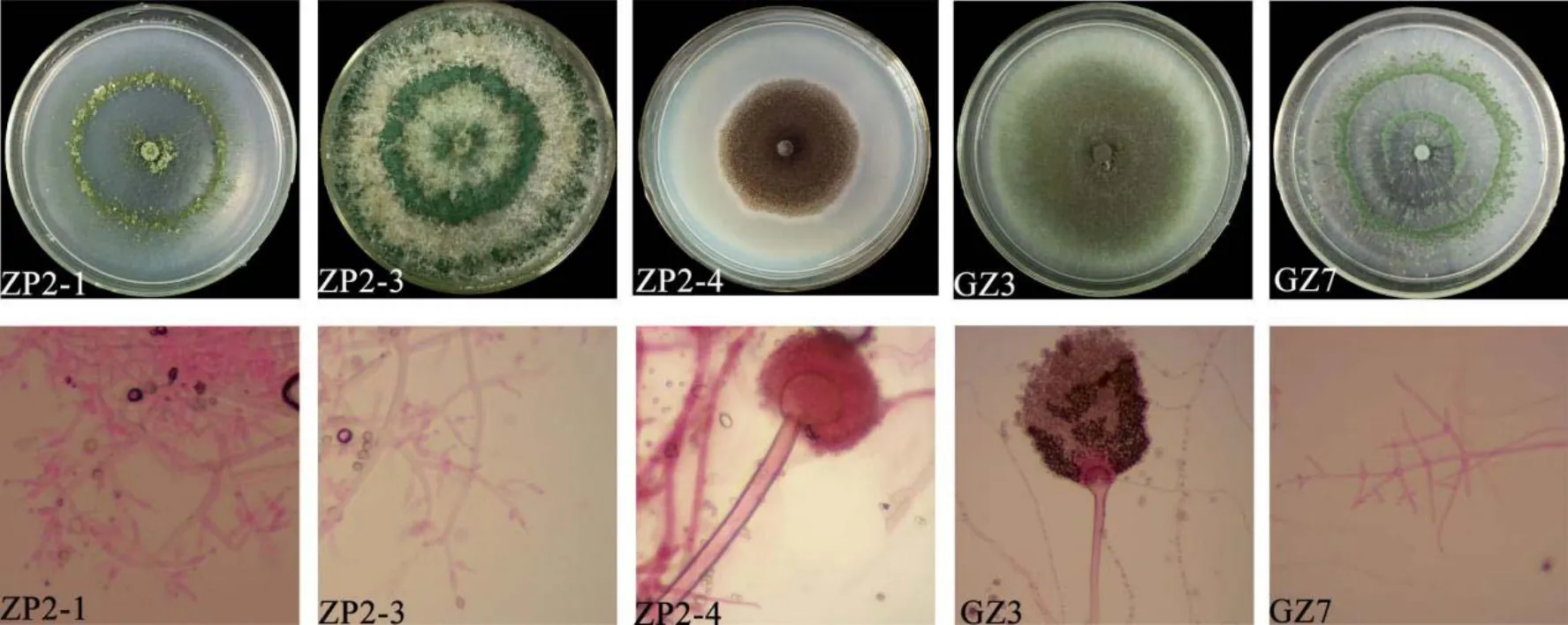
图3 拮抗真菌菌落形态与显微图Fig. 3 Colony morphology and micrograph of antagonistic fungi
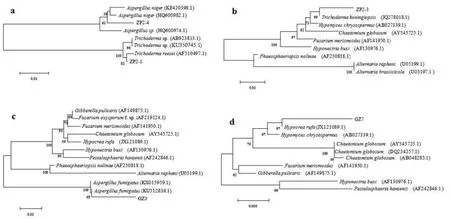
图4 根据18S rRNA基因序列构建的拮抗真菌与参考类群间的系统发育树Fig. 4 Phylogenetic tree of antagonistic fungi based on 18S rRNA and reference taxa
2.4 纤维素酶分泌
将5株拮抗真菌活化后,接种至刚果红纤维素培养基培养3 d后,经刚果红染色处理及NaCl洗脱后,观察得出各菌株分解纤维素能力差异明显(图5)。ZP2-1在刚果红培养基上无水解圈产生,说明其分泌纤维素酶能力极弱;GZ3无水解圈产生,但可见有稀疏的菌丝生长;ZP2-3无水解圈产生,但菌落菌丝生长旺盛;GZ7、ZP2-4能出现明显的水解圈且水解圈大小为GZ7>ZP2-4。因此,5株真菌分泌纤维素酶能力强弱依次为GZ7、ZP2-4、ZP2-3、GZ3、ZP2-1。
2.5 蛋白酶分泌
各真菌在酪蛋白培养基上28 ℃培养3 d后生长情况如图6。只有ZP2-4菌落生长与在PDA上生长无差异,可见明显水解圈。其余真菌生长均有变化,ZP2-1表现为菌丝生长缓慢,菌落向四周扩散,中心产孢子,无明显水解圈,说明其产蛋白酶量少,仅供自身生长所需。GZ3菌丝生长旺盛,菌落扩散慢,无明显水解圈。GZ7菌丝稀疏生长,周围扩散快,边缘聚集成絮状,不产孢子,无明显水解圈。ZP2-3菌丝生长稀疏,周围扩散,边缘聚集成絮状,菌落中心有浅绿色孢子产生。说明5株真菌分泌蛋白酶能力强弱依次为ZP2-4、ZP2-3、GZ7、GZ3、ZP2-1。
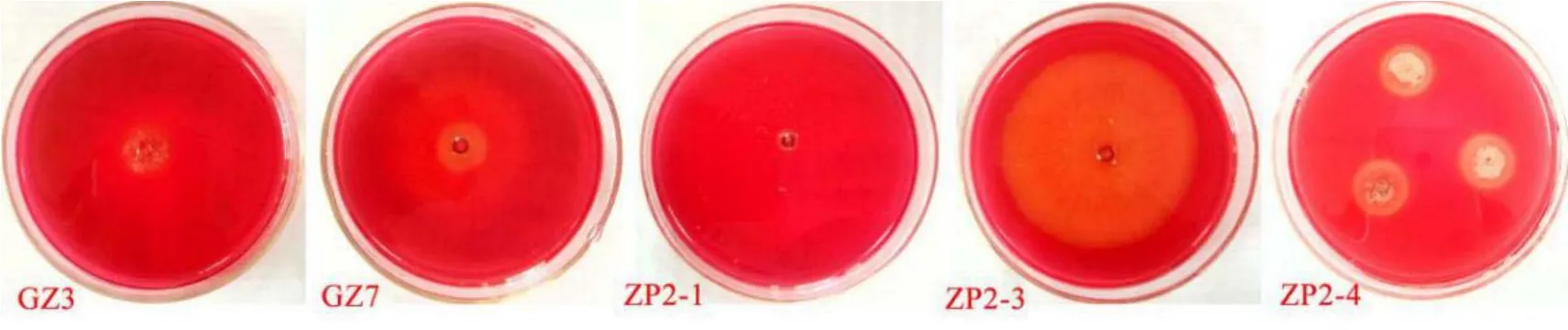
图5 拮抗真菌纤维素酶分泌的检测Fig. 5 Detection of cellulase secretion with antagonistic fungi
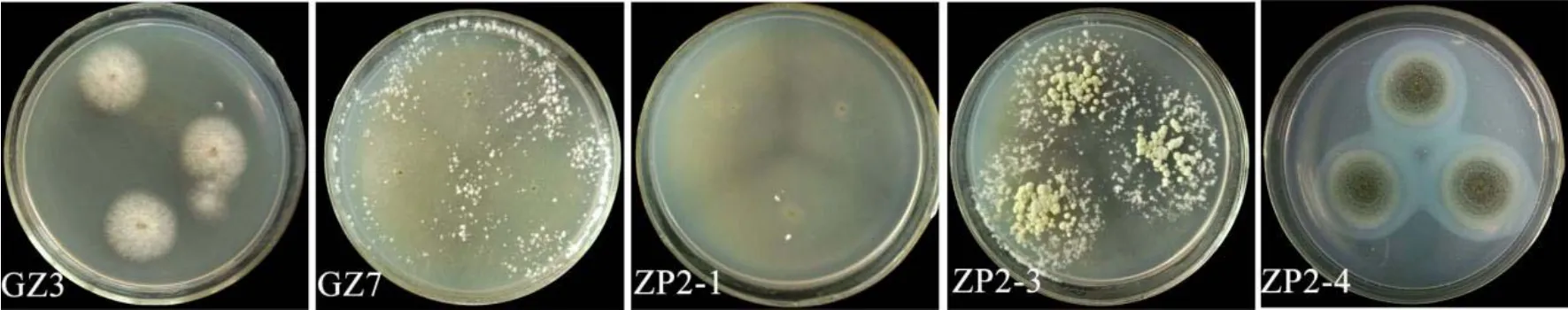
图6 拮抗真菌蛋白酶分泌的检测Fig. 6 Detection of protease secretion with antagonistic fungi
2.6 产孢子能力比较
为了进一步探究各拮抗真菌生长能力,为筛选制作菌剂菌种做准备,对各真菌不同发酵时间产孢子能力进行比较。发酵第 8天时 ZP2-1产孢量为1×109个/g,与 ZP2-4、GZ3、GZ7、ZP2-3 产孢量相比分别是其 1.15、1.33、1.81、3.57倍。发酵第10 d时ZP2-4产孢量最大,为2.58×109个/g,显著高于其余菌株,分别是GZ3、ZP2-1、ZP2-3、GZ7的1.58、2.61、4.16、8.06倍。发酵第12 d时ZP2-4产孢量依然最大,较第10天有所降低;GZ3产孢量较第10天有所上升,但低于ZP2-4;其余3株真菌产孢量与第 10天时相当,维持不变。综合不同时间点各真菌产孢量的变化,可得出产孢能力大小为 ZP2-4>GZ3>ZP2-1>ZP2-3> GZ7(图 7)。
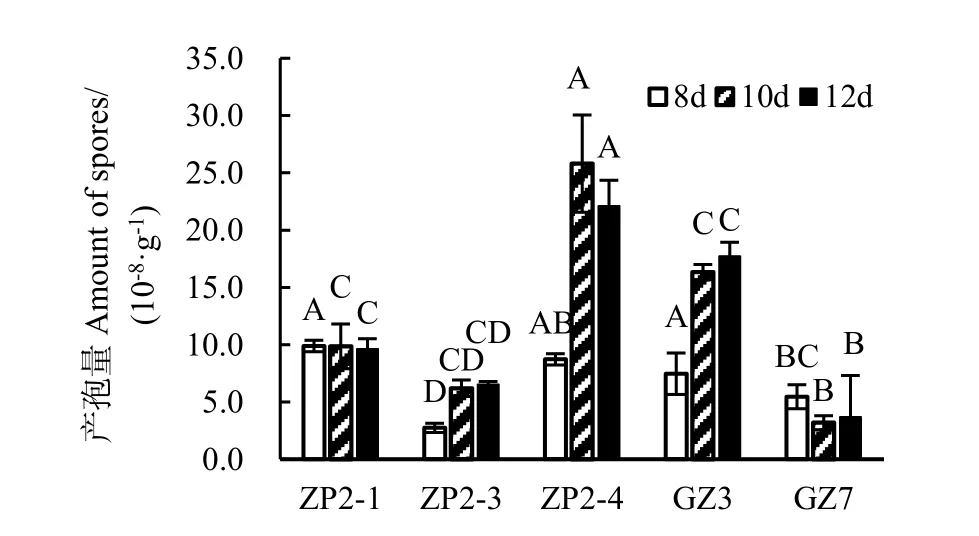
图7 拮抗真菌固态发酵产孢子能力比较Fig. 7 Comparison of spore producing ability of antagonistic fungi in solid state fermentation
2.7 固体发酵产物羧甲基纤维素酶活比较
固体发酵培养8 d时,各真菌发酵产物羧甲基纤维素酶活性如图8所示,ZP2-1 CMC活性最高为388.51 µg/(mL·min),GZ3 次之为354.60 µg/(mL·min),ZP2-4 为 336.21 µg/(mL·min),都显著高于 GZ7 和ZP2-3(分别为 29.31 和 129.31 µg/(mL·min);可得出各真菌固态发酵产物CMC酶活大小为:ZP2-1>GZ3>ZP2-4>ZP2-3>GZ7。

图 8 拮抗真菌固态发酵纤维素酶活性比较Fig. 8 Comparison of cellulase production by solid fermentation of antagonistic fungi
2.8 田间试验
综合各拮抗真菌固态发酵产孢子能力以及固态发酵产物CMC酶活性,选取ZP2-1、GZ3、ZP2-4制成微生物固态发酵菌剂进行试验。对3种拮抗真菌进行田间防治效果测定,结果表明,3种拮抗真菌对烟草黑胫病均有防治效果(表2),黑曲霉ZP2-4防治效果最佳高达85.00%,木霉ZP2-1为59.50%、烟曲霉GZ3为61.28%,化学药剂为45.23%。表明黑曲霉ZP2-4防治效果高于化学药剂,且优于烟曲霉GZ3和木霉ZP2-1。
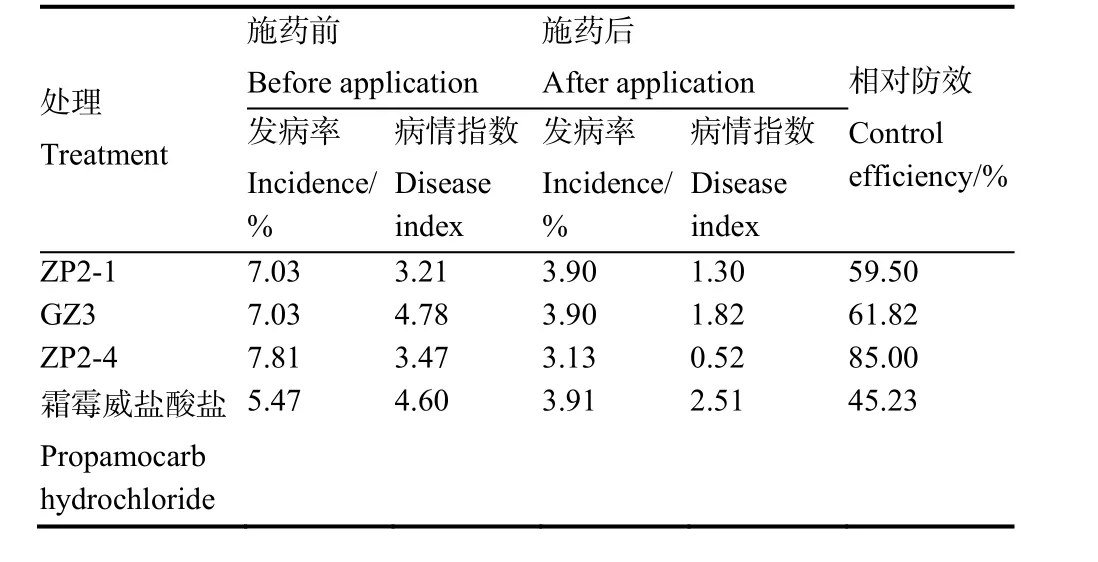
表2 拮抗真菌对烟草黑胫病的田间防治效果Table 2 Control efficacy of antagonistic fungi against tobacco black shank in the field
3 讨 论
木霉被认为是一种重要的植物生防因子,广泛用于番茄枯萎病菌[17]、番木瓜炭疽病菌[18]、棉花枯萎病菌、莴苣枯萎病菌[19]、水稻恶苗病菌等病原菌引起的植物病害防治[20],且蔡勇[21]从烟草土壤分离得到2株拟康宁木霉对烟草黑胫病菌具有明显抑制效果。我们发现其对由烟草黑胫病菌可进行有效控制,因而具有较高的研究价值。
已有研究显示,烟曲霉对烟草青枯病菌(Ralstonia solanacearum)具有稳定的拮抗作用,对烟苗生长无影响[22];郭夏丽等[23]从染病烟草根际土壤分离筛选出一株对烟草黑胫病菌有明显抑制作用的烟曲霉,也成功用于烟草黑胫病防治。王岩等[24]将从烟草黑胫病发病严重烟株根际土壤分离的黑曲霉Ty-3制成生防制剂应用于田间试验,可显著降低烟草黑胫病发病率。本研究的对峙实验发现,黑曲霉 ZP2-4对烟草黑胫病菌具有很好的抑制效果,且兼有营养要求简单、生长繁殖快、产孢子能力强等特点。在为烟草黑胫病生物防治提供有益菌种资源,大规模生产绿色环保型菌剂方面潜力巨大。
本次木霉与烟草黑胫病菌对峙实验中,木霉菌落向外逐渐扩散,最终覆盖在病原菌表面,表明木霉可迅速占领空间和营养对病原菌形成抑制。高雪丽等从堆肥中分离的侧钩木霉(Trichoderma ghanense)通过同样的机制对立丝枯核菌(Rhizotonia solani)和腐皮镰刀菌(Fusarium solani)产生拮抗作用[25]。黑曲霉ZP2-4、红棕肉座菌GZ7可水解羧甲基纤维素形成明显水解圈,说明其可分泌纤维素酶对烟草黑胫病菌产生抑制;黑曲霉在酪蛋白平板上形成明显水解圈,说明其可分泌蛋白酶对烟草黑胫病菌产生抑制。报道指出黑曲霉既可产纤维素酶[26]也可产蛋白酶[27],本实验结果印证了这一结论。对于在纤维素平板和酪蛋白平板上不能形成水解圈但可缓慢生长的菌株,可能是由于病原菌菌丝等诱导其产生少量纤维素酶和蛋白酶[28]所致。对5种拮抗真菌固态发酵产孢能力进行比较,结合固体发酵产物中纤维素酶活性大小选出3株真菌,田间试验结果显示,固态发酵产孢多且产物中纤维素酶活性高的黑曲霉ZP2-4的防治效果显著高于化学药剂对照和木霉及烟曲霉,说明黑曲霉可作为烟草黑胫病田间防治的一个新的菌种资源,在烟草真菌病害防治中的应用具有巨大潜力。
4 结 论
本研究结果表明,筛选的木霉 ZP2-1、烟曲霉GZ3、黑曲霉ZP2-4对烟草黑胫病有较好的防效,可用于烟草黑胫病生物防治。ZP2-4防效最高,可能与其分泌蛋白酶和纤维素酶能力强、固体发酵产孢量多有关。
[1] 巢进,张战泓,田峰,等. 烟草黑胫病防控技术研究进展[J]. 湖南农业科学,2016(8):120-122.CHAO J, ZHANG Z H, TIAN F, et al. Advance in technologies for preventing tobacco black shank[J].Hunan Agricultural Sciences, 2016(8)∶ 120-122.
[2] 胡燕,王开运,许学明,等. 烯酰吗啉对我国烟草黑胫病菌的毒力研究[J]. 农药学学报,2006,8(4):339-343.HU Y, WANG K Y, XU X M, et al. Inhibitory effect of dmiethomorph onPhytophthora parasitica var.nicotianaein China[J]. Chinese Journal of Pesticide Science, 2006,8(4)∶ 339-342.
[3] Banaay C G B.Trichoderma ghanensepromotes plant growth and controls disease caused byPythium arrhenomanesin seedlings of aerobic rice variety Apo[J].Philippine Agricultural Scientist, 2012, 95(2)∶ 175-184
[4] 宋晓妍,孙彩云,陈秀兰,等. 木霉生防作用机制的研究进展[J]. 中国农业科技导报,2006,8(6):20-25.SONG X Y, SUN C Y, CHEN X L, et al. Research advances on mechanism ofTrichodermain biological control[J]. Review of China Agricultural Science and Technology, 2006, 8(6)∶ 20-25.
[5] Harman G E. Myths and dogmas of biocontrol changes in perceptions derived from research onTrichoderma harzinumT-22[J]. Plant Disease, 2007, 84(4)∶ 377-393.
[6] Schuster E, Dunncoleman N, Frisvad J C, et al. On the safety ofAspergillus niger-a review[J]. Applied Microbiology & Biotechnology, 2002, 59(4-5)∶ 426.
[7] 高秋芬,倪辉,李利君,等. 黑曲霉胞外酶对柑橘果汁的脱苦作用[J]. 中国食品学报,2014,14(4):156-163.GAO Q F, NI H, LI L J, et al. Characterization of extracellular enzymes fromAspergillus nigerfor debittering citrus juice[J]. Journal of Chinese Institute of Food Science and Technology, 2014, 14(4)∶ 156-163
[8] 李静. 黑曲霉发酵制备香蕉皮可溶性膳食纤维研究[J].中国食品添加剂,2015(5):137-141.LI J. Study on extraction of soluble dietary fiber from banana peel withAspergillus niger[J]. China Food Additives, 2014(5)∶ 137-141.
[9] 胥海东,王永泽,王金华. 津巴布韦烟叶中淀粉酶和蛋白酶产生菌的分离及鉴定[J]. 生物技术通讯,2011,22(4):536-539.XU H D, WANG Y Z, WANG J H. Isolation and identification of protease and amylase producing bacteria strains from the Zimbabwe tobacco leaves[J]. Letters in Biotechnology, 2011, 22(4)∶ 536-539.
[10] 张建强,李亚澜,李勇. 纤维素降解菌的分离鉴定及固态发酵条件[J]. 西南交通大学学报,2006,41(4):442-446.ZHANG J Q, LI Y L, LI Y. Investigation into screening identifying and solid-state fermentation of cellulolytic strains[J]. Journal of Southwest Jiaotong University, 2006,41(4)∶ 442-446.
[11] 农业部微生物肥料质量监督检验测试中心,中国农业科学院土壤肥料研究所. 农用微生物菌剂:GB 20287—2006[S]. 北京:中国标准出版社,2006:1-14.Quality Supervision and Testing Center for Microbial Fertilizer of Ministry of Agriculture, Soil and Fertilizer Institute, Chinese Academy of Agricultural Sciences.Agricultural microbial inoculum∶ GB 20287—2006[S].Beijing∶ China Standard Press, 2006∶ 1-14.
[12] NIEMANN H, LÖSEKANN T, BEER D D, et al. Novel microbial communities of the Haakon Mosby mud volcano and their role as a methane sink[J]. Nature, 2006,443(7113)∶ 854.
[13] 兰楠,祁高富,喻子牛,等. 油菜内生真菌的分离鉴定及抑菌作用[J]. 华中农业大学学报,2011,30(3):270-275.LAN N, QI G F, YU Z N, et al. Isolation, identification and anti-fungal action of endophytic fungi of rapeseed[J].Journal of Huazhong Agricultural University, 2011, 30(3)∶270-275.
[14] 尚博菲. 土壤真菌多样性研究及塑料降解真菌菌株的筛选[D]. 长春:吉林大学,2013.SHANG B F. The research of soil fungal diversity and screening of degradable plastics fungal strains[D].Changchun∶ Jilin University, 2013.
[15] BORNEMAN J, HARTIN R J. PCR primers that amplify fungal rRNA genes from environmental siamples[J].Applied & Environmental Microbiology, 2000, 66(10)∶4356-4360.
[16] 中国烟草总公司青州烟草研究所. 烟草病虫害分级及调查方法GB/T 23222—2008[S]. 北京:中国标准出版社,2008:1-6.Qingzhou Tobacco Research Institute of China tobacco company. Grade and investigation method of tobacco diseases and insect pests GB/T 23222—2008[S]. Beijing∶China Standard Press, 2008∶ 1-6.
[17] EL_KOMY M H, SALEH A A, ERANTHODI A, et al.Characterization of novelTrichoderma asperellumisolates to select effective biocontrol agents against tomatoFusariumwilt[J]. Plant Pathology Journal, 2015,31(1)∶ 50-60.
[18] VALENZUELA N L, ANGEL D N, ORTIZ D T, et al.Biological control of anthracnose by postharvest application ofTrichoderma. spp. on maradol papaya fruit[J]. Biological Control, 2015, 91∶ 88-93.
[19] INNOCENTI G, ROBERTI R, PIATTONI F. Biocontrol ability ofTrichoderma harzianumstrain T22 againstFusariumwilt disease on water-stressed lettuce plants[J].Biological Control, 2015, 60(4)∶ 1-9.
[20] 陈方新,齐永霞,戴庆怀,等. 哈茨木霉对几种植物病原真菌的拮抗作用及其抗药性测定[J]. 中国农学通报,2005,21(11):314-317.CHEN F X, QI Y X, DAI Q H, et al. In-Lab determination of antagonism against severl plant pathogenic fungi and resistance to fungieides ofTrihodermaharzianum[J]. Chinese Agriculture Science Bulletin, 2005, 21(11)∶ 314-317.
[21] 蔡勇. 烟草黑胫病高效生防木霉菌的筛选及其拮抗机制的研究[D]. 长沙:湖南农业大学,2010.CAI Y. Resarch on the screening and antagonistic mechanism of the high effective biocontrolTrichodermaagainstPhytophthora parasitica var. nicotianae[D].Changsha∶ Hunan Agricultural University, 2010.
[22] 周晓见,査鑫垚,董夏伟,等. 烟草青枯病拮抗真菌烟曲霉发酵条件的优化[J]. 河南农业科学,2011,40(12):93-97.ZHOU X J, ZHA X Y, DONG X W, et al. Optimization of fermentation conditions of fungus inhibitingRalstonia solanacearumby orthogonal test[J]. Journal of Henan Agricultural Sciences, 2011, 40(12)∶ 93-97.
[23] 郭夏丽,李红丽,王岩,等. 一种烟曲霉及其应用:CN102533566A[P]. 2012-07-04.GUO X L, LI H L, WANG Y, et al. A kind ofAspergillus fumigatusand its application∶ CN102533566A[P].2012-07-04.
[24] 王岩,李红丽,郭夏丽,等. 一种黑曲霉菌及其应用:CN102732430A[P]. 2012-10-17.WANG Y, LI H L, GUO X L, et al. A kind ofAspergillus nigerand its application∶ CN102732430A[P]. 2012-10-17.
[25] 高雪丽,吴坚平,徐刚,等. 侧钩木霉的分离、鉴定及产孢条件优化[J]. 中国生物工程杂志,2014,34(2):84-92.GAO X L, WU J P, XU G, et al. Isolation, identification ofTrichoderma ghanenseand optimization of spores production[J]. China Biotechnology, 2014, 34(2)∶ 84-92.
[26] Kang S W, Park Y S, Lee J S, et al. Production of cellulases and hemicellulases byAspergillus nigerKK2 from lignocellulosic biomass[J]. Bioresource Technology,2004, 91(2)∶ 153-156.
[27] 袁康培,郑春丽,冯明光. 黑曲霉HU53菌株产酸性蛋白酶的条件和酶学性质[J]. 食品科学,2003,24(8):46-49.YUAN K P, ZHENG C L, FENG M G. Conditions and enzymology properties of acid protease produced byAspergillus nigerHU53[J]. Food Science, 2003, 24(8)∶46-49.
[28] 徐同,柳良好. 木霉几丁质酶及其对植物病原真菌的拮抗作用[J]. 植物病理学报,2002,32(2):97-102.XU T, LIU L H. Chitinases fromTrichodermaspp. and their antagonism against phytopathogenic fungi[J]. Acta Phytopathologica Sinica, 2002, 32(2)∶ 97-102.
