安石榴苷还原壳聚糖/纳米银溶胶制备表征及其抑菌性能
2018-03-09薛海燕张宝艳薛丽欢
薛海燕,张 颖,张宝艳,薛丽欢
安石榴苷还原壳聚糖/纳米银溶胶制备表征及其抑菌性能
薛海燕,张 颖,张宝艳,薛丽欢
(陕西科技大学食品与生物工程学院,西安 710021)
该文的研究目的用安石榴苷作为绿色还原剂制备壳聚糖/纳米银(CS/AgNPs)溶胶,并对CS/AgNPs表征及抑菌性能进行研究。结果表明:pH值为5,浓度为0.5%~1%的壳聚糖100mL,硝酸银溶液浓度0.6 mol/L,加入质量浓度1%的安石榴苷溶液,25 ℃还原6 h可得粒径范围较窄,银粒子质量分数较高较的稳定纳米复合材料CS/AgNPs溶胶。经透射电镜和X-射线衍射仪分析溶胶中纳米银粒子粒径为8~11 nm,晶型为面心立方型。傅里叶红外光谱表明壳聚糖中-NH2与Ag+发生了螯合及CS/AgNPs中AgNPs的存在。CS/AgNPs溶胶对大肠杆菌和金黄色葡萄球菌作用24 h后的抑菌率为95.5%,97.6%,刃天青法检测对2种菌的最小抑菌浓度均为0.096L/mL。透射电镜扫描及细胞内容物渗漏实验表明,CS/AgNPs溶胶可以吸附菌体于细胞,破坏细胞膜,增加细胞的通透性,抑制菌体生长。安石榴苷原位还原制备的CS/AgNPs溶胶具有良好的抑菌性能,可为食品保鲜或医用材料制备提供理论支撑。
纳米复合材料;杀菌;优化;壳聚糖;壳聚糖;纳米银;安石榴苷;抑菌性能
0 引 言
壳聚糖(chitosan,CS)具有良好的成膜性,同时安全无毒且具有螯合性,但是单一的壳聚糖广谱性较差[1]。研究表明,壳聚糖对大肠杆菌、沙门氏菌及芽孢杆菌等的生长具有抑制作用,而对革兰氏阳性菌及霉菌的抑制效果较差[2-3]。纳米银的粒径小,比表面积大,抑菌具有广谱性[4-6],但由于光照或者长期存放会发生团聚或变黑[7]降低抑菌性能。将壳聚糖与纳米银(AgNPs)复合能够稳定纳米银,增强天然生物材料壳聚糖的抑菌能力,进而拓展应用。合成纳米银一般用AgNO3提供Ag+,再使用还原剂使其被还原成Ag,常采用的还原剂有葡萄糖,柠檬酸钠,硼氢化钠,生物活性成分等[8]。Vigneshwaran等[9-10]等报道了利用可溶性淀粉作为稳定剂和还原剂,还原银离子,并防止粒子团聚,形成粒径10~30 nm的纳米银。刘冲冲等[11]利用姜的提取液作为还原剂和稳定剂成功制备了纳米银抑菌材料,得出制备的纳米银为球形粒子,大小均匀,粒径大约在15 nm左右。Nersisyan等[12]发展了一种用葡萄糖作还原剂制备纳米银,但葡萄糖是有机弱还原剂,形成的纳米银颗粒粒径大,粒径分布宽。姬振行[13]利用溶胶-凝胶法制备壳聚糖/银溶胶时即用的强的还原剂硼氢化钠,用戊二醛做交联剂,其中硼氢化钠被氧化生成硼酸,而硼酸对人体呼吸道等都有危害。
安石榴苷(C48H28O30)是从石榴皮中提取得到的一种可水解单宁,分子量1 084.72,棕黄色粉末,无毒。分子结构基团以没食子酸及其没食子酰衍生物为主,其中含有大量的酚羟基,具有较强的还原性能,在体内、体外都有较强的抗氧化活性,具有抑制肿瘤生长,抗动脉粥样硬化[14]等功能。本文主要研究安石榴苷代替NaBH4作为还原剂制备CS/AgNPs溶胶,并探讨该溶胶的抑菌性能,进而安全的使用及扩展其在食品医药行业的应用。目的在于为多酚类绿色还原剂制备CS/AgNPs溶胶提供技术参数。
1 材料与方法
1.1 试验材料及主要试剂
壳聚糖(CS),相对分子质量约15万,脱乙酰度≥90%;冰乙酸,分析纯,天津市天力化学试剂有限公司;硝酸银,分析纯,广州市金华大化学试剂有限公司;安石榴苷(质量分数40%),成都瑞芬思生物科技有限公司;牛肉膏,分析纯,北京澳博星生物技术有限公司;大肠杆菌(),陕西省食品药品检验所;金黄色葡萄球菌(),陕西省食品药品检验所;其他试剂均为分析纯。
1.2 试验仪器设备
78-1型磁力加热搅拌器,国华电器有限公司;SW-CJ-1D型洁净工作台,苏州净化设备厂;752型紫外-可见分光光度计,上海光谱仪器有限公司;PHS-3C型pH计,上海仪电科学仪器股份有限公司;SC-3610型低速离心机,科大创新股份有限公司中佳分公司;LDZM-40KCS-II型立式压力蒸汽灭菌器,上海申安医疗器械厂;Verios-460型扫描电镜,美国FEI公司;VECTOR-22型傅立叶变换红外光谱,德国布鲁克Bruker公司;D/max-2200PC型X射线衍射仪,日本理学公司;Turbiscan Lab型稳定性分析仪,法国Formulation公司。
1.3 试验方法
1.3.1 CS/AgNPs溶胶制备
配制pH值为5的乙酸-乙酸钠缓冲溶液,用该缓冲溶液配制质量分数为0.5%壳聚糖溶液,再量取100 mL,加入250 mL 0.6 mol/L的硝酸银溶液,磁力搅拌0.5 h后加入800L的0.8%安石榴苷,室温下持续搅拌6 h后,待测。单因素试验时,其他试验条件不变,分别改变溶液pH值(3、4、5、6),壳聚糖质量分数(0.1%、0.3%、0.5%、1.0%、1.5%),AgNO3浓度(0.1、0.3、0.6、0.9 mol/L),安石榴苷加入量(0.2%、0.4%、0.6%、0.8%、1%)以体积分数计,反应温度(25、40、60、80 ℃)以及室温下的持续搅拌时间(2、4、6、8 h),以纳米银特征吸收光谱为指标研究各因素对CS/AgNPs溶胶生成的影响。以安石榴苷溶液为对照,将不同单因素条件下所制备的CS/AgNPs溶胶用紫外-可见分光光度计进行扫描,扫描波长范围300~600 nm,纳米银的表面等离子共振(surface plasmon resonance,SPR)吸收峰范围在400~500 nm内[15-16],根据峰高反映纳米银质量分数,峰宽反映纳米银粒径分布范围探讨最佳制备条件。每个试验设置3组平行。对采用最佳制备条件制备出的CS/AgNPs溶胶样品经聚乙烯砜膜超滤浓缩2倍,除去残余Ag+后进行结构表征和用于抑菌性能及机理研究。
1.3.2 CS/AgNPs的结构表征
1)CS/AgNPs溶胶的稳定性。对采用优化工艺参数所制备的CS/AgNPs溶胶的稳定性使用Turbiscan Lab稳定性分析仪测定[17]。
设定每个样品每隔10 min扫1次,扫18次,即扫描3 h,温度为25℃对20 mL样品溶胶进行测试。
2)CS/AgNPs溶胶的透射电镜观察(transmission electron microscope, TEM)。将制备的CS/AgNPs溶胶和同等条件制备的纳米银分别滴在铜网上,室温干燥后用透射电镜进行观察。
3)傅立叶变换红外光谱分析(Fourier transform infrared spectroscopy, FTIR)。在上述制备好的CS/AgNPs溶胶加入氨水使pH值为7,离心并冷冻干燥即得壳聚糖/纳米银的固体样品。将待测样与KBr干粉按1:100混合后进行研磨,然后压制成透明的薄片,用傅立叶变换红外光谱仪测定纯壳聚糖及壳聚糖/纳米银样品的红外光谱[18]。
4)X-射线衍射仪(X-ray diffraction, XRD)检测。将3)中制得的壳聚糖/纳米银固体、壳聚糖以及安石榴苷在管电压36 kV,管电流20 mA,扫描范围5°~80°,扫描速度2 °/min的条件下连续扫描,采样步长0.01°。参考JCDPS卡片分析纳米银的晶型[19]。
1.3.3 CS/AgNPs溶胶的抑菌性能试验
将织物剪成直径5 cm大小圆形样片,121 ℃,20 min高压灭菌后浸泡于CS/AgNPs溶胶和PBS缓冲溶液中24 h后取出干燥,即得抑菌织物和对照织物。在无菌超净工作台中,吸取50L活化好的浓度为106~107cfu/mL的、.分别均匀涂抹在琼脂固体培养基上,待几分钟菌悬液干后将上述的抑菌织物和对照织物放于固体培养基上,以双抗作为阳性对照,二甲基亚砜作为阴性对照,置于37 ℃恒温培养箱18 h后,取培养皿,观察结果。
将上述准备的抑菌织物和对照织物,参照鲁波的定量试验[20],计算CS/AgNPs溶胶的抑菌率,计算方法如公式(1)。

1.3.4 CS/AgNPs溶胶抑菌机理的研究
1)CS/AgNPs溶胶的最小抑菌浓度的测定。将5 mL的菌液(107cfu/mL)和8L的刃天青指示剂(0.07 g/100 mL)混合,取100L混合液于无菌96孔板中,按张雨菲等[21]法用NaBH4作还原剂制备的CS/AgNPs溶胶样品(CS/AgNPs-B)和本文用安石榴苷作还原剂制备的CS/AgNPs溶胶样品(CS/AgNPs-A),采用对半稀释法稀释7次,分别加入于96孔中,无菌生理盐水为对照组,37℃恒温培养,每12 h左右用肉眼观察,有细菌生长孔的颜色会变红或者粉,无菌生长的孔仍然为蓝色,以发生颜色变化的前一孔为最低抑菌浓度(minimal inhibitory concentration,MIC)。重复3次,同时,用二甲基亚砜(dimethyl sulfoxide,DMSO)作为阴性对照,以双抗(青霉素-链霉素)作为阳性对照。
2) CS/AgNPs溶胶对细菌生长曲线的影响。取20L培养至对数期、浓度106cfu/mL的菌悬液于96孔板上,再加200L液体培养基的96孔板中,其中,2孔分别加入终浓度为1×MIC、2×MIC浓度的抑菌剂,对照组加PBS。在37 ℃培养,分别在培养0、2、4、6、8、12、24 h时,在波长600 nm处测定吸光度,并绘制微生物的生长曲线,该操作重复3次。
3)微生物扫描电镜观察。将E.和制成终浓度为106~107cfu/mL的菌悬液。分别加入CS/AgNPs-A和CS/AgNPs-B(终浓度是MIC),对照组加pH值为7.2的无菌缓冲溶液,在37℃培养6 h后结束培养。将菌悬液10 000 r/min离心15 min,弃去上清夜,菌体用2.5%戊二醛在4℃冰箱固定过夜。然后用乙醇的水溶液进行梯度洗脱(乙醇浓度30%、50%、70%、90%、100%),用叔丁醇置换乙醇,放入临界点干燥仪干燥,最后进行喷金处理,用扫描电镜观察微生物抑菌前后形态的变化。
4)CS/AgNPs溶胶对细胞内容物渗漏的影响。将2种受试菌活化,分别将菌悬液分为3等份,每份10 mL,分别加入终浓度为MIC值的CS/AgNPs-A和CS/AgNPs-B,对照组加PBS。5 h后分别取10 mL,离心(5 000 r/min,15 min)取上清液,用紫外可见分光光度计测定A260。再各取离心后上清液0.5 mL,加入5 mL考马斯亮蓝试剂,5 min后测定A595,考马斯亮蓝法测上清中蛋白质质量分数[22],通过标准曲线查得待测样品的蛋白质质量分操作重复3次。
2 结果与分析
2.1 CS/AgNPs溶胶制备参数的优化结果
纳米银的紫外吸收在380~420nm之间,对制备的溶胶样品在300~600nm进行波长扫描。不同pH值对CS/AgNPs溶胶的影响结果如图1a所示。pH值为5时峰形窄而高,峰强较强,说明纳米银颗粒的粒径分布较窄,颗粒尺寸较均一。因此pH值为5为较佳制备条件。因为壳聚糖分子链上有大量的酚羟基,在酸性条件下会质子化,随着H+浓度变小,质子化的强度会随之变小,进而会导致壳聚糖分子链上可以与银离子络合的氨基数变多,壳聚糖分子链间相对于质子化程度较高时较紧密,均使得银粒子在体系中更稳定不易团聚。所以pH值不宜过小,但pH值过高时,壳聚糖上-NH2质子化程度变弱,金属离子难容易接近-NH2发生配位反应[23]。所以体系的pH值也不能太大。
据图1b所示,温度高于25 ℃时制备的CS/AgNPs溶胶均没有25 ℃生成的纳米银理想,这可能是安石榴苷在高温下不稳定[24]。温度过高导致反应速率过快,稳定剂还来不及包裹AgNPs粒子,出现了二次团聚[25],从而使生成AgNPs的粒径减小且分布不均匀[26]。当温度为25 ℃时,CS/AgNPs溶胶中生成的纳米银很稳定[27]。因此在本试验选用最适反应温度为25 ℃。

注: 单因素试验时,初始条件为:反应pH值为5,反应温度为25 ℃,壳聚糖溶液质量分数为0.5%,硝酸银浓度为0.6 mol/L,安石榴苷质量分数为0.8%,室温下持续搅拌6 h。
如图1c所示,在不同的壳聚糖浓度在380~420 nm范围内都出现了纳米银的紫外吸收峰[28],有纳米银生成。随壳聚糖浓度增大,吸收值减小。当壳聚糖浓度大于1.0%时,吸收值峰下降幅度增大。可能因为壳聚糖上的羟基以及部分没有质子化的氨基形成分子内氢键和分子间氢键,使得壳聚糖成网状结构,且壳聚糖上未质子化的氨基以及羟基均可以与银离子发生鳌合作用[29],银离子会被壳聚糖的网状结构包裹,而还原剂安石榴苷需渗透壳聚糖分子后才能还原银离子。壳聚糖的浓度越大,银离子会被包裹得越严,还原剂安石榴苷越难渗透,被还原出来的银粒子越少,另外,从图1c壳聚糖浓度为0.1%和0.3%时吸收峰较其他浓度有红移及二次出峰现象,这是因为部分银粒子发生团聚使粒径增大且不均一,所以壳聚糖浓度也不应太小。因此,在制备CS/AgNPs溶胶时选用壳聚糖质量分数为0.5%~1.0%较佳。
由图1d可知,随着安石榴苷用量增大纳米银的量也会增大,这是因为还原剂量大就会增加渗透到壳聚糖网状结构内还原银离子的几率。但是当安石榴苷的质量分数为1%时UV-Vis吸收峰峰形较宽,而且吸收峰发生红移及二次出峰,说明纳米银可能发生团聚。所以,在制备CS/AgNPs溶胶时还原剂安石榴苷的用量选择质量分数0.8%。
由图1e可知,当银离子浓度为0.1~0.6 mo1/L时,制备的CS/AgNPs溶胶中的银粒子均为纳米级的。随着银离子的浓度增加,溶胶的紫外吸收峰峰强度一直在增加。但当硝酸银浓度为0.9 mo1/L时峰宽增大,而且最大吸收峰发生红移,这是由于银浓度太大还原反应的速率加大,更容易发生团聚现象,所以制备过程中硝酸银的浓度不宜太大。当硝酸银浓度为0.6 mo1/L时,UV-Vis吸收峰的峰宽较窄;且峰强度明显高于其他的吸收峰,说明此条件下制备的CS/AgNPs溶胶中纳米银粒子含量高且粒径分布较集中。因此制备CS/AgNPs溶胶时硝酸银浓度选用0.6 mol/L。
由图1f可以看出:随着反应时间的增长,生成吸收峰的强度也随之加强。即在还原时间为2和4 h时,并没有出现明显的吸收峰,可能是安石榴苷和银离子反应几率小所致。随着还原时间的加长,还原剂安石榴苷与银离子反应几率增大导致吸收强度增强。但是当反应时间为8 h时峰值不再增高可能是由于还原反应较完全。因此在用安石榴苷作为还原剂制备CS/AgNPs溶胶时选用还原时间为6 h为理想的反应时间
2.2 CS/AgNPs结构表征结果
2.2.1 CS/AgNPs溶胶稳定性的结果
多次扫描所接收光强(backscattered, BS)的偏差反映体系稳定程度,曲线从左到右代表样品从底部到顶部。图2比较了3种胶体体系稳定性,可知质量分数5%的壳聚糖光强度变化不大,说明其较稳定,纳米银溶液的光强度变化很大,说明纳米银溶液不稳定,而CS/AgNPs溶胶的光强度变化比纯纳米银溶液变化小的多,表明壳聚糖可以稳定纳米银。
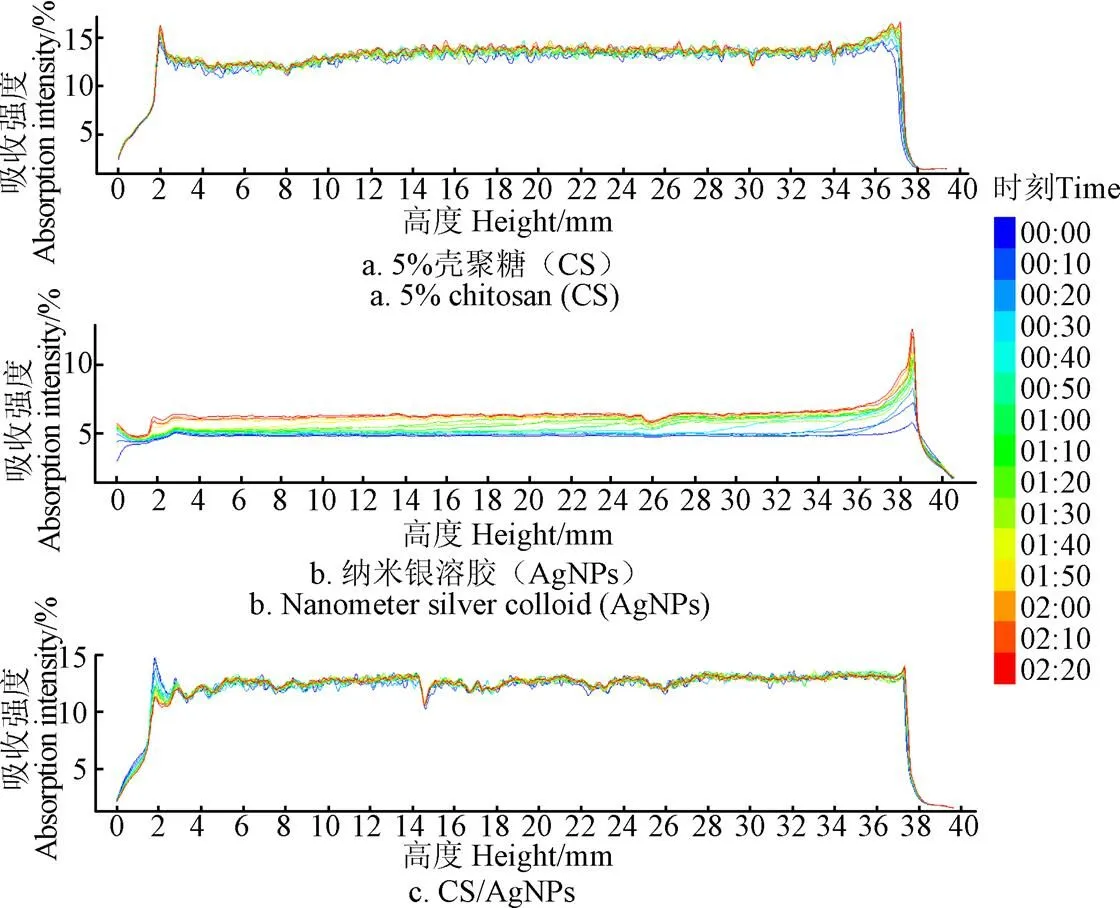
图2 稳定性分析的典型图谱
2.2.2 透射电镜(TEM)分析
TEM可以表征纳米银离子是否发生团聚。由图3a AgNPs图中颗粒不均匀,而图3b中的AgNPs分散而且颗粒均匀,粒径较小为8~11 nm。图3说明壳聚糖能够有效的抑制纳米银的团聚。通过磁力搅拌可以使银离子均匀的分散在壳聚糖分子链之间,壳聚糖分子中的氮原子和氧原子上的孤对电子与银离子可以发生螯合反应[30],加入还原剂安石榴苷,在银离子螯合部位发生还原反应,得到的纳米银因为有壳聚糖网络结构的的包裹而相对稳定,不易团聚,因此可以生成分布的比较均匀、粒径小的纳米银颗粒。这与稳定性分析结果一致。

图3 纳米银及壳聚糖/纳米银的TEM图
2.2.3 傅立叶红外光谱分析(FTIR)
FTIR可以分析纳米银与壳聚糖的螯合程度。图4为CS和CS/AgNPs的红外图谱,与壳聚糖的红外图谱相比,CS/AgNPs溶胶的整体基本没有变化,即特征吸收峰仍然存在,但1 425.12、1 319.07 cm-1处的C-N的伸缩振动吸收峰[31]消失,说明壳聚糖上的氨基(-NH2)与Ag+发生了螯合反应,1 087.65 cm-1所对应的伯醇C-O伸缩振动吸收峰[32-33]基本未变,说明壳聚糖的伯醇的羟基没有与银发生配位反应,1 405.85 cm-1出现对应的Ag-N伸缩振动吸收峰,说明壳聚糖的氨基上的氮与银形成了配位键。而1 554.34 cm-1出现的特征吸收峰[34]对应于纳米银的特征峰。说明CS/AgNPs溶胶中AgNPs的螯合形成。
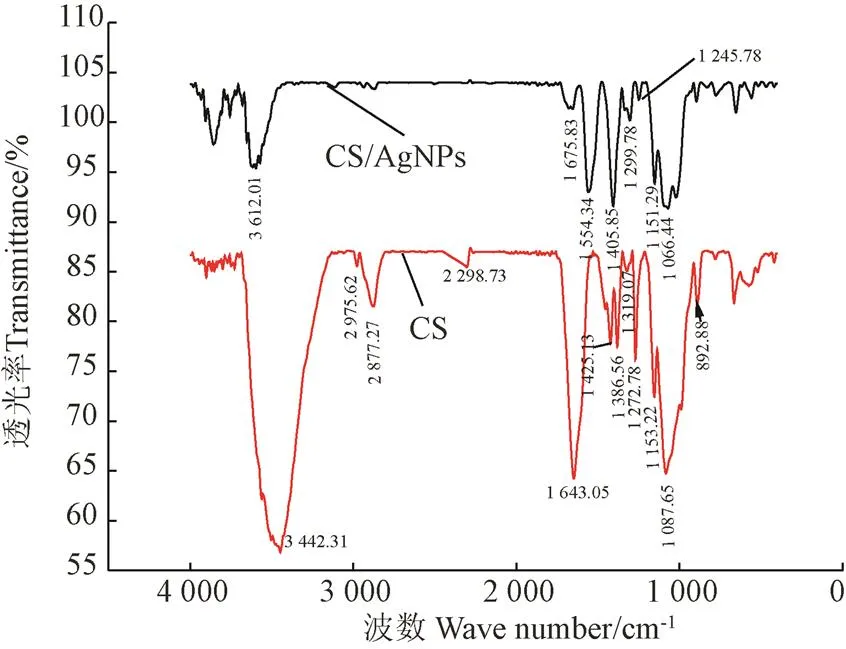
图4 壳聚糖和壳聚糖/纳米银的傅立叶红外光谱图
2.2.4 XRD分析结果
图5为壳聚糖/纳米银、壳聚糖和40%安石榴苷的XRD图。
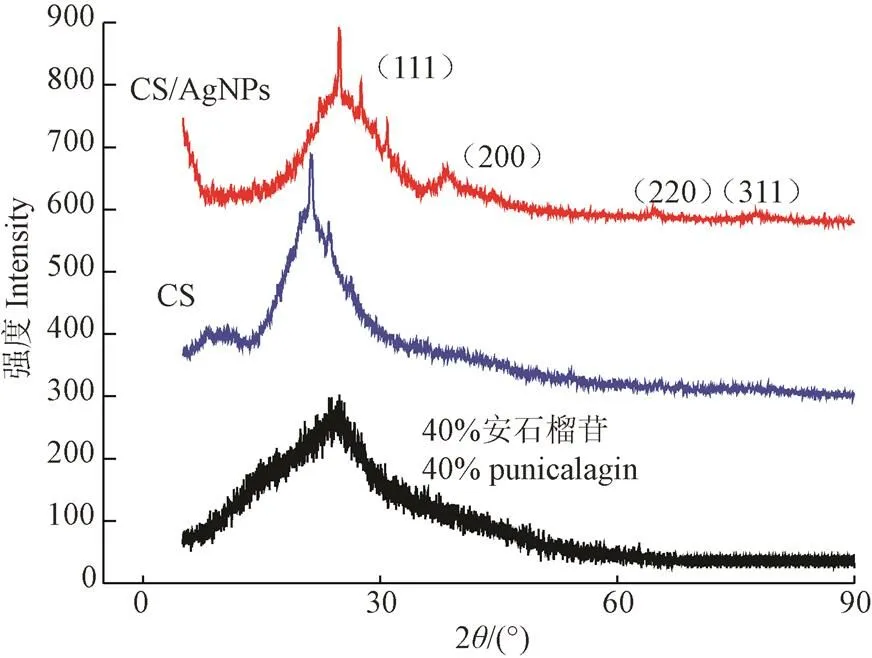
图5 最佳条件制备的壳聚糖/纳米银(CS/AgNPs)的X-射线衍射图
图5中壳聚糖和40%安石榴苷的衍射峰峰形复杂,说明壳聚糖和该纯度的安石榴苷为典型的无定形晶型。此外壳聚糖/纳米银的衍射图在2为38.58°、44.36°、64.92°和77.96°处有4个明显的衍射峰,这些衍射峰分别对应标准晶态银卡片上的(111),(200),(220)和(311)晶面,与樊新等[35]分析的相近,说明CS/AgNPs溶胶中形成了单质银,且为典型面心的立方晶型。
2.3 CS/AgNPs溶胶的抑菌性能检测结果
2.3.1 改进滤纸法试验结果
由图6可知,用NaBH4作还原剂制备的CS/AgNPs-B和用安石榴苷作还原剂制备的CS/AgNPs-A均对受试菌都有抑菌作用。CS/AgNPs-B中.的抑菌圈直径是6 mm,而.的抑菌圈直径是6.5 mm。CS/AgNPs-A中.的抑菌圈直径是4.5 mm,而.的抑菌圈直径是5.5 mm。说明CS/AgNPs对革兰氏阳性菌抑制能力强于对革兰氏阴性菌的能力。

注 :CS/AgNPs-B、A、双抗和DMSO分别为安石榴苷制备的壳聚糖/纳米银溶胶,硼氢化钠还原制备的溶胶,以及阳性对照双抗(青霉素-链霉素),阴性对照二甲基亚砜(DMSO)。
同时CS/AgNPs溶胶浸泡织物后织物有较好的抑菌能力,与Jung等[36]的结论是一致的。原因是革兰氏阳性菌的细胞壁壁厚15~80 nm,主要成分是肽聚糖以及磷壁酸,可以在细胞壁的周围形成带有负电荷的环境,与壳聚糖直链分子上的大量的-NH2发生反应使细菌的细胞壁不完整起到抑菌的效果[37-38],为以后应用提供理论依据。
由图7a可知抑菌织物与作用1 min时抑菌率为72.9%,作用24 h时抑菌率是95.5%;由图7b可得抑菌织物与作用1 min时抑菌率为77.6%,作用24 h时抑菌率是97.6%。研究表明CS/AgNPs溶胶具有良好的抑菌性。

注:图中a、c为空白对照组,b、d为CS/AgNPs溶胶试验组;图中e、g为空白对照组,f、h为CS/AgNPs溶胶试验组。
2.3.2 最小抑菌浓度的测定结果
当微生物繁殖时产生还原酶,使得刃天青颜色从蓝变红,从而证明其中存在微生物且在不断繁殖。由表1可知CS/AgNPs-B对.和.的最小抑菌浓度(minimal inhibitory concentration, MIC)均为0.19L/mL,CS/AgNPs-A对.和.的最小抑菌浓度均为0.096L/mL,由此可知用安石榴苷制备代替NaBH4作为还原剂制备得到的CS/AgNPs溶胶的抑菌效果好,这与所制备的溶胶中AgNPs的粒径及安石榴苷本身具有抑菌效果有关[39],也可能是由于CS/AgNPs-A和CS/AgNPs-B中前者粒径对2种菌的抑菌效果更好。

表1 4种样品对受试菌的最小抑菌浓度
2.3.3 CS/AgNPs溶胶对细菌生长曲线影响的结果
由图8可知,加入CS/AgNPs-B和CS/AgNPs-A的试验组中微生物均比正常组微生物生长缓慢,且加入CS/AgNPs-A试验组的微生物比加入CS/AgNPs-B微生物生长趋势更缓慢,原因可能是前者溶胶的粒径更适合抑制2种细菌,或者因为前者溶胶中仍有未发生反应具有抑菌性能的安石榴苷的存在。
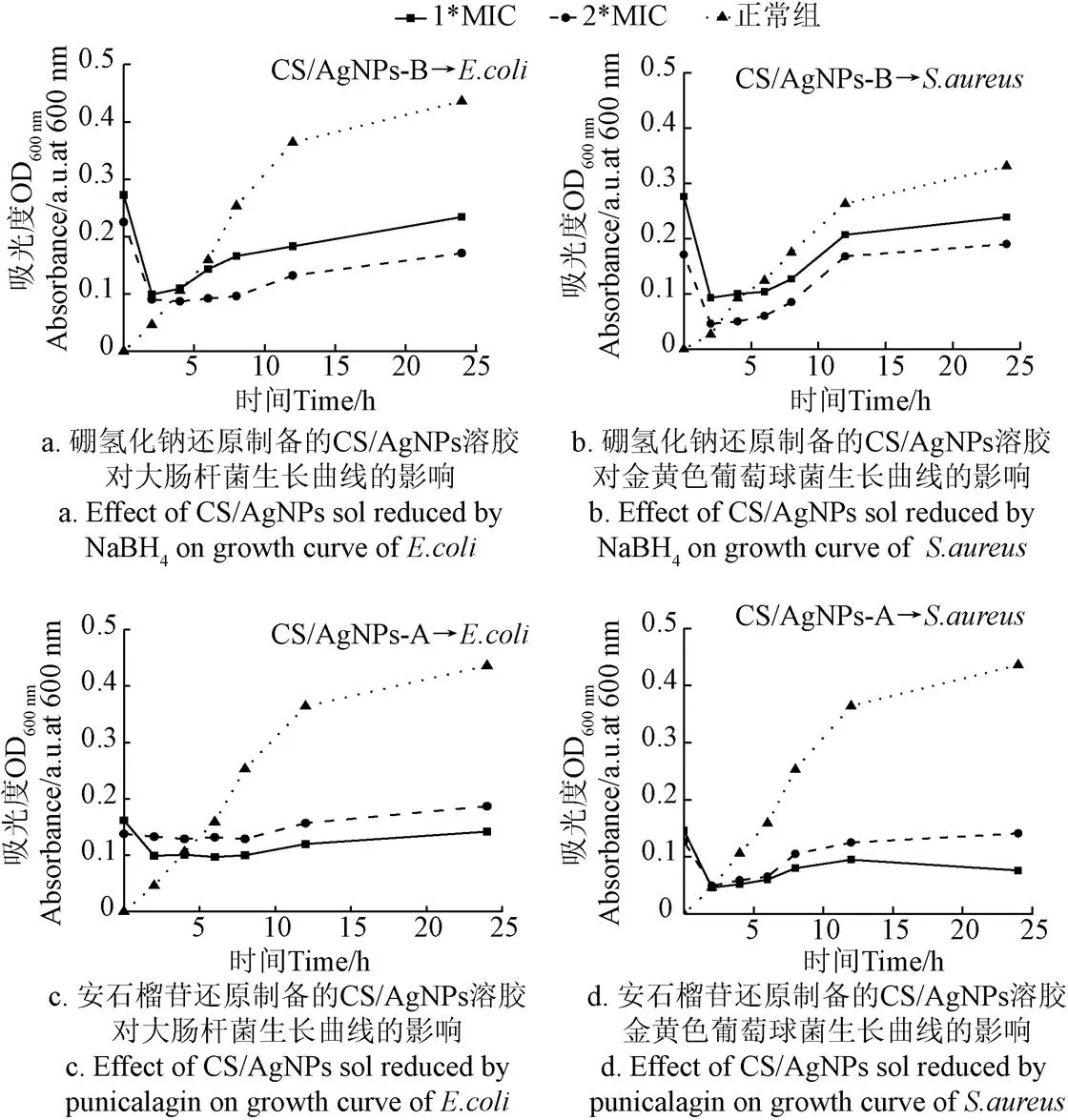
图8 CS/AgNPs溶胶对微生物的生长曲线的影响
2.3.4 微生物与抑菌溶胶结合的扫描电镜观察结果
扫描电镜观察CS/AgNPs溶胶处理前后微生物形态上的变化。图9中空白对照组的.表面光滑,细胞完整而且饱满,而2组试验组中.的细胞壁损害严重,表面粗糙有大量附着物,且大部分杆菌的长度很短,尤其是CS/AgNPs-A作用.中有部分细胞成扁平状,细胞被破坏严重。.的电镜图发现(右边),空白对照组.的表面光滑,细胞完整而且饱满,而2试验组.表面粗糙有大量附着物,且球形发生变小和不规则的变形。CS/AgNPs溶胶对微生物的破坏主要表现为微生物细胞壁变形内容物泄露。
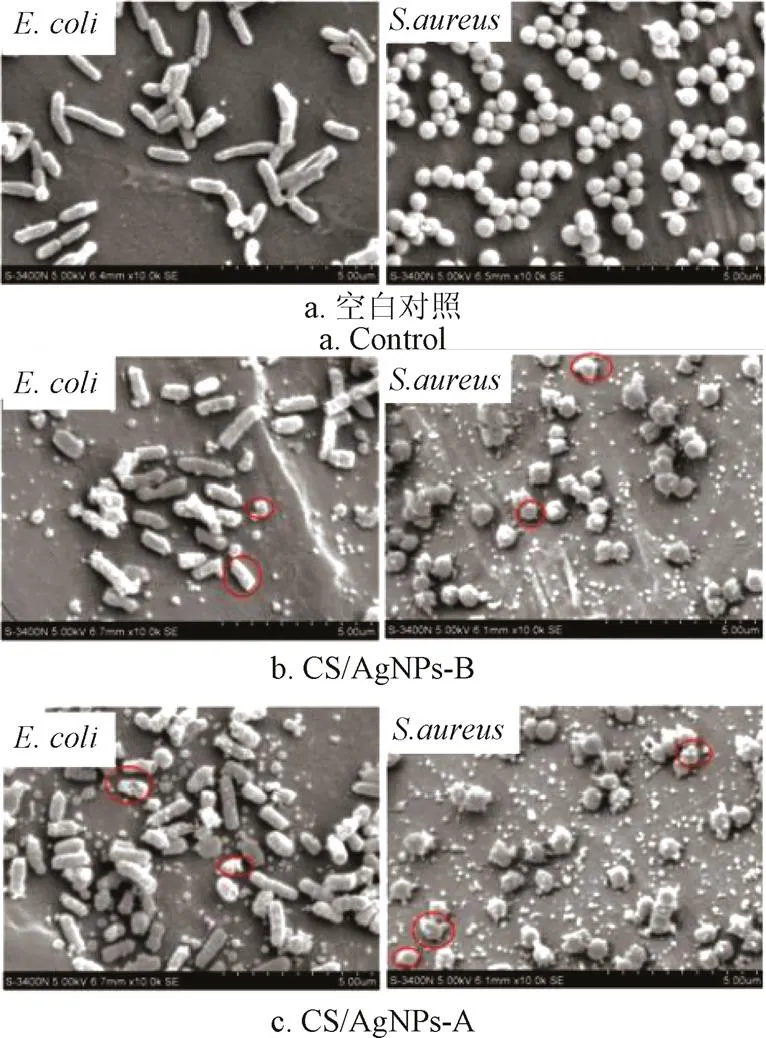
图9 受试菌扫描电镜观察图片
2.3.5 CS/AgNPs溶胶对细胞内容物渗漏影响结果
用上清液的OD260nm和上清液中的蛋白质的量作为细胞内容物渗漏的指标如表2,经过CS/AgNPs-B和CS/AgNPs-A作用的2种细菌外蛋白质的量和OD260nm值均比对照组大,说明CS/AgNPs溶胶可以使得细胞膜的通透性增大甚至可以损坏细胞膜。由表2还可知,CS/AgNPs-A 2个指标比CS/AgNPs-B高,说明前者抑菌性能强,此结果与前面结果一致。
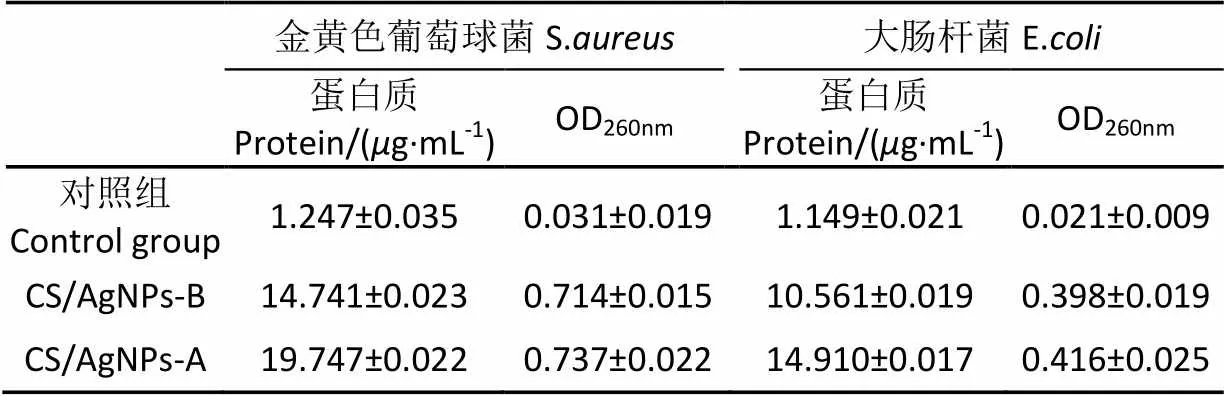
表2 CS/AgNPs溶胶对细胞内容物渗漏的影响
以植物提取物安石榴苷作为还原剂,经过试验可以制得粒径较小的AgNPs颗粒,在此粒径范围下,制得的CS/AgNPs溶胶的抑菌效果最好。与刘冲冲等[11,40-42]利用姜和黑胡椒以及海藻江蓠菜提取液作为还原剂和稳定剂成功制备了纳米银抑菌材料,粒径在20~100 nm之间的结果一致。与壳聚糖和壳聚糖衍生物的抑菌效果[43]相比,对革兰氏阳性菌的抑制能力大大增加,提高了壳聚糖复合材料的抑菌广谱性。CS/AgNPs溶胶可以吸附于菌体细胞,破坏菌体细胞膜,增加细胞的通透性,从而抑制菌体生长。纳米银除抑制细菌外,对真菌也有良好的抑制效果,所制备的CS/AgNPs溶胶对真菌的抑制效果有待进一步研究。
3 结 论
采用安石榴苷原位还原制备CS/AgNPs溶胶的最佳制备条件为,pH值为5,质量分数为0.5%~1%的壳聚糖100 mL,加入0.6 mol/L硝酸银250mL,磁力搅拌30 min后,再加入0.8%安石榴苷800L,在25 ℃反应6 h。可制得纳米银颗粒的粒径为8~11 nm CS/AgNPs溶胶。壳聚糖可以稳定纳米银,阻止纳米银发生团聚现象。在制备过程中壳聚糖与银离子确实发生了螯合反应,并被还原成纳米银,其中纳米银是典型的面心立方晶型结构。抑菌性能研究表明CS/AgNPs溶胶具有良好的抑菌性能,且对S.的抑制效果强于E.。进一步对该复合物的抑菌机理研究表明,CS/AgNPs溶胶可以粘附在菌体表面,增加细胞的通透性,甚至可以破坏细胞膜,抑制菌体生长。
因此采用多酚类物质安石榴苷代替传统的无机还原剂硼氢化钠制备CS/AgNPs溶胶具有可行性,能够提高此类复合物安全性并拓展其在食品医药行业的应用。
[1] 王鸿,沈月新. 不同脱乙酰度壳聚糖的抑菌性[J]. 上海海洋大学学报,2001,10(4):380-382.Wu Hong, Shen Yuexin. The antibiotic activities of chitosan with different deacetyl degrees[J]. Journal of Shanghai Ocean University, 2001, 10(4): 380-382. (in Chinese with English abstract)
[2] 张宾,汪东风,邓尚贵,等. 壳聚糖-胰蛋白酶抑制剂复合可食性膜的制备及抗黄曲霉活性[J]. 农业工程学报,2012,28(4):287-292.
Zhang Bin, Wang Dongfeng, Deng Shanggui, et al. Preparation and anti-Aspergillus flavus activity of chitosan-trypsin inhibitor blend edible film[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2012, 28(4): 287-292. (in Chinese with English abstract)
[3] Suzuki S, Ying B, Yamane H, et al. Surface structure of chitosan and hybrid chitosan-amylose films-restoration of the antibacterial properties of chitosan in the amylose film[J]. Carbohy drate Research, 2007, 342(16): 2490-2493.
[4] 魏坤,吴远,席云,等. 复方纳米银抗菌乳液杀菌效果的研究[J]. 中国消毒学杂志,2010,27(5):521-523.
Wei Kun, Wu Yuan, Xi Yun, et al. Rsearch on disinfection efficacy of the compound antimicrobila emulsion containing silver nanoparticles[J]. Chinese Journal of Disinfection, 2010, 27(5): 521-523. (in Chinese with English abstract)
[5] Gao J, Zhao C, Zhou J, et al. Plasma sprayed rutile titania-nanosilver antibacterial coatings[J]. Applied Surface Science, 2015, 355: 593-601.
[6] Ivask A, Elbadawy A, Kaweeteerawat C, et al. Toxicity mechanisms invary for silver nanoparticles and differ from ionic silver[J]. Acs Nano, 2014, 8(1): 374-86.
[7] 王瑶,王瑜,程昱,等. 纳米银粒径与抗细菌性能的关系[J]. 中国皮革,2016,45(5):1-4.
Wang Yao, Wang Yu, Cheng Yu, et al. Antibacterial properties of different sizes of nano/sliver to bacteria[J]. China Leather, 2016, 45(5): 1-4. (in Chinese with English abstract)
[8] 王立英,蔡灵剑,沈頔,等. 金属纳米颗粒制备中的还原剂与修饰剂[J]. 化学进展,2010,22(4):580-592.
Wang Liying, Cai Lingjian, Shen Di, et al.Reducing agents and capping agents in the preparation of metal nanoparticles[J]. Chemical Industry and Engineering Progress, 2010, 22(4): 580-592. (in Chinese with English abstract)
[9] Vigneshwaran N, Nachane R P, Balasubramanya R H, et al. A novel one-pot ‘green’ synthesis of stable silver nanoparticles using soluble starch[J]. Carbohydrate Research, 2006, 341(12): 2012-2018.
[10] 高向华. 纳米银/天然高聚物复合抗菌溶胶的合成及其性能研究[D]. 太原:太原理工大学,2013.
Gao Xianghua. Preparation and Properties of Nanoscaled Silver/natural Polymer Antibacterial Sols[D]. Taiyuan: Taiyuan University of Technology, 2013. (in Chinese with English abstract)
[11] 刘冲冲,王磊,徐慧,等. 姜提取物生物合成纳米银抑菌活性的研究[J]. 食品与生物技术学报,2017,36(6):590-597.
Liu Chongchong, Wang Lei, Xu Hui, et al. Antibacterial study of silver nanoparticles biosynthesized with ginger extract[J]. Journal of Food Science and Biotechnology, 2017, 36(6): 590-597. (in Chinese with English abstract)
[12] Nersisyan H H, Lee J H, Son H T, et al. A new and effective chemical reduction method for preparation of nanosized silver powder and colloid dispersion[J]. Materials Research Bulletin, 2003, 38(6): 949-956.
[13] 姬振行. 壳聚糖/银纳米微球的制备与表征[D]. 石家庄:河北科技大学,2010.
Ji Zhenxing. Preparation and Characterization of Chitosan/Silver Nano Microspheres[D]. Shi Jiazhuang: Heibei University of Science and Technology, 2010. (in Chinese with English abstract)
[14] 李思诺,周宏勇,何彦刚,等. 改性壳聚糖及其膜材料的制备与表征[J]. 高分子材料科学与工程,2014,30(12):128-133.Li Sinuo, Zhou Hongyong, He Yan’gang, et al. Preparation and characterization of n-Methylene phosphonic chitosan and its membrane material[J]. Polymeric Materials Science and Engineering, 2014, 30(12): 128-133. (in Chinese with English abstract)
[15] Sadeghi B, Gholamhoseinpoor F. A study on the stability and green synthesis of silver nanoparticles using Ziziphora tenuior (Zt) extract at room temperature[J]. Spectrochim Acta A Mol Biomol Spectrosc, 2015, 134(134C): 310-315.
[16] 孔杰,李国强,叶菁芸,等. 纳米银/壳聚糖复合水凝胶的原位制备、表征及抗菌性能研究[J]. 功能材料,2012,43(12):1662-1664.
Kong Jie, Li Guoqiang, Ye Jingyun, et al. In situ preparation, characterization and zntibacterial properties research of nano-silver/chitosan composite hydrogels[J]. Functional Materials, 2012, 43(12): 1662-1664. (in Chinese with English abstract)
[17] 冯建国,郁倩瑶,史雅丽,等. Turbiscan Lab分散稳定性分析仪研究异丙甲草胺水乳剂物理稳定性[J]. 中国农业大学学报,2015,20(6):152-159.
Feng Jianguo, Yu Qianyao, Shi Yali, et al. Study on the physical stability of metolachlor emulsionoil in water by Tturbiscan Lab analyzer[J]. Journal of China Agricultural University, 2015, 20(6): 152-159. (in Chinese with English abstract)
[18] 徐雄立,周美华. 含纳米银的明胶/壳聚糖纳米纤维的制备及其抗菌性能研究[J]. 化工新型材料,2010,38(2):23-25.
Xu Xiongli, Zhou Meihua. Study on the preparation and antibacterial activity of gelatin/chitosan nanofibers containing silver nanoparticles[J]. New Chemical Materials, 2010, 38(2): 23-25.(in Chinese with English abstract)
[19] 康虹,马森源,高向华,等. 壳聚糖/银-铜复合抗菌剂的制备及在硅橡胶基体上的应用[J]. 太原理工大学学报,2015,46(5):489-494.
Kang Hong, Ma Senyuan, Gao Xianghua, et al. Preparation of chitosan/silver-copper composite antibacterial agent and its application on silicone rubber matrix[J]. Journal of Taiyuan University of Technology, 2015, 46(5): 489-494. (in Chinese with English abstract)
[20] 鲁波,李霞,陈西平,等. 抗菌织物抑菌效果评价[J]. 中国公共卫生,2002,18(4):491-491.
[21] 张雨菲,李友良,姚远,等. 壳聚糖纳米银溶液的稳定性及在织物抗菌整理上的应用[J]. 高等学校化学学报,2012,33(8):1860-1865.
Zhang Yufei, Li Youliang, Yao Yuan, et al. Stabiliby of chitosan-stablized nanosilver solutions and its application for antibacterial durability of cotton fabrics[J]. Chemical Journal of Chinese Universities, 2012, 33(8): 1860-1865. (in Chinese with English abstract)
[22] 冯昕,王吉中,尧俊英,等. 考马斯亮蓝法测定乳与乳制品中蛋白质含量[J]. 粮食与食品工业,2010,17(3):57-59.
Feng Xin, Wang Jizhong, Yao Junying, et al.Determination of protein content in milk and dairy products by Coomassie Brilliant Blue method[J]. Cereal & Food Industry, 2010, 17(3): 57-59. (in Chinese with English abstract)
[23] 张艺钟,刘珊,刘志文,等. 壳聚糖凝胶球对Cu(Ⅱ)和Cr(Ⅵ)吸附行为的对比[J]. 化工进展,2017,36(2):712-719.
Zhang Yizhong, Liu Shan, Liu Zhiwen, et al. Comparison for Cu(Ⅱ) and Cr(Ⅵ) adsorption behavior onto chitosan hydrogel beads[J]. Chemical Industry and Engineering Progress, 2017, 36(2): 712-719. (in Chinese with English abstract)
[24] 崔艳娜. 石榴皮中安石榴苷的纯化工艺及其酪氨酸酶活性抑制研究[D]. 开封:河南大学,2014.
Cui Yanna. Study on the Purification Technology of Pomegranate Peel and the Inhibition of Tyrosinase Activity[D]. Kaifeng: Henan University, 2014. (in Chinese with English abstract)
[25] Kim B H, Lee J S. One-pot photochemical synthesis of silver nanodisks using a conventional metal-halide lamp[J]. Materials Chemistry & Physics, 2015, 149: 678-685.
[26] 吕佳,张浩春,张冰,等. 纳米材料比色分析传感器在食品检测中的应用进展[J]. 化工进展,2017,36(1):20-28.
Lü Jia, Zhang Haochun, Zhang Bing, et al. Application of colorimetric sensor based nanomaterials in food detection[J]. Chemical Industry and Engineering Progress, 2017, 36(1): 20-28. (in Chinese with English abstract)
[27] 贾瑞秀,邱苗,黄建颖,等. 壳聚糖及其衍生物对镰孢菌的抑菌机理[J]. 中国食品学报,2016,16(11):70-75.
Jia Ruixiu, Qiu Miao, Huang Jianying, et al. Antibacterial mechanism of chitosan and its derivatives on fusarium concentricum[J]. Journal of Chinese Institute of Food Science and Technology, 2016, 16(11): 70-75. (in Chinese with English abstract)
[28] 李高青,桑青,崔凯. 壳聚糖纳米银复合物基温敏水凝胶的抑菌性及细胞相容性研究[J]. 中国生化药物杂志,2016,36(6):63-66.
Li Gaoqing, Sang Qing, Cui Kai. Antibacterial activity and cytocompatibility of chitosan-nano-silver complex thermosensitive hydrogel[J]. Chinese Journal of Biochemical and Pharmaceutics, 2016, 36(6): 63-66. (in Chinese with English abstract)
[29] 田华. 饮用水体系银/壳聚糖类抑菌材料的制备及其性能研究[D]. 西安:西安建筑科技大学,2011.
Tian Hua. Preparation and Application of Chitosan/Silver Anti-bacterial Materials for Drinking Water[D]. Xi’an: Xi’an University of Architecture and Technology, 2011. (in Chinese with English abstract)
[30] Junlabhut P, Boonruang S, Mekprasart W, et al. Ag nanoparticle-doped SiO2/TiO2, hybrid optical sensitive thin film for optical element applications[J]. Surface & Coatings Technology, 2016, 306: 262-266.
[31] 孙金旭. 纳米银的抑菌研究[J]. 衡水学院学报,2010,12(4):28-30.
Sun Jinxu. On the bactriostasis of nano silver[J]. Journal of Hengshui University, 2010, 12(4): 28-30. (in Chinese with English abstract)
[32] Yuan Q, Venkatasubramanian R, Hein S, et al. A stimulus-responsive magnetic nanoparticle drug carrier: Magnetite encapsulated by chitosan-grafted-copolymer[J]. Acta Biomaterialia, 2008, 4(4): 1024-1037.
[33] Papadimitriou S, Bikiaris D, Avgoustakis K, et al. Chitosan nanoparticles loaded with dorzolamide and pramipexole[J]. Carbohydrate Polymers, 2008, 73(1): 44-54.
[34] Zhao Y, Jiang Y, Fang Y. Spectroscopy property of Ag nanoparticles.[J]. Spectrochimica Acta Part A Molecular & Biomolecular Spectroscopy, 2006, 65(5): 1003-1006.
[35] 樊新,黄可龙,刘素琴,等. 化学还原法制备纳米银粒子及其表征[J]. 功能材料,2007,38(6):996-999.
Fan Xin, Huang Kelong, Liu Suqin, et al. Preparation and characteristic of silver nanoparticles by chemical reduction[J]. Functional Materials, 2007, 38(6): 996-999. (in Chinese with English abstract)
[36] Jung E J, Youn D K, Lee S H, et al. Antibacterial activity of chitosans with different degrees of deacetylation and viscosities[J]. International Journal of Food Science & Technology, 2010, 45(4): 676-682.
[37] Liu H, Du Y, Wang X, et al. Chitosan kills bacteria through cell membrane damage[J]. International Journal of Food Microbiology, 2004, 95(2): 147-155.
[38] Mignot T, Denis B, Couture-Tosi E, et al. Distribution of S-layers on the surface of, strains: Phylogenetic origin and ecological pressure[J]. Environmental Microbiology, 2001, 3(8): 493-501.
[39] 徐霄龙. 安石榴苷通过诱导小鼠巨噬细胞M2型分化抑制急性炎症反应[D]. 北京:中国农业大学,2015.
Xu Xiaolong. Punicalagin Suppresses Acute Inflammatory Response via Promoting Mouse Macrophages M2 Polarization[D]. Beijing: China Agricultural University, 2015. (in Chinese with English abstract)
[40] Shukla V K, Singh R P, Pandey A C. Black pepper assisted biomimetic synthesis of silver nanoparticles[J]. Journal of Alloys & Compounds, 2010, 507(1): 13-16.
[41] Aragão A P D, Oliveira T M D, Quelemes P V, et al. Green synthesis of silver nanoparticles using the seaweed gracilaria birdiae, and their antibacterial activity[J]. Arabian Journal of Chemistry, 2016.
[42] Sankar R, Rahman P K S M, Varunkumar K, et al. Facile synthesis of curcuma longa, tuber powder engineered metal nanoparticles for bioimaging applications[J]. Journal of Molecular Structure, 2017, 1129: 8-16.
[43] 钟宇,李云飞. 酸溶剂对葛根淀粉/壳聚糖复合可食膜性能的影响[J]. 农业工程学报,2012,28(13):263-268.
Zhong Yu, Li Yunfei. Effects of acid solvents on properties of kudzu starch/chitosan composite edible films[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2012, 28(13): 263-268. (in Chinese with English abstract)
Preparation characterization and bacteriostatic properties of punicalagin reducing chitosan/nano silver sol
Xue Haiyan, Zhang Ying, Zhang Baoyan, Xue Lihuan
(,,’710021,)
Chitosan is the only natural cation polysaccharides derived from shrimp and crab shell, which displays some bioactive functions and antibacterial properties with a narrow antimicrobial spectrum. Here, we investigated in situ synthesis of nano-silver particles to enhance the antibacterial properties of chitosan. The chitosan/nano-silver particles (CS/AgNPs) sol was prepared by reducing silver nitrate in situ synthesis within chitosan using punicalagin as a green reducing agent, and then its antibacterial properties and mechanism were investigated. The preparation of CS/AgNPs sol was optimized by single factor experiments. The effects of the preparation conditions pH, temperature and reaction time, with concentration of chitosan, silver nitrate and punicalagin solution were evaluated by characteristic ultraviolet-visible spectrophotometry of nano-silver particles. The existence AgNPs in CS/AgNPs sol was confirmed by UV-visible spectra, Turbiscan Lab, XRD diffraction patterns and TEM images. The optimal conditions to prepare CS/AgNPs sol were found as follows. Every 100 mL of chitosan at pH value 5 in concentration of 0.5% - 1% blended well with 250 mL of silver nitrate in concentration of 0.6 mol/L, and then chelated for 30 min at room temperature. The silver nitrate in this mixture was reduced by adding 800L of punicalagin solution in concentration of 1%, bathing at 25℃ and stirring for 6 h. Consequently, a kind of stable CS/AgNPs sol with high content of AgNPs was produced. Transmission electron microscopy (TEM) images indicated that the AgNPs nanoparticles were between 8 and 11 nm in diameter dispersed uniformly in the sol. The X-ray diffraction (XRD) showed that AgNPs formed in a type of face-centered cubic structure reflected by the enhanced diffraction intensity of Ag. And the Fourier transform infrared spectroscopy (FTIR) showed that -NH2 groups of chitosan chelated with Ag+in the CS/AgNPs. We used methods of disc agar diffusion and liquid medium dilution to study the bacteriostasis. For disc agar diffusion, the experiment was modified that the filters would be replaced by the fabric, so as to improve the diffusion ability of chitosan in agar. The results indicated that the CS/AgNPs sol could inhibit the two typical species of bacteria (and) which caused infection. The inhibition zone of thewas 5.5 mm, slightly higher than the inhibition zone of the, when soaked in the fabric. The inhibitory rate of CS/AgNPs sol on E. coli and S. aureus was 95.5% and 97.6% after a 24 h-incubation respectively. The antibacterial effect of CS/AgNPs sol was tested by the minimum inhibitory concentrations (MIC). The results showed that the MIC for bothandwere 0.096L/mL detected by resazurin test for the CS/AgNPs sol taking punicalagin as the reducing agent, which was moderately better than that taking sodium borohydride as the reducing agent from which the MIC for bothandwere 0.19L/mL by resazurin test. The bacteriostatic mechanism of this kind of composites was explored. The SEM scanning and cell contents leakage experiments of the cultures after a 24 h-incubation showed that the CS/AgNPs sol can adsorb to bacterial cells, disrupted the cell membrane, and increased the cell permeability and then inhibited the cell growth. The CS/AgNPs sol prepared by the green reducing reagent punicalagin showed a good performance on technical parameters and bacteriostatic. This article provides a theoretical basis for the application in the future, which could be used in food preservative or as the medical material.
nanocomposites; sterilization; optimization; chitosan; nanoscale silver; punicalagin; antibacterial properties
2017-10-16
2018-01-26
国家自然科学基金项目(31301405);陕西省科技统筹计划项目(2013KTZB02-02-05(2));陕西省教育厅专项项目(16JK1101)。
薛海燕,女,陕西兴平人,研究方向食品加工与保藏技术。Email:xuehaiyan@sust.edu.cn
10.11975/j.issn.1002-6819.2018.04.038
TB333
A
1002-6819(2018)-04-0306-09
薛海燕,张 颖,张宝艳,薛丽欢. 安石榴苷还原壳聚糖/纳米银溶胶制备表征及其抑菌性能[J]. 农业工程学报,2018,34(4):306-314.doi:10.11975/j.issn.1002-6819.2018.04.038 http://www.tcsae.org
Xue Haiyan, Zhang Ying, Zhang Baoyan, Xue Lihuan. Preparation characterization and bacteriostatic properties of punicalagin reducing chitosan/nano silver sol[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(4): 306-314. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2018.04.038 http://www.tcsae.org
