重组人白细胞介素-2的原核可溶表达
2018-03-08李冠英李海红徐士勋潘晓雨
李冠英, 李海红, 徐士勋, 潘晓雨
(上海华新生物高技术有限公司,上海 201206)
白细胞介素-2(Interleukine-2,IL-2),是由白细胞分泌的一种糖蛋白,可介导细胞间的相互作用,在细胞的活化、增殖和分化中起调节作用[1]。IL-2是机体免疫调节网络中的核心物质,与其他细胞因子有协同和拮抗作用,共同完成机体免疫机能的平衡调节作用[2];IL-2能刺激NK细胞、CTL、LAK细胞的活化和增殖,也能促使T淋巴细胞、NK细胞产生干扰素、肿瘤坏死因子等[3]。所以IL-2作为一种具有广泛生物学活性的细胞因子,在抗病毒、抗细菌感染和抗肿瘤等治疗中被广泛应用[4]。目前,IL-2在临床上已被广泛应用于肿瘤、免疫缺陷和感染性疾病的治疗,并取得了显著的效果,如临床乙肝、肾癌及黑色素瘤的治疗[5-8]。IL-2的广泛临床应用带来的效益,使不少样品生产厂家纷纷进入这一领域[9-10]。为获得重组人白细胞介素-2(recombinant human interleukin-2,rhIL-2),普遍使用的策略是构建重组质粒,在大肠杆菌中表达rhIL-2。
rhIL-2以大肠杆菌作为宿主表达虽然取得了很大成功,但是其表达形式为包涵体,获得具有生物活性的rhIL-2,需要后续变性、复性等复杂的一系列步骤[11];而rhIL-2的变复性效率极低,这就成了工业化生产的一个瓶颈,严重限制了工业化的大规模生产。使用可溶表达策略,直接表达可溶性的rhIL-2成了现阶段的一种诉求。
麦芽糖结合蛋白(maletose-binding protein,MBP),是E.coli中主要负责麦芽糖摄取和分解的蛋白质[12];现有研究表明MBP与外源蛋白融合时,具有强烈的助溶作用,可以显著提高与之融合的外源蛋白的可溶表达[13-14]。
本研究小组利用基因重组技术将rhIL-2融合在MBP的C端,构建pMAL-c2x-rhIL2表达载体;通过 BL21(DE3)宿主菌进行表达最终经过分离纯化及裂解得到可溶性的rhIL-2。
1 材料与方法
1.1 材料
il-2由南京金斯瑞生物科技公司合成;菌种DH5α、BL21(DE3)均由江苏大学谭小力教授惠赠;载体pMAL-c2X购于NEB(New England Biolabs)公司,DNA回收试剂盒、质粒小提试剂盒购于上海捷瑞生物工程有限公司。DNA连接试剂盒、IPTG、DNA marker 均购于大连宝生物工程有限公司等;限制性内切酶、Amylose树脂、Factor Xa蛋白酶购自NEB公司。
1.2 方法
1.2.1 引物合成
根据il-2序列设计特异性引物, 交于上海生工生物合成;序列如下:上游引物rhIL2-F:5′CATATGGCACCTACTTCAAGTTC 3′(下划线部分为NdeI位点);下游引物rhIL2-R: 5′ GGATCCCCCCTGATATGTTTTAA 3′(下划线部分为BamH I位点)。
1.2.2 目的基因的扩增与纯化
反应体系:模板0.2 μL;引物rhIL2-F,rhIL2-R (10 μmol/L)各2.5 μL;ExTaq(5 U/μL) 0.2 μL;dNTP mixture(各2.5 mmol/L)5 μL;10×PCR Buffer 5 μL,加ddH2O至50 μL;扩增反应条件:94℃预变性10 min;94℃变性45 s,56.0℃退火45 s,72℃延伸50 s,共36个循环;72℃终末延伸10 min。PCR产物用1%的琼脂糖电泳,将目的条带进行割胶,用DNA回收试剂盒回收纯化。
1.2.3 克隆载体rhIL2-T的构建与鉴定
PCR回收产物进行TA克隆(步骤按照 pMD19T 载体说明书),并转化DH5α感受态,于含有0.1 mg/mL氨苄青霉素的LB培养基平板上涂布,挑选单菌落,进行PCR鉴定,将阳性克隆送上海生工生物进行测序。
1.2.4 表达载体rhIL2-pMAL-c5x的构建与鉴定
测序正确的rhIL2-T阳性克隆,提取质粒并和表达载体分别进行双酶切,50 μL体系如下:BamH I 1.0 μL、NdeI 1.0 μL,10×Cutsmart Buffer 5 μL,质粒10 μL,加ddH2O至50 μL。双酶切产物PCR产物用1%的琼脂糖电泳,将目的条带进行割胶,用DNA回收试剂盒回收纯化,DNA连接试剂盒16℃过夜连接。连接产物转化感受态BL21(DE3),挑选单菌落,进行PCR鉴定,将阳性克隆送上海生工生物进行测序。
1.2.5 重组子的诱导表达及定位分析
将测序正确的转化子,于液体LB中过夜活化,1∶100(V/V)接种于50 mL 2×YT液体培养基中(含0.1 mg/mL氨苄青霉素),37℃摇床培养至OD600=0.5~0.8;加入诱导剂IPTG,使其终浓度为1 mmol/L;分别于不同条件下培养(A: 37℃摇床培养4 h; B: 25℃摇床培养6 h);离心收集菌体,弃上清,菌体用ddH2O洗涤2次,-20℃保存备用。
将诱导后收集的菌体,悬浮于20 mL 平衡Buffer(0.1mol/L NaCl,2 mmol/L CaCl2,20 mmol/L Tris-HCl,pH 8.0)中;样品置于冰上,超声破碎仪中破碎,条件为工作5 s,停止10 s,共30 min;镜检90% 以上细胞破碎;破碎后样品,取50 μL留样作为总蛋白SDS-PAGE检测;剩余样品12 000 r/min,30 min;取出上清,作为可溶蛋白, SDS-PAGE检测;沉淀悬浮于20 mL(等体积) 20 mmol/L PB(pH 7.0)中,作为不可溶蛋白, SDS-PAGE检测。
1.2.6 融合蛋白的纯化及裂解
将2 mL Amylose树脂装于重力流柱管中,5体积ddH2O洗涤,5体积平衡Buffer平衡柱,将细胞破碎后的上清上柱,5体积平衡Buffer洗柱,用15 mL含50 mmol/L麦芽糖的平衡Buffer洗脱并收集洗脱液(每1 mL收集1管,连续收集) ;洗涤柱并保存于20%的乙醇。
将纯化后的MBP-rhIL2,按1∶50(W/W)加入Factor Xa蛋白酶,23℃孵育6 h进行裂解,SDS-PAGE检测。
1.2.7 生物学活性分析
IL-2依赖性细胞株CTLL-2在不同的IL-2浓度下,表现出生长、死亡等不同的生长状态,另外活细胞可将MTT摄入,并在线粒体中琥珀酸脱氢酶的作用下,将黄色的MTT分解成一种蓝紫色结晶——甲瓒,甲瓒溶解后在570 nm处有最大光吸收。在一定的浓度范围内,IL-2的浓度与吸光值呈线性关系,根据在不同IL-2的浓度下,其细胞依赖株CTLL-2细胞存活率不同,以此检测IL-2的生物学活性。根据2015版《中国药典》第三部,“重组人白介素-2生物学活性测定法”一节,测定rhIL-2生物学活性。
实验过程:CTLL-2细胞用完全培养液(1 mL成分:胎牛血清0.1 mL,RPMI1640培养液0.9 mL,400 U IL2)于37℃,5% CO2条件下培养至足够量,离心收集CTLL-2细胞,用RPMI1640培养液洗涤3次,然后重悬于基础培养液中配制成每l mL含6.0×105个细胞的细胞悬液,37℃,5% CO2条件下备用。在加有标准品溶液和供试品溶液的96孔细胞培养板中,每孔加入细胞悬液50 μL,于37℃、5% CO2条件下培养18~24 h;然后每孔20 μL加入MTT溶液,于37℃,5% CO2条件下培养4~6 h;每孔加人裂解液15 μL,于37℃,5% CO2条件下保温18~24 h。以上操作均在无菌条件下进行。混匀细胞板中的液体,放入酶标仪,以630 nm为参比波长,在波长570 nm处测定吸光度,记录测定结果。试验数据采用计算机程序或四参数回归计算法进行处理,并按下式计算结果:
待测品生物学活性(IU/mL)=Pr×(Ds×Es)/(Dr×Er)
式中:Pr为标准品生物学活性,IU/mL;Ds为供试品预稀释倍数;Dr为标准品预稀释倍数;Es为供试品相当于标准品半效量的稀释倍数;Er为标准品半效量的稀释倍数。
2 结果与分析
2.1 密码子优化与载体构建
2.1.1 密码子优化
il-2序列是基于GenBank(LOCUS:NM_000586),去掉信号肽序列,在保证氨基酸序列不变的情况下,考虑mRNA二级结构自由能及稳定性、影响表达的基序等,替换并使用E.coli中偏爱密码子优化基因序列(图1)然后进行全基因合成。

图1 rhIL-2基因序列优化前后对比
2.1.2 目的基因的扩增
以含优化后il-2的质粒为模板,rhIL2-F和rhIL2-R 为引物,进行 PCR扩增。结果如图2,在450 bp 左右有一条带,大小与预计相符。
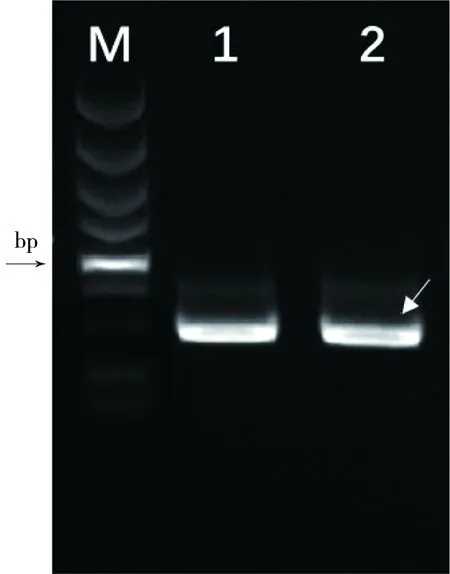
图2 rhIL-2 基因 PCR扩增
M: DL5000 DNA Marker;1,2:rhIL-2 基因
2.1.3 克隆载体rhIL2-T的构建与鉴定
以rhIL2-F和rhIL2-R 为引物,挑取平板上单菌落为模板,进行PCR鉴定,产物经1% 琼脂糖电泳,可见在450 bp处有明显条带,表明il-2已成功连接到 T 载体(图3) 。
2.1.4 表达载体rhIL2-pMAL-c5X的构建与鉴定
以rhIL2-F和rhIL2-R 为引物,挑取平板上单菌落为模板,以rhIL2-T质粒为阳性对照,以不加任何模板为阴性对照,进行PCR鉴定,产物经1%琼脂糖电泳,可见在450 bp处有明显条带,阴性对照无任何条带,表明il-2已成功连接到pMAL-c5X载体(图4)。
2.2 MBP-rhIL2诱导表达及定位分析
rhIL2-pMAL-c5X BL21(DE3)转化子分别在37℃、4 h和25℃、6 h条件下添加1 mmol/L IPTG诱导,菌体超声破碎后进行SDS-PAGE检测。结果(图5)显示,37℃诱导后,有20%的MBP-rhIL2表达且为可溶,在56 ku处与预期大小一致。而在25℃条件下诱导,仅有少量目的蛋白表达。可见,37℃是MBP-rhIL2的较佳表达温度。

图3 rhIL2-T转化子Pcr鉴定
M: DL5000 DNA Marker;-:阴性对照;1~4:rhIL2-T转化子鉴定

图4 rhIL2-pMAL-c5X转化子PCR鉴定
M: DL5000 DNA Marker;+:阳性对照;-:阴性对照;1~5:rhIL2-pMAL-c5X转化子鉴定

图5 MBP-rhIL2诱导表达及定位分析
M:蛋白marker;CK:未诱导对照;T:诱导后总蛋白;S:诱导后可溶蛋白;I:诱导后不溶蛋白。图中箭头所指处为MBP-rhIL2融合蛋白
2.3 MBP-rhIL2的纯化及裂解
将诱导后的可溶蛋白,缓慢流过Amylose树脂柱,通过MBP与树脂结合,分离MBP-rhIL2。结果如图6所示,Amylose树脂能有效地纯化MBP-rhIL2。
将纯化后的蛋白混合,利用Factor Xa蛋白酶将MBP-rhIL2经过23℃,6 h孵育后, rhIL2完全被释放,如图7所示。

图6 MBP-rhIL2纯化后SDS-PAGE分析

图7 MBP-rhIL2 裂解分析
2.4 rhIL2生物学活性分析
采用IL-2依赖型细胞株CTLL-2,以标准品IL-2为对照,对裂解后的rhIL-2进行了生物学活性测定。结果显示,重组rhIL-2和标准品IL-2一样,可以有效刺激CTLL-2细胞的增殖(图8),说明本研究表达并纯化到的rhIL-2具有生物学活性。另外根据分子量可知rhIL-2占融合蛋白的27%,经计算裂解后的rhIL-2比活性为4.4×106IU/mg。
3 结论
本研究构建了表达载体rhIL2-pMAL-c5x,并转入大肠杆菌BL21(DE3)中,在37℃,1mol/L IPTG条件下经诱导后,融合蛋白有20%的表达量,且为可溶性表达;通过Amylose树脂,融合蛋白能够很便利地被纯化出来;进一步利用Factor Xa蛋白酶进行裂解融合蛋白, rhIL-2能够成功释放,并具有4.4×106IU/mg的比活性。本研究为rhIL-2在大肠杆菌中的可溶性表达及工业放大生产提供了依据。

图8 rhIL2生物学活性测定
[1]HINO M, KAWANAMI T, XU J, et al. High-level expression and purification of biologically active human IL-2 using silkworm-baculovirus expression vector system[J]. Journal of Asia-Pacific Entomology, 2016, 19:313-317.
[2]JACQUES Y, MORTIER E. Interleukin 2 revival: a revisited model and new therapeutic applications[J]. Med Sci (Paris), 2016, 32(6):612-618.
[3]郑建华. 白介素-2研究进展[J]. 海峡药学, 2006, 18(4):1-3.
[4]LEVASHOV P A, OVCHINNIKOVA E D, MOROZOVA O A, et al. Human interleukin-2 and hen egg white lysozyme: screening for bacteriolytic activity against various bacterial cells[J]. Acta Naturae, 2016, 8(1):98-102.
[5]MEHTA K, APPLEMAN L, WANG H, et al. Annual hospital volume of high dose interleukin-2 and in patient mortality in melanoma and renal cell carcinoma patients.[J]. Plos One, 2016, 11(1):e0147153.
[6]高 晋. 重组人白介素-2的纯化工艺研究[D]. 长春:吉林大学,2012.
[7]LISSONI P. Therapy implications of the role of interleukin-2 in cancer[J]. Expert Rev Clin Immunol, 2017, 13(5):491.
[8]MIRJACIC M K, BABOVIC N L, DZODIC R R, et al. Beneficial in-vitro effects of interleukin-2, interleukin-12, and their combination on functional and receptor characteristics of natural killer cells in metastatic melanoma patients with normal serum lactate dehydrogenase levels[J]. Melanoma Res, 2016, 26(6):551-564.
[9]常瑞雪,颜天华,王秋娟,等. 白细胞介素-2及其相关药物的应用研究进展[J]. 药学进展, 2011, 35:1-7.
[10]ASANO T, MATSUOKA K I, IYAMA S, et al. Phase I/IIa study of low dose subcutaneous interleukin-2 (IL-2) for treatment of refractory chronic graft versus host disease[J]. Acta Med Okayama, 2016, 70(5):429-433.
[11]ESFANDIAR S, HASHEMI-NAJAFABADI S, SHOJAOSADATI S A, et al. Purification and refolding ofEscherichiacoli-expressed recombinant human interleukin-2[J]. Biotechnol Appl Biochem, 2010, 55(4):209-214.
[12]王 婉. 大肠杆菌麦芽糖结合蛋白调节肿瘤相关巨噬细胞由M2型向M1型极化作用机制研究[D]. 长春:吉林大学, 2015.
[13]NGUYEN M T, KRUPA M, KOO B K, et al. Prokaryotic soluble overexpression and purification of human VEGF165 by fusion to a maltose binding protein tag[J]. Plos One, 2016, 11(5):e0156296.
[14]REUTEN R, NIKODEMUS D, OLIVEIRA M B, et al. Maltose-binding protein (MBP), a secretion-enhancing tag for mammalian protein expression systems[J]. PLoS One, 2016, 11(3):e152386.
