水稻脆性突变体w7bc5的生物学特性研究
2018-03-08陆荷微刘斌美陶亮之叶亚峰吴振宇吴跃进
陆荷微, 刘斌美, 陶亮之, 叶亚峰, 吴振宇, 范 爽, 吴跃进, 王 钰
(1. 安徽大学 资源与环境工程学院, 合肥 230601; 2. 中国科学院合肥物质科学研究院 技术生物与农业工程研究所, 合肥 230031)
水稻脆性突变体是一种经典的形态学突变,植株的茎秆和叶片等组织脆性增加,是水稻突变类型中常见的一种[1]。机械强度作为茎秆的重要特性之一,直接关系植株后期的抗倒伏情况[2]。脆性突变一方面会导致茎秆强度的减弱,进而降低其支撑力,倒伏风险增大,所以一般认为脆性突变对水稻的田间管理和收获生产是不利的;但是另一方面纤维素含量降低,木质素含量升高,营养成分改变,对反刍动物反而口感好、易消化,所以将水稻脆性突变体发展成一种稻饲兼用型水稻,在提高秸秆资源的利用率等方面具有很大的应用前景[3-5]。
物理诱变是获得水稻脆性突变的一个重要途径,吴跃进等利用低能离子束和重离子等物理平台创建一系列水稻脆性突变体,丰富了脆性突变体遗传资源[6-7]。刘斌美等利用离子束诱变技术,在籼稻9311中分离1个茎、叶均表现脆性的bc9311-1突变体,通过细胞壁组分检测和组织解剖的扫描电镜观察研究了bc933-1的生物学特性[8]。叶亚峰等在氮离子束诱变的突变体中发现一脆秆矮生突变体dfr并完成控制该脆性性状基因的定位研究[9]。从目前的研究来看,水稻脆性性状的发生和细胞壁主要成分的改变关系密切,纤维素含量降低,木质素含量升高以及其他多种组分变化的结合作用影响了细胞壁的生物合成,进而改变植株的支撑情况。因此,在选育水稻品种时利用物理技术创建和发掘新的脆性突变材料对研究细胞壁形成机理以及茎秆机械支撑力与细胞壁主要成分含量的关系有着重要的价值。
本研究围绕通过重离子辐照粳稻品种wyj7获得的水稻脆性突变体w7bc5的农艺与经济特征,细胞壁主要成分,抗折力和茎秆中可溶性糖含量等展开,进而为揭示该突变体的脆性机制及深入研究和应用奠定一定的基础。
1 材料与方法
1.1 材料
水稻材料:2015年,利用重离子辐照诱变粳稻品种wyj7获得一水稻脆性突变体,暂命名为w7bc5,其茎秆和叶片手折脆弱易断。
材料种植:实验水稻材料正季(5月—11月)均种植于合肥物质科学研究院水稻育种实验基地(117°18′E,31°52′N)。水稻南繁(当年12月至翌年4月)材料均种植于海南省三亚市实验基地(109°49′E,18°34′N)。
1.2 方法
1.2.1 农艺性状分析
在田间随机取15株(取样时注意避取边行株)成熟期供试水稻材料,考察其主要农艺特征和经济性状,包括:全生育期、株高、穗长、分蘖数、每穗粒数、千粒重及结实率等。
1.2.2 细胞壁组分含量的分析
根据Van Soest等[10]方法测定细胞壁组分含量。取抽穗期的水稻材料,将茎秆和叶片分开,剪成合适的长度放入65℃烘箱中,待完全烘干后取出,用旋风磨分别将茎秆和叶片粉碎,粉末装入干净的封口袋中以备后续实验所用。
1.2.3 茎秆抗折力的测定和倒伏指数的计算
茎秆抗折力(resistance snapping, RS)的测定参考杨惠杰[11]的方法。田间取回抽穗后35 d的水稻,将完整水稻茎秆放入水槽中保持其不失水,注意保留茎秆外部叶鞘及叶片。将待测水稻茎秆第二节间置于两块约7 cm左右的宽板中间,保持茎秆的水平状态,将数显示推拉力计挂于茎秆中间部位,垂直向下轻轻拉动测力仪,由于该仪器可记载推拉过程中的最大数值,所以当茎秆折断弯曲45°以上时,测力仪上的数值就是茎秆基部第二节间对应的抗折力(N)。从田间取回的水稻样品放置实验室内极易失水皱缩,因此尽量保证所有试验材料在当天测定完毕。
倒伏指数(lodging index, LI)={[第2节间基部至穗顶长度(cm)×第2节间基部至穗顶鲜重(g)] / 抗折力}×100。倒伏指数越大,表示植株越容易倒伏,倒伏指数临界值为200[12]。
1.2.4 不同生长时期水稻茎秆中可溶性糖含量的测定
水稻不同时期茎秆中可溶性糖含量的测定参照蒽酮比色法[13]。
1.3 分析方法
采用SAS 8.0对本文试验数据进行差异显著性分析。
2 结果与分析
2.1 w7bc5突变体的表型特征
突变体w7bc5在整个生长过程中都表现脆性,茎秆相较于野生型明显变脆(图1),在田间易于用手折方式辨别其脆性性状。两者在其他表型特征上几乎一致。

图1突变体w7bc5和野生型wyj7植株茎秆抗折情况

性状突变体w7bc5野生型wyj7Characteristicsmutantw7bc5wildtypewyj7生育期growthperiod124125株高plantheight(cm)947±169515±105穗长paniclelength(cm)1539±0721548±093分蘖数tillernumberperplant105±04110±027每穗粒数numberofgrainperpanicle10894±56712045±325∗千粒重thousandseedweight(g)2334±02628095±0125∗结实率seedfertility(%)92±0689683±19∗
注:*表示显著差异(P<0.05);下同
2.2 w7bc5突变体农艺性状分析
如表1所示:突变体w7bc5和野生型wyj7的全生育期和株高相近,每穗粒数有所减少,千粒重和结实率也有下降,其他性状差异不明显,可以看出突变体w7bc5的农艺经济特征较好。
2.3 细胞壁组分含量的分析
分别测定w7bc5突变体和wyj7野生型茎秆、叶片的细胞壁各主要组分含量。结果(图2)显示野生型wyj7茎秆中纤维素的含量为31.34%,而脆性突变体w7bc5的是22.97%,减少了26.7%;野生型wyj7茎秆中半纤维素含量为18.9%,突变体w7bc5的是27.48%,显然w7bc5半纤维素含量显著提高;而两者木质素含量相当,差异不明显。木质纤维素含量的变化导致突变体w7bc5和wyj7细胞壁结构的变化,从而导致外部的脆性特征,这也与相关的研究[14]结果是一致的。

图2 野生型wyj7和突变体w7bc5茎秆细胞壁组成成分含量分析
由图3不难发现,w7bc5与wyj7水稻叶片中木质纤维素含量的变化趋势与茎秆中的是一致的,纤维素含量显著降低,半纤维素含量升高,而木质素和无机盐含量未表现明显差异。由此也可以看出,在对细胞壁结构的影响中,纤维素和半纤维素含量的变化较为明显。

图3 野生型wyj7和突变体w7bc5叶片细胞壁组成成分含量分析
Fig 3 Difference of leaf cell wall components between wild typewyj7 and mutantw7bc5
2.4 抽穗后水稻脆茎突变体w7bc5的物理特性
茎秆的机械强度是水稻重要的物理特性之一,机械强度的改变导致茎秆出现脆嫩易折的特性,影响植株支撑力。我们取了抽穗后35 d左右的两种水稻材料,分别进行了茎秆抗折力的测定以及倒伏指数的计算(表2)。从w7bc5与野生型wyj7茎秆基部第二节间抗折力的测定结果来看,w7bc5比wyj7降低了约29.8%,这与田间观察两者茎秆手折即断的程度相符,突变体所需的折断力明显减小。以倒伏指数为指标综合评价脆性突变体w7bc5与野生型水稻后期可能存在的倒伏风险,突变体w7bc5与野生型水稻的倒伏指数都不是很大,且都小于倒伏指数的临界值200[12],该结果也与田间的实际观察情况保持一致。因此,突变体w7bc5具有良好的抗倒伏特性,便于田间收获和管理。
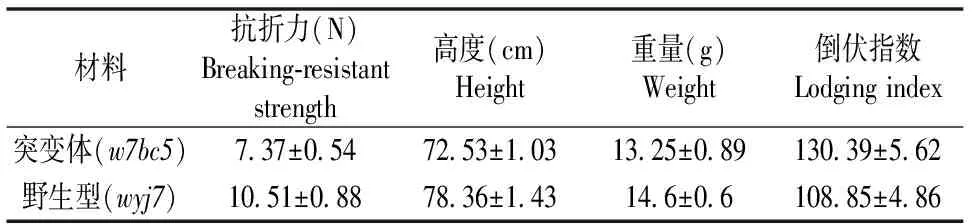
表2 突变体w7bc5与野生型wyj7的物理特性
2.5 水稻不同生育期茎秆的可溶性糖含量
由表3可以看出,突变体w7bc5与野生型wyj7茎秆中可溶性糖含量在拔节期与抽穗期的差异并不显著,而后两者的差距由抽穗期的12.8 mg/g扩大到成熟期的62.9 mg/g,成熟期突变体茎秆中可溶性糖含量显著低于野生型,可见突变体在抽穗之后茎秆中的可溶性糖可能更多地转运去籽粒或其他组织中,导致在此过程中茎秆充实度下降,抗折力减小,最终引起脆性性状的表达。

表3 突变体w7bc5与野生型wyj7不同时期可溶性糖含量
注:通过Duncan检验,同列不同小写字母表示两个材料之间的差异显著(P<0.05)
3 讨论
水稻脆性性状的发生涉及多个复杂的生理生化过程,目前对其机理的研究已经有了新的进展,但是具体的脆性发生机制还不是很清晰。本文研究的重离子辐照粳稻wyj7获得的一个脆性突变体w7bc5,与野生型相比,该突变体的发育生长未受到较大的影响,产量相关经济性状较为优良。目前在水稻脆性突变已有的报道中,茎秆和叶片等其他组织脆嫩易折的性状大部分与木质纤维素的合成有关,细胞壁主要成分含量的改变导致其结构的变化[15]。纤维素是细胞壁的主要成分,是细胞骨架的基础,它起到控制细胞大小和维持细胞形态的重要作用,在遭遇外界压力的时候给予植株机械支撑力[16]。w7bc5突变体叶片和茎秆的纤维素含量比野生型wyj7的都要低,半纤维素含量有所升高,且差异显著,木质素、无机盐含量并没有明显差异,从中可以看出木质纤维素含量的改变导致植株脆性性状的发生。从不同时期水稻茎秆中可溶性糖含量来看,脆性突变体w7bc5可溶性糖含量从拔节期后一直小于野生型品种,成熟期差异达到最大。研究表明,可溶性糖含量的降低可能改变了茎秆的充实度,从而影响了茎秆的抗折性,中空的结构或不充实的组织更容易引起脆性的表现[17]。但是鉴于水稻脆性性状的发生原因涉及多种茎秆生化成分的变化,所以还要进一步从茎秆形态结构、不同生育期茎秆硅、钾、钙、镁含量以及后期茎秆含水等方面进行深入研究[18]。
通过重离子诱变获得一系列的水稻脆性突变体,这些突变体为研究水稻细胞壁的生物合成提供宝贵的材料[19]。创建和发掘新的脆性突变体对于阐明水稻茎秆支撑力改变的发生过程同样具有重大意义[20-22]。水稻秸秆数量多,体积大,自然状态下降解速率缓慢,秋收季节秸秆焚烧随处可见,造成严重环境污染和资源浪费。通过重离子辐照诱变的脆性突变体茎秆和叶片变脆,收获时易破碎降解,减少机器耗能和损伤,更有利于水稻秸秆的自然还田。同时还可以将脆性材料直接作为家畜饲料,其较低的纤维素含量对反刍动物更易消化。木质纤维素的含量与茎秆的抗折力大小密不可分,直接影响植株的脆性特征,由于纤维素等主要成分含量的改变,植株茎秆、叶片等变脆,通过手折等方法容易在田间鉴别,因此在遗传育种实践中发现脆茎突变的概率远远高于发现茎秆坚硬的突变材料,所以注意田间选择应该可以发现更多类型的细胞壁合成突变材料。同时通过选择适当变化的突变材料,为适合秸秆还田、新株型、生物质能源、稻饲兼用等作物育种提供目标性状,从而进一步发掘新种质的应用价值。
[1]张水金,郑 轶,朱永生,等.水稻脆性突变体研究进展[J].福建农业学报,2011,26 (5):895-898.
[2]WANG H F, WU Y M, LIU J X, et al. Morphological fractions, chemical compositions and in vitro gas production of rice straw from wild and brittle culm J variety harvested at different growth stages[J].Animal Feed Science and Technology, 2006, 129(1-2):159-171.
[3]吴 超,朱 丽,林 凤,等.水稻脆茎突变体的研究进展[J].安徽农业科学,2007,35 (17):5085-5086.
[4]李文丽,吴先军.一个水稻脆秆突变体的遗传分析与基因定位[J].核农学报,2006,20 (6):500-502.
[5]彭良才.中国生物能源发展的根本出路[J].华中农业大学学报(社会科学版),2011(2):1-6.
[6]刘斌美,吴跃进,童继平,等.水稻显性半矮秆基因的SCAR标记及初步定位[J].作物学报,2006,32 (3):449-454.
[7]许 学,刘斌美,宋 美,等.氮离子束与γ 射线辐照日本晴和“9311”水稻突变体的筛选[J].核农学报,2008,22 (4):389-393.
[8]刘斌美,叶亚峰,章忠贵,等.一个籼稻脆性突变体的生物学特性及基因定位研究[J].植物遗传资源学报,2011,12(5):259-264.
[9]叶亚峰,刘斌美,许 学,等.水稻脆秆矮生突变体鉴定及基因定位研究[J].核农学报,2012,26(1): 1-5.
[10]VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10):3583-3597.
[11]杨惠杰,杨仁崔,李义珍,等.水稻茎秆性状与抗倒伏能力的关系[J].福建农业学报,2000,15 (2):1-7.
[12]OOKAWA T, ISHIHARA K. Varietal difference of physical characteristic of the culm related to lodging resistance in paddy rice[J]. Japan Journal Crop Science,1992, 61(3):419-425.
[13]张志良,翟伟菁,李小方.植物生理学实验指导[M].北京:高等教育出版社,2005,127-128.
[14]冯永清,邹维华,李丰成,等.特异水稻脆茎突变体生物学特性及生物质降解效率的研究[J].中国农业科技导报,2013,15 (3):77-83.
[15]ZHONG R, YE Z H. The Arabidopsis NAC transcription factor NST2 functions together with SND1 and NST1 to regulate secondary wall biosynthesis in fibers of inflorescence stems[J]. Plant Signal Behav, 2015, 10(2):e989746.
[16]ZHONG R, YE Z H. Secondary cell walls: biosynthesis, patterned deposition and transcriptional regulation[J]. Plant & Cell Physiology, 2015, 56(2):195 214.
[17]ZHAO Y, SU J, XU P, et al. Intron-mediated alternative splicing of wood-associated NAC transcription factor1B regulates cell wall thickening during fiber development inPopulusspecies[J]. Plant Physiology, 2014, 164(2):765-776.
[18]YOSHIDA K, SAKAMOTO S, KAWEI T, et al. Engineering theOryzasativacell wall with rice NAC transcription factors regulating secondary wall formation[J]. Frontiers in Plant Science, 2013, 4:383.
[19]ZHANG B, ZHOU Y. Rice brittleness mutants: a way to open the black box′ of monocot cell wall biosynthesis[J]. Journal of Integrative Plant Biology, 2011, 53 (2):136-142.
[20]HIRANO K, KOTAKE T, KAMIHARA K, et al. Rice brittle culm3(BC3) encodes a classical dynamin OsDRP2B essential for proper secondary cell wall synthesis[J]. Planta, 2010, 232 (1):95-108.
[21]全东兴,韩龙植,南钟浩,等.特种稻种质资源研究进展与展望[J].植物遗传资源学报,2004,5 (3):227-232.
[22]汪海峰,朱军莉,刘建新,等.饲喂脆茎全株水稻对生长肥育性能、养分消化和胴体品质的影响[J].畜牧兽医学报,2005, 36 (11):1139-1144.
