迪沟采煤沉陷湖泊浮游植物群落结构特征
2018-03-08周忠泽汪晨琛吴奇丽
万 阳, 周忠泽, 汪晨琛, 林 志, 吴奇丽
(安徽大学 资源与环境工程学院, 合肥 230000)
浮游植物是水生生态系统重要的初级生产者,能对水体生态环境的变化做出最直接的响应。因此,浮游植物群落物种多样性及其数量动态作为水体生态环境监测指表之一,广泛用于生物监测、水质污染评价和营养水平检测[1-3]。同时,水体内的环境因子也可以影响浮游植物群落结构的变化[4-5],Tornes等研究发现水文、温度、透明度以及水库富营养物滞留会影响浮游植物的时空分布格局[6]。其中,氮磷是水体内浮游植物群落生长常见的限制性元素[7]。另外,叶绿素a浓度是反映水体水质的重要生物学指标[8],其浓度与浮游植物群落结构有着密切的关系。同时,根据对浮游植物现存量与环境因子的相关研究,浮游植物现存量一般通过细胞密度和生物量直接表征[9],浮游植物细胞密度反映水体中藻细胞数量的多少[10],光照、温度、营养盐环境因子对其产生影响[11-12]。另外,Wang等研究了浮游植物生物量和相关环境因子的关系,结果显示在季节变化中,水温和总磷为主要控制因素[13]。
迪沟采煤沉陷湖泊,是采煤活动导致的地面持续沉陷而形成的特殊水体。塌陷湖泊周围河流输入为塌陷湖泊带来了丰富的营养元素,支撑了浮游植物的初级生产[14]。不同营养状态沉陷湖泊内浮游生物群落结构组成、季节动态及演替过程具有显著的区别[15-17]。测定叶绿素 a、生物量和藻密度等生物指标,是水华预警防治监测过程中最为直接有效的方法之一[8]。本文选取迪沟采煤沉陷湖泊展开研究,在对研究区水生态环境进行监测的基础上,重点分析浮游植物群落结构特征,探索其时空变化规律,找出影响浮游植物的主要环境因子。从生态学角度来为采煤沉陷湿地这一特殊水体的水华风险预测、资源合理利用、生物多样性保护及生态恢复提供必要的科学依据。
1 材料和方法
1.1 研究区域概况
迪沟采煤沉陷湖泊位于安徽省淮河冲积平原,属于大陆性暖温带半湿润季风气候,年平均气温为15.3℃,年平均降雨量为937.2 mm,矿区沉陷湖泊东西长近8.8 km,南北宽1.5~2.5 km,面积约12.1 km2。迪沟采煤沉陷湖泊为小型复合湖泊,由煤矿开采沉陷积水形成,沉陷时间8~15年,平均水深4.4 m,南侧有自西向东的济河与其连通。
1.2 采样点与采样时间设置
参照《淡水浮游生物研究方法》[18]进行采样点设置,根据沉陷水域面积大小,在沉陷湖泊中心周围共设置12个采样点(图1)。于2015年8月至2016年6月分别对迪沟采煤沉陷湖泊进行了每2个月1次的采样,共采样6次。
1.3 样品采集与分析
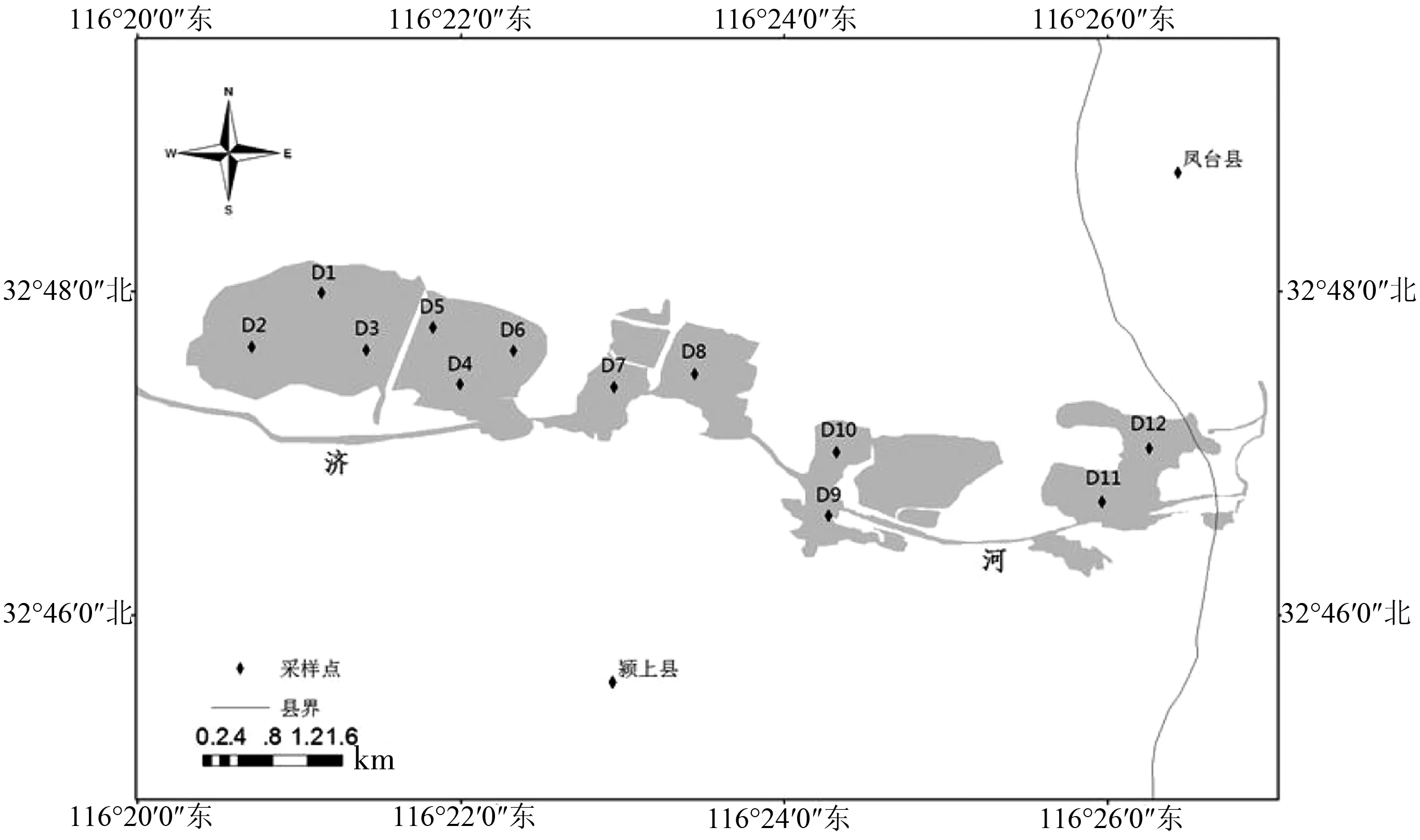
图1 迪沟采煤沉陷湖泊采样点位置
1.4 数据分析
通过Mcnaughton优势度指数(Y),以Y≥0.02为界限,计算优势种。计算各时期浮游植物的Shannon-Wiener多样性指数(H′)、Margalef丰富度指数(D)、Pielou均匀度指数(J)。基于水质计算水体的综合营养状态指数(TLI)[20]。计算公式如下:
(1)
TLI=1/4(TLc+TLs+TLp+TLn)
(2)
TLc=2.22+2.54log(Chl a)
(3)
TLs=5.10+2.27log(1/SD-1/40)
(4)
TLp=0.218+2.92log(TP)
(5)
TLn=-3.61+3.01log(TN)
(6)
式(1)中,ni为第i种的总个体数,fi为该种在各样品中出现的频率,Pi为ni/N,N为全部样品中的总个体数,S为浮游植物种类数;式(2)中,TLc、TLs、TLp、TLn为等效营养状态值;式(3)中,Chl a为叶绿素a浓度;式(4)中,SD为透明度;式(5)中,TP为总磷;式(6)中,TN为总氮。
使用Excel 2010进行基本计算和图表绘制,使用Canoco 4.5软件对浮游植物优势种生物量与环境因子数据进行冗余分析(RDA)。此外,采用 SPSS19.0软件对不同湖泊位点及不同时期内水质指标及浮游植物密度等数据进行方差分析,比较其差异的显著性。
2 结果与分析
2.1 浮游植物种类组成和优势种
调查期间,共鉴定出浮游植物8门10纲17目32科62属155种,其中绿藻门(Chlorophyta)59种,占浮游植物种类总数的38.06%;硅藻门(Bacillariophyta)47种,占30.32%;蓝藻门(Cyanophyta)18种,占11.61%;裸藻门(Euglenophyta)17种,占10.97%;隐藻门(Cryptophyta)4种,占2.58%;甲藻门(Dinophyta)4种,占2.58%;黄藻门(Xanthophya)3种,占1.93%;金藻门(Chrysophyta)2种,占1.29%(图2)。2015年10月的浮游植物种类总数最多,达到85种,其中绿藻门种类较多,占种类总数的36.47%;2016年2月浮游植物种类数相对较少,为45种,其中绿藻门和硅藻门种类数量相同,均占种类总数的35.56%。迪沟沉陷湖泊各时期各门藻类种数及百分比结果显示:绿藻门、硅藻门和蓝藻门种类数在整个调查期间占优势,其种类总和占各时期藻类种类总数比例超过75%。
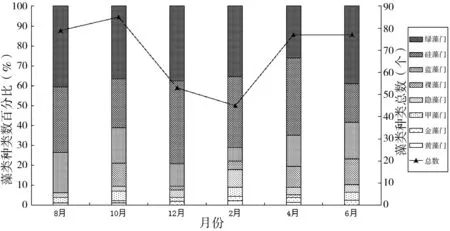
图2 迪沟采煤沉陷湖泊浮游植物群落结构组成
调查期间主要优势种为小席藻(Phormidiumtenu)、两栖颤藻(Oscillatoriaamphibia)、小球藻(Chlorellavulgaris)、肘状针杆藻(Synedraulna)、尖尾蓝隐藻(Chroomonasacuta)、密集锥囊藻(Dinobryonsertularia)和噬蚀隐藻(Cryptomonaserosa)等(表1)。蓝藻门始终为第一优势类群,绿藻门只在2015年的8月和12月为优势类群。硅藻门在各时期作为次优势类群出现。隐藻门在2016年2月成为优势类群。金藻门仅在2016年的2月和4月作为次优势类群出现。
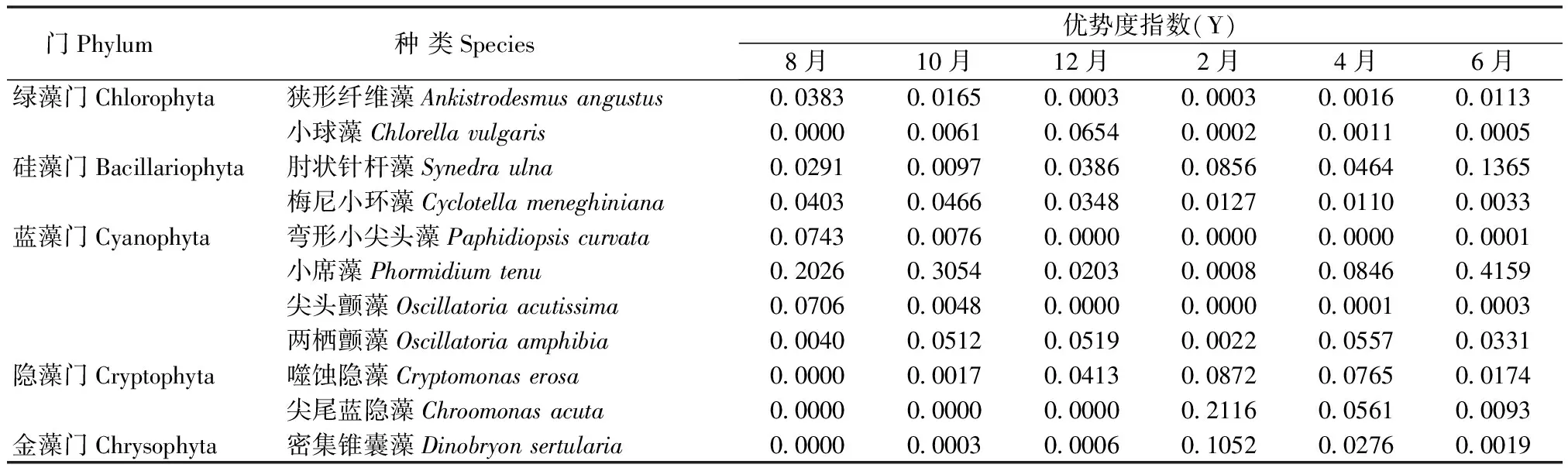
表1 迪沟采煤沉陷湖泊浮游植物优势度
2.2 浮游植物细胞密度和生物量的时空变化
2015年8月至2016年6月,蓝藻的细胞密度和生物量在大部分调查时期都占优势。浮游植物细胞密度时间变化显著(F= 15.48,P< 0.05),其总体变化趋势为先降后升(图3)。藻类生物量在时间上呈现显著变化(F= 11.00,P< 0.05),其总体变化趋势与细胞密度变化趋势相似(图5)。迪沟采煤沉陷湖泊浮游植物细胞密度年平均值为151.36×105cells/L,范围为22.68×105~290.24×105cells/L。藻类平均细胞密度最大值290.24×105cells/L出现在2015年10月,蓝藻占藻类细胞总数的92.76%。浮游植物细胞密度最小平均值22.68×105cells/L出现在2016年2月,隐藻在数量上占据优势,占藻类细胞总数的33.46%。在空间分布上,浮游植物细胞密度最高值出现在2015年10月的D1位点,蓝藻门占该位点藻类细胞总数的93.76%(图4)。
迪沟沉陷湖泊浮游植物生物量范围为2.37~7.41 mg/L,年平均值为5.00 mg/L(图5)。全年藻类生物量最大值7.41 mg/L出现在2015年10月,其中蓝藻占藻类生物量的56.79%。浮游植物生物量平均值最小为2.37 mg/L,出现在2016年2月,硅藻在生物量上占据优势,占藻类生物量的42.80%。在空间变化上,浮游植物生物量峰值为13.07 mg/L,出现在2016年6月的D1号位点,该位点中硅藻门生物量比例高达57.13%(图6)。
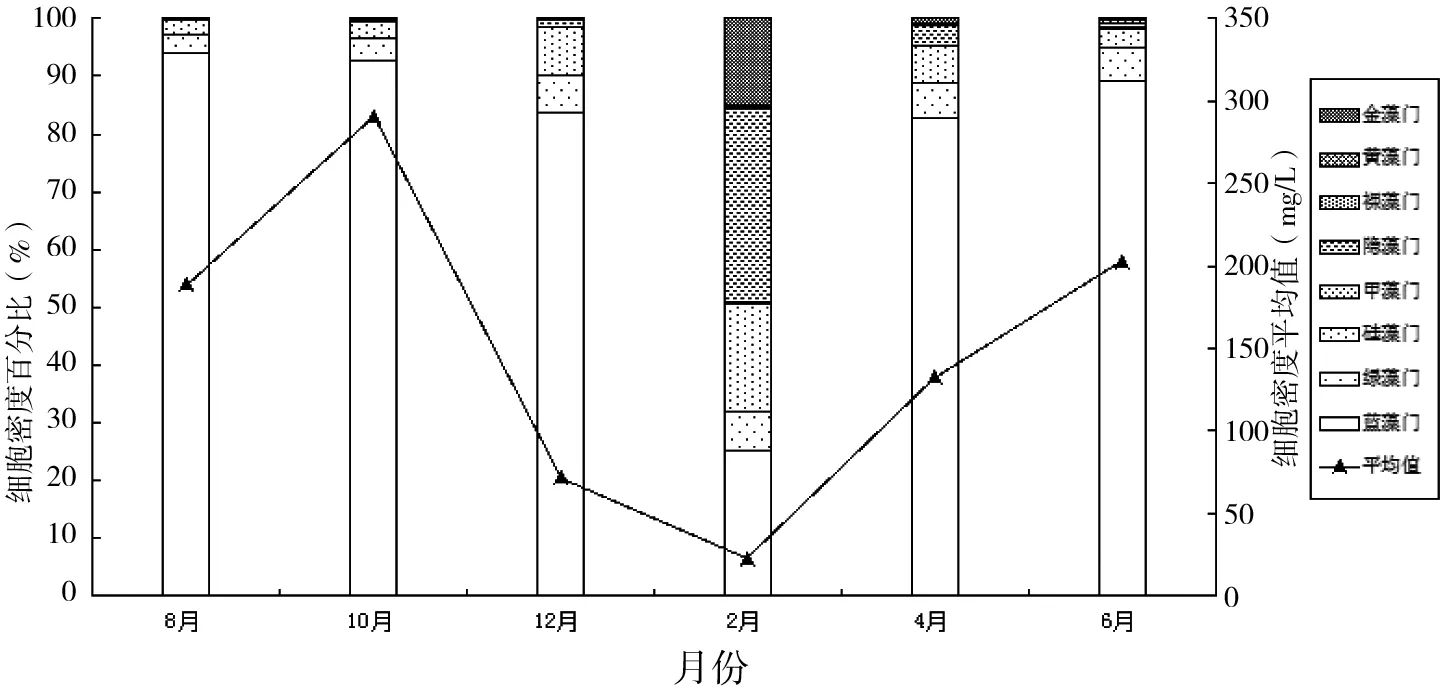
图3 迪沟采煤沉陷湖泊浮游植物细胞密度时间变化
2.3 浮游植物的生物多样性
迪沟采煤沉陷湖泊浮游植物Shannon-Wiener多样性指数(H′)其平均值的变化范围是1.09~3.68(表2),其空间差异显著(F= 2.71,P< 0.05),D7、D8、D9和D10位点在大多数时期具有较高的Shannon-Wiener多样性指数。Margalef丰富度指数(D)平均值的变化范围是0.39~2.10,其数值在空间上的无显著差别(F=0.47,P>0.05)。Pielou均匀度指数(J)平均值的变化范围是0.40~0.72,其空间差异亦不显著(F=0.88,P> 0.05)。
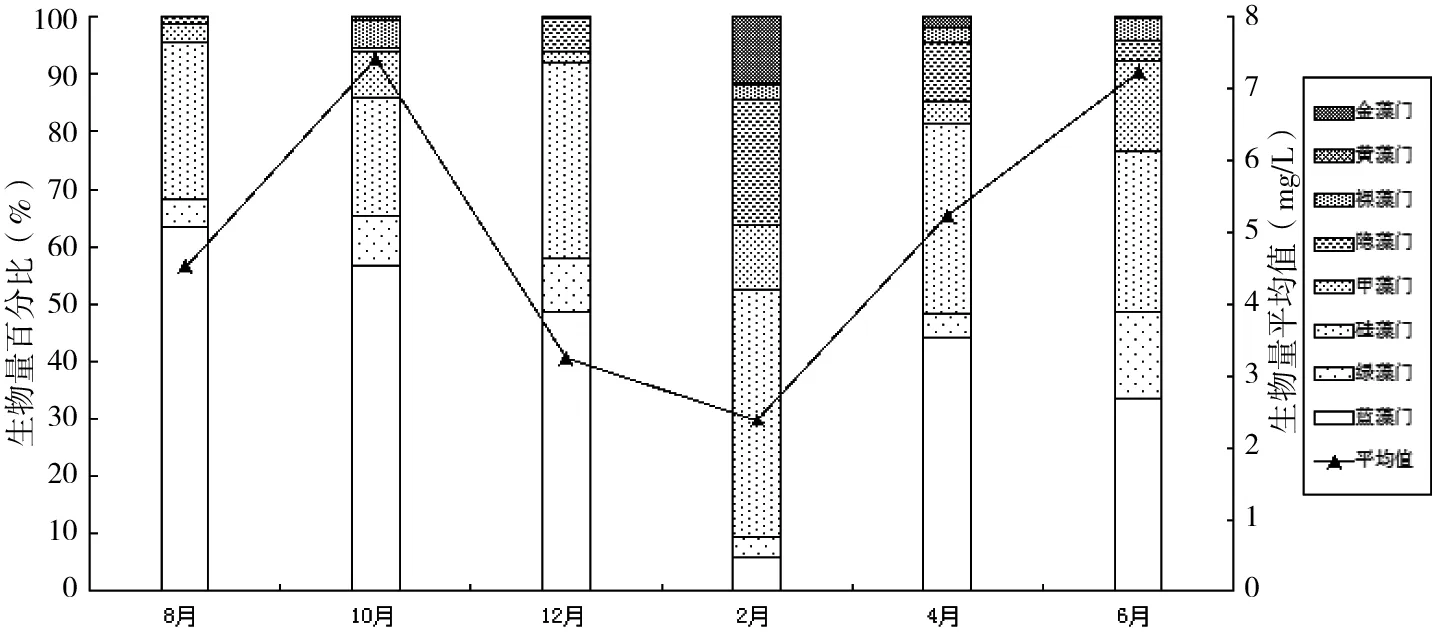
图5 迪沟采煤沉陷湖泊浮游植物生物量的时间变化
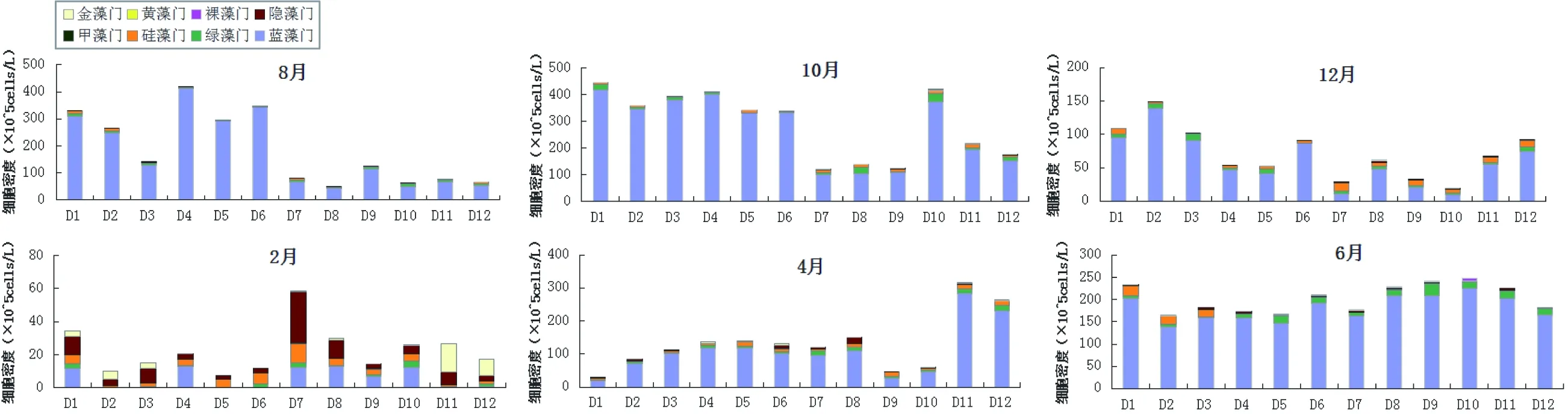
图4 迪沟采煤沉陷湖泊浮游植物细胞密度的空间变化
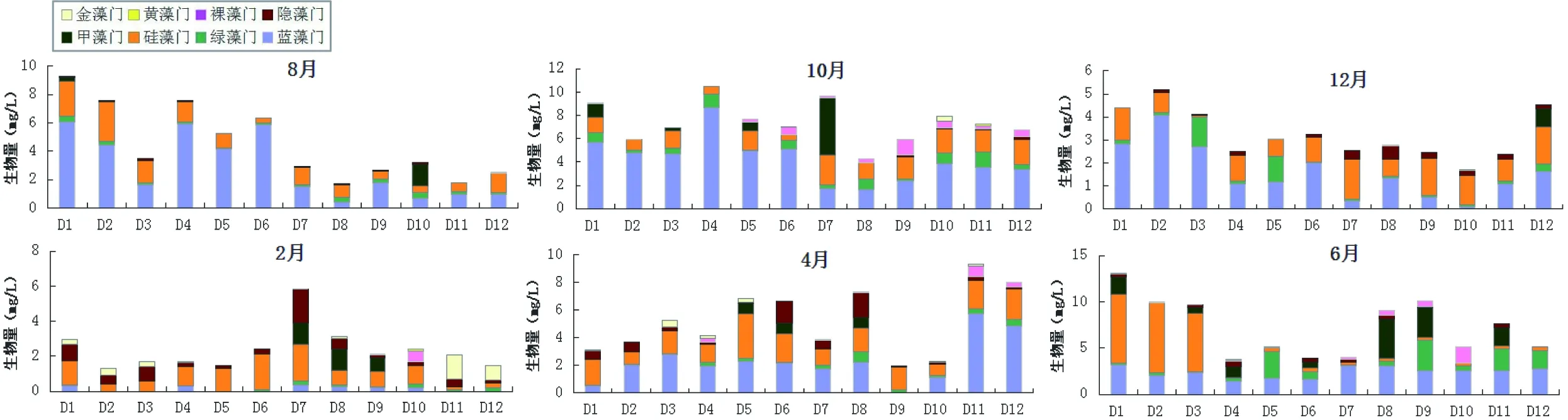
图6 迪沟采煤沉陷湖泊浮游植物生物量的空间变化
根据浮游植物多样性指数水质评价标准[21],H′的年平均值为2.25,D的年平均值为0.98,J的年平均值为0.53,综合以上3个多样性指数值,迪沟采煤沉陷湖泊水体状况为中度污染环境类型。
2.4 迪沟采煤沉陷湖泊水质特征分析
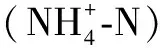
根据湖泊和水库的监测和分类系统[20],迪沟采煤沉陷湖泊的综合营养状态指数(TLI)的年平均值为5.7,沉陷湖泊营养水平为富营养状态。
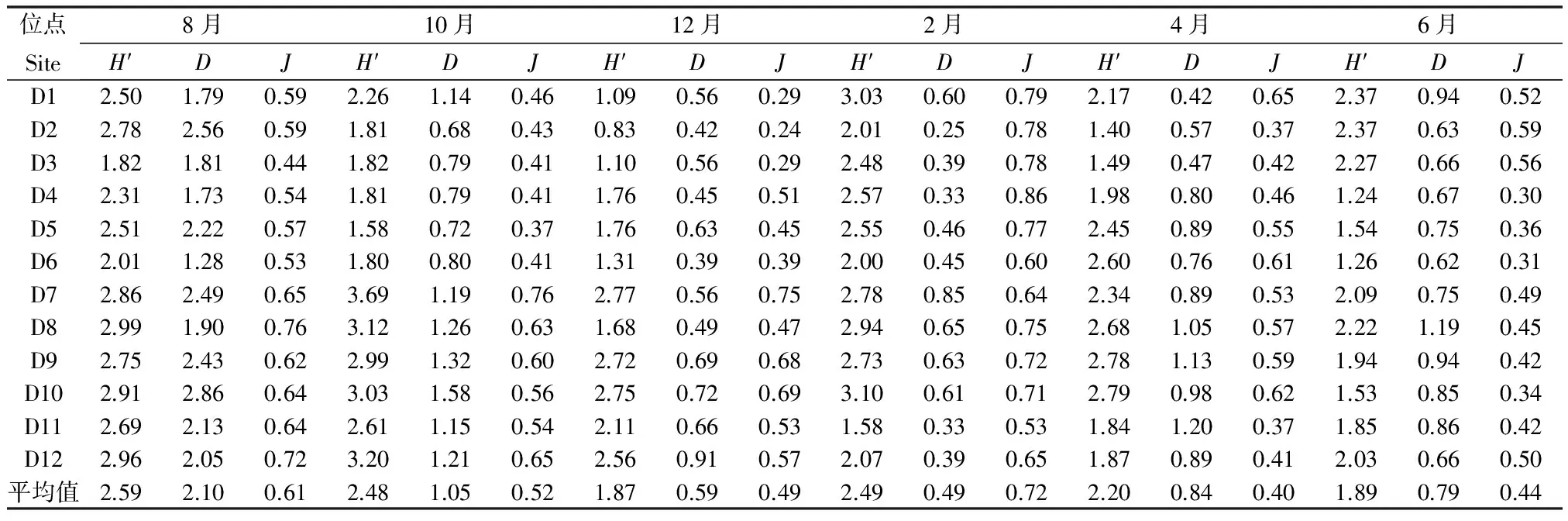
表2 迪沟采煤沉陷湖泊浮游植物多样性、丰富度和均匀度
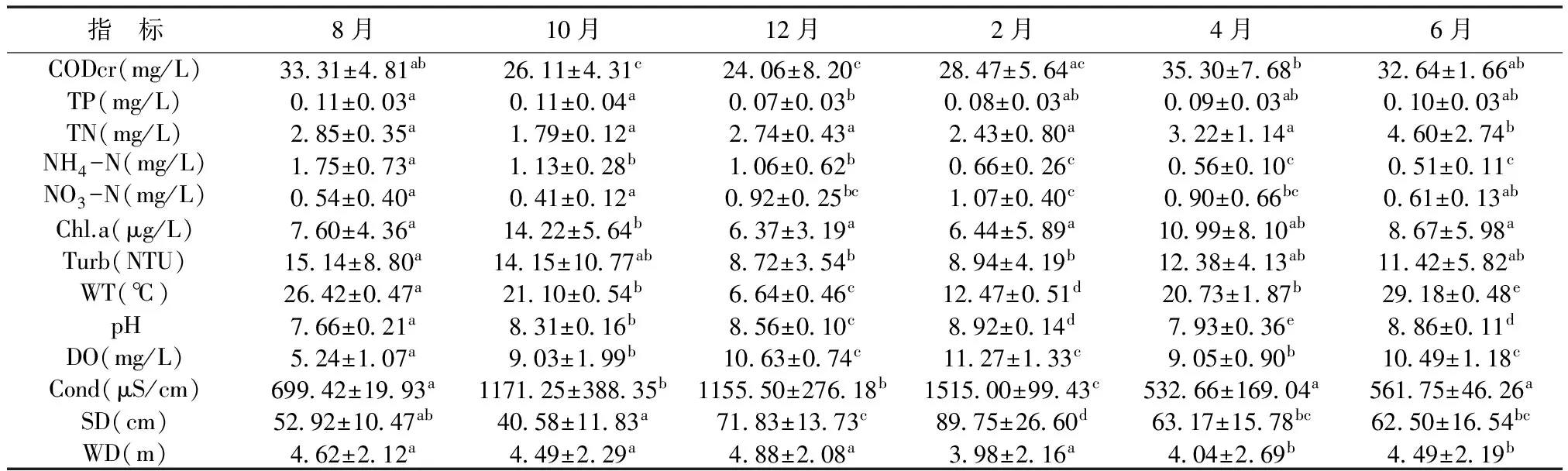
表3 迪沟采煤沉陷湖泊水质指标的平均值和标准差
注:不同的字母上标表示同一位点不同季节间的差异(P<0.05,Duncan′s test)
2.5 浮游植物群落与环境因子的相关分析
使用Canoco4.5首先对Y≥0.02的11种浮游植物优势种生物量与表3中13个环境因子进行去趋势对应分析(DCA),结果显示,排序轴最大梯度的长度为2.030,故选用冗余分析(RDA)。对13个环境因子进行蒙特卡罗置换检验后,选取解释能力较强的9个环境因子进行RDA分析。
RDA结果显示,排序轴1和排序轴2的特征值分别为0.191和0.088,前2个排序轴共解释了71.7%的物种与环境相关性。由图7可知,弯形小尖头藻、小席藻、尖头颤藻与水温呈正相关,与硝酸盐氮呈负相关;小球藻和梅尼小环藻与总磷呈正相关,与水温呈负相关;噬蚀隐藻和尖尾蓝隐藻与总磷呈正相关,与水温呈负相关;密集锥囊藻与透明度呈正相关,与水温呈负相关;两栖颤藻与叶绿素a浓度呈正相关;肘状针杆藻与水深呈正相关。水温对蓝藻门浮游植物优势种生物量的影响最大,是控制其生长的关键因子。
3 讨论
3.1 浮游植物群落的时空变化
研究期间,迪沟采煤沉陷湖泊形成了以蓝藻为优势群体的水域藻类体系,其浮游植物密度的总体趋势为先降后升,生物量变化趋势与密度变化相似,蓝藻的细胞密度和生物量在大部分时期占优势,这一结果与淮南采煤塌陷区浮游植物群落演替规律相似[22]。从浮游植物种类组成上看,除了2016年2月以外,蓝藻门始终为第一优势类群。绿藻门在细胞密度上不占据主要优势,但其种类数均高于其他类群,这与徐鑫等[23]的研究结果相一致。硅藻门在采样时期均占一定优势,低水温时期种类数量超过绿藻门,说明迪沟采煤沉陷湖泊浮游植物的季节动态与亚热带自然淡水湖泊的藻类变化规律具有相似性[24]。低水温时期浮游植物种类总数出现采样期间的最低值,这表明大多数藻类的生长受到低温抑制。浮游植物细胞密度与生物量的最高值均出现在D1位点,细胞密度最高值出现在2015年10月,其中蓝藻门占该位点藻类细胞总数的93.76%,原因是该点位营养盐的影响;而生物量最高值出现在2016年6月,该位点中硅藻门生物量比例高达57.13%,这主要由于该位点水深较大,达到7.9 m,由此形成的水体热分层[25]为肘状针杆藻提供了适宜生长的低温环境。
Shannon-Wiener多样性指数、Margalef 丰富度指数和Pielou均匀度指数可以反映浮游植物群落结构的复杂程度、物种丰富程度和均匀程度[26],三者的年平均值表明,迪沟采煤沉陷湖泊水体状况为中度污染环境类型。Shannon-Wiener多样性指数呈现显著的空间差异,其数值在D7、D8、D9和D10位点较高,可能是由于沉陷湖泊南面的济河直接贯通流过这些位点,污染物得到快速去除[27],改善了湖泊的水质[28],进而提高了浮游植物多样性。
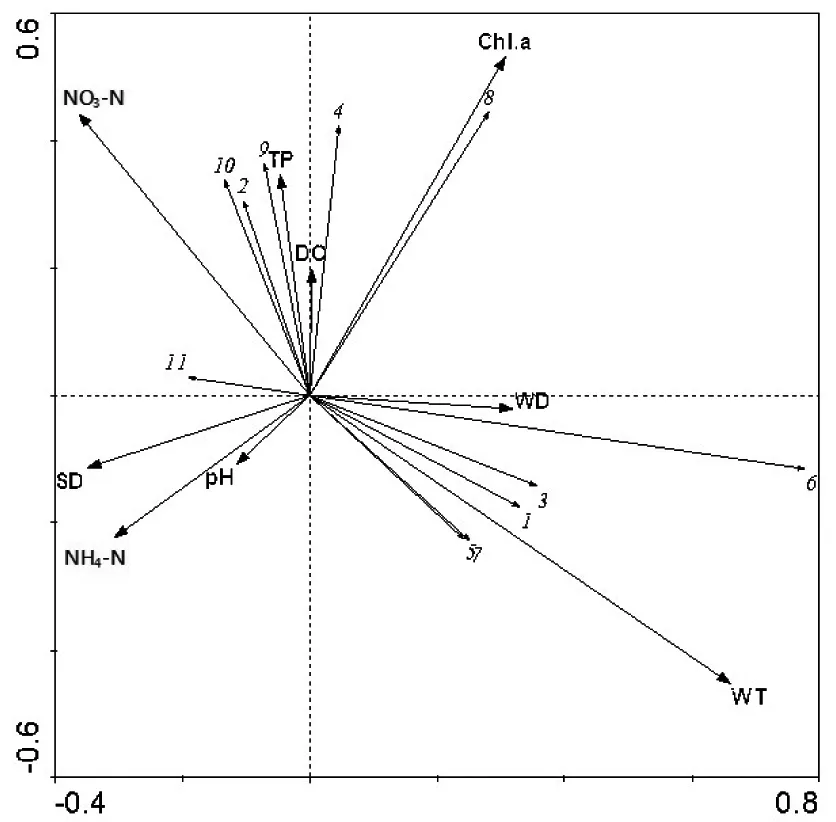
图7 全年环境因子与浮游植物的RDA排序图
1:狭形纤维藻; 2:小球藻; 3:肘状针杆藻; 4:梅尼小环藻; 5:弯形小尖头藻; 6:小席藻; 7:尖头颤藻; 8:两栖颤藻; 9:噬蚀隐藻; 10:尖尾蓝隐藻; 11:密集锥囊藻
3.2 浮游植物与环境因子的关系
营养盐、光照和水温是影响浮游植物生长和时空分布的关键因子[22-23, 29]。沉陷湖泊环境因子与浮游植物优势种生物量冗余分析显示,水温、透明度、总磷和硝酸盐氮是影响浮游植物的主要环境因子,其中水温是影响优势种生物量变化的关键因子(图7)。Elliott等在温带的Bassenthwaite湖中观察到,在高营养盐和高水温的共同作用下,蓝藻能够最大限度地发挥潜能,并在浮游植物群落结构中占优势[30]。蓝藻成为沉陷湖泊高水温时期主要优势类群,与水温有直接关系,RDA分析显示弯形小尖头藻、小席藻、尖头颤藻与水温呈正相关(图7)。2015年10月,此时水温在20℃左右,并非蓝藻生长最适温度[31],水体中的硝酸盐氮平均值最小(表3),RDA分析显示蓝藻门几个主要的优势种与硝酸盐氮呈负相关,浮游植物中蓝藻门的生物量达到研究期间的峰值。
RDA分析显示,小球藻与总磷呈正相关关系,而与水温呈负相关关系。2015年12月,沉陷湿地水温较低,绿藻、硅藻、隐藻大量出现,绿藻门的小球藻成为主要优势种,这整个时期的种类和细胞密度处于较低水平,小球藻生物量相对较高,表明小球藻对低温的适应性较强,这与薛凌展等[32]的研究结果一致。本研究的RDA分析还显示,噬蚀隐藻和尖尾蓝隐藻与TP呈正相关关系,而与水温呈负相关关系,隐藻门的尖尾蓝隐藻在2016年2月成为主要优势种,这表明尖尾蓝隐藻更适应低温的水环境,此结果与刘歆璞等[33]在青草沙水库研究浮游植物群落时的观点一致。另外,有研究表明金藻生长繁殖的最适应环境条件是较低的温度,较大的透明度,且对温度变化感应灵敏[34],RDA分析显示密集锥囊藻与透明度呈正相关关系,与温度呈负相关关系,定量分析发现密集锥囊藻在低水温时期(2015年12月)生物量出现峰值0.27 mg/L。一般情况,低温环境下硅藻能够大量增殖[35],而本次调查发现在高水温时期的2016年6月,硅藻拥有一个较高的生物量。通过RDA分析显示硅藻门的肘状针杆藻与水深成正相关关系,这表明较大的水深有利于肘状针杆藻的生长,可能是由于较大水深形成的水体热分层为肘状针杆藻提供了适宜生长的低温环境。因此沉陷湖泊形成的较大水深,导致硅藻能在高水温时期拥有较高的生物量。
3.3 小型富营养化沉陷湖泊的水华风险
根据综合营养状态指数(TLI),迪沟采煤沉陷湖泊水体呈现富营养化状态。高水温和最佳营养条件下,蓝藻有最大生长速度[36]。迪沟采煤沉陷湖泊浮游植物群落结构有明显的富营养化特征(生物量年平均值为5.00 mg/L),2015年8月、10月和2016年4月、6月为高水温时期,此时水温高(水温>20℃),营养盐浓度高(总磷浓度>0.09 mg / L),蓝藻是优势类群,其细胞密度和生物量在短时间内达到非常高的值(蓝藻门的细胞密度和生物量在2015年10月达到峰值,分别为269.21×105cells/L和5.82 mg/L)。一般而言,水温超过20℃时、pH大于8的水体就可以发生蓝藻水华[37],蓝藻某些种类易在富营养化水体中大量增殖[38],如颤藻属和席藻属,在本研究中,这两个属的藻类在高水温时期为主要优势种(表1)。蓝藻暴发性增长,对整个沉陷湖泊的水生生态系统造成强烈的冲击,破坏水生态平衡,严重影响人类的生产和生活[39-40]。总而言之,迪沟采煤沉陷湖泊的水体呈现高营养和高水温状态,存在潜在的蓝藻水华风险。
[1]唐雅萍, 张哲海, 梅卓华, 等. 南京市主要湖泊浮游植物群落结构分析[J]. 环境科技, 2008, 21(5): 14-16.
[2]翁建中, 李继影, 梁 柱, 等. 太湖蓝藻水华时空分布与预警监测响应的分析[J]. 环境监控与预警, 2010, 2(3): 1-4.
[3]宋晓兰, 刘正文, 潘宏凯, 等. 太湖梅梁湾与五里湖浮游植物群落的比较[J]. 湖泊科学, 2007, 19(6): 643-651.
[4]LEPISTÖ L, HOLOPAINEN A L, VUORISTO H. Type specific and indicator taxa of phytoplankton as a quality criteron forassessing the ecollogical status of Finnish boreal lakes[J]. Limnological, 2004, 34(3): 236-248.
[5]WHITTON B A. Changing approaches to monitoring during the period of the use of algae for monitoring rivers′symposia [J]. Hydrobiologia, 2012, 695(1): 7-16.
[6]TORNÉS E, PÉREZ M C, DURN C, et al. Reservoirs override seasonal variability of phytoplankton communities in a regulated Mediterranean river [J]. Science of the Tital Environment, 2014, 475: 225-233.
[7]VADAS P A, KLEINMAN P J, SHARLEY A N, et al. Relating soil phosphorus to dissolved phosphorus in runoff: a single extraction coefficient for water quality modeling [J]. Journal of Environmental Quality, 2005, 34(2): 572-580.
[8]杜胜蓝, 黄岁睴, 臧常娟, 等. 浮游植物现存量表征指标间相关性研究Ⅰ: 叶绿素a与生物量[J]. 水资源与水工程学报, 2011, 22(1): 40-44.
[9]杜胜蓝, 黄岁睴, 臧常娟, 等. 浮游植物现存量表征指标间相关性研究Ⅱ: 叶绿素a与生物量[J]. 水资源与水工程学报, 2011, 22(2): 44-49.
[10]金相灿, 屠清瑛. 湖泊富营养化调查规范(第二版)[M]. 北京: 中国环境科学出版社, 1990: 239-245.
[11]MARTIN J H, FITZWATER S E. Iron deficiency limits phytoplankton growth in the northeast subarctic Pacific[J]. Nature, 1988, 331(6154): 341-343.
[12]HECKY R E, HESSLEIN R H. Contributions of benthic algae to lake food webs as revealed by stable isotope analysis[J]. Journal of the North American Benthological Society, 1995, 14(4): 631-653.
[13]WANG X L, LU Y L, HE G Z, et al. Exploration of relationships between phytoplankton biomass and related environmental variables using multivariate statistic analysis in a eutrophic shallow lake: A 5-year study[J]. Journal of Environmental Sciences, 2007, 19: 920-927.
[14]易齐涛, 徐 鑫, 曲喜杰, 等. 两淮采煤沉陷积水区水体初级生产特征[J]. 中国环境科学, 2014, 34(8): 2101-2110.
[15]王振红, 桂和荣, 罗专溪, 等. 采煤塌陷塘浮游生物对矿区生态变化的响应[J]. 中国环境科学, 2005, 25(1): 42-46.
[16]邓道贵, 孟小丽, 雷 娟, 等. 淮北采煤塌陷区小型湖泊浮游植物群落结构和季节动态[J]. 生态科学, 2010, 29(6): 499-506.
[17]邓道贵, 金显文, 葛 茜, 等. 淮北采煤塌陷区小型湖泊轮虫群落结构的季节变化[J]. 湖泊科学, 2012, 24(1): 111-116.
[18]章宗涉, 黄祥飞. 淡水浮游生物研究方法[M]. 北京: 科学出版社, 1991: 334-346.
[19]胡鸿钧, 魏印心. 中国淡水藻类——系统、分类及生态[M]. 北京: 科学出版社, 2006.
[20]BURNS N M, RUTHERFORD J C, CLAYTON J S. A monitoring and classification system for New Zealand lakes and reservoirs [J]. Journal of Lake and Reservoir Management, 1999, 15(4): 255-271.
[21]姚恩亲, 姚玉鑫, 杨晓红, 等. 南太湖入湖2008-2009浮游植物及营养现状评价[J]. 环境科学导刊, 2010, 29(4): 72-74.
[22]易齐涛, 陈求稳, 赵德慧, 等. 淮南采煤塌陷湖泊浮游植物功能群的季节演替及其驱动因子[J]. 生态学报, 2016, 36(15): 4843-4854.
[23]徐 鑫, 易齐涛, 王晓萌, 等. 淮南矿区小型煤矿塌陷湖泊浮游植物群落结构特征[J]. 水生生物学报, 2015, 39(4): 740-750.
[24]董旭辉, 羊向东, 王 荣. 长江中下游地区湖泊富营养化的硅藻指示性属种[J]. 中国环境科学, 2006, 26(5): 570-574.
[25]付 莉, 张 磊, 蔚建军, 等. 三峡库区支流回水区水体分层与藻类生长[J]. 环境工程学报, 2015, 9(5): 2265-2271.
[26]朱 英, 沈根祥, 钱晓雍, 等. 上海大莲湖水域浮游植物群落结构特征及水质评价[J]. 生态与农村环境学报, 2010, 26(6): 544-549.
[27]吴 洁, 虞左明. 西湖浮游植物的演替及富营养化治理措施的生态效应[J]. 中国环境科学, 2001, 21(6): 540-544.
[28]JASSER I. The influence of macrophytes on a phytoplankton community in experimental conditions[J]. Hydrobiologia, 1995, 306(1): 21-32.
[29]CHAPMAN B R, FERRY B W, FORD T W. Phytoplankton communities in water bodies at Dungeness, U.K.: analysis of seasonal changes in response to environmental factors[J]. Hydrobiologia, 1997, 362(1-3): 161-170.
[30]ELLIOTT J A, JONES I D, THACKERAY S J. Testing the sensitivity of phytoplankton communities to changes in water temperatureand nutrient load, in a temperate lake [J]. Hydrobiologia, 2006, 559(1): 401-411.
[31]杨东方, 陈生涛, 胡 均, 等. 光照, 水温和营养盐对浮游植物生长重要影响大小的顺序[J]. 海洋环境科学, 2007, 26(3): 201-207.
[32]薛凌展, 陈小晨, 黄种持, 等. 温度和磷交互作用对铜绿微囊藻和小球藻生长的影响[J]. 安徽农学通报, 2011, 17(13): 23-25.
[33]刘歆璞, 张 玮, 王丽卿, 等. 青草沙水库浮游植物群落结构及其与环境因子的关系[J]. 上海海洋大学学报, 2015, (4): 532-543.
[34]谢树莲, 冯 佳. 中国淡水金藻门植物研究进展[J]. 世界科技研究与发展, 2007, 29(6): 1-6.
[35]SILVA C A, TRAIN S, RONDRIGUES L C. Phytoplankton assemblages in a Brazilian subtropical cascading reservoir system[J]. Hydrobiologia, 2005, 537 (1): 99-109.
[36]ISLAM M N, KITAZAWA D, PARK H D. Numerical modeling on toxin produced by predominant species of cyanobacteria withinthe ecosystem of Lake Kasumigaura, Japan [J]. Procedia Environmental Sciences, 2012, 13: 166-193.
[37]苗晓青, 宋义辉, 李文化. 池塘不同藻类水华形成的生态学原因探讨[J]. 安徽农业科学, 2011, 39(21): 12899-12901.
[38]王扬才, 陆开宏. 蓝藻水华的危害及治理动态[J]. 水产学杂志, 2004, 17(1): 90-94.
[39]刘 玥, 李 毅. 富营养化水体除藻方法的研究[J]. 环境科学导刊, 2009, 28(增刊): 76-78.
[40]陆开宏, 晏维金, 苏尚安. 富营养化水体治理与修复的环境生态工程——利用明矾浆和鱼类控制桥墩水库蓝藻水华[J]. 环境科学学报, 2002, 22(6), 732-737.
