模拟氮沉降对温带森林土壤线虫群落组成和代谢足迹的影响
2018-03-08程云云王清奎梁文举张晓珂
程云云,孙 涛,王清奎,梁文举,张晓珂,*
1 中国科学院沈阳应用生态研究所,中国科学院森林生态与管理重点实验室,沈阳 110016 2 中国科学院大学,北京 100049
森林生态系统是我国重要的陆地生态系统类型之一,其更易受到全球变化的干扰。至20世纪中叶以来,由于矿物燃料燃烧、含氮肥料的大量生产和使用以及畜牧业发展等原因,大气氮沉降迅速增加[1- 2]。大气氮素以无机态和有机态形式发生沉降,二者分别占总氮沉降量的70%和30%左右[3]。其中,无机氮素形态主要以硝态氮和铵态氮为主,而有机氮沉降形态主要为尿素和氨基酸[3]。
土壤动物是生态系统中不可分割的组成部分,它对生态系统物质循环、能量流动、土壤结构改善均具有重要的作用。土壤线虫是土壤中最丰富的后生动物,广泛存在于各种生境,在土壤生态系统腐屑食物网中占有重要地位[4],在土壤养分循环过程中发挥着重要的作用。土壤线虫的形态或生命特征与其生境特点之间表现出很强的关联性[5],土壤线虫的营养类群多样,目前已被广泛用作揭示土壤污染状况和评价土壤环境质量的模式生物[6-7]。
Ferris[8]在2010年提出用线虫功能代谢足迹的分析来度量线虫代谢活性和土壤食物网功能,代谢足迹能够提供关于土壤食物网碳和能流的大小等信息。线虫功能代谢足迹主要由富集代谢指数和结构代谢指数两部分组成,二者分别反映了较低营养级和较高营养级线虫的碳代谢过程[8]。线虫功能代谢足迹为估算线虫对生态系统功能的贡献提供了有效的方法。
近年来,关于模拟氮沉降对土壤线虫群落影响的研究已引起了人们广泛的关注,但是由于氮沉降过程中氮素形态不同以及发生地区不同等诸多因素,一些研究结果还存在争议性。Forge等[9]研究发现在英国南部森林中施加无机氮增加了土壤线虫多度;Sohlennius等[10]报道了在瑞典中部森林施加无机氮降低了土壤线虫多度。而在我国热带地区的次生林中,施加氮并未影响土壤线虫多度和生态指数,但显著改变了线虫功能团的组成[11]。另外,目前关于不同氮素形态对土壤线虫群落影响的研究还较少。因此,为真实反映氮沉降对生态系统功能的影响,亟需探讨不同氮素形态对土壤线虫群落的影响,从而为深入了解氮沉降如何改变土壤食物网结构和生态系统过程提供科学依据。
1 材料与方法
1.1 研究区概况
本试验在黑龙江省尚志市帽儿山林场老山试验站进行。该站位于45°20′N,127°34′E,气候属于大陆性季风气候,年平均温度2.7℃,年降雨量600—800 mm,雨量主要集中于7、8月份,年蒸发量1093.9 mm,年相对湿度70%。主要乔木层树种为落叶松Larixspp,伴有少量的水曲柳FraxinusmandshuricaRupr、白桦Betulaplatyphylla、胡桃楸JuglansmandshuricaMaxim和紫椴Tiliaamurensis等。地带性土壤为典型暗棕壤[12]。
1.2 研究方法
1.2.1 样地设置与取样方法
本研究共设置了4个处理,分别为对照(CK,无氮添加),无机氮(IN,硝酸铵),有机氮(ON,尿素和甘氨酸1∶1混合),无机有机混合氮(MN,无机氮和有机氮7∶3混和)。施氮量均为10 g N m-2a-1,每个处理3次重复,共12个小区。试验开始于2010年4月,在兴安落叶松人工林内共设立了12个(4个处理×3次重复)10 m×20 m的小区,样方之间留有15 m左右的缓冲带以防止相互之间干扰,每个小区完全随机排列。每年5—10月份进行模拟氮沉降处理,将所需的氮肥溶解在50 L自来水中,然后采用背式喷雾器人工有序的均匀喷洒在林地,对照样方喷施等量的自来水。5—10月份生长季内,每月喷洒1次,每次喷洒氮量保持一致,共喷洒6次氮肥。
本试验于2015年9月在每个10 m×20 m的样地上随机选择10个点,先将上层凋落物移除,然后在每个点用土钻(2.5 cm 直径)取0—10 cm土层,然后将这10钻土壤混合后装入自封袋作为一个重复,4个处理共采集12个土壤样品。采集的土壤样品放在铺有冰袋的保温箱内带回实验室,将植物根和石块挑除后充分混匀并置于4℃冰箱冷藏备用。
1.2.2 土壤理化指标测定方法
土壤全碳(TC)和全氮(TN)使用元素分析仪测定; 土壤含水量(SM)采用烘干法测定; 土壤pH值以土水比为1∶5, 使用pH计测定; 硝态氮和铵态氮采用2 mol/L KCl浸提之后使用连续流动分析仪(FIAstar 5000 Analyzer, Denmark)测定。
1.2.3 土壤线虫分类和鉴定方法
从50 g新鲜土样中利用改良的浅盘法对土壤线虫进行分离提取。线虫总数通过解剖镜直接计数,最终折算成100 g干土中土壤线虫的数量。随机抽取100条线虫(不足100条的处理全量鉴定)在光学显微镜下进行科属鉴定。根据线虫的取食习性和食道特征可将其划分为4个营养类群:食细菌线虫(Bacterivores,BF)、食真菌线虫(Fungivores,FF)、植物寄生线虫(Plant parasites,PP)和捕食/杂食线虫(Omnivores-predators,OP)[6,13]。土壤线虫的分类鉴定参照Bongers[14]的分类图鉴进行。
1.3 分析方法
1.3.1 土壤线虫生态指数
土壤线虫生态指数按以下公式计算:①多样性指数(Diversity index)H′=-∑Pi×ln(Pi);②均匀度指数(Evenness)J′=H′/ln(S);③优势度指数(Dominance index)λ=∑Pi2;④线虫通路比值(Nematode channel ratio):NCR=B/(B+F)。公式中Pi为第i个分类单元中个体所占的比例;S是所鉴定属的数量;B为食细菌线虫的相对多度;F为食真菌线虫的相对多度[15-16]。
1.3.2 土壤线虫区系分析
按照Ferris等[17]的方法进行线虫区系分析,具体计算公式如下:富集指数EI=100×(e/(e+b)),用于评估食物网对可利用资源的响应;结构指数SI=100×(s/(s+b)),指示在人为干扰或生态恢复过程中土壤食物网结构的变化。其中b(basal)代表食物网中的基础成分,主要指Ba2和Fu2这两个类群(即食细菌线虫和食真菌线虫中cp值为2的类群);e(enrichment)代表食物网中的富集成分,主要指Ba1和Fu2这两个类群(即食细菌线虫中cp值为1和食真菌线虫中cp值为2的类群);s(structure)代表食物网中的结构成分,包括Ba3—Ba5、Fu3—Fu5、Om3—Om5、Ca2Ca5类群(分别为食细菌线虫、食真菌线虫和杂食线虫中cp值为3—5的类群以及捕食线虫中cp值为2—5的类群)。b、e和s对应的值分别为∑kbnb、∑kene和∑ksns,其中kb,ke和ks为各类群所对应的加权数(其值在0.8—5.0之间), 而nb、ne和ns则为各类群的相对多度。
根据计算出的富集指数和结构指数,可以将线虫区系划分为A、B、C、D4个象限,其中,EI和SI的值在0—100之间变化,当EI大于50但SI小于50 (A象限) 时,表明土壤养分状况较好但受干扰程度较高,食物网受到一定程度的干扰;当EI和SI都大于50(B象限)时,表明土壤养分状况较好而且受干扰程度较小,食物网稳定成熟;EI小于50但SI大于50(C象限)时,表明土壤养分状况较差但受干扰程度较小,食物网处于结构化的状态;而EI和SI都小于50时(D象限)时,表明土壤养分状况较差而且受干扰程度最高,已对环境造成胁迫,食物网退化[17]。
1.3.3 土壤线虫生物量碳和代谢足迹利用http://plpnemweb.ucdavis.edu/nemaplex/Ecology/nematode_weights.htm[18]估算线虫每个个体的生物量(鲜重)(W)和代谢足迹(NMF)。线虫代谢足迹:NMF=∑{Nt[0.1(Wt/mt)+0.273(W0.75)]},其中,Nt指第t个属的个体数量,Wt和mt分别是第t个属的身体重量和c-p值。线虫的干重为鲜重的20%,体内生物量碳的比例为干重的52%[8]。富集代谢指数(enrichment footprint,efoot)是指通常c-p值较低(1—2),对资源富集反应迅速的一类线虫的代谢足迹;结构代谢指数(structure footprint,sfoot)反映的是c-p值较高(3—5)的一类线虫的碳代谢过程,这类线虫对食物网具有调节功能。功能代谢足迹(Functional metabolic footprint,FMF)是富集代谢和结构代谢圈定区域的总和,即(Fs×Fe)/2[8]。
1.4 统计分析
数据采用SPSS 19.0软件进行Duncan多重比较,显著性水平为α=0.05。单因素方差分析用于分析不同形态氮素对土壤线虫群落各参数的影响。
2 结果与分析
2.1 模拟氮沉降不同处理对土壤理化性质的影响
在土壤理化性质方面,仅土壤硝态氮含量在不同处理间具有显著差异(P< 0.05,表1)。与CK相比,IN处理、ON处理和MN处理均显著增加了土壤硝态氮含量;同时,ON处理和MN处理中的土壤硝态氮含量显著高于IN处理(P< 0.05),但二者之间无显著性差异。

表1 不同处理土壤理化性质(平均值±标准误)
CK:对照(不加氮),control (no nitrogen addition);IN:无机氮(硝酸铵),inorganic nitrogen (NH4NO3); ON:有机氮(尿素和甘氨酸1∶1混合),organic nitrogen (urea and glycine 1∶1);MN:混合氮(无机氮和有机氮7∶3混合),mixed nitrogen (inorganic N and organic N at the ratio of 7∶3);不同字母表示处理间显著差异(Duncan多重比较,α=0.05)
2.2 模拟氮沉降不同处理对土壤线虫群落组成的影响
通过对不同处理土壤线虫进行分离、鉴定和分析(表2),共鉴定出线虫50个属,其中在CK样地中共发现29个属,在IN,ON和MN处理中分别发现线虫属37个,34个和29个。土壤线虫优势属为个体数占群落个体总数10%以上的属,因此由表2可以看出盘旋属Rotylenchus和大节片属Macroposthonia在所有处理中均为优势属;在CK和IN处理中,绕线属Plectus为优势属。有些属如拟绕线属Anaplectus、真矛线属Eudorylaimus、表矛线属Epidorylaimus和咽针属Laimydorus只在ON处理中存在,而托布利属Tobrilus、三孔属Tripyla、Kochinema和缢咽属Axonchium只在MN处理中存在。

表2 不同处理线虫属的相对丰度/%
Ba:食细菌线虫,Bacterivores;Fu:食真菌线虫, Fungivores;H:植食性线虫,Herbivores;OP:捕食杂食性线虫, Predators/OmnivoresBax、Fux、Hx、OPx, x指c-p值
2.3 模拟氮沉降对土壤线虫总数和营养类群数量的影响
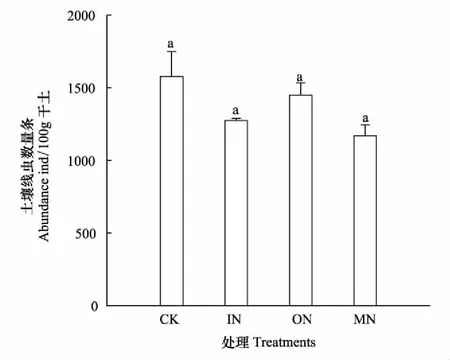
图1 不同处理土壤线虫数量Fig.1 Total nematode abundance in different treatments CK:对照(不加氮),control (no nitrogen addition);IN:无机氮(硝酸铵),inorganic nitrogen (NH4NO3);ON:有机氮(尿素和甘氨酸1∶1混合),organic nitrogen (urea and glycine 1∶1);MN:混合氮(无机氮和有机氮7∶3混合),mixed nitrogen (inorganic N and organic N at the ratio of 7∶3)
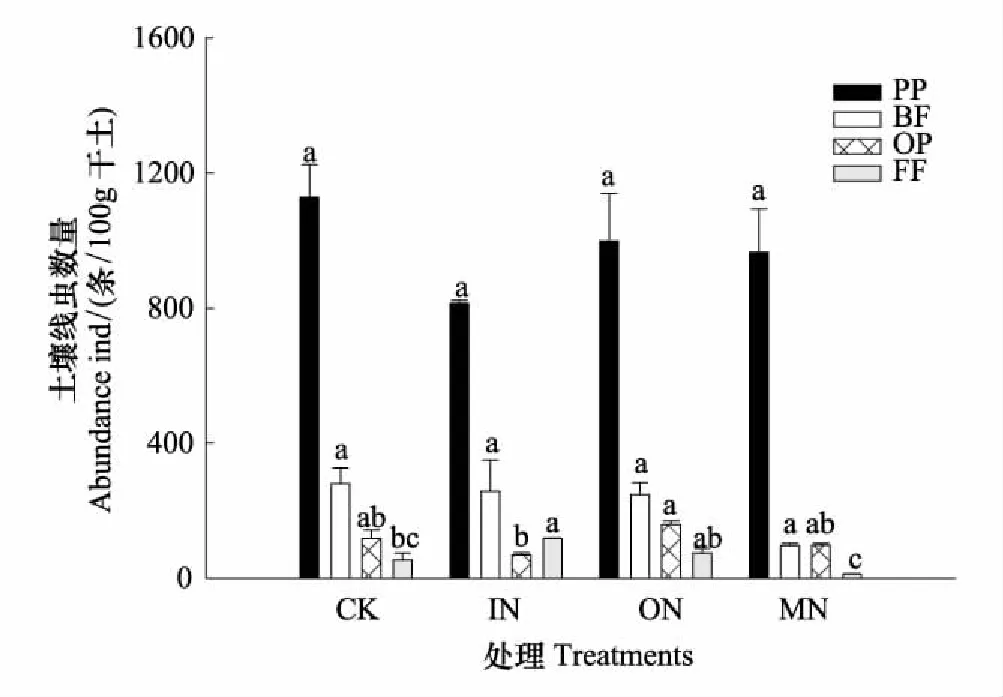
图2 不同处理土壤线虫营养类群 Fig.2 Abundance of nematode trophic groups in different treatments BF: 食细菌类,Bacterivores; FF: 食真菌类,Fungivores; PP: 植物寄生类,Plant-parasites; OP: 捕食-杂食类,Omnivores-predators;不同字母表示同一营养类群在不同处理间具有显著差异
从图1可以看出,与对照相比,土壤线虫的总数在各个处理中均有降低的趋势,但并无显著性差异。在所有处理中,植物寄生线虫数量均最高,食细菌线虫次之,分别占线虫总数的63.84%—82.47%和8.22%—20.21%;而捕食/杂食类线虫和食真菌线虫数量较低,分别占线虫总数的5.39%—10.96%和0.95%—9.16%(图2)。从不同处理间的土壤线虫营养类群差异来看,食真菌线虫数量在IN处理显著高于CK和MN处理,但与ON处理无显著差异。捕食/杂食性线虫数量在ON处理显著高于IN,但与CK和MN处理无显著差异。植物寄生线虫数量和食细菌线虫数量在不同处理间没有显著性差异。
2.4 土壤线虫群落生态指数及线虫区系分析
土壤线虫生态指数在不同处理间具有显著差异(P<0.05,表3)。IN处理对应的多样性指数(H′)显著高于CK,与其他两个处理无显著差异。IN处理的均匀度指数(J)显著高于CK和MN处理,与ON处理无显著差异。MN处理的优势度指数(λ)显著高于其他3个处理。所有处理的NCR指数均大于0.75,说明土壤分解的过程均以细菌通道为主。
从图3可以看出,线虫富集指数(EI)在不同处理间具有显著差异(P< 0.05),主要表现为CK的富集指数(EI)显著低于其他3个处理,其余3个处理中MN处理的富集指数(EI)最大。结构指数(SI)在不同处理间没有显著差异。线虫区系分析结果表明,在CK和ON处理,线虫的结构指数(SI)较高,富集指数(EI)较低,样点多数分布在C象限,表明这两个处理的土壤养分富集状况较差,但受干扰程度较小,食物网处于结构化状态。在IN和MN处理,土壤线虫富集指数和结构指数均较高(>50),因此样点分布在B象限,表明土壤养分状况较好而且受干扰程度较小, 食物网稳定成熟。
2.5 模拟氮沉降对土壤线虫生物量碳和代谢足迹的影响
土壤线虫生物量碳和代谢足迹方差分析结果表明(表4),土壤线虫总生物量碳和食真菌线虫、捕食杂食性线虫生物量碳和代谢足迹在不同处理间均有显著差异(P<0.05)。土壤线虫总生物量碳、捕食杂食性线虫生物量碳和代谢足迹在ON处理和MN处理显著高于其他两个处理;食真菌线虫生物量碳和代谢足迹在IN处理显著高于其他3个处理;食细菌线虫和植物寄生线虫生物量碳和代谢足迹在不同处理间无显著差异。

表3 不同处理土壤线虫生态指数(平均值±标准误)

表4 不同处理线虫生物量碳和代谢足迹(平均值±标准误)
不同字母表示处理间显著差异(Duncan多重比较,α=0.05);BF: 食细菌类,Bacterivores; FF: 食真菌类,Fungivores; PP: 植物寄生类,Plant-parasites; OP: 捕食-杂食类,Omnivores-predators

图3 不同处理土壤线虫区系分析图 Fig.3 Soil food web indicated by nematode faunal analysis in different treatmentsSI: 结构指数,Structure Index; EI: 富集指数, Enrichment Index
3 讨论
大气氮沉降主要来自土壤、肥料和家畜粪便中铵态氮的挥发和含N有机物的燃烧[19],石油和生物体的燃烧及N的自然氧化如雷击[20]等等。大气氮沉降数量的急剧增加严重影响了陆地生态系统的生产力和稳定性,特别是土壤生态系统,例如氮输入增加改变土壤氮循环过程,降低土壤固氮的能力;导致土壤酸化、盐基离子损耗[21]。本研究表明,无机氮(硝酸铵)、有机氮(尿素和甘氨酸)和混合氮处理的土壤硝态氮含量均显著高于对照,同时有机氮和混合氮处理的土壤硝态氮含量显著高于无机氮处理。张平等[22]对不同氮肥处理对土壤养分影响的研究也发现了相似的结果,即与对照相比,硝酸铵和尿素施肥处理显著增加了土壤硝态氮含量;另外,尿素施肥处理的土壤硝态氮含量显著高于硝酸铵施肥处理。


Ferris等[17]在线虫功能团划分的基础上,提出了线虫区系分析的方法,可以揭示出土壤线虫食物网结构和养分富集状况等信息[17, 26-28]。不同氮处理下的线虫区系分析结果表明,与对照相比,其他3个施氮处理显著增加了富集指数(EI),这一结果主要是由于施氮处理促进了食细菌线虫中c-p值为1和2以及食真菌线虫中c-p值为2的类群引起的。Zhao等[11]研究了氮磷添加对热带森林土壤线虫群落的影响,结果也表明,氮添加增加了食细菌线虫中c-p值为2和食真菌线虫中c-p值为2的类群的权重。c-p值较小的线虫r-策略者,个体较小,生命周期相对短,因此通常对外源养分的添加反应非常迅速[15]。
本研究中,不同氮处理对土壤线虫总生物量碳、食真菌线虫和捕食/杂食性线虫的生物量碳产生显著影响,而土壤全碳在不同处理间无显著差异,这可能表明土壤生物群落对土壤环境的变化更加敏感,即土壤理化性质的微小变化可能引起土壤线虫群落的一些显著性的改变[29]。因此,作为衡量土壤环境变化的指示生物—土壤线虫,更加能反映出土壤环境扰动产生的细微变化。线虫代谢足迹是指征线虫代谢过程中用于生物量增长和呼吸的碳量[30-31],其不仅可以表明线虫对资源分配的响应,还可表征线虫对生态系统功能和服务的贡献[29]。有机氮和混合氮处理中捕食/杂食性线虫足迹显著高于其他两个处理,说明在有机氮和混合氮处理中捕食/杂食性线虫代谢活性被增强,这反映了生产系统资源输入的增加,使得被捕食者生产力和代谢活动增强的同时充分满足了捕食者的需求和维持了系统的代谢平衡[8]。由资源输入引起的上行效应,促进了食物网内的能流在捕食者和被捕食者之间的流动,维持了土壤食物网的代谢活性。食真菌线虫代谢足迹在无机氮处理最高,且显著高于其他处理,这表明进入真菌分解途径的碳和能流在无机氮处理中要相对高于其他氮处理。真菌分解通道通常针对于相对难降解的物质,无机氮添加增加了难分解物质[32],而有机氮的添加可促进土壤中难分解化合物转化为易分解化合物[33]。因此,这可能就是无机氮处理食真菌线虫代谢足迹增加的原因。
4 结论
综上所述,与对照相比,无机氮、有机氮和混合氮处理均显著增加了土壤硝态氮含量。各个氮处理并未对土壤线虫总数产生显著影响,但对食真菌线虫和捕食/杂食线虫产生了显著影响。无机氮处理显著提高了线虫多样性,混合氮处理的线虫优势度指数增加。线虫生物量碳和代谢足迹同样受到了氮素形态的影响,其中食真菌线虫和捕食/杂食线虫代谢足迹变化更加显著。线虫代谢足迹的变化,揭示了土壤食物网的能量流动状况,为探明温带森林对氮沉降的响应机制提供科学依据。
[1] Galloway J N, Townsend A R, Erisman J W, Bekunda M, Cai Z C, Freney J R, Martinelli L A, Seitzinger S P, Sutton M A. Transformation of the nitrogen cycle: recent trends, questions, and potential solutions. Science, 2008, 320(5878): 889- 892.
[2] Gruber N, Galloway J N. An Earth-system perspective of the global nitrogen cycle. Nature, 2008, 451(7176): 293- 296.
[3] Cornell S E, Jickells T D, Cape J N, Rowland A P, Duce R A. Organic nitrogen deposition on land and coastal environments: a review of methods and data. Atmospheric Environment, 2003, 37(16): 2173- 2191.
[4] 肖能文, 谢德燕, 王学霞, 闫春红, 胡理乐, 李俊生. 大庆油田石油开采对土壤线虫群落的影响. 生态学报, 2011, 31(13): 3736- 3744.
[5] Gaucherel C, Burel F, Baudry J. Multiscale and surface pattern analysis of the effect of landscape pattern on carabid beetles distribution. Ecological Indicators, 2007, 7(3): 598- 609.
[6] Yeates G W, Bongers T, De Goede R G M, Freckman D W, Georgieva S S. Feeding habits in soil nematode families and genera——an outline for soil ecologists. The Journal of Nematology, 1993, 25(3): 315- 331.
[7] 凌斌, 肖启明, 戈峰, 肖能文, 刘向辉. 云南省高黎贡山土壤线虫群落结构及多样性. 湖南农业大学学报: 自然科学版, 2008,34(3): 341- 346.
[8] Ferris H. Form and function: metabolic footprints of nematodes in the soil food web. European Journal of Soil Biology, 2010, 46(2):97- 104.
[9] Forge T A, Simard S W. Structure of nematode communities in forest soils of southern British Columbia: relationships to nitrogen mineralization and effects of clearcut harvesting and fertilization. Biology and Fertility of Soils, 2001, 34(3): 170- 178.
[10] Sohlenius B, Wasilewska L. Influence of irrigation and fertilization on the nematode community in a swedish pine forest soil. Journal of Applied Ecology, 1984, 21(1): 327- 342.
[11] Zhao J, Wang F M, Li J, Zou B, Wang X L, Li Z A, Fu S L. Effects of experimental nitrogen and/or phosphorus additions on soil nematode communities in a secondary tropical forest. Soil Biology and Biochemistry, 2014, 75: 1- 10.
[12] Sun T, Dong L L, Mao Z J. Simulated atmospheric nitrogen deposition alters decomposition of ephemeral roots. Ecosystems, 2015,18(7): 1240- 1252.
[13] Liang W J, Lavian I, Pen-Mouratov S, Steinberger Y. Diversity and dynamics of soil free-living nematode populations in a Mediterranean agroecosystem. Pedosphere, 2005, 15(2): 204- 215.
[14] Bongers,T. De Nematoden van Nederland. 2nd edition. Vormgeving en technische realisatie:Uitgenerij, Pirola, Schoorl, Netherland,1994.
[15] Bongers T. The maturity index: an ecological measure of environmental disturbance based on nematode species composition.Oecologia, 1990, 83(1): 14- 19.
[16] Yeates G W, Bongers T. Nematode diversity in agroecosystems. Agriculture, Ecosystems & Environment, 1999, 74(1/3): 113- 135.
[17] Ferris H, Bongers T, de Goede R G M. A framework for soil food web diagnostics: extension of the nematode faunal analysis concept. Applied Soil Ecology, 2001, 18(1): 13- 29.
[18] Sieriebriennikov B, Ferris H, de Goede R G M. NINJA: an automated calculation system for nematode-based biological monitoring. European Journal of Soil Biology, 2014, 61: 90- 93.
[19] Dentener F J, Crutzen P J. A three-dimensional model of the global ammonia cycle. Journal of Atmospheric Chemistry, 1994, 19(4): 331- 369.
[20] Duce R A, Liss P S, Merrill J T, Atlas E L, Buat-Menard P, Hicks B B, Miller J M, Prospero J M, Arimoto R, Church T M, Ellis W, Galloway J N, Hansen L, Jickells T D, Knap A H, Reinhardt K H, Schneider B, Soudine A, Tokos J J, Tsunogai S, Wollast R, Zhou M. The atmospheric input of trace species to the world ocean. Global Biogeochemical Cycles, 1991, 5(3): 193- 259.
[21] 吕超群, 田汉勤, 黄耀. 陆地生态系统氮沉降增加的生态效应. 植物生态学报, 2007, 31(2): 205- 218.
[22] 张平, 洪坚平, 李娜. 不同氮肥对酥梨品质及土壤养分的影响. 山西农业大学学报: 自然科学版, 2016, 36(2): 120- 127.
[23] Wolters V, Silver W L, Bignell D E, Coleman D C, Lavelle P, Van Der Putten W H, De Ruiter P, Rusek J, Wall D H, Wardle D A, Brussard L, Dangerfield J M, Brown V K, Giller K E, Hooper D U, Sala O, Tiedje J, Van Veen J A. Effects of global changes on above- and belowground biodiversity in terrestrial ecosystems: implications for ecosystem functioning. BioScience, 2000, 50(12): 1089- 1098.

[25] Russell A E, Laird D A, Mallarino A P. Nitrogen fertilization and cropping system impacts on soil quality in midwestern mollisols. Soil Science Society of America Journal, 2006, 70(1): 249- 255.
[26] Wu J H, Fu C Z, Chen S S, Chen J K. Soil faunal response to land use: effect of estuarine tideland reclamation on nematode communities. Applied Soil Ecology, 2002, 21(2): 131- 147.
[27] Ferris H, Matute M M. Structural and functional succession in the nematode fauna of a soil food web. Applied Soil Ecology, 2003, 23(2): 93- 110.
[28] Liang W J, Zhang X K, Li Q, Jiang Y, Ou W, Neher D A. Vertical distribution of bacterivorous nematodes under different land uses. The Journal of Nematology, 2005, 37(3): 254- 258.
[29] Zhang X K, Guan P T, Wang Y L, Li Q, Zhang S X, Zhang Z Y, Bezemer T M, Liang W J. Community composition, diversity and metabolic footprints of soil nematodes in differently-aged temperate forests. Soil Biology and Biochemistry, 2015, 80: 118- 126.
[30] 陈云峰, 韩雪梅, 李钰飞, 胡诚. 线虫区系分析指示土壤食物网结构和功能研究进展. 生态学报, 2014, 34(5): 1072- 1084.
[31] Bhusal D R, Tsiafouli M A, Sgardelis S P. Temperature-based bioclimatic parameters can predict nematode metabolic footprints. Oecologia, 2015, 179(1): 187- 199.
[32] Waldrop M P, Zak D R, Sinsabaugh R L, Gallo M, Lauber C. Nitrogen deposition modifies soil carbon storage through changes in microbial enzymatic activity. Ecological Applications, 2004, 14(4): 1172- 1177.
[33] Du Y H, Guo P, Liu J Q, Wang C Y, Yang N, Jiao Z X. Different types of nitrogen deposition show variable effects on the soil carbon cycle process of temperate forests. Global Change Biology, 2014, 20(10): 3222- 3228.
